CAPÍTULO 4 Imunidade Inata
RECONHECIMENTO DE MICRO-ORGANISMOS E ESTRUTURAS ORGÂNICAS DANIFICADAS PELO SISTEMA IMUNE INATO,
RECEPTORES CELULARES DE RECONHECIMENTO DE PADRÕES DA IMUNIDADE INATA,
COMPONENTES CELULARES DO SISTEMA IMUNE INATO,
MOLÉCULAS SOLÚVEIS DE RECONHECIMENTO E MOLÉCULAS EFETORAS DA IMUNIDADE INATA,
ESTIMULAÇÃO DA IMUNIDADE ADAPTATIVA,
MECANISMOS DE RETROALIMENTAÇÃO QUE REGULAM A IMUNIDADE INATA,
A imunidade inata é a primeira linha de defesa contra infecções. As células e moléculas solúveis da imunidade inata são completamente funcionais antes do encontro com os micro-organismos ou são rapidamente ativadas pelos patógenos, antes do desenvolvimento das respostas imunológicas adaptativas (Cap. 1, Fig. 1-1). A imunidade inata evoluiu juntamente com os micro-organismos de modo a proteger todos os seres multicelulares de infecções. Alguns componentes do sistema imune inato do mamífero são muito similares àqueles existentes em plantas e insetos, sugerindo que seu aparecimento se deu em ancestrais comuns. Os peptídeos que são tóxicos a bactérias e fungos, chamados defensinas, por exemplo, são encontrados em plantas e mamíferos, apresentando essencialmente a mesma estrutura terciária nestas duas formas de vida. A família de receptores que discutiremos em detalhes mais à frente neste capítulo, chamada receptores semelhantes a Toll (Toll-like receptors), é composta por proteínas que respondem à presença de micro-organismos patogênicos através da ativação de mecanismos de defesa antimicrobianos nas células em que são expressos. Os receptores semelhantes a Toll são encontrados em todas as formas de vida da árvore evolutiva, de insetos até mamíferos. A principal via de transdução de sinal empregada pelos receptores semelhantes a Toll na ativação de células, chamada NF-κB em mamíferos, também apresenta grande conservação evolutiva. Na verdade, a maioria dos mecanismos da defesa imune inata, que discutiremos neste capítulo, apareceu muito cedo na evolução, depois do desenvolvimento de organismos multicelulares complexos, há cerca de 750 milhões de anos. O sistema imune adaptativo, por outro lado, é claramente reconhecível apenas em vertebrados, surgindo há cerca de 500 milhões de anos. A imunidade adaptativa melhora alguns dos mecanismos antimicrobianos da imunidade inata, tornando-os mais poderosos. Além disso, a imunidade adaptativa pode reconhecer uma gama muito maior de substâncias e, diferentemente da imunidade inata, apresenta memória do encontro com o antígeno e especialização dos mecanismos efetores.
Neste capítulo, descrevemos os componentes, a especificidade e os mecanismos antimicrobianos do sistema imune inato. O restante deste livro é, em grande parte, devotado ao papel da resposta imune adaptativa na defesa do hospedeiro e em doenças.
A imunidade inata desempenha três importantes funções.
• A imunidade inata é a primeira resposta aos micro-organismos que previne, controla ou elimina a infecção do hospedeiro por muitos patógenos. A importância da imunidade inata na defesa do hospedeiro é ilustrada por estudos que mostram que a inibição ou eliminação de qualquer um dos diversos mecanismos da imunidade inata aumenta, de forma significativa, a suscetibilidade a infecções, mesmo quando o sistema imune adaptativo está intacto e funcional. Revisaremos exemplos de tais estudos mais à frente, neste capítulo e no Capítulo 15, quando discutiremos a imunidade a diferentes tipos de micro-organismos. Muitos patógenos desenvolveram estratégias de resistência à imunidade inata, e estas estratégias são cruciais à virulência dos micro-organismos. Na infecção por tais agentes infecciosos, as defesas imunes inatas podem manter a doença sob controle até que as respostas imunes adaptativas sejam ativadas. As respostas imunes adaptativas, sendo mais potentes e especializadas, são capazes de eliminar micro-organismos que resistem aos mecanismos de defesa da imunidade inata.
Diferentes mecanismos da imunidade inata atuam em diferentes estágios das infecções. As barreiras epiteliais dificultam a entrada de micro-organismos no hospedeiro. Fagócitos residentes e recrutados para os tecidos subepiteliais e para outros locais conferem proteção caso estas barreiras sejam ultrapassadas, e as proteínas plasmáticas e os fagócitos circulantes conferem proteção caso os micro-organismos atinjam a corrente sanguínea.
• Os mecanismos da imunidade inata reconhecem os produtos de células danificadas e mortas do hospedeiro e servem para eliminar tais células, iniciando o processo de reparo tecidual. O sistema imune inato também responde a diversas substâncias que não são de origem microbiana, mas que não deveriam ser encontradas em tecidos saudáveis, como cristais intracelulares.
• A imunidade inata aos micro-organismos estimula as respostas imunológicas adaptativas e pode influenciar a natureza das respostas específicas, tornando-as mais eficazes contra diferentes tipos de patógenos. Assim, a imunidade inata não apenas desempenha funções defensivas logo após a infecção, mas também dá um “alerta” de presença de infecção, contra a qual a resposta imune adaptativa subsequente deve ser montada. Além disso, diferentes componentes da resposta imune inata frequentemente reagem de formas distintas a diferentes micro-organismos (p. ex., bactérias ou vírus) e, portanto, influencia o tipo de resposta imune adaptativa a ser desenvolvida. Retornaremos a este conceito no final do capítulo.
Os dois principais tipos de respostas do sistema imune inato que nos protegem contra micro-organismos são a inflamação e a defesa antiviral. A inflamação é o processo pelo qual leucócitos e proteínas plasmáticas circulantes são enviados aos sítios de infecção e ativados para destruir e eliminar os agentes ofensores. A inflamação é também uma importante reação às células danificadas ou mortas e a acúmulos de substâncias anormais em células e tecidos. A defesa antiviral é composta por alterações nas células que impedem a replicação viral e aumentam a suscetibilidade à morte por linfócitos, eliminando, assim, os reservatórios de infecção viral. Além destas reações, os mecanismos da imunidade inata incluem defesas físicas e químicas através das barreiras epiteliais e da ativação de diversas células e proteínas circulantes que podem eliminar os micro-organismos presentes no sangue, independentemente da inflamação. Os mecanismos utilizados pelo sistema imune inato na proteção contra infecções são descritos adiante, neste capítulo.
Nos organismos superiores, muitas células e tecidos são capazes de atuar nas reações imunes inatas. Alguns componentes da imunidade inata trabalham o tempo todo, mesmo antes da infecção; dentre estes, estão incluídas as barreiras à entrada microbiana formada pelas superfícies epiteliais, como a pele e o revestimento dos tratos gastrointestinal e respiratório. Outros componentes da imunidade inata são normalmente inativos, mas respondem rapidamente à presença de micro-organismos e células danificadas; dentre estes componentes, incluem-se os fagócitos e o sistema complemento. Começaremos nossa discussão da imunidade inata pela descrição de como o sistema imune inato reconhece os micro-organismos e as células do hospedeiro danificadas pela infecção. A seguir, discutiremos cada componente da imunidade inata e suas funções na defesa do hospedeiro.
RECONHECIMENTO DE MICRO-ORGANISMOS E ESTRUTURAS ORGÂNICAS DANIFICADAS PELO SISTEMA IMUNE INATO
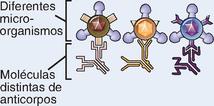
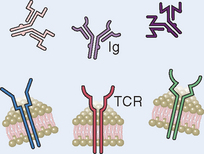
As especificidades do reconhecimento imune inato evoluíram para combater micro-organismos e são diferentes, em diversos aspectos, daquelas do sistema imune adaptativo (Tabela 4-1).
TABELA 4-1 Especificidade da Imunidade Inata e Adaptativa
| Imunidade Inata | Imunidade Adaptativa | |
|---|---|---|
| Especificidade | Para estruturas compartilhadas por classes de micro- organismos (padrões moleculares associados a patógenos) | Para detalhes estruturais de moléculas microbianas (antígenos); pode reconhecer antígenos não microbianos |
 |
 |
|
| Receptores | Codificados por genes na configuração germinativa; diversidade limitada (receptores de reconhecimento de padrões) | Codificados por genes produzidos por recombinação somática de segmentos gênicos; maior diversidade |
 |
 |
|
| Distribuição dos receptores | Não clonal: receptores idênticos em todas as células da mesma linhagem | Clonal: clones de linfócitos com especificidades distintas expressam diferentes receptores |
| Discriminação entre próprio e não próprio | Sim; células saudáveis do hospedeiro não são reconhecidas ou podem expressar moléculas que impedem o desenvolvimento de reações imunes inatas | Sim; baseada na eliminação ou inativação de linfócitos reativos ao próprio; pode ser imperfeita (levando à autoimunidade) |
O sistema imune inato reconhece estruturas moleculares que são características de patógenos microbianos, mas não de células mamíferas. As substâncias microbianas que estimulam a imunidade inata são denominadas padrões moleculares associados aos patógenos (PAMP). Diferentes classes de micro-organismos (p. ex., vírus, bactérias gram-negativas, bactérias gram-positivas e fungos) expressam diferentes PAMP. Estas estruturas incluem ácidos nucleicos presentes exclusivamente em micro-organismos (como o RNA de fita dupla encontrado em vírus em replicação e as sequências de CpG não metiladas do DNA encontradas em bactérias), proteínas com características observadas em micro-organismos, como proteínas cuja síntese é iniciada por N-formilmetionina (típica de bactérias) e lipídios e carboidratos complexos que são sintetizados por micro-organismos, mas não por células de mamíferos (como o lipopolissacarídeo [LPS] de bactérias gram-negativas, o ácido lipoteicoico de bactérias gram-positivas, e oligossacarídeos ricos em manose observados em glicoproteínas microbianas, mas não nos mamíferos) (Tabela 4-2). Na verdade, existe apenas um número limitado de diferenças fundamentais entre as moléculas microbianas e as moléculas produzidas por organismos superiores. Assim, o sistema imune inato evoluiu para reconhecer somente um número limitado de moléculas, cuja maioria é unicamente encontrada em micro-organismos, enquanto o sistema imune adaptativo é capaz de reconhecer uma gama de substâncias estranhas muito mais ampla, sejam ou não produtos microbianos.
TABELA 4-2 Exemplos de PAMP e DAMP
| Padrões Moleculares Associados aos Patógenos | Tipo de Micro-organismo | |
|---|---|---|
| Ácidos nucleicos | ||
| Proteínas | ||
| Lipídios de parede celular | ||
| Carboidratos | ||
| Padrões Moleculares Associados a Danos | ||
| Proteínas induzidas por estresse | HSP | |
| Cristais | Urato monossódico | |
| Proteínas nucleares | HMGB1 | |
CpG, citidina-guanina dinucleotídeo; dsRNA, RNA de dupla fita; HMGB1, grupo box de alta mobilidade 1; HSP, proteínas de choque térmico; LPS, lipopolissacarídeo; ssRNA, RNA de fita simples.
O sistema imune inato reconhece produtos microbianos que são frequentemente essenciais à sobrevivência destes micro-organismos. Esta característica do reconhecimento imune inato é importante, uma vez que garante que os alvos da imunidade inata não possam ser perdidos pelos micro-organismos na tentativa de evitar seu reconhecimento pelo hospedeiro. Um exemplo de alvo da imunidade inata que é essencial aos micro-organismos é o RNA viral de fita dupla, que desempenha um importantíssimo papel na replicação de certos vírus. Da mesma maneira, o LPS e o ácido lipoteicoico são componentes estruturais de paredes celulares bacterianas que são reconhecidos por receptores da imunidade inata; estas duas moléculas são necessárias à sobrevivência bacteriana e não podem ser perdidas. Por outro lado, como veremos no Capítulo 15, os micro-organismos podem sofrer mutações ou perder muitos dos antígenos que são reconhecidos pelo sistema imune adaptativo, permitindo, assim, sua evasão da defesa do hospedeiro sem comprometer sua própria sobrevivência.
O sistema imune inato também reconhece moléculas endógenas que são produzidas ou liberadas por células danificadas ou mortas. Estas substâncias são denominadas padrões moleculares associados a danos (DAMP) (Tabela 4-2). Os DAMP podem ser produzidos como resultado de danos celulares provocados por infecções, mas também podem indicar a ocorrência de lesões celulares assépticas causadas por diversos mecanismos, como toxinas químicas, queimaduras, traumas ou redução do suprimento sanguíneo. Os DAMP geralmente não são liberados de células mortas por apoptose. Em alguns casos, células saudáveis do sistema imune são estimuladas a produzir e liberar DAMP, aumentando a resposta imune inata às infecções.
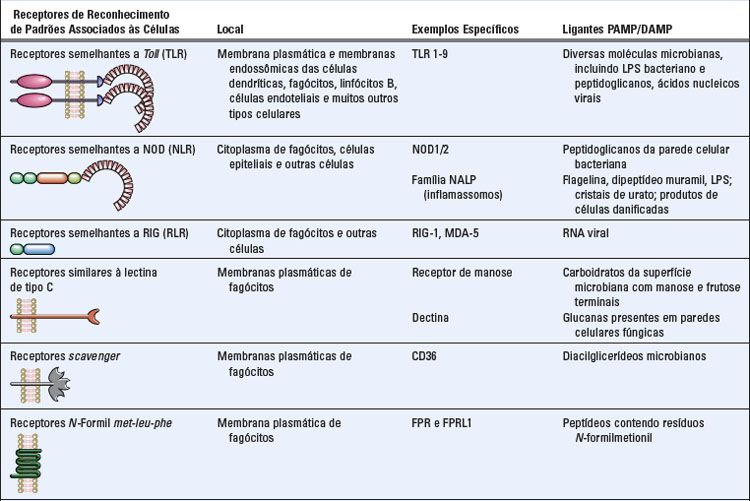
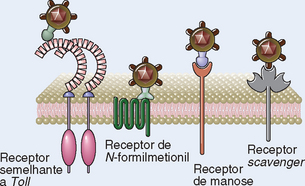
O sistema imune inato usa diversos tipos de receptores celulares, presentes em diferentes localizações nas células, e moléculas solúveis no sangue e nas secreções de mucosas para reconhecer PAMP e DAMP (Tabela 4-3). Moléculas de reconhecimento associadas a células do sistema imune inato são expressas por fagócitos (principalmente macrófagos e neutrófilos), células dendríticas, células epiteliais (que compõem a interface da barreira entre o corpo e o ambiente externo) e muitos outros tipos celulares de tecidos e órgãos. Estes receptores celulares de patógenos e moléculas associadas a lesões são frequentemente chamados de receptores de reconhecimento de padrões. Tais receptores são expressos na membrana plasmática ou na membrana endossômica de diversos tipos celulares e também em seu citoplasma. Estas diversas localizações de receptores garantem que o sistema imune inato possa responder a micro-organismos presentes fora das células ou no interior de diferentes compartimentos celulares (Fig. 4-1). Quando estas moléculas de reconhecimento de padrões associadas às células se ligam a PAMP e DAMP ativam eventos de transdução de sinal que promovem as funções antimicrobianas e pró-inflamatórias das células em que são expressas. Além disso, existem muitas proteínas presentes no sangue e nos fluidos extracelulares (Tabela 4-3) que reconhecem PAMP. Estas moléculas solúveis são capazes de facilitar a eliminação de micro-organismos do sangue e de fluidos extracelulares por aumentar sua ingestão por células ou ativar mecanismos extracelulares de morte.
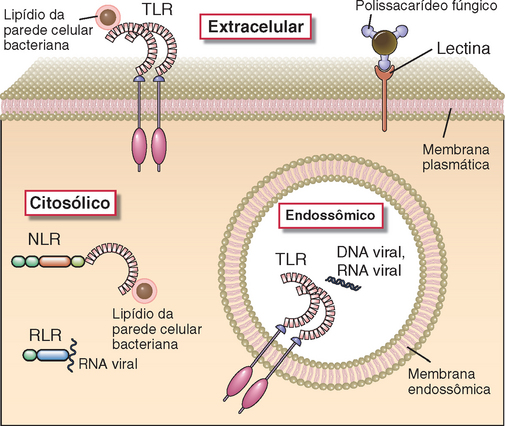
FIGURA 4-1 Localizações celulares das moléculas de reconhecimento de padrões do sistema imune inato. Algumas moléculas de reconhecimento de padrões da família TLR (Fig. 4-2) são expressas na superfície celular, onde podem se ligar a padrões moleculares extracelulares associados aos patógenos. Outros TLR são expressos em membranas endossômicas e reconhecem ácidos nucleicos de micro-organismos que foram fagocitados por células. As células também apresentam sensores citoplasmáticos de infecção microbiana (discutidos mais adiante neste capítulo), incluindo a família NLR de proteínas, que reconhece peptidoglicanos bacterianos, receptores RIG-símile (que se ligam ao RNA viral) e receptores lectina-símile da membrana plasmática (que reconhecem glicanas fúngicas). Os receptores citoplasmáticos que reconhecem produtos de células danificadas, bem como alguns micro-organismos, são mostrados na Figura 4-4.
Os receptores do sistema imune inato são codificados por genes em sua sequência germinativa, enquanto os receptores da imunidade adaptativa são gerados por mecanismos de recombinação somática a partir de genes receptores em precursores de linfócitos maduros. Assim, o repertório de especificidades dos receptores do sistema imune inato é pequeno quando comparado ao dos linfócitos B e T do sistema imune adaptativo. Estima-se que o sistema imune inato possa reconhecer cerca de 103 padrões moleculares. Por sua vez, o sistema imune adaptativo é capaz de reconhecer 107 ou mais antígenos distintos. Além disso, enquanto o sistema imune adaptativo pode diferenciar antígenos de diferentes micro-organismos da mesma classe e mesmo diferentes antígenos de um micro-organismo, a imunidade inata pode diferenciar apenas classes de micro-organismos, ou apenas produtos de células danificadas, mas não espécies particulares de micro-organismos ou tipos celulares.
O sistema imune inato não reage contra células e tecidos normais e saudáveis. Esta característica é essencial à saúde do organismo. É determinada, em parte, pela especificidade dos mecanismos da imunidade inata a PAMP e DAMP e, em parte, por proteínas reguladoras expressas por células normais, que impedem a ativação de diversos componentes da imunidade inata. Discutiremos exemplos de tal regulação mais à frente, neste capítulo.
RECEPTORES CELULARES DE RECONHECIMENTO DE PADRÕES DA IMUNIDADE INATA
Com esta introdução, podemos passar a discutir a grande variedade de moléculas do corpo capaz de reconhecer PAMP e DAMP, examinando sua especificidade, localização e funções. Começaremos pelos PAMP e DAMP expressos em membranas ou citoplasma celulares. As moléculas solúveis de reconhecimento e as moléculas efetoras da imunidade inata, encontradas no sangue e nos fluidos extracelulares, são descritas mais adiante.
A maioria dos tipos celulares expressa receptores de reconhecimento de padrões e, portanto, é capaz de participar de respostas imunes inatas. Fagócitos, incluindo neutrófilos e macrófagos, e células dendríticas expressam as maiores variedades e quantidades destes receptores, o que é consistente com seu papel fundamental na detecção de micro-organismos e células danificadas e sua ingestão objetivando sua eliminação (como o fazem os neutrófilos e macrófagos), ou na indução de uma reação tendo como meta estimular a inflamação com subsequente indução da imunidade adaptativa (o que é uma importante função das células dendríticas). Os receptores de reconhecimento de padrões são associados a vias intracelulares de transdução de sinal que ativam diversas respostas celulares, incluindo a produção de moléculas que promovem a inflamação e a defesa contra micro-organismos. Organizaremos nossa discussão ao redor das diversas classes de receptores celulares de reconhecimento de padrões, que apresentam diferentes estruturas e especificidades para diversos tipos de micro-organismos.
Receptores Semelhantes a Toll
Os receptores semelhantes a Toll (TLR), uma família evolutivamente conservada de receptores de reconhecimento de padrões, são expressos em muitos tipos celulares e reconhecem produtos de uma ampla variedade de micro-organismos. O gene Toll foi originalmente identificado em Drosophila como responsável pelo estabelecimento do eixo dorsoventral durante a embriogênese, mas, subsequentemente, descobriu-se que a proteína Toll também medeia respostas antimicrobianas nestes organismos. Esta descoberta levou à identificação de homólogos a Toll em mamíferos, que foram denominados receptores semelhantes a Toll (Toll-like receptors). Existem nove diferentes TLR funcionais em humanos, denominados TLR1 a TLR9 (Fig. 4-2). Os TLR são glicoproteínas do tipo I integrais de membrana que contêm repetições ricas em leucina flanqueadas por motivos característicos ricos em cisteína em suas regiões extracelulares, que estão envolvidas na interação com o ligante, e que também possuem um domínio de homologia Toll/receptor de IL-1 (TIR) em suas caudas citoplasmáticas, que é essencial à sinalização. Os domínios TIR são também encontrados nas caudas citoplasmáticas de receptores das citocinas IL-1 e IL-18, e vias similares de sinalização são usadas por TLR, IL-1 e IL-18.
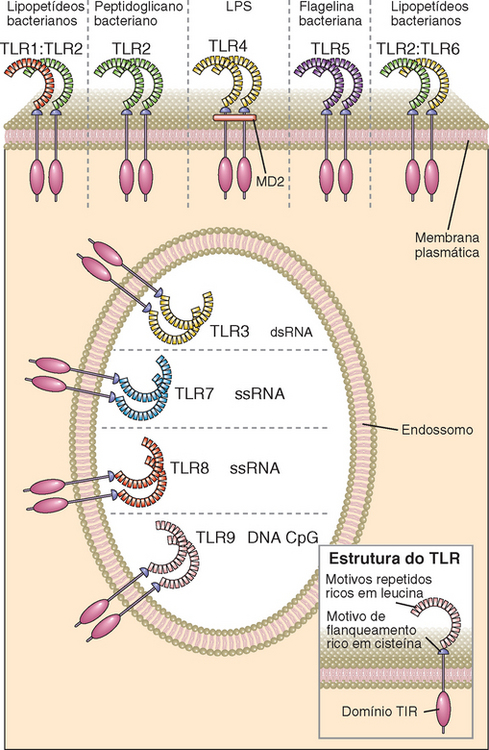
FIGURA 4-2 Estrutura, localização e especificidade dos TLR mamíferos. Note que alguns TLR são expressos em endossomos, e outros, na superfície celular.
Os TLR de mamíferos participam de respostas a uma grande variedade de moléculas expressas por micro-organismos, mas não por células saudáveis de mamíferos. Os ligantes reconhecidos pelos diferentes TLR são estruturalmente diversos e incluem produtos de todas as classes de micro-organismos (Fig. 4-2). Exemplos de produtos bacterianos que se ligam a TLR são o LPS e o ácido lipoteicoico, constituintes de paredes celulares de bactérias gram-negativas e bactérias gram-positivas, respectivamente, e a flagelina, uma subunidade proteica presente no flagelo de bactérias móveis. Exemplos de ligantes de TLR produzidos por vírus são RNA de fita dupla (que compõe o genoma de alguns vírus e é gerado durante o ciclo de vida da maioria dos vírus de RNA, mas não é produzido por células eucarióticas) e RNA de fita simples (que é diferente dos transcritos citoplasmáticos celulares de RNA de fita simples devido à sua localização em endossomos e à alta concentração de guanosina e uridina). Polissacarídeos ricos em manoses presentes em fungos (mananas) são também ligantes de TLR.
Os TLR também participam da resposta a moléculas endógenas cuja expressão ou localização indica dano celular. Exemplos de moléculas do hospedeiro que interagem com TLR incluem proteínas de choque térmico (HSP), que são chaperonas induzidas em resposta a diversos estímulos estressores às células, e a proteína do grupo box de alta mobilidade 1 (HMGB1), uma molécula expressa em grande quantidade que se liga ao DNA e que está envolvida na transcrição e no reparo gênico. Tanto as HSP quanto as HMGB1 são, normalmente, intracelulares, mas podem passar a ser extracelulares quando liberadas de células danificadas ou mortas. Quando localizadas extracelularmente, essas proteínas ativam a sinalização via TLR2 e TLR4 em células dendríticas, macrófagos e outros tipos celulares.
A base estrutural das especificidades do TLR reside nos múltiplos módulos extracelulares ricos em leucina encontrados nestes receptores, que se ligam diretamente aos PAMP ou a moléculas adaptadoras que interagem com PAMP. Existem entre 16 e 28 repetições ricas em leucina nos TLR, e cada um destes módulos é composto por 20 a 30 aminoácidos, incluindo motivos LxxLxLxxN conservados (onde L é leucina, x é qualquer aminoácido e N é asparagina) e resíduos de aminoácidos que variam entre os diferentes TLR. Os resíduos variáveis dos módulos de interação com o ligante compõem uma superfície convexa formada por α-hélices e alças β. Estas repetições contribuem para a capacidade de ligação a moléculas hidrofóbicas, como o LPS bacteriano, apresentada por alguns TLR. Os domínios ricos em leucina são responsáveis pelas interações físicas entre os TLR e a formação de dímeros desta molécula. O repertório de especificidades do sistema TLR é aumentado pela capacidade de formação de heterodímeros destas moléculas. Dímeros de TLR2 e TLR6, por exemplo, são necessários às respostas a peptidoglicanas.
As especificidades dos TLR são também influenciadas por diversas moléculas acessórias não TLR. Um bom exemplo é a resposta de TLR4 ao LPS. O LPS primeiro se liga a uma proteína solúvel específica no sangue ou no fluido extracelular, e este complexo facilita a interação entre o LPS e a superfície da célula respondedora. Uma proteína extracelular chamada MD2 (proteína de diferenciação mieloide 2) se liga ao componente lipídico A do LPS, formando um complexo que, então, interage com TLR4 e inicia a sinalização. Outra proteína, chamada CD14, é também necessária à sinalização eficiente induzida por LPS. O CD14 é expresso pela maioria das células (à exceção das células endoteliais) como uma proteína solúvel ou como uma proteína de membrana associada às membranas citoplasmáticas por âncoras de glicofosfatidilinositol. Tanto CD14 quanto MD2 podem também se associar a outros TLR. Assim, diferentes combinações de moléculas acessórias em complexos TLR podem aumentar a variedade de produtos microbianos que podem induzir respostas imunes inatas.
Os TLR são encontrados na superfície celular e em membranas intracelulares e, assim, são capazes de reconhecer micro-organismos em diferentes localizações celulares (Fig. 4-2). Os TLR 1, 2, 4, 5 e 6 são expressos na membrana plasmática, onde reconhecem diversos PAMP no ambiente extracelular. Alguns dos mais potentes estímulos microbianos para as respostas imunes inatas são moléculas que se ligam a estes TLR de membrana plasmática, como o LPS e o ácido lipoteicoico bacterianos, que são reconhecidos por TLR 2 e 4, respectivamente. Por sua vez, os TLR 3, 7, 8 e 9 são expressos principalmente no interior das células, no retículo endoplasmático e nas membranas endossômicas, onde detectam diferentes ligantes de ácido nucleico (Fig. 4-2). Alguns destes ácidos nucleicos são expressos de forma muito mais abundante por micro-organismos do que por mamíferos, como RNA de fita dupla, que é sintetizado por vírus de RNA e se liga a TLR3, e motivos CpG não metilados comuns em DNA procariótico, que se liga ao TLR9. O RNA de fita simples, que se liga ao TLR8, e o DNA de fita simples ou dupla, que se liga ao TLR9, não são unicamente expressos por micro-organismos, mas a relativa especificidade destas moléculas a produtos microbianos é associada à sua localização endossômica. O RNA e o DNA das células do hospedeiro não são normalmente encontrados em endossomos, mas os RNA e DNA microbianos podem terminar em endossomos de neutrófilos, macrófagos ou células dendríticas quando os micro-organismos são fagocitados por estas células. Além disso, o DNA do hospedeiro de células mortas devido à infecção, ou por outras causas, pode terminar em endossomos dos fagócitos. Em outras palavras, os TLR 3, 7, 8 e 9 podem diferenciar componentes próprios saudáveis de moléculas estranhas ou próprias que só são detectados quando as células são danificadas. Uma proteína do retículo endoplasmático, chamada UNC-93B, é necessária à localização endossômica e ao funcionamento adequado de TLR 3, 7, 8 e 9.
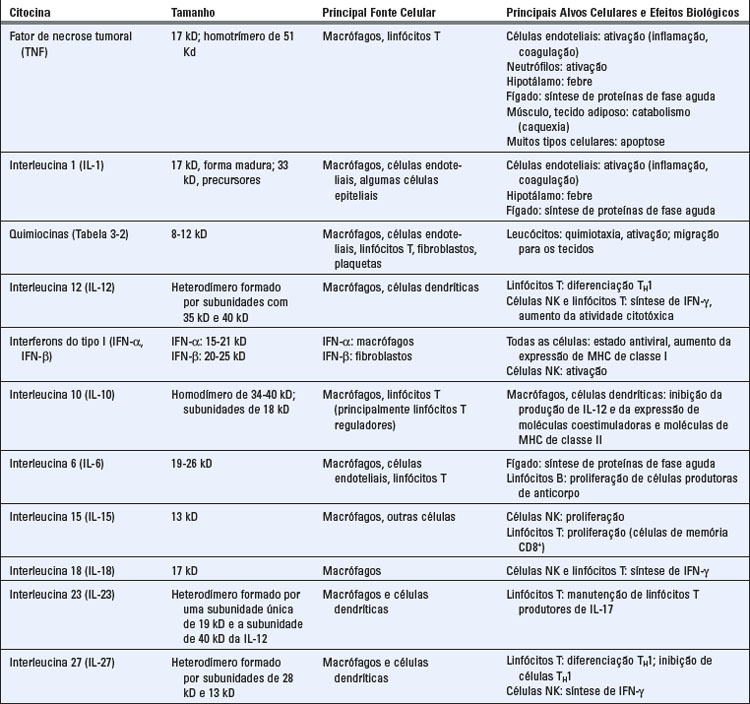
O reconhecimento de ligantes microbianos por TLR leva à ativação de diversas vias de sinalização e, por fim, de fatores de transcrição, que induzem a expressão de genes cujos produtos são importantes para o desenvolvimento de respostas inflamatórias e antivirais (Fig. 4-3). As vias de sinalização são iniciadas pela interação entre ligante e TLR na superfície celular, no retículo endoplasmático ou nos endossomos, levando à dimerização das proteínas TLR. A dimerização do TLR induzida por ligante é feita pela aproximação de domínios TIR das caudas citoplasmáticas de cada proteína. A seguir, há o recrutamento do domínio TIR contendo proteínas adaptadoras, o que facilita o recrutamento e a ativação de diversas proteínas cinases, levando à ativação de diferentes fatores de transcrição. Os principais fatores de transcrição que são ativados pelas vias de sinalização dos TLR são o fator nuclear κB (NF-κB), a proteína ativadora 1 (AP-1), o fator de resposta ao interferon 3 (IRF3) e ao IRF7. O NF-κB e a AP-1 estimulam a expressão de genes que codificam muitas das moléculas necessárias às respostas inflamatórias, incluindo citocinas inflamatórias (p. ex., TNF e IL-1), quimiocinas (p. ex., CCL2 e CXCL8) e moléculas de adesão endotelial (p. ex., E-selectina) (discutidas a seguir). O IRF3 e o IRF7 promovem a produção de interferons de tipo I (IFN-α e IFN-β), importantes para o desenvolvimento de respostas imunes inatas antivirais.
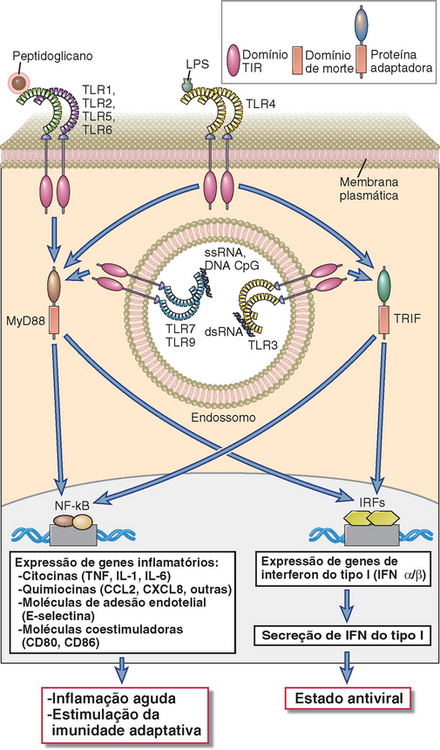
FIGURA 4-3 Funções de sinalização dos TLR. Os TLR 1, 2, 5 e 6 usam a proteína adaptadora MyD88 e ativam os fatores de transcrição NF-κB e AP-1. O TLR3 usa a proteína adaptadora TRIF e ativa os fatores de transcrição IRF3 e IRF7. O TLR4 pode ativar ambas as vias. Os TLR 7 e 9 presentes no endossomo utilizam MyD88 e ativam NF-κB e IRF7 (não mostrados).
Diferentes combinações de intermediários adaptadores e sinalizadores são usados por diferentes TLR, o que é a base dos efeitos comuns e únicos destas moléculas. Os TLR de superfície celular que se engajam ao adaptador MyD88, por exemplo, levam à ativação de NF-κB, e a sinalização por TLR que usa o adaptador chamado TRIF (domínio TIR contendo adaptador que induz IFN-β) leva à ativação de IRF3. Todos os TLR, à exceção do TLR3, sinalizam através de MyD88 e são, portanto, capazes de ativar NF-κB e induzir respostas inflamatórias. A sinalização de TLR3 ocorre através de TRIF e, portanto, ativa IRF3, induzindo a expressão de interferons de tipo I. O TLR4 sinaliza através de MyD88 e TRIF e é capaz de induzir ambos os tipos de respostas. A sinalização dos TLR 7 e 9 endossômicos, que são mais expressos por células dendríticas plasmocitoides, se dá através de uma via dependente de MyD88 e independente de TRIF, que ativa NF-κB e IRF4. Portanto, TLR7 e TLR9, como o TLR4, induzem respostas inflamatórias e antivirais. Detalhes da ativação por NF-κB são discutidos no Capítulo 7.
Receptores Citosólicos de PAMP e DAMP
Além dos TLR ligados à membrana, que percebem patógenos fora das células ou em endossomos, o sistema imune inato também possui células equipadas com receptores de reconhecimento de padrões que detectam infecções ou danos celulares no citoplasma (Fig. 4-1 e Tabela 4-3). As duas principais classes destes receptores citoplasmáticos são os receptores semelhantes a NOD e os receptores semelhantes a RIG. Estes receptores citoplasmáticos, como os TLR, são associados a vias de transdução de sinal que promovem a inflamação ou a produção de interferon do tipo I. A capacidade do sistema imune inato de detectar infecção no citoplasma é importante, uma vez que partes dos ciclos normais de vida de alguns micro-organismos, como a tradução gênica viral e a montagem de partículas virais, ocorrem neste compartimento celular. Algumas bactérias e parasitas possuem mecanismos de escape das vesículas fagocíticas para o citoplasma. Os micro-organismos podem produzir toxinas que criam poros na membrana plasmática da célula hospedeira, incluindo membranas endossômicas, através dos quais as moléculas microbianas podem acessar o citoplasma. Estes poros podem também ser resultantes de alterações na concentração de moléculas endógenas no citoplasma, que são claros sinais de infecção e de dano, sendo então detectados pelos receptores citoplasmáticos.
Receptores Semelhantes a NOD
Os receptores semelhantes a NOD (NLR) compõem uma família de mais de 20 diferentes proteínas citosólicas, algumas das quais percebem PAMP e DAMP citoplasmáticos e recrutam outras proteínas, formando complexos de sinalização que promovem a inflamação. Esta família de proteínas recebe o nome NOD (proteína contendo domínio de oligomerização nucleotídica). As proteínas NLR características contêm pelo menos três diferentes domínios com estruturas e funções distintas. Dentre estes, incluem-se um domínio rico em repetições de leucina (que reconhece o ligante, similar ao observado em TLR), um domínio NACHT (proteína neuronal de inibição de apoptose [NAIP], CIITA, HET-E e TP1), que permite que os NLR se liguem uns aos outros e formem oligômeros, e um domínio efetor, que recruta outras proteínas, formando complexos de sinalização. Existem três subfamílias de NLR, cujos membros usam diferentes domínios efetores para iniciar a sinalização, chamados CARD, Pirina e BIR. Os NLR são encontrados em muitos tipos celulares, embora alguns apresentem distribuições teciduais restritas. Alguns dos NLR mais bem estudados são encontrados em células imunológicas, inflamatórias e de barreiras epiteliais.
As moléculas NOD1 e NOD2, membros da subfamília de NLR que contém o domínio CARD, são expressas no citoplasma de diversos tipos celulares, incluindo células epiteliais mucosas e fagócitos, e respondem a peptidoglicanas da parede celular bacteriana. NOD2 é particularmente expresso em grandes quantidades nas células intestinais de Paneth, onde estimula a expressão de substâncias antimicrobianas, chamadas defensinas, em resposta a patógenos. NOD1 reconhece substâncias derivadas, principalmente, de bactérias gram-negativas, enquanto NOD2 reconhece uma molécula distinta chamada dipeptídeo muramil, presente em organismos gram-negativos e gram-positivos. Estes peptídeos são liberados por bactérias intracelulares ou extracelulares; a presença destas últimas no citoplasma requer a utilização de mecanismos especializados de liberação de peptídeos nas células do hospedeiro. Estes mecanismos incluem os sistemas de secreção de tipo III e tipo IV, que evoluíram, em bactérias patogênicas, como formas de liberação de toxinas nas células do hospedeiro. Quando oligômeros de NOD reconhecem seus ligantes peptídicos, incluindo toxinas bacterianas, há uma alteração conformacional que permite que o domínio efetor CARD das proteínas NOD recrutem múltiplas cópias da cinase RIP2, formando um complexo de sinalização que foi denominado sinalossomo NOD. As cinases RIP2 destes complexos ativam NF-κB, que promove a expressão de genes inflamatórios, de maneira similar à sinalização dos TLR por MyD88, anteriormente discutida. NOD1 e NOD2 parecem ser importantes em respostas imunes inatas a patógenos bacterianos do trato gastrointestinal, como Helicobacter pylori e Listeria monocytogenes. Há grande interesse em descobrir se certos polimorfismos em NOD2 aumentam o risco de desenvolvimento de uma doença inflamatória intestinal chamada doença de Crohn, que provavelmente se deve a um defeito da resposta inata a organismos comensais e patogênicos presentes neste órgão. Além disso, mutações em NOD2 que aumentam a sinalização desta via provocam uma doença inflamatória sistêmica denominada síndrome de Blau.
A subfamília NLRP de NLR responde a PAMP e DAMP citoplasmáticos através da formação de complexos de sinalização chamados inflamassomos, que geram formas ativas da citocina inflamatória IL-1 (Fig. 4-4). Existem 14 NLRP (proteínas da família de NLR contendo domínio de pirina), sendo que muitos compartilham o domínio efetor Pirina, que recebe este nome devido à raiz grega pyro, que significa calor, por ter sido identificado pela primeira vez em um gene mutante associado a uma doença febril congênita. Os inflamassomos, contendo apenas três destes NLRP, foram bem estudados, notavelmente os IPAF/NLRC4, NLRP3 e NLRP1. Quando estes NLRP são ativados pela presença de produtos microbianos ou por alterações na quantidade de moléculas endógenas ou íons no citoplasma, eles se ligam a outras proteínas através de interações homotípicas entre domínios estruturais compartilhados, formando, portanto, um complexo designado inflamassomo. Após a interação com o ligante, por exemplo, diversas proteínas NLRP3 idênticas formam um oligômero, e cada NLRP3 do oligômero se liga a uma proteína adaptadora chamada ASC. Os adaptadores, então, se ligam à forma precursora inativa da enzima caspase 1, através de interações dos domínios de recrutamento de caspase presentes em ambas as proteínas. As caspases são proteases com resíduos de cisteína em seus sítios ativos que clivam as proteínas em resíduos de aspartato. A caspase 1 passa a ser ativa apenas após o recrutamento do complexo inflamassomo. Embora diversas outras caspases participem de uma forma de morte celular chamada apoptose (Cap. 14), a principal função da caspase 1 é clivar formas precursoras citoplasmáticas inativas de duas citocinas homólogas, chamadas IL-1β e IL-18. A clivagem por caspase 1 gera formas ativas destas citocinas, que, então, deixam a célula e desempenham diversas funções pró-inflamatórias. Descreveremos a ação destas citocinas e as respostas inflamatórias em detalhes mais à frente, neste capítulo. Por hora, é suficiente dizer que a inflamação induzida por IL-1 desempenha uma função protetora contra micro-organismos que incitam a formação do inflamassomo. Quando a atividade do inflamassomo é anormalmente estimulada, há a produção elevada de IL-1 a que pode provocar dano tecidual. Algumas das febres periódicas hereditárias (também chamadas síndromes autoinflamatórias), por exemplo, que são doenças raras caracterizadas por surtos repetidos de febre, inflamação e destruição tecidual, são causadas por mutações de ganho de função no gene NLRP3, e os antagonistas de IL-1 são muito eficazes em seu tratamento.
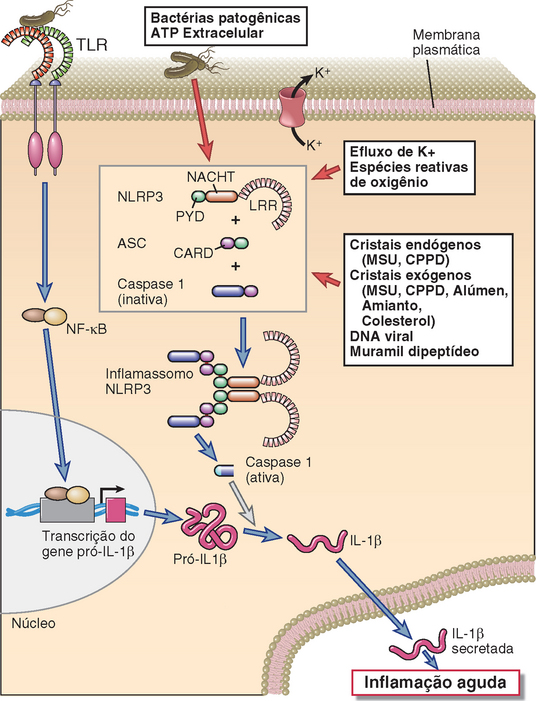
FIGURA 4-4 Um inflamassomo. A ativação do inflamassomo NLRP3, que processa a pró-IL-1β a IL-1 ativa, é mostrada. Os inflamassomos de outras proteínas NLRP funcionam de forma similar. A expressão de pró-IL-1β é induzida por diversos PAMP ou DAMP, através da sinalização do receptor de reconhecimento de padrão, como os TLR. CPPD, pirofosfato di-hidratado de cálcio; MSU, urato monossódico.
As respostas do NLRP-inflamassomo são induzidas por uma grande variedade de estímulos citoplasmáticos, incluindo produtos microbianos, cristais ambientais ou endógenos, e redução nas concentrações citoplasmáticas do íon potássio (K+), que são frequentemente associadas a infecções e estresses celulares (Fig. 4-4). Dentre os produtos microbianos que ativam os NLRP-inflamassomos, incluem-se moléculas bacterianas como flagelina, dipeptídeo muramil, LPS e toxinas formadoras de poros, assim como o RNA bacteriano e viral. Substâncias cristalinas são também potentes ativadores de inflamassomos, e estes cristais podem ser derivados do ambiente, como amianto ou sílica, ou ser endogenamente derivados de células mortas, como urato monossódico e pirofosfato desidratado de cálcio. Outros estímulos endógenos à ativação de inflamassomos é o ATP extracelular, talvez liberado por células mortas e transportados ao citoplasma da célula respondedora. A diversidade estrutural dos agentes que ativam o inflamassomo sugere que estes não se ligam diretamente às proteínas NLRP, mas podem agir por meio da indução de um pequeno conjunto de alterações das condições citoplasmáticas endógenas que ativam tais moléculas. As menores concentrações citoplasmáticas de íon potássio podem ser um destes mecanismos comuns, uma vez que, quando induzidas por alguma toxina bacteriana formadora de poros, podem ativar os inflamassomos, e muitos dos demais conhecidos ativadores de inflamassomos aumentam o efluxo de K+ das células. Outro mecanismo comum implicado na ativação do inflamassomo é a geração de espécies reativas de oxigênio, que são radicais livres tóxicos de oxigênio que são frequentemente produzidos durante lesões celulares. O tipo de inflamassomo que usa a proteína chamada AIM2 (ausente em melanoma 2), em vez de proteínas da família NLRP, reconhece DNA de fita dupla (dsDNA) citosólico.
A descoberta de que algumas substâncias cristalinas são potentes ativadores de inflamassomos mudou nosso entendimento de certas doenças inflamatórias. A gota é uma doença inflamatória dolorosa há muito conhecida por provocar a deposição de cristais de urato monossódico nas articulações. Com base em nosso conhecimento de que cristais de urato ativam o inflamassomo, há interesse em usar antagonistas de IL-1 no tratamento de casos graves de gota, que são resistentes aos fármacos anti-inflamatórios convencionais. Da mesma maneira, a pseudogota é causada pela deposição de cristais de pirofosfato de cálcio e ativação do inflamassomo. A inalação ocupacional de sílica ou amianto pode provocar doenças pulmonares inflamatórias e fibróticas crônicas, e há também interesse na possibilidade de bloqueio do inflamassomo ou administração de antagonistas de IL-1 em seu tratamento.
Receptores Semelhantes a RIG
Os receptores semelhantes a RIG (RLR) são sensores citosólicos de RNA viral que respondem a ácidos nucleicos de vírus através da indução da produção de interferons antivirais de tipo I. Os RLR podem reconhecer RNA de fita simples e dupla, inclusive os genomas de vírus de RNA transcritos de RNA e DNA vírus. Os dois RLR mais bem caracterizados são o RIG-I (gene indutível por ácido retinoico I) e o MDA5 (gene de melanoma associado à diferenciação 5). Estas duas proteínas contêm dois domínios de recrutamento de caspase na região N-terminal, que interagem com outras proteínas de sinalização, e um domínio RNA-helicase de função desconhecida. RIG-I e MDA5 apresentam diferentes especificidades para o RNA viral, parcialmente baseadas no comprimento do genoma do RNA de dupla fita, que podem aumentar a sensibilidade de detecção de uma ampla gama destes ácidos nucleicos de tamanhos diferentes. Os RLR também podem discriminar o RNA viral de fita simples de transcritos de RNA de fita simples de células normais. O RIG-I, por exemplo, apenas reconhece RNA com trifosfato 5′, que não é encontrado no RNA citoplasmático das células do hospedeiro, devido à adição de 7-metilguanosina ou remoção do trifosfato 5′. Os RLR são expressos por uma ampla variedade de tipos celulares, incluindo leucócitos derivados da medula óssea e diversas células teciduais. Estes receptores, portanto, permitem que muitos tipos celulares suscetíveis à infecção por vírus de RNA participem das respostas imunes inatas a estes patógenos.
Ao se ligarem ao RNA, os RLR iniciam eventos de sinalização que levam à ativação de IRF3 e IRF7, e estes fatores de transcrição induzem a produção de interferons de tipo I. Além disso, a sinalização por RLR pode também ativar NF-κB. A sinalização de RIG-I e MDA5 depende de sua ligação a proteínas adaptadoras e da ativação de cascatas de sinalização que provocam a ativação de IRF3/7 ou NF-κB.
Outros Receptores Celulares de Reconhecimento de Padrões
Diversos tipos de receptores citoplasmáticos e de membrana plasmática que não os anteriormente descritos são expressos em várias populações celulares e reconhecem moléculas microbianas (Tabela 4-3). Alguns destes receptores transmitem sinais de ativação, como os TLR, que promovem respostas inflamatórias e aumentam a morte de micro-organismos. Outros receptores participam principalmente da ingestão de micro-organismos pelos fagócitos.
Receptores de Carboidratos
Os receptores que reconhecem carboidratos na superfície de micro-organismos facilitam a fagocitose destes patógenos e estimulam o desenvolvimento das respostas imunológicas adaptativas subsequentes. Estes receptores pertencem à família das lectinas de tipo C, assim chamadas por se ligarem a carboidratos (lectinas) de modo dependente de Ca++ (daí, tipo C). Algumas destas lectinas são proteínas solúveis encontradas no sangue e em fluidos extracelulares (discutidas a seguir); outras são proteínas de membrana encontradas nas superfícies de macrófagos, células dendríticas e algumas células teciduais. Todas estas moléculas contêm um domínio conservado de reconhecimento de carboidratos. Existem diversos tipos lectinas de tipo C nas membranas plasmáticas, com especificidades para diferentes carboidratos, incluindo manose, glicose, N-acetilglicosamina e β-glucanas. De modo geral, estas lectinas de superfície celular reconhecem carboidratos encontrados nas paredes celulares de micro-organismos, mas não de células mamíferas. Algumas destas lectinas de tipo C atuam na fagocitose de patógenos, e outras desempenham funções de sinalização que induzem respostas protetoras nas células do hospedeiro aos micro-organismos.
• Receptor de manose. Uma das mais estudadas lectinas de membrana de tipo C é o receptor de manose (CD206), que atua na fagocitose de micro-organismos. Este receptor reconhece certos açúcares terminais presentes nos carboidratos da superfície microbiana, incluindo d-manose, l-fucose e N-acetil-d-glucosamina. Estes açúcares terminais são frequentemente encontrados na superfície de micro-organismos, enquanto os carboidratos de células eucarióticas tendem a apresentar terminações de galactose e ácido siálico. Assim, os açúcares terminais dos micro-organismos podem ser considerados PAMP. Os receptores de manose não possuem quaisquer funções intrínsecas conhecidas de sinalização e acredita-se que se liguem a micro-organismos na primeira etapa de sua ingestão por macrófagos e células dendríticas. No entanto, a importância da fagocitose mediada por esse receptor na eliminação dos micro-organismos ainda não é conhecida.
• Dectinas. A dectina 1 (lectina de tipo C associada à célula dendrítica 1) e a dectina 2 são receptores de célula dendrítica que reconhecem padrões de dois estágios do ciclo de vida de fungos. A dectina 1 se liga à β-glucana, que é o principal componente da forma leveduriforme de Candida albicans, um fungo ubíquo, mas potencialmente patogênico. A dectina 2 reconhece oligossacarídeos ricos em manose presentes nas hifas de Candida. Em resposta à interação com seus ligantes nas paredes celulares de fungos, estas duas dectinas induzem eventos de sinalização em células dendríticas que estimulam a produção de citocinas e outras proteínas que promovem a inflamação e estimulam as respostas imunológicas adaptativas. A estimulação das células dendríticas por dectinas induz a produção de algumas citocinas que promovem a diferenciação de linfócitos T CD4+ virgens (naïve) a um tipo de linfócito T efetor denominado TH17, que é particularmente eficaz na defesa contra infecções fúngicas. Outros receptores de carboidratos encontrados nas células dendríticas são a langerina (CD207), expressa principalmente por células de Langerhans epidérmicas, e DC-SIGN, expressa pela maioria das células dendríticas. DC-SIGN pode desempenhar um papel patogênico na promoção da infecção por HIV-1 nos linfócitos T. A glicoproteína gp120 do envelope do HIV-1 se liga ao DC-SIGN das células dendríticas em tecidos de mucosa; o vírus é, então, carreado pelas células dendríticas através dos vasos linfáticos até os gânglios linfáticos drenantes, onde é transferido a linfócitos T CD4+, infectando-os.
Receptores Scavenger
Os receptores scavenger formam um grupo de proteínas de membrana celular de estrutura e função diversas, que foram originariamente agrupadas com base em características comuns relacionados à ingestão de lipoproteínas oxidadas pelas células. Alguns destes receptores scavenger, incluindo SR-A e CD36, são expressos por macrófagos e medeiam a fagocitose de micro-organismos. Além disso, o CD36 atua como correceptor no reconhecimento e resposta ao ácido lipoteicoico e aos lipopeptídeos diacilados de origem bacteriana por TLR2/6. Uma ampla gama de estruturas moleculares pode se ligar aos receptores scavenger, incluindo LPS, ácido lipoteicoico, ácidos nucleicos, β-glucanas e proteínas. A importância dos receptores scavenger na imunidade inata é destacada pela maior suscetibilidade à infecção observada em camundongos que não possuem (knockout) tais receptores e pela observação de que diversos patógenos microbianos expressam fatores de virulência que bloqueiam o reconhecimento e a fagocitose por eles mediados.
Receptores N-Formil Met-Leu-Phe
Os receptores N-Formil met-leu-phe, incluindo FPR e FPRL1 expressos por neutrófilos e macrófagos, respectivamente, reconhecem peptídeos bacterianos contendo resíduos de metionida N-formilados (N-formilmetionil) e estimulam o movimento direcionado das células. Uma vez que todas as proteínas bacterianas e algumas proteínas dos mamíferos (apenas aquelas sintetizadas no interior das mitocôndrias) são iniciadas por N-formilmetionina, FPR e FPRL1 permitem que os fagócitos detectem e respondam preferencialmente a proteínas bacterianas. Os ligantes peptídicos bacterianos que interagem com estes receptores são alguns dos quimioatraentes primeiramente identificados e mais potentes para leucócitos. Os quimioatraentes incluem diversos tipos de moléculas, frequentemente produzidas nos sítios de infecção, que se ligam a receptores específicos nas células e direcionam seu movimento em direção à fonte destas substâncias. Outros quiomioatraentes, como as quimiocinas discutidas no Capítulo 3, são sintetizados pelas células do hospedeiro. FPR e FPRL1, assim como todos os outros receptores de quimiotáticos, pertencem a uma superfamília de receptores que atravessam setes vezes a membrana citoplasmática acoplados à proteína G que se liga à guanosina trifosfato (GTP) (GPCR). Estes receptores iniciam as respostas intracelulares através de proteínas G triméricas associadas (Cap. 7). As proteínas G estimulam muitos tipos de respostas celulares, incluindo alterações no citoesqueleto, aumentando a motilidade celular.
COMPONENTES CELULARES DO SISTEMA IMUNE INATO
As células do sistema imune inato realizam diversas funções que são essenciais para a defesa contra micro-organismos. Algumas células formam barreiras físicas que impedem infecções. Diversos tipos celulares expressam os vários receptores de reconhecimento de padrões que acabamos de discutir e, portanto, são capazes de reconhecer PAMP e DAMP e de produzir citocinas inflamatórias e proteínas antivirais, culminando com a morte dos micro-organismos ou eliminação de células infectadas. Além disso, algumas células da imunidade inata são críticas à estimulação das respostas imunes adaptativas subsequentes. Agora, discutiremos os tipos celulares que realizam tais funções.
Barreiras Epiteliais
Superfícies epiteliais intactas formam barreiras físicas entre os micro-organismos do ambiente externo e os tecidos do hospedeiro; além disso, as células epiteliais produzem substâncias químicas antimicrobianas que impedem a entrada de micro-organismos (Fig. 4-5). As principais interfaces entre o ambiente e o hospedeiro mamífero são a pele e as superfícies de mucosas dos tratos gastrointestinal, respiratório e genitourinário. Estas interfaces são revestidas por contínuas camadas de células epiteliais especializadas que desempenham muitas funções fisiológicas, incluindo a prevenção da entrada de micro-organismos. A perda de integridade destas camadas epiteliais, por traumas ou outras razões, predispõe o indivíduo a infecções. A função da barreira protetora é, em grande parte, física. As células epiteliais são muito próximas umas às outras, bloqueando a passagem de micro-organismos por entre elas. A camada externa de queratina, que se acumula com a morte dos queratinócitos da superfície cutânea, bloqueia a penetração microbiana em camadas mais profundas da epiderme. O muco, uma secreção viscosa contendo glicoproteínas chamadas mucinas, é produzido pelas células epiteliais respiratórias, gastrointestinais e urogenitais. O muco impede, fisicamente, a invasão microbiana e facilita a remoção de micro-organismos pela ação ciliar da árvore brônquica e do peristaltismo intestinal. Embora estas propriedades da barreira física sejam muito importantes na defesa do hospedeiro, outros mecanismos epiteliais de defesa evoluíram para complementá-las.
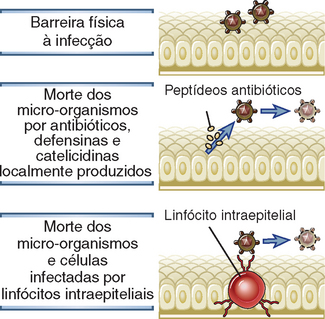
FIGURA 4-5 Barreiras epiteliais. Os epitélios nas portas de entrada dos micro-organismos são barreiras físicas, produzem substâncias antimicrobianas e albergam linfócitos intraepiteliais que aparentemente matam micro-organismos e células infectadas.
As células epiteliais, assim como alguns leucócitos, produzem peptídeos que apresentam propriedades antimicrobianas. Duas famílias estruturalmente distintas de peptídeos antimicrobianos são as defensinas e as catelicidinas.
• As defensinas são pequenos peptídeos catiônicos, com cerca de 29 a 34 aminoácidos de comprimento, que contêm três pontes dissulfeto intracadeias. As duas famílias de defensinas humanas, denominadas α e β, são diferenciadas pela localização destas pontes. As defensinas são produzidas por células epiteliais de superfícies de mucosa e por leucócitos contendo grânulos, incluindo neutrófilos, células assassinas naturais (natural killer − NK) e linfócitos T citotóxicos. Cada tipo celular produz uma determinada molécula de defensina. As células de Paneth no interior das criptas do intestino delgado são as principais células produtoras de defensinas α. As defensinas das células de Paneth são às vezes chamadas cripticidinas, e sua função é limitar a quantidade de micro-organismos no lúmen. As defensinas são também produzidas em outras áreas do intestino, em células mucosas respiratórias e na pele. Algumas defensinas são constitutivamente produzidas por alguns tipos celulares, mas sua secreção pode ser aumentada por citocinas ou produtos microbianos. Em outras células, as defensinas são produzidas apenas em resposta a citocinas e produtos microbianos. As ações protetoras das defensinas incluem efeitos tóxicos diretos aos micro-organismos, incluindo bactérias e fungos, e a ativação das células envolvidas nas respostas inflamatórias a micro-organismos. Os mecanismos de seus efeitos microbicidas diretos são pouco compreendidos.
• As catelicidinas são produzidas por neutrófilos e diversas barreiras epiteliais, incluindo a pele, o trato gastrointestinal e o trato respiratório. A catelicidina é sintetizada como precursor, com dois domínios de 18 kD, que é proteoliticamente clivado em dois peptídeos, ambos com funções protetoras. A síntese do precursor e a clivagem proteolítica podem ser estimuladas por citocinas inflamatórias e produtos microbianos. As catelicidinas ativas protegem contra infecções por múltiplos mecanismos, incluindo efeitos tóxicos diretos a uma ampla gama de micro-organismos e a ativação de diversas respostas em leucócitos e outros tipos celulares, que promovem a erradicação dos agentes infecciosos. O fragmento C-terminal, chamado LL-37, pode também se ligar ao LPS, um componente tóxico da parede externa de bactérias gram-negativas (anteriormente mencionado), e inativá-lo.
As barreiras epiteliais contêm certos tipos de linfócitos, incluindo linfócitos T intraepiteliais, que reconhecem e respondem aos micro-organismos comumente encontrados. Os linfócitos T intraepiteliais são encontrados na epiderme em epitélios mucosos. Diversos subtipos de linfócitos intraepiteliais são observados em diferentes proporções, dependendo da espécie animal e da localização tecidual. Estes subtipos são diferenciados, principalmente, pelos receptores de antígeno dos linfócitos T (TCR) que expressam. Alguns linfócitos T intraepiteliais expressam uma forma convencional do TCR, chamada αβ, que está presente na maioria das células T em tecidos linfoides. Outros linfócitos T epiteliais expressam uma forma do receptor de antígeno chamada γδ, que pode reconhecer antígenos peptídicos e não peptídicos. Uma característica comum destes linfócitos T é a limitada diversidade de seus receptores de antígeno quando comparados à maioria das células T do sistema imune adaptativo. Acredita-se que os linfócitos T intraepiteliais reconheçam um número limitado de estruturas microbianas comumente encontradas (p. ex., PAMP). Os linfócitos intraepiteliais podem atuar na defesa do hospedeiro através da secreção de citocinas, da ativação de fagócitos e da morte de células infectadas.
Fagócitos
Células que apresentam funções fagocíticas especializadas, principalmente macrófagos e neutrófilos, são a primeira linha de defesa contra micro-organismos que ultrapassam as barreiras epiteliais. Introduzimos estes tipos celulares no Capítulo 2, e discutiremos muitos outros detalhes de suas funções mais à frente, neste capítulo, e em outros trechos deste livro. Por hora, é importante saber que estas células fagocíticas realizam dois tipos gerais de funções na defesa contra micro-organismos. Primeiro, são capazes de internalizar e matar micro-organismos. Neutrófilos e macrófagos são particularmente bons nesta função. Segundo os fagócitos respondem aos micro-organismos produzindo diversas citocinas que promovem inflamação e também aumentam a função antimicrobiana das células do hospedeiro no sítio de infecção. Entre os “fagócitos profissionais”, os macrófagos são particularmente bons nesta segunda função. Os macrófagos estão também envolvidos no reparo de tecidos danificados, que é outra importante função na defesa do hospedeiro. Um papel essencial desempenhado pelos fagócitos na defesa imune inata contra agentes infecciosos é demonstrado pela alta taxa de infecções bacterianas e fúngicas letais em pacientes com baixos números de neutrófilos no sangue, causados por cânceres da medula óssea ou quimioterapia em pacientes com diferentes cânceres, ou ainda em pacientes com deficiências congênitas das funções fagocitárias.
Células Dendríticas
As células dendríticas desempenham funções essenciais de reconhecimento, além de papéis efetores, na imunidade inata. Introduzimos as células dendríticas no Capítulo 2, e seu papel na apresentação de antígenos aos linfócitos T é discutido no Capítulo 6. Lembre-se de que a célula dendrítica representa na verdade uma família heterogênea de células derivadas da medula óssea, com longos processos citoplasmáticos similares a dendritos, e que são constitutivamente encontradas em epitélios e muitos tecidos do corpo. Dadas as suas localização e morfologia, estas células detectam micro-organismos invasores. Além disso, as células dendríticas expressam mais tipos diferentes de TLR e receptores citoplasmáticos de reconhecimento de padrões do que qualquer outra população celular, tornando-as os mais versáteis sensores de PAMP e DAMP de todo o corpo. Um dado subtipo de células dendríticas, as células dendríticas plasmocitoides, assim chamadas por sua morfologia similar à de plasmócitos produtores de anticorpos, é a maior fonte de citocinas antivirais, os interferons de tipo I, sintetizadas em resposta às infecções virais. Esta característica das células dendríticas plasmocitoides se deve ao fato de que, em parte, estas células, mais do que qualquer outro tipo celular, expressam TLR endossômicos (TLR 3, 7, 8, 9) que reconhecem ácidos nucleicos dos vírus que foram internalizados pela célula. Discutiremos as ações antivirais dos interferons de tipo I em maiores detalhes mais à frente, neste capítulo.
As células dendríticas são as células mais eficientes em desencadear e direcionar respostas imunes adaptativas mediadas por linfócitos T, e isto depende de suas respostas imunes inatas aos micro-organismos. Esta capacidade reflete a habilidade das células dendríticas de internalizar antígenos proteicos microbianos, transportá-los aos gânglios linfáticos, onde estão os linfócitos T virgens, e apresentá-los de modo que possam ser reconhecidos por estes linfócitos. Estas funções serão discutidas em maior detalhe no Capítulo 6. É importante notar que a resposta inata mediada pelas células dendríticas aos PAMP é essencial para estas funções, que são aumentadas pela sinalização por TLR. Além disso, a sinalização por TLR induz a célula dendrítica a expressar moléculas, incluindo moléculas coestimuladoras e citocinas, que são necessárias, além do antígeno, à ativação de linfócitos T virgens e à sua diferenciação em células efetoras. Dependendo da natureza do micro-organismo que induz a resposta inata, a célula dendrítica direciona a diferenciação do linfócito T virgem em tipos distintos de células efetoras, como células TH1 produtoras de IFN-γ ou células TH17 produtoras de IL-17. A influência das células dendríticas na ativação do linfócito T e na sua diferenciação será mais discutida no Capítulo 9.
Células Assassinas Naturais (Natural Killer – NK)
As células assassinas naturais (natural killer − NK) são linfócitos distintos dos linfócitos T e B que desempenham importantes funções nas respostas imunes inatas, principalmente contra vírus e bactérias intracelulares. O termo natural killer deriva do fato de que estas células são capazes de realizar sua função de morte sem a necessidade de expansão clonal e diferenciação, o que é requerido para respostas efetoras de outras células assassinas do sistema imune diante de células do hospedeiro infectadas por micro-organismos, os linfócitos T citotóxicos (CTL). As células NK constituem 5% a 15% das células mononucleares do sangue e do baço, sendo raras em outros órgãos linfoides, mas são encontrados em grandes números no fígado e no útero gravídico. As células NK são originárias de precursores da medula óssea e parecem grandes linfócitos, com numerosos grânulos citoplasmáticos. As células NK não expressam os receptores de antígeno altamente diversos e clonalmente distribuídos característicos dos linfócitos B e T. Em vez disso, usam receptores codificados pelo DNA em sua configuração germinativa, discutidos a seguir, para diferenciar células infectadas por patógenos de células saudáveis. No sangue, as células NK podem ser identificadas pela expressão de CD56 e ausência de CD3, duas proteínas de membrana frequentemente encontradas juntas em CTL ativados.
Reconhecimento de Células Infectadas e sob Estresse pelas Células NK
As NK diferenciam células infectadas e sob estresse de células saudáveis, e sua ativação é regulada pelo equilíbrio entre sinais gerados por receptores de ativação e de inibição. Existem diversas famílias destes receptores (Fig. 4-6), e discutiremos alguns de seus membros mais adiante. Estes receptores reconhecem moléculas na superfície de outras células e geram sinais de ativação ou inibição que promovem ou inibem as respostas das células NK. De modo geral, os receptores de ativação reconhecem ligantes em células infectadas e danificadas, e os receptores de inibição reconhecem ligantes que são normalmente expressos nas células saudáveis normais. Quando uma célula NK interage com outra célula, o resultado é determinado pela integração dos sinais gerados pelo conjunto de receptores de ativação e inibição expressos pelas NK e que interagem com os ligantes das outras células. Dada a natureza estocástica de sua expressão, o conjunto de receptores de ativação e inibição expressos pelas células NK de qualquer indivíduo apresenta significativa diversidade. Assim, as células NK de um indivíduo respondem a diferentes tipos de micro-organismos ou células infectadas. Além disso, os genes que codificam muitos destes receptores são polimórficos; isto significa que existem diversas variantes gênicas em uma população, de modo que um indivíduo pode expressar formas ligeiramente diferentes de receptores do que outro indivíduo.
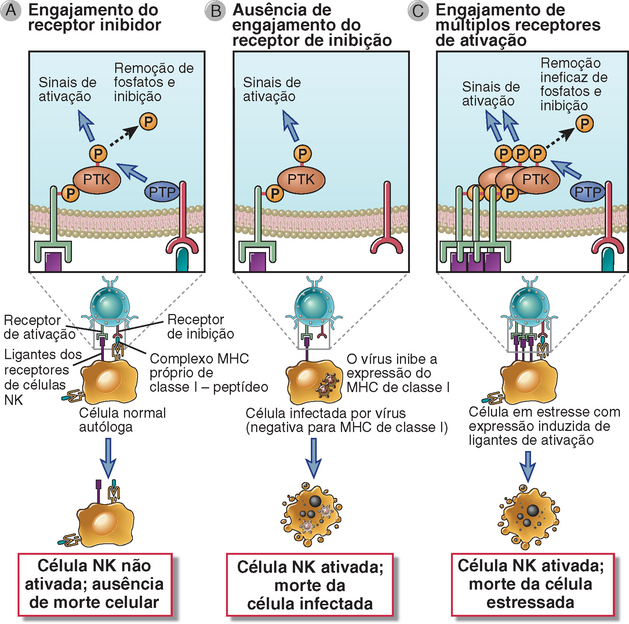
FIGURA 4-6 Funções dos receptores de ativação e inibição das células NK. A, Os receptores de ativação das células NK reconhecem ligantes em células-alvo e ativam a proteína tirosina cinase (PTK), cuja atividade é suprimida por receptores inibidores que reconhecem moléculas de MHC de classe I e ativam a proteína tirosina fosfatase (PTP). As células NK não matam eficientemente células saudáveis que expressam MHC de classe I. B, Caso uma infecção viral ou outro estresse iniba a expressão de MHC de classe I pelas células e induza a expressão de outros ligantes de ativação, o receptor inibidor da célula NK não é engajado e o receptor de ativação age sem oposição, desencadeando as respostas das células NK, como morte de células-alvo e secreção de citocina. C, Células estressadas por infecção ou transformação neoplásica podem expressar quantidades maiores de ligantes ativadores. Tais ligantes se ligam aos receptores de ativação da célula NK e induzem maior fosforilação da tirosina do que pode ser impedido pelas fosfatases associadas ao receptor inibidor, resultando em morte da célula em estresse. Os detalhes estruturais e os ligantes dos receptores de ativação e inibição das células NK são mostrados na Figura 4-7.
Muitas células NK expressam receptores inibidores que reconhecem moléculas do complexo principal de histocompatibilidade (MHC) de classe I, que são proteínas de superfície celular normalmente expressas por quase todas as células saudáveis do corpo (Fig. 4-7). A principal função das moléculas de MHC de classe I, além de seu papel na regulação da ativação das células NK, é apresentar os peptídeos derivados de proteínas citoplasmáticas, incluindo proteínas microbianas, na superfície celular, para serem reconhecidos por linfócitos T CD8+. Descreveremos a estrutura e a função das moléculas de MHC em relação ao reconhecimento de antígenos do linfócito T CD8+ no Capítulo 6. Por hora, é importante entender que as células NK usam tipos fundamentalmente diferentes de receptores do que os empregados pelos linfócitos T no reconhecimento de moléculas de MHC de classe I. Diferentemente dos linfócitos T, muitos dos receptores das células NK para moléculas de MHC de classe I respondem inibindo sua ativação. Isto é importante porque células normais expressam MHC de classe I, e muitos vírus e outros eventos que estressam as células levam à perda da expressão destas moléculas. Assim, as células NK interpretam a presença das moléculas de MHC de classe I como marcadores de células próprias normais, e sua ausência é uma indicação de infecção ou dano. Por sua vez, as células NK não recebem sinais de inibição de células infectadas ou sob estresse. Ao mesmo tempo, as células NK tendem a receber sinais de ativação destas mesmas células infectadas através de receptores de ativação. O resultado geral é a ativação das células NK, que secretam citocinas e matam a célula infectada ou sob estresse. Esta capacidade de ativação das células NK por células do hospedeiro que não apresentam MHC de classe I é chamada de reconhecimento da ausência de próprio.
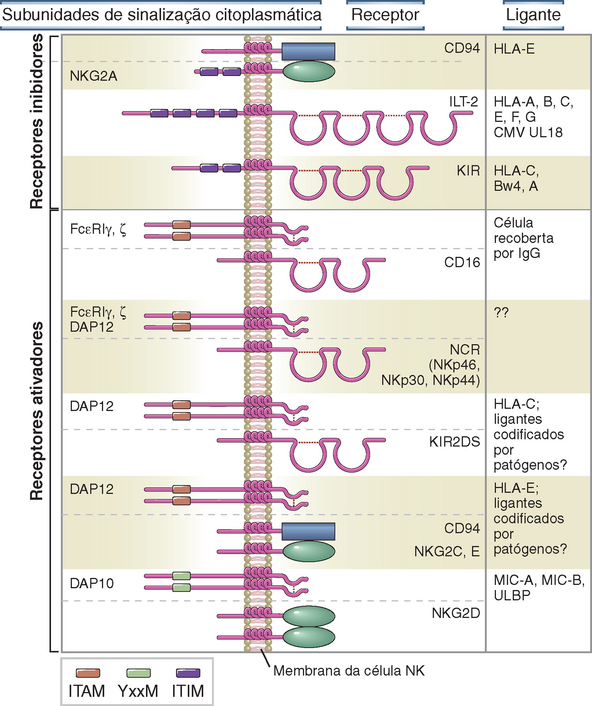
FIGURA 4-7 Estrutura e ligantes dos receptores de ativação e inibição das células NK. Exemplos de receptores inibidores e ativadores de células NK e seus ligantes. O CD16 e os receptores citotóxicos naturais (NCR) associam-se a homodímero de cadeia ζ, homodímeros FcεRIγ ou heterodímeros ζ-FcεRIγ. Existem diversos KIR, com especificidades de ligação variáveis.
Os receptores inibidores das células NK compartilham uma característica comum, o motivo estrutural de suas caudas citoplasmáticas, chamado motivo de inibição à base de tirosina do imunorreceptor (ITIM), que se liga às moléculas que bloqueiam as vias de sinalização dos receptores de ativação (Figs. 4-6 e 4-7). Os ITIM contêm resíduos de tirosina que são fosforilados seguindo a interação entre o ligante e o receptor inibidor. A fosoforilação desses ITIM leva ao recrutamento e à ativação de fosfatases que removem fosfatos de diversas proteínas ou lipídios envolvidos nas vias de sinalização gerados durante a ativação dos receptores de NK. O resultado final é o bloqueio das funções de sinalização dos receptores de ativação. Os ITIM são encontrados nas caudas citoplasmáticas de outros receptores além dos receptores inibidores de NK, e suas estruturas e funções de sinalização são discutidas com detalhes no Capítulo 7.
O maior grupo de receptores inibidores expressos nas NK é composto pelos receptores imunoglobulina-símile de células killer (KIR), que são membros da superfamília da imunoglobulina (Ig). Os membros desta família contêm um domínio estrutural chamado dobra Ig, identificado pela primeira vez em anticorpos (também conhecidos como Ig), discutidos no Capítulo 5. Os KIR se ligam a diversas moléculas de MHC de classe I. O segundo grupo importante de receptores inibidores de NK pertence à família das lectinas de tipo C, que inclui proteínas que se ligam a carboidratos, como anteriormente discutido. Um destes receptores é o heterodímero chamado CD94/NKG2A, que reconhece a molécula de MHC de classe I denominada HLA-E. É interessante notar que o HLA-E apresenta peptídeos derivados de outras moléculas de MHC de classe I; assim, em essência, o CD94/NKG2A é um receptor de vigilância de diversas moléculas de classe I de MHC. A terceira família de receptores inibidores das células NK, chamados receptores leucocitários Ig-símile (LIR), também é membro da superfamília da Ig que se liga a moléculas de MHC de classe I, embora com menor afinidade do que os KIR, e sendo a maioria expressa em linfócitos B do que em células NK.
Os receptores de ativação das células NK reconhecem um grupo heterogêneo de ligantes, alguns dos quais podem ser expressos por células normais e outros que são expressos principalmente por células que foram submetidas a estresse infeccioso ou metabólico. Os aspectos moleculares dos ligantes de muitos destes receptores não são bem caracterizados. A expressão induzida de ligantes em células não saudáveis, que interagem com os receptores de ativação das células NK, pode gerar sinais que suplantam os sinais dos receptores inibidores, especialmente quando a célula não saudável apresenta poucas, ou nenhuma, moléculas de MHC de classe I (Fig. 4-6).
A maioria dos receptores de ativação das células NK compartilha um motivo estrutural comum em suas caudas citoplasmáticas, chamado motivo de ativação à base de tirosina do imunorreceptor (ITAM), que participa de eventos de sinalização que promovem a morte da célula-alvo e a secreção de citocinas (Fig. 4-7). Em alguns destes receptores, uma única cadeia polipeptídica contém intracelularmente o ITAM e extracelularmente a porção capaz de interagir com o ligante. Em outros receptores, os ITAM estão em cadeias polipeptídicas separadas, como em FcεRIγ, ζ e DAP12, que não interagem com o ligante, mas são associados de forma não covalente à cadeia do receptor envolvida em reconhecer o ligante. Os ITAM são também encontrados em caudas citoplasmáticas de outros receptores de sinalização no sistema imune, incluindo os receptores de antígeno dos linfócitos T e B. Depois da interação entre o ligante e os receptores de ativação das células NK, os resíduos de tirosina dos ITAM são fosforilados por cinases citoplasmáticas e outras proteínas cinases são recrutadas, interagem com os ITAM fosforilados e são ativadas. Estas cinases aumentam a sinalização por fosforilarem outras proteínas. A estrutura e as funções de sinalização dos ITAM são discutidas em mais detalhes no Capítulo 7.
Muitos dos receptores de ativação das células NK são membros das famílias das lectinas de tipo C ou dos KIR, que também incluem receptores inibidores, como discutido anteriormente. Alguns dos receptores de ativação parecem se ligar a moléculas de MHC de classe I, como os receptores inibidores, mas não se sabe como estes receptores são preferencialmente ativados por células infectadas ou danificadas. Sabe-se também que os receptores de ativação reconhecem ligantes que não as clássicas moléculas de MHC. Um receptor de ativação das células NK da família das lectinas de tipo C bem conhecido é o NKG2D, que se liga a proteínas semelhantes às moléculas de MHC de classe I, incluindo MIC-A e MIC-B, que são encontradas em células infectadas por vírus e células tumorais, mas não em células normais. O receptor NKG2D é associado à subunidade de sinalização denominada DAP10, que apresenta motivos de sinalização diferentes dos ITAM encontrados em outros receptores de ativação, mas que também aumenta a citotoxicidade das células NK contra as células-alvo.
Outro importante receptor de ativação das células NK é o CD16 (FcγRIIIa), que é um receptor de baixa afinidade para anticorpos IgG. As moléculas de anticorpo apresentam regiões de ligação ao antígeno altamente variáveis e, no lado oposto, uma estrutura invariante, chamada região Fc, que interage com diversas outras moléculas do sistema imune. Descreveremos a estrutura dos anticorpos em detalhes no Capítulo 5, mas, por ora, é suficiente saber que o CD16 se liga à região Fc de certos tipos de anticorpo chamados IgG1 ou IgG3. O CD16 se associa a uma das três diferentes proteínas de sinalização contendo ITAM (p. ex., FcεRIγ, ζ e proteínas DAP12). Durante a infecção, o sistema imune adaptativo produz anticorpos IgG1 e IgG3 que, especificamente, se ligam aos micro-organismos e a seus antígenos nas células infectadas, e o CD16 das células NK pode se ligar às regiões Fc destas imunoglobulinas. Assim, o CD16 gera sinais de ativação, através de seus parceiros de sinalização, e as células NK podem matar as células infectadas que foram recobertas pelas moléculas de anticorpo. Este processo é chamado citotoxicidade mediada por células dependente de anticorpo; esta é uma função efetora da imunidade adaptativa e será discutida no Capítulo 12, quando falarmos da imunidade humoral.
A capacidade dos receptores de ativação em induzir respostas funcionais nas células NK é aumentada por citocinas. As principais citocinas do sistema imune inato que estimulam a função das células NK são IL-12, IL-15, IL-18 e interferons de tipo I (discutidos a seguir). Cada uma destas citocinas aumenta a atividade citotóxica das células NK e a quantidade da citocina IFN-γ secretada pelas células NK. O IFN-γ apresenta diversos efeitos antimicrobianos e será discutido em detalhes no Capítulo 10. Além disso, a IL-12 e a IL-15 são importantes fatores de crescimento para as células NK.
Os genes KIR são polimórficos, o que significa que existem diversas variantes alélicas na população humana, e os grupos de alelos KIR são frequentemente herdados juntos, de um único progenitor. Estes grupos de genes associados são denominados haplótipos KIR. Existem dois haplótipos KIR principais e alguns mais raros. Os haplótipos diferem quanto ao número de receptores codificados, e alguns apresentam mais ou menos receptores de ativação do que outros. Alguns haplótipos são associados à maior suscetibilidade a algumas doenças, incluindo aborto espontâneo e uveíte.
Funções Efetoras das Células NK
As funções efetoras das células NK são matar células infectadas e ativar os macrófagos para destruição dos micro-organismos fagocitados (Fig. 4-8). O mecanismo da citotoxicidade mediada por células NK é essencialmente o mesmo utilizado por CTL CD8+, que descreveremos em detalhes no Capítulo 10. As células NK, como os CTL, apresentam grânulos contendo proteínas que medeiam a morte das células-alvo. Quando as células NK são ativadas, a exocitose de seus grânulos liberam estas proteínas nas proximidades das células-alvo. Uma das proteínas presentes nos grânulos da célula NK, chamada perforina, facilita a entrada de outras proteínas dos grânulos, chamadas granzimas, no citoplasma das células-alvo. As granzimas são enzimas que iniciam a sequência de eventos de sinalização que provocam a morte das células-alvo por apoptose. As vias de sinalização que causam apoptose são discutidas no Capítulo 14. Por matarem as células infectadas por vírus e bactérias intracelulares, as células NK eliminam os reservatórios de infecção. Alguns tumores, principalmente aqueles de origem hematopoiética, são alvos das células NK, talvez porque as células tumorais não expressem níveis normais das moléculas de MHC de classe I.
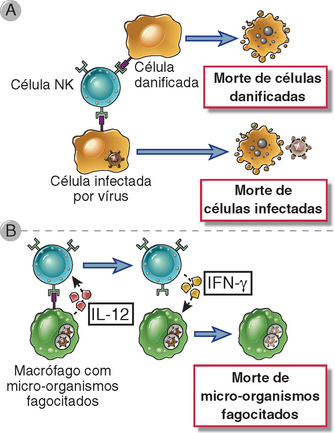
FIGURA 4-8 Funções das células NK. A, As células NK reconhecem ligantes em células infectadas ou submetidas a outros tipos de estresse, matando as células do hospedeiro. Dessa forma, as células NK eliminam os reservatórios de infecção, bem como células disfuncionais. B, As células NK respondem à IL-12 produzida por macrófagos e secretam IFN-γ, que induz os macrófagos a matar os micro-organismos fagocitados.
O IFN-γ derivado de células NK ativa macrófagos, como o IFN-γ produzido por linfócitos T, e aumenta a capacidade de morte das bactérias fagocitadas por estas células (Cap. 10). O IFN-γ produzido por células NK nos gânglios linfáticos pode também direcionar a diferenciação dos linfócitos T virgens em células TH1 (Cap. 9).
As células NK desempenham diversos papéis importantes na defesa contra micro-organismos intracelulares. As células NK matam as células infectadas por vírus antes da ativação completa de CTL antígeno-específicos, isto é, nos primeiros dias depois da infecção. Logo no início da infecção viral, as células NK são expandidas e ativadas por IL-12 e IL-15, e matam as células infectadas, especialmente aquelas que apresentam menores níveis de moléculas de MHC de classe I. Além disso, o IFN-γ secretado por células NK ativa macrófagos que destroem os micro-organismos fagocitados. Esta reação macrofágica mediada pelo IFN-γ dependente de células NK pode ajudar a controlar uma infecção por bactérias intracelulares, como Listeria monocytogenes, por vários dias ou semanas, e assim permite tempo para o desenvolvimento da imunidade mediada por linfócitos T, que erradica a infecção. A depleção de células NK aumenta a suscetibilidade à infecção por alguns vírus e bactérias intracelulares. Em camundongos deficientes em linfócitos T, a resposta das células NK pode manter a infecção por tais micro-organismos sob controle por algum tempo, mas os animais acabam sucumbindo, por não apresentarem a imunidade adaptativa celular. As células NK também podem ser importantes na fase tardia da resposta imune do hospedeiro por matar células infectadas que escaparam ao ataque imunológico mediado por CTL por apresentarem menor expressão de moléculas de MHC de classe I. Uma vez que as células NK podem matar certas células tumorais in vitro, foi também proposto que estas atuem sobre clones malignos in vivo.
Linfócitos T e B com Receptores de Antígeno de Especificidade Limitada
Como discutiremos em mais detalhes nos capítulos seguintes, a maioria dos linfócitos T e B é componente do sistema imune adaptativo e caracterizada por um repertório de especificidades altamente diverso para reconhecimento de diferentes antígenos. A diversidade dos receptores de antígeno é gerada pela recombinação somática aleatória de um grande grupo de segmentos de DNA encontrado na forma germinativa, assim como pela adição de sequências de nucleotídeos nas junções entre os segmentos recombinados, originando genes de receptores de antígeno únicos em cada clone de linfócito (Cap. 8). No entanto, certos subtipos de linfócitos T e B apresentam diversidade muito pequena, uma vez que as mesmas sequências dos genes de receptores de antígenos são recombinadas em cada clone e há pouca ou nenhuma modificação nas sequências de junção. Parece que estes subtipos de linfócitos T e B reconhecem estruturas compartilhadas que são expressas por muitas espécies microbianas diferentes e comumente encontradas; em outras palavras, reconhecem PAMP. Os subtipos de linfócitos T com limitada diversidade de receptores de antígeno incluem os linfócitos T assassinos naturais (natural killer) invariantes (iNKT), os linfócitos T γδ e os linfócitos T intraepiteliais com TCR αβ (já mencionados). Os subtipos de linfócitos B que produzem anticorpos de especificidade limitada são os linfócitos B-1 e os linfócitos B da zona marginal. Embora estes linfócitos T e B desempenhem funções efetoras similares aos seus equivalentes de maior diversidade clonal, a natureza de suas especificidades os coloca em uma categoria especial, já que são mais parecidos com as células efetoras da imunidade inata do que com as células da imunidade adaptativa. Estes subtipos especiais de linfócitos T e B são descritos nos Capítulos 10 e 11, respectivamente.
Mastócitos
Os mastócitos estão presentes na pele e no epitélio de mucosa e rapidamente secretam citocinas pró-inflamatórias e mediadores lipídicos em resposta a infecções e outros estímulos. Começamos a falar sobre os mastócitos no Capítulo 2. Lembre-se de que estas células apresentam abundantes grânulos citoplasmáticos contendo diversos mediadores inflamatórios que são liberados quando as células são ativadas, seja por produtos microbianos ou por um mecanismo especial dependente de anticorpos. Os grânulos contêm aminas vasoativas (como a histamina), que provocam vasodilatação e aumento da permeabilidade capilar, e enzimas proteolíticas que podem matar bactérias ou inativar toxinas microbianas. Os mastócitos também sintetizam e secretam mediadores lipídicos (como as prostaglandinas) e citocinas (como o TNF). Uma vez que mastócitos geralmente estão localizados nas proximidades de vasos sanguíneos (Fig. 2-1), o conteúdo de seus grânulos rapidamente induz alterações vasculares, que promovem a inflamação aguda. Os mastócitos expressam TLR, e os ligantes de TLR podem induzir sua desgranulação. Camundongos deficientes em mastócitos apresentam dificuldade de controle de infecções bacterianas, o que provavelmente se deve à alteração das respostas imunes inatas. Os produtos mastocitários também atuam na defesa contra helmintos e são responsáveis pelos sintomas de doenças alérgicas. Voltaremos a discutir os mastócitos e sua relação às doenças alérgicas no Capítulo 19.
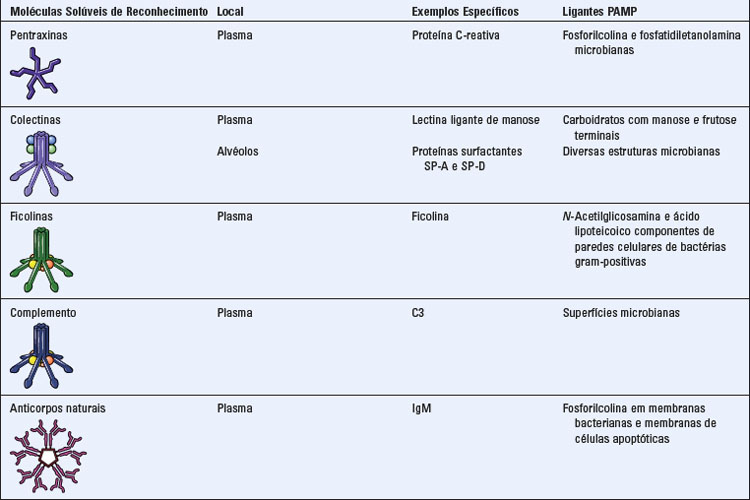
MOLÉCULAS SOLÚVEIS DE RECONHECIMENTO E MOLÉCULAS EFETORAS DA IMUNIDADE INATA
Diferentes tipos de moléculas que reconhecem micro-organismos e promovem respostas inatas são encontradas em forma solúvel no sangue e nos fluidos extracelulares. Estas moléculas são responsáveis pela primeira defesa contra patógenos presentes fora das células do hospedeiro em alguma parte de seu ciclo de vida. As moléculas efetoras solúveis atuam de duas formas principais.
• Por se ligarem aos micro-organismos, atuam como opsoninas e aumentam a capacidade de fagocitose pelos macrófagos, neutrófilos e células dendríticas. Isto ocorre porque as células fagocíticas expressam receptores de membrana específicos para as opsoninas, e estes receptores podem mediar, de forma eficiente, a internalização do complexo formado pela opsonina e o agente invasor.
• Depois da ligação aos micro-organismos, os mediadores solúveis da imunidade inata promovem respostas inflamatórias que induzem recrutamento adicional de mais fagócitos para os sítios de infecção, podendo também matá-los diretamente.
As moléculas efetoras solúveis são, às vezes, chamadas de mediadores humorais da imunidade inata, assim como os anticorpos são considerados como mediadores humorais da imunidade adaptativa. Os principais componentes do sistema imune inato humoral são os anticorpos naturais, o sistema complemento, as colectinas, as pentraxinas e as ficolinas. A seguir, descreveremos as principais características e funções destes componentes da imunidade inata.
Anticorpos Naturais
Muitos anticorpos com milhões de diferentes especificidades são produzidos nas respostas imunológicas humorais por linfócitos B e suas progênies, como parte do sistema imune adaptativo, e descreveremos as imunoglobulinas e as respostas dos linfócitos B em detalhes em capítulos posteriores. No entanto, existem subtipos de linfócitos B que produzem anticorpos com um número limitado de especificidades, sem exposição excessiva a antígenos estranhos, e estas imunoglobulinas são denominadas anticorpos naturais. Como observado em outros componentes da imunidade inata, os anticorpos naturais já estão presentes antes da infecção e reconhecem padrões moleculares comuns em micro-organismos ou células estressadas ou mortas. Os anticorpos naturais geralmente são específicos para moléculas de carboidrato ou lipídio, mas não proteínas, e a maioria é de isótipo IgM, uma das diferentes classes das moléculas de Ig (Cap. 5). A maioria dos anticorpos naturais em humanos e em camundongos é específica para lipídios oxidados, incluindo as regiões terminais de alguns fosfolipídios como lisofosfatidilcolina e fosforilcolina, encontradas em membranas bacterianas e em células apoptóticas, mas que não são expostas na superfície das células saudáveis do hospedeiro. Algumas evidências experimentais indicam que os anticorpos naturais específicos para estes fosfolipídios conferem proteção contra infecções bacterianas e facilitam a fagocitose de células apoptóticas. Os grupos de anticorpos sanguíneos anti-ABO, outro exemplo de anticorpos naturais, reconhecem certos glicolipídios (os antígenos de grupo sanguíneo) expressos na superfície de muitos tipos celulares, incluindo células sanguíneas. Os antígenos e anticorpos de grupo sanguíneo são importantes em transplantes, mas não na defesa do hospedeiro, e são discutidos no Capítulo 16.
O Sistema Complemento
O sistema complemento é composto por várias proteínas plasmáticas que trabalham juntas na opsonização de micro-organismos, na promoção do recrutamento de fagócitos para o sítio de infecção e, em alguns casos, na morte direta de patógenos (Fig. 4-9). A ativação do sistema complemento é baseada em cascatas proteolíticas, em que uma enzima precursora inativa, chamada zimógeno, é transformada em uma protease ativa que cliva, e portanto induz, a atividade proteolítica da próxima proteína do sistema complemento em uma cascata. Na sequência da cascata, as atividades enzimáticas resultam em uma tremenda amplificação da quantidade de produtos proteolíticos gerados. Estes produtos realizam as funções efetoras do sistema complemento. Outras cascatas proteolíticas são as vias de coagulação do sangue e o sistema cinina-calicreína que regula a permeabilidade vascular.
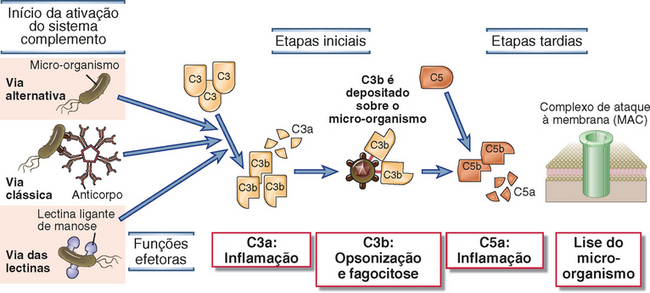
FIGURA 4-9 Vias de ativação do sistema complemento. A ativação do sistema complemento pode ser iniciada por três vias distintas, que levam à produção de C3b (nas primeiras etapas). O C3b inicia as etapas tardias de ativação do sistema complemento, culminando na produção de peptídeos que estimulam a inflamação (C5a) e em C9 polimerizado, que forma o complexo de ataque à membrana, assim chamado por criar orifícios em membranas plasmáticas. As funções mais importantes das principais proteínas produzidas nas diferentes etapas são mostradas. A ativação, as funções e a regulação do sistema complemento são discutidas em mais detalhes no Capítulo 12.
A primeira etapa de ativação do sistema complemento é o reconhecimento das moléculas nas superfícies microbianas, mas não nas células do hospedeiro. A ativação do sistema complemento pode ocorrer através de três distintas vias.
• A via clássica, assim chamada por ter sido a primeira a ser descoberta, usa uma proteína plasmática denominada C1q para detectar anticorpos ligados à superfície de um micro-organismo ou outra estrutura (Fig. 4-10). Após a ligação de C1q à porção Fc dos anticorpos, duas serina proteases associadas, chamadas C1r e C1s, são ativadas e iniciam a cascata proteolítica das demais proteínas do sistema complemento. A via clássica é um dos principais mecanismos efetores do braço humoral das respostas imunes adaptativas (Cap. 12). Uma vez que anticorpos naturais IgM são muito eficientes na ligação a C1q, a via clássica também participa da imunidade inata. Além disso, outras proteínas solúveis do sistema imune inato, chamadas pentraxinas, discutidas a seguir, podem se ligar a C1q e iniciar a via clássica.
• A via alternativa, descoberta mais tarde, mas que é filogeneticamente mais antiga do que a via clássica, é desencadeada quando uma proteína do sistema complemento chamada C3 reconhece, diretamente, certas estruturas da superfície microbiana, como o LPS bacteriano. O componente C3 é também constitutivamente ativado em solução em baixo nível e se liga a superfícies celulares, mas é, então, inibido por moléculas reguladoras presentes em células mamíferas. Uma vez que os micro-organismos não possuem estas proteínas reguladoras, a ativação espontânea pode ser amplificada nas superfícies microbianas. Assim, esta via pode diferenciar estruturas próprias normais de micro-organismos com base na presença ou ausência de proteínas reguladoras.
• A via das lectinas é desencadeada por uma proteína plasmática chamada lectina ligante de manose (MBL), que reconhece resíduos terminais de manose presentes em glicoproteínas e glicolipídios microbianos, assim como o receptor de manose das membranas de fagócitos, anteriormente descritas (Fig. 4-10). A MBL é um membro da família das colectinas (discutidas a seguir), com estrutura hexamérica similar à do componente C1q do sistema complemento. Depois que a MBL se liga aos micro-organismos, dois zimógenos chamados MASP1 (serina protease associada à lectina ligante de manana) e MASP2, com funções similares a C1r e C1s, se associam a ela e iniciam as etapas proteolíticas finais idênticas às da via clássica.
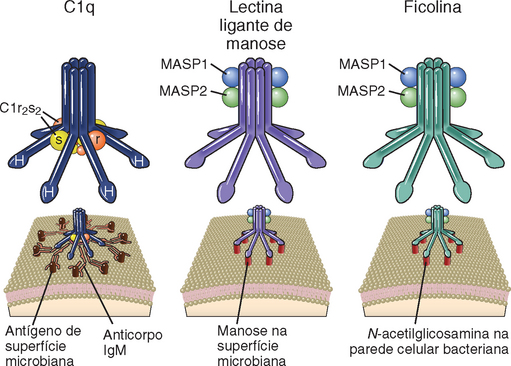
FIGURA 4-10 C1, lectina ligante de manose e ficolina. Estas três proteínas hexaméricas homólogas podem iniciar a ativação do sistema complemento ao se unirem aos seus ligantes nas superfícies celulares. As cabeças globulares da lectina de tipo C ao final das hastes colagenosas de C1q e da lectina ligante de manose se ligam às regiões Fc da IgM ou à manose presente na superfície de micro-organismos, respectivamente. As cabeças globulares similares ao fibrinogênio da ficolina se ligam à N-acetilglicosamina da superfície de micro-organismos. Esta ligação gera alterações conformacionais que ativam a serino protease de C1r e C1s, associadas a C1q, ou MASP1 e MASP2, associadas à lectina ligante de manose e à ficolina.
O reconhecimento de micro-organismos por qualquer uma das três vias do sistema complemento resulta no recrutamento sequencial e na montagem de outras proteínas deste sistema em complexos de proteases (Fig. 4-9). Um destes complexos, chamado C3 convertase, cliva a proteína central do sistema complemento, C3, produzindo C3a e C3b. O fragmento maior, C3b, se liga de forma covalente à superfície microbiana onde a via do sistema complemento foi ativada. C3b é uma opsonina que promove a fagocitose de micro-organismos. O fragmento menor, C3a, é liberado e estimula a inflamação por agir como quimiotático para neutrófilos. O C3b se liga a outras proteínas do sistema complemento, formando uma protease chamada C5 convertase, que cliva C5, gerando um peptídeo pequeno (C5a) e um fragmento maior (C5b) que permanece ligado à membrana microbiana. O C5a, além se ser quimiotático, induz alterações nos vasos sanguíneos, levando ao extravasamento de proteínas plasmáticas e fluidos nos sítios de infecção. O C5b inicia a formação de um complexo proteico do sistema complemento formado de C6, C7, C8 associados a vários C9, que são montados em uma estrutura denominada complexo de ataque à membrana (MAC), que provoca a lise das células em que o complemento é ativado.
O sistema complemento é um componente essencial da imunidade inata; pacientes com deficiências em C3 são altamente suscetíveis a infecções bacterianas recorrentes e frequentemente letais. No entanto, as deficiências genéticas na formação do MAC (o produto terminal da via clássica) aumentam a suscetibilidade a um número limitado de patógenos, principalmente bactérias do gênero Neisseria, que, por apresentarem paredes celulares delgadas, são especialmente sensíveis à ação lítica do MAC. O sistema complemento será discutido em mais detalhes no Capítulo 12.
Pentraxinas
Diversas proteínas plasmáticas que reconhecem estruturas microbianas e participam da imunidade inata pertencem à família das pentraxinas, que é um grupo filogeneticamente antigo de proteínas pentaméricas de estruturas homólogas. Os principais membros desta família são as pentraxinas curtas, a proteína C-reativa (CRP) e amiloide sérica (SAP) e a pentraxina longa PTX3. CRP e SAP se ligam a diversas espécies de bactérias e fungos. Os ligantes moleculares reconhecidos por CRP e SAP incluem a fosforilcolina e a fosfatidiletanolamina, respectivamente, que são encontradas em membranas bacterianas e células apoptóticas, como anteriormente discutido. A PTX3 reconhece diversas moléculas de fungos, de algumas bactérias gram-positivas e gram-negativas e de vírus. CRP, SAP e PTX3 ativam o sistema complemento por ligação a C1q, iniciando a via clássica.
As concentrações plasmáticas de CRP são muito baixas em indivíduos saudáveis, mas podem aumentar até 1.000 vezes durante infecções e em resposta a outros estímulos inflamatórios. O aumento dos níveis de CRP é resultado de sua maior síntese pelo fígado, induzida pelas citocinas IL-6 e IL-1, que são produzidas por fagócitos durante a resposta imune natural. A síntese hepática e os níveis plasmáticos de diversas outras proteínas, incluindo SAP e outras não relacionadas às pentraxinas, também aumentam em resposta a IL-1 e IL-6, e este grupo de proteínas plasmáticas é denominado proteínas de fase aguda.
A PTX3 é produzida por diversos tipos celulares, incluindo células dendríticas, macrófagos e células endoteliais, em resposta a ligantes de TLR e a citocinas inflamatórias, como TNF, mas não é uma proteína de fase aguda. A PTX3 é também armazenada em grânulos neutrofílicos e liberada quando os neutrófilos morrem. A PTX3 reconhece células apoptóticas e certos micro-organismos. Estudos realizados com camundongos knockout revelaram que a PTX3 confere proteção contra alguns micro-organismos, incluindo o fungo Aspergillus fumigatus.
Colectinas e Ficolinas
As colectinas pertencem a uma família de proteínas triméricas ou hexaméricas, em que cada subunidade contém uma cauda colagenosa conectada à região do pescoço por uma cabeça de lectina dependente de cálcio (tipo C). Três membros desta família atuam como moléculas efetoras solúveis no sistema imune inato; estas são a lectina ligante de manose (MBL) e as proteínas surfactantes pulmonares SP-A e SP-D.
A MBL, que é um receptor solúvel de reconhecimento de padrão que se liga aos terminais dos carboidratos ricos em manose e fucose, foi anteriormente discutida, quando falamos sobre a via das lectinas de ativação do sistema complemento (Fig. 4-10). A MBL pode também atuar como uma opsonina por se ligar aos micro-organismos e aumentar sua fagocitose. Lembre-se de que as opsoninas se ligam simultaneamente ao patógeno e aos receptores de superfície presentes nas membranas de fagócitos, e no caso da MBL, estes receptores são chamados receptores de C1q, uma vez que também se ligam a esta molécula. Este receptor medeia a internalização dos micro-organismos que são opsonizados pela MBL. O gene que codifica a MBL é polimórfico, e certos alelos são associados a alterações na formação do hexâmetro e redução dos níveis sanguíneos da molécula. Baixos níveis de MBL são associados à maior suscetibilidade a diversas infecções, especialmente quando combinados a outros estados de imunodeficiência.
As proteínas surfactantes A (SP-A) e D (SP-D) são colectinas com propriedades lipofílicas compartilhadas por outros surfactantes. Estas proteínas são encontradas nos alvéolos pulmonares, e suas principais funções parecem ser a mediação de respostas imunes inatas neste órgão. SP-A e SP-D se ligam a diversos micro-organismos e atuam como opsoninas, facilitando sua ingestão por macrófagos alveolares. Estas proteínas podem também inibir, diretamente, o crescimento bacteriano e ativar macrófagos. Camundongos deficientes em SP-A e SP-D apresentam menor resistência a diversas infecções pulmonares.
As ficolinas são proteínas plasmáticas que são estruturalmente similares às colectinas, apresentando um domínio colagenoso, mas, em vez de possuírem o domínio de lectina do tipo C, têm um domínio de reconhecimento de carboidratos semelhante ao fibrinogênio (Fig. 4-10). Estas proteínas se ligam a diversas espécies de bactérias, opsonizando-as e ativando o sistema complemento de maneira similar à MBL. Os ligantes moleculares das ficolinas incluem N-acetilglicosamina e o ácido lipoteicoico presente nas paredes celulares de bactérias gram-positivas.
Agora que discutimos as propriedades gerais e os diversos componentes do sistema imune inato, incluindo as células, os receptores celulares de reconhecimento de patógenos, as moléculas solúveis de reconhecimento e as moléculas efetoras, podemos ver como estes diversos componentes trabalham na proteção contra micro-organismos. As três principais formas utilizadas pelo sistema imune inato na proteção contra infecções são a indução de inflamação, a indução da defesa antiviral e a estimulação da imunidade adaptativa. Muitas destas reações são mediadas por citocinas, que desempenham papéis importantes e diversos na imunidade inata (Tabela 4-4). Como discutiremos a seguir, estas citocinas atuam principalmente nas proximidades de seu sítio de produção (ações parácrinas), mas algumas também podem ter efeitos distantes (ações endócrinas).
A RESPOSTA INFLAMATÓRIA
A principal forma pela qual o sistema imune inato lida com infecções e lesões teciduais é através da indução da inflamação aguda, que é o acúmulo de leucócitos, proteínas plasmáticas e fluidos derivados do sangue em um sítio de infecção ou lesão no tecido extravascular. Os leucócitos e as proteínas plasmáticas normalmente circulam no sangue e são recrutados aos sítios de infecção e lesão, onde realizam diversas funções efetoras que matam patógenos e iniciam o reparo do dano tecidual. O principal leucócito que é recrutado do sangue aos sítios de inflamação aguda é o neutrófilo, mas monócitos circulantes, que se transformam em macrófagos nos tecidos, tornam-se cada vez mais proeminentes com o passar do tempo e podem ser a população dominante em algumas reações. Entre as importantes proteínas plasmáticas que adentram os sítios inflamatórios estão as proteínas do sistema complemento, os anticorpos e as proteínas de fase aguda. A chegada destes componentes sanguíneos ao sítio inflamatório é dependente de alterações reversíveis nos vasos sanguíneos do tecido infectado ou danificado. Estas alterações incluem aumento do fluxo sanguíneo no tecido, conseguido através da dilatação arteriolar, maior adesão dos leucócitos circulantes ao revestimento endotelial das vênulas e aumento da permeabilidade de capilares e vênulas às proteínas plasmáticas e aos fluidos. Todas estas alterações são induzidas por citocinas e por pequenos mediadores moleculares inicialmente derivados de células residentes nos tecidos, como mastócitos, macrófagos e células endoteliais, em resposta à estimulação de PAMP ou DAMP. Com o desenvolvimento do processo inflamatório, os mediadores podem ser derivados de leucócitos recém-chegados e ativados e de proteínas do sistema complemento.
A inflamação aguda pode se desenvolver minutos a horas e perdura por dias. A inflamação crônica é um processo que ocorre após a inflamação aguda caso a infecção não seja eliminada ou em resposta a lesão tecidual prolongada. Este tipo de inflamação envolve o recrutamento e a ativação de monócitos e linfócitos. Sítios inflamatórios crônicos também frequentemente sofrem remodelamento tecidual, com angiogênese e fibrose. Embora os estímulos imunológicos inatos possam contribuir para o desenvolvimento da inflamação crônica, o sistema imune adaptativo pode também estar envolvido, já que as citocinas produzidas por linfócitos T são potentes indutores da inflamação (Cap. 10). Descrições detalhadas dos diversos mediadores e das manifestações patológicas da inflamação aguda e crônica podem ser encontradas em livros de patologia. Focaremos nossa discussão em aspectos particulares do processo inflamatório crônico que têm grande relevância na imunidade inata e adaptativa e nas doenças inflamatórias imunomediadas.
As Principais Citocinas Pró-inflamatórias: TNF, IL-1 e IL-6
Uma das primeiras respostas do sistema imune inato a infecções e danos teciduais é a secreção de citocinas por células, que é extremamente importante nas respostas inflamatórias agudas. Três das mais importantes citocinas pró-inflamatórias do sistema imune inato são o TNF, a IL-1 (que já mencionamos diversas vezes) e a IL-6 (Tabela 4-4). Os macrófagos e os mastócitos teciduais são as principais fontes destas citocinas, embora outros tipos celulares, incluindo células endoteliais e epiteliais, possam também produzir IL-1 e IL-6. Discutiremos as principais características destas citocinas, principalmente do TNF e da IL-1, antes de descrever seu papel na inflamação aguda.
Fator de Necrose Tumoral
O fator de necrose tumoral (TNF) é o mediador das respostas inflamatórias agudas a bactérias e outros micro-organismos infecciosos. O nome desta citocina é derivado de sua identificação original como substância sérica (fator) que provoca a necrose de tumores, agora sabidamente resultante da inflamação local e da trombose dos vasos sanguíneos na área neoplásica. O TNF é também chamado TNF-α, para sua diferenciação do TNF-β, também denominado linfotoxina. O TNF é produzido por macrófagos, células dendríticas e outros tipos celulares. Em macrófagos, é sintetizado como uma proteína de membrana não glicosilada de tipo II e expresso como homotrímero, capaz de se ligar a uma forma do receptor de TNF. A forma membranosa do TNF é clivada por uma metaloproteinase associada à membrana, liberando um fragmento polipeptídico, e três destas cadeias polipeptídicas são polimerizadas, constituindo proteínas circulantes de TNF em formato de pirâmide (Fig. 4-11). Os sítios de ligação ao receptor são localizados na base da pirâmide, permitindo a interação simultânea da citocina a três moléculas de receptor.
FIGURA 4-11 Estrutura do receptor de TNF ligado à linfotoxina. A estrutura em fita mostra a porção superior do complexo formado pelos três receptores de TNF (TNF-RI) e uma molécula de citocina ligada, revelada por cristalografia de raios X. A linfotoxina é um homotrímero em que as três subunidades são mostradas em azul- escuro. O homotrímero de linfotoxina forma uma pirâmide invertida de três lados, com sua base no topo, e o ápice, na porção inferior. As três moléculas de TNF-RI, mostradas em magenta, ciano e vermelho, ligam-se a um homotrímero de linfotoxina, e cada uma interage com dois diferentes monômeros de linfotoxina no complexo homotrímero. As pontes dissulfetos do receptor são mostradas em amarelo. O TNF é homólogo à linfotoxina e presumivelmente se liga a seus receptores da mesma maneira.
(De Banner DW, et al., Cell: Crystal structure of the soluble human 55 kd TNF-receptor–human TNFβ complex: 73:431-445. © Cell Press, 1993.)
Existem dois receptores distintos de TNF, chamados tipo I (TNF-RI) e tipo II (TNF-RII). A afinidade do TNF por seus receptores é incomumente baixa para uma citocina, com Kd de apenas 1 × 10−9 M para a ligação ao TNF-RI e de aproximadamente 5 × 10−10 M para a ligação ao TNF-RII. Os dois receptores de TNF são encontrados na maioria dos tipos celulares. Os receptores de TNF são membros de uma grande família de proteínas denominada superfamília do receptor de TNF, muitas das quais estão envolvidas em respostas imunológicas e inflamatórias. Estes receptores são expressos como trímeros na membrana plasmática. A ligação da citocina a alguns membros da família dos receptores de TNF, como TNF-RI, TNF-RII e CD40, leva ao recrutamento de proteínas chamadas fatores associados ao receptor de TNF (TRAF) aos domínios citoplasmáticos dos receptores. Os TRAF ativam fatores de transcrição, notavelmente NF-κB e AP-1. A ligação da citocina a outros membros da família, como TNF-RI, leva ao recrutamento de uma proteína adaptadora que ativa caspases e desencadeia a apoptose. Assim, diferentes membros da família de receptores de TNF podem induzir a expressão gênica ou a morte celular, e alguns podem fazer ambos (Cap. 7).
A produção de TNF por macrófagos é estimulada por PAMP e DAMP. TLR, NLR e RLR podem induzir a expressão gênica de TNF, em parte por ativação do fator de transcrição NF-κB. Muitos produtos microbianos podem, portanto, induzir a produção de TNF. Grandes quantidades desta citocina podem ser produzidas durante infecções por bactérias gram-negativas e gram-positivas, que liberam os ligantes de TLR, o LPS e ácido lipoteicoico, respectivamente, de suas paredes celulares. O choque séptico, uma doença letal provocada pela entrada de bactérias na corrente sanguínea, é mediado, em grande parte, por TNF. Discutiremos o choque séptico mais à frente, neste capítulo.
Interleucina 1
A interleucina 1 (IL-1) é também um mediador de respostas inflamatórias agudas e desempenha muitas ações similares ao TNF. A principal fonte celular de IL-1, assim como de TNF, é formada por fagócitos mononucleares ativados. Diferentemente do TNF, a IL-1 é também produzida por muitos tipos celulares que não os macrófagos, como neutrófilos, células epiteliais (p. ex., queratinócitos) e células endoteliais. Existem duas formas de IL-1, chamadas IL-1α e IL-1β, que apresentam homologia inferior a 30%, mas se ligam aos mesmos receptores celulares de superfície e desempenham as mesmas ações biológicas. A principal forma biologicamente ativa secretada é a IL-1β.
A produção de IL-1 geralmente requer dois sinais distintos, um que ativa a nova transcrição gênica com a produção do polipeptídeo precursor pró-IL-1β de 33 kD, e um segundo sinal que ativa o inflamassomo que irá clivar proteoliticamente o precursor, gerando a proteína IL-1β madura de 17 kD (Fig. 4-4). Como já discutido neste capítulo, a transcrição gênica de IL-1β é induzida pelas vias de sinalização TLR e NOD, que ativam NF-κB, enquanto a clivagem da pró-IL-1β é mediada por NLRP3 do inflamassomo. A IL-1 é secretada pela via não clássica, uma vez que, diferentemente da maioria das proteínas secretadas, nem IL-1α nem IL-1β apresentam sequências de sinalização hidrofóbicas que têm como alvo o polipeptídeo nascente à membrana do retículo endoplasmático. É possível que a IL-1 madura seja liberada principalmente quando as células infectadas ou os macrófagos ativados morrem. Algumas bactérias patogênicas induzem tanto o processamento mediado pelo inflamassomo da IL-1β e de IL-18 em macrófagos quanto a morte celular dependente de caspase 1, levando à liberação de citocinas inflamatórias. O TNF pode também estimular fagócitos e outros tipos celulares a produzirem IL-1. Este é um exemplo da cascata de citocinas que apresentam atividades biológicas similares.
A IL-1 medeia seus efeitos biológicos através de um receptor de membrana chamado receptor de IL-1 do tipo I, expresso por muitos tipos celulares, incluindo células endoteliais, células epiteliais e leucócitos. Este receptor é uma proteína de membrana que contém um domínio Ig extracelular de interação com o ligante e um domínio de sinalização Toll/receptor de IL-1 (TIR) na região citoplasmática, já descrito em referência aos TLR. Os eventos de sinalização que ocorrem quando a IL-1 se liga ao receptor de IL-1 de tipo I são similares àqueles desencadeados por TLR, resultando na ativação dos fatores de transcrição NF-κB e AP-1 (Cap. 7). O receptor de IL-1 do tipo II parece ser incapaz de ativar tais vias.
Interleucina 6
A IL-6 é outra importante citocina em respostas inflamatórias agudas que apresenta efeitos locais e sistêmicos, incluindo a indução da síntese hepática de diversos outros mediadores inflamatórios, a estimulação da produção de neutrófilos na medula óssea e a diferenciação de linfócitos T auxiliares (helper) produtores de IL-17. A IL-6 é sintetizada por fagócitos mononucleares, células endoteliais vasculares, fibroblastos e outras células em resposta a PAMP, IL-1 e TNF. A IL-6 é um polipeptídeo homodímero da família de citocinas do tipo I. O receptor de IL-6 é composto por uma cadeia polipeptídica capaz de interagir com a citocina e uma subunidade capaz de transduzir sinal (chamada gp130), que é também um componente de sinalização de receptores de outras citocinas. O receptor de IL-6 participa da via de sinalização que ativa o fator de transcrição STAT3.
Recrutamento dos Leucócitos para os Sítios de Infecção
O recrutamento de grandes números de neutrófilos, seguidos de monócitos, do sangue para os tecidos caracteristicamente ocorre como parte das respostas inflamatórias agudas a infecções e lesões teciduais. As citocinas TNF, IL-1 e IL-6 e as quimiocinas, que são secretadas em sítios locais de infeccção ou de lesão tecidual, têm múltiplos efeitos sobre as células endoteliais vasculares, os leucócitos e a medula óssea, que, juntos, aumentam a concentração local de células que podem combater os patógenos e reparar os tecidos (Fig. 3-3, Cap. 3). O recrutamento de leucócitos foi descrito no Capítulo 3 e será apenas brevemente discutido aqui.
TNF e IL-1 induzem as células endoteliais das vênulas pós-capilares expressar tanto a E-selectina quanto a aumentar a expressão de ICAM-1 e VCAM-1, ligantes das integrinas de leucócitos. Estas alterações na expressão de moléculas de adesão nas células endoteliais são resultantes da ativação, por TNF e IL-1, de fatores de transcrição, incluindo NF-κB, levando à transcrição gênica de novas moléculas de adesão. A expressão de P-selectina é também induzida nas células endoteliais venulares nos sítios de infecção e lesão tecidual, mas, em grande parte, se deve aos efeitos da histamina e da trombina, que estimulam a rápida mobilização da P-selectina armazenada em grânulos nas células endoteliais à superfície celular.
O TNF e a IL-1 também estimulam a secreção de quimiocinas, como CXCL1 e CCL2, por diversas células, que se ligam a receptores de neutrófilos e monócitos, respectivamente, aumentam a afinidade das integrinas leucocitárias a seus ligantes, estimulando assim o movimento direcionado de leucócitos. O resultado da maior expressão de selectinas, integrinas e quimiocinas é o aumento da adesão de neutrófilos e monócitos às células endoteliais e sua transmigração através da parede vascular. Os leucócitos que se acumulam nos tecidos compõem o infiltrado inflamatório. As ações do TNF sobre o endotélio e os leucócitos são extremamente importantes nas respostas inflamatórias locais a micro-organismos. Em caso de presença de quantidades inadequadas de TNF (p. ex., em pacientes submetidos a tratamento com agentes que bloqueiam o TNF ou em camundongos que não o secretam [knockout]), a consequência pode ser a falha do controle das infecções.
Além disso, o TNF, a IL-1 e a IL-6 produzidos nos sítios inflamatórios podem cair no sangue e chegar à medula óssea, onde aumentam a produção de neutrófilos a partir de progenitores medulares, geralmente agindo em conjunto com fatores estimuladores de colônias. Dessa forma, essas citocinas aumentam o suprimento de células que podem ser recrutadas aos sítios de infecção.
Fagocitose e Morte dos Micro-organismos por Fagócitos Ativados
Neutrófilos e macrófagos recrutados aos sítios de infecção ingerem micro-organismos em vesículas pelo processo de fagocitose, destruindo-os (Fig. 4-12). A fagocitose é um processo ativo, dependente de energia, de incorporação de partículas grandes (> 0,5 μm de diâmetro) em vesículas. As vesículas fagocíticas se fundem aos lisossomos, onde as partículas ingeridas são destruídas e, desta forma, os mecanismos de morte, que podem danificar o fagócito, são isolados do restante da célula.
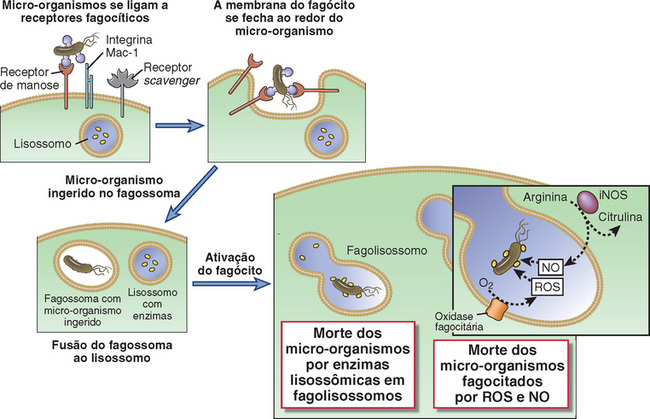
FIGURA 4-12 Fagocitose e destruição intracelular de micro-organismos. Os micro-organismos podem ser ingeridos por diferentes receptores de membrana dos fagócitos; alguns se ligam diretamente aos micro-organismos e outros a patógenos opsonizados. (Note que a integrina Mac-1 se liga aos micro-organismos opsonizados por proteínas do sistema complemento, não mostradas). Os micro-organismos são internalizados em fagossomos, que se fundem com os lisossomos formando fagolisossomos, onde os micro-organismos são mortos por espécies reativas de oxigênio e nitrogênio e enzimas proteolíticas. iNOS, óxido nítrico sintase indutível; NO, óxido nítrico; ROS, espécies reativas de oxigênio.
Os neutrófilos e macrófagos expressam receptores que especificamente reconhecem os micro-organismos, e a ligação desses patógenos a estes receptores é a primeira etapa da fagocitose. Alguns destes receptores são receptores de reconhecimento de padrões, incluindo lectinas de tipo C e receptores scavenger, já discutidos. Os receptores de reconhecimento de padrões podem auxiliar a fagocitose apenas de organismos que expressam determinados padrões moleculares, como a manose. Os fagócitos também apresentam receptores de alta afinidade por certas opsoninas, incluindo moléculas de anticorpos, proteínas do sistema complemento e lectinas plasmáticas; estes receptores são muito importantes para a fagocitose de diversos micro-organismos que são revestidos por opsoninas. Um dos mais eficientes sistemas de opsonização de micro-organismos é seu revestimento por anticorpos. Lembre-se de que as moléculas de anticorpos apresentam um sítio de ligação ao antígeno em uma extremidade, e a outra, a região Fc, interage com células e moléculas efetoras do sistema imune inato. Existem diversos tipos de anticorpos, que discutiremos em detalhes nos Capítulos 5 e 12. Os fagócitos expressam receptores de Fc de alta afinidade chamados FcγRI, específicos para um tipo de anticorpo chamado IgG (Cap. 12). Assim, caso um indivíduo responda a uma infecção por meio da síntese de anticorpos IgG contra antígenos microbianos, estas imunoglobulinas se ligam aos antígenos, e as regiões Fc dos anticorpos ligados podem interagir com FcγRI dos fagócitos; o resultado final é a fagocitose eficiente dos micro-organismos. Uma vez que diversos anticorpos podem ser produzidos, ligando-se a vários produtos microbianos, a opsonização mediada por anticorpos permite a fagocitose de uma gama de patógenos maior do que a conseguida por meio dos receptores de reconhecimento de padrões. A fagocitose dependente de antígenos ilustra a ponte entre a imunidade inata e a imunidade adaptativa — os anticorpos são produtos do sistema imune adaptativo (linfócitos B) que recrutam células efetoras do sistema imune inato (fagócitos) para o desempenho de suas funções protetoras.
Após a ligação dos micro-organismos ou partículas aos receptores dos fagócitos, a membrana plasmática da região dos receptores começa a se redistribuir e estende uma projeção com formato de taça ao redor do patógeno. Quando esta protrusão da membrana se estende além do diâmetro da partícula, o topo da taça se fecha e, em seu interior, se forma uma vesícula intracelular (Fig. 4-12). Esta vesícula, chamada fagossomo, contém a partícula estranha ingerida e se solta da membrana plasmática. Os receptores de superfície também enviam sinais de ativação que estimulam as atividades microbicidas dos fagócitos. Os micro-organismos fagocitados são destruídos, como descrito a seguir; ao mesmo tempo, são gerados peptídeos das proteínas microbianas, que são apresentados aos linfócitos T, que por sua vez iniciam as respostas imunológicas adaptativas (Cap. 6).
Neutrófilos e macrófagos ativados matam os micro-organismos fagocitados por meio da ação de moléculas microbicidas nos fagolisossomos (Fig. 4-12). Diversos receptores que reconhecem os micro-organismos, incluindo TLR, receptores acoplados à proteína G, receptores para a porção Fc de anticorpos e receptores para o componente C3 do sistema complemento e para citocinas, principalmente IFN-γ, atuam de forma cooperativa, ativando os fagócitos a matar os patógenos ingeridos. A fusão dos vacúolos fagocíticos (fagossomos) com os lisossomos resulta na formação dos fagolisossomos, onde está concentrada a maioria dos mecanismos microbicidas. Três tipos de mecanismos microbicidas são considerados os mais importantes.
• Espécies reativas de oxigênio. Macrófagos e neutrófilos ativados convertem o oxigênio molecular em espécies reativas de oxigênio (ROS), que são agentes oxidativos altamente reativos que destroem micro-organismos (e outras células). O sistema primário de geração de radicais livres é o sistema da oxidase fagocitária. A oxidase fagocitária é uma enzima composta por múltiplas subunidades e é montada nos fagócitos ativados, principalmente na membrana do fagolissossomo. A oxidase fagocitária é induzida e ativada por muitos estímulos, incluindo IFN-γ e sinais dos TLR. A função desta enzima é a redução do oxigênio molecular em ROS, como os radicais superóxidos, utilizando, como cofator, a forma reduzida da nicotinamida adenina dinucleotídeo fosfato (NADPH). O superóxido é enzimaticamente transformado em peróxido de hidrogênio, usado pela enzima mieloperoxidase na conversão de íons haleto normalmente não reativos em ácidos hipo-haletos reativos que são tóxicos para bactérias. O processo de produção de ROS é chamado explosão (ou burst) respiratória, uma vez que ocorre durante o consumo de oxigênio (respiração celular). Embora a geração de ROS tóxicos seja comumente vista como uma importante função da oxidase fagocitária, outra função desta enzima é a produção de condições, no interior dos vacúolos fagocíticos, necessárias à atividade das enzimas proteolíticas anteriormente discutidas. A oxidase atua como uma bomba de elétrons, gerando um gradiente eletroquímico através da membrana do vacúolo, que é compensado pelo movimento de íons para o interior desta estrutura. O resultado é o aumento do pH e da osmolaridade no interior do vacúolo, necessário à atividade da elastase e da catepsina G. Uma enfermidade conhecida como doença granulomatosa crônica é causada pela deficiência congênita de um dos componentes da oxidase fagocitária; esta deficiência compromete a capacidade de morte de certas espécies de bactérias gram-positivas por neutrófilos (Cap. 20).
• Óxido nítrico. Além de ROS, os macrófagos produzem espécies reativas de nitrogênio, principalmente o óxido nítrico, pela ação de uma enzima chamada óxido nítrico sintase indutível (iNOS). A iNOS é uma enzima citosólica ausente em macrófagos em repouso, mas pode ser induzida em resposta a produtos microbianos que ativam TLR, especialmente quando combinados ao IFN-γ. A iNOS catalisa a conversão de arginina a citrulina, com liberação do gás óxido nítrico, de difusão livre. No interior dos fagolisossomos, o óxido nítrico pode se combinar ao peróxido de hidrogênio ou ao superóxido, gerados pela oxidase fagocitária, produzindo radicais de peroxinitrito altamente reativos que matam micro-organismos. A função cooperativa e redundante de ROS e óxido nítrico é demonstrada pelo achado de que camundongos knockout para a enzima iNOS e para a oxidase fagocitária são mais suscetíveis a infecções bacterianas do que animais que não expressam apenas a oxidase fagocitária ou iNOS.
• Enzimas proteolíticas. Neutrófilos e macrófagos ativados produzem diversas enzimas proteolíticas nos fagolisossomos que destroem micro-organismos. Uma das importantes enzimas dos neutrófilos é a elastase, uma serino protease de amplo espectro conhecida por ser necessária à morte de muitos tipos de bactérias. Outra enzima importante é a catepsina G. Estudos realizados em camundongos knockout confirmaram a exigência da presença destas enzimas na morte de bactérias por fagócitos.
Quando neutrófilos e macrófagos são fortemente ativados, podem danificar tecidos normais do hospedeiro através da liberação de enzimas lisossômicas, ROS e óxido nítrico. Os produtos microbicidas destas células não diferenciam tecidos próprios de não próprios (de origem microbiana). Assim, caso estes produtos entrem no ambiente extracelular, são capazes de provocar lesão tecidual.
Outras Funções de Macrófagos Ativados
Além de matarem micro-organismos fagocitados, os macrófagos desempenham muitas outras funções na defesa contra infecções (Fig. 4-13). Muitas destas funções são mediadas pelas citocinas produzidas pelos macrófagos. Já descrevemos como o TNF, a IL-1 e as quimiocinas sintetizadas por fagócitos aumentam as reações inflamatórias a micro-organismos e atraem mais leucócitos, assim como facilitam a passagem de proteínas plasmáticas. Os macrófagos ativados também produzem fatores de crescimento para fibroblastos e células endoteliais que participam do remodelamento de tecidos após infecções e lesões. O papel dos macrófagos na imunidade mediada por células é descrito no Capítulo 10.
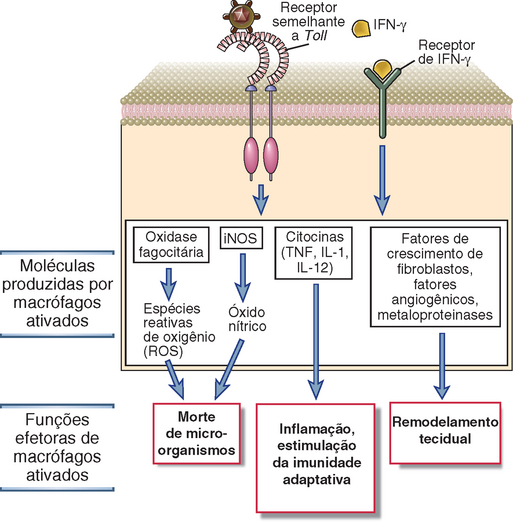
FIGURA 4-13 Funções efetoras dos macrófagos. Os macrófagos são ativados por produtos microbianos, como o LPS, e pelo IFN-γ produzido por células NK (como anteriormente descrito neste capítulo). O processo de ativação do macrófago leva à ativação de fatores de transcrição, à transcrição de diversos genes e à síntese de proteínas que medeiam as funções destas células. Na imunidade adaptativa mediada por células, os macrófagos são ativados por estímulos oriundos dos linfócitos T (ligante de CD40 e IFN-γ) e respondem, essencialmente, da mesma maneira (Cap. 10, Fig. 10-7).
Outras Citocinas Produzidas durante as Respostas Imunológicas Inatas
Além de TNF, IL-1 e IL-6, células dendríticas e macrófagos ativados por PAMP e DAMP produzem outras citocinas que desempenham importantes papéis nas respostas imunes inatas (Tabela 4-4). Algumas das principais características dessas citocinas e seus papéis na imunidade inata são discutidos nesta seção. Essas citocinas também têm importantes efeitos na estimulação da imunidade adaptativa, como discutiremos mais tarde, neste capítulo, e em mais detalhes nos Capítulos 9 e 10.
A IL-12 é secretada por células dendríticas e macrófagos e estimula a produção de IFN-γ por células NK e linfócitos T, aumenta a citotoxicidade mediada por NK e CTL e promove a diferenciação de células TH1. A IL-12 é um heterodímero ligado por pontes dissulfeto, formado por subunidades de 35 kD (p35) e 40 kD (p40). A subunidade p35 é um membro da família de citocinas do tipo I. Além da IL-12, existem outras citocinas heterodiméricas cujas subunidades são homólogas a uma ou ambas as cadeias da IL-12, incluindo a IL-23, a IL-27 e a IL-35. Isto é importante, uma vez que anticorpos terapêuticos específicos para subunidades compartilhadas estão sendo desenvolvidos para o tratamento de doenças inflamatórias, e alguns destes anticorpos podem bloquear a função de mais de uma citocina. As principais fontes de IL-12 são células dendríticas e macrófagos ativados. Muitas células parecem sintetizar a subunidade p35, mas macrófagos e células dendríticas são os principais tipos celulares que produzem o componente p40 e, portanto, a citocina biologicamente ativa. Durante reações imunes inatas aos micro-organismos, a IL-12 é produzida em resposta à sinalização por TLR e outros receptores de reconhecimento de padrão induzidos por muitos estímulos microbianos, incluindo o LPS bacteriano, o ácido lipoteicoico e vírus. O IFN-γ produzido por células NK ou por linfócitos T também estimula a produção de IL-12, participando da alça de amplificação positiva.
O receptor de IL-12 (IL-12R) é um heterodímero composto pelas subunidades β1 e β2, que são membros da família de receptores de citocina do tipo I. Ambas as cadeias são necessárias à ligação de alta afinidade da IL-12 e à sinalização, que ativa o fator de transcrição STAT4. A expressão da cadeia β2 do receptor de IL-12 é aumentada pelo IFN-γ, cuja produção é estimulada pela própria IL-12, em outro exemplo da alça de amplificação positiva das respostas imunes. Estudos realizados com camundongos nocauteados (knockouts) e o fenótipo apresentado pelos raros pacientes portadores de mutações no receptor de IL-12 apoiam a conclusão de que esta citocina é importante para a produção de IFN-γ por células NK e linfócitos T e para a resistência do hospedeiro a bactérias intracelulares e alguns vírus. Pacientes portadores de mutações na subunidade β1 do receptor de IL-12, por exemplo, são altamente suscetíveis a infecções por bactérias intracelulares, notavelmente Salmonella e micobactérias atípicas. A IL-12 secretada por DC durante a apresentação do antígeno aos linfócitos T CD4+ virgens promove sua diferenciação no subtipo TH1 de linfócitos T, que são importantes na defesa contra infecções intracelulares (Cap. 9). Esta é a principal forma pela qual a imunidade inata influencia as respostas imunológicas adaptativas.
A IL-18 aumenta as funções das células NK, assim como a IL-12. Lembre-se de que a produção de IL-18, como a de IL-1, é dependente do inflamassomo. Também como a IL-1, a IL-18 se liga ao receptor que sinaliza através do domínio TIR.
A IL-15 é a citocina que atua como importante estimulador do crescimento e da sobrevivência de células NK e linfócitos T. A IL-15 é estruturalmente homóloga ao fator de crescimento de linfócitos T, a IL-2, e o receptor heterotrimérico de IL-15 compartilha duas subunidades idênticas com o receptor de IL-2. Uma interessante característica da IL-15 é a possibilidade de expressão na superfície celular ligada à cadeia α de seu receptor e, nesta forma, ela pode ser apresentada a células próximas, estimulando-as a expressar o receptor composto pelas duas outras cadeias (β e γ). A IL-15 apresentada desta forma por células dendríticas a células NK, nos gânglios linfáticos, ativa vias de sinalização que promovem a produção de IFN-γ pelas células NK. A IL-15 também é um fator de sobrevivência para as NK e os linfócitos T CD8+ de memória.
Consequências Sistêmicas e Patológicas das Respostas Inflamatórias Agudas
TNF, IL-1 e IL-6 produzidos durante a resposta imune inata a infecções ou danos teciduais têm efeitos sistêmicos que contribuem para a defesa do hospedeiro e são responsáveis por muitos dos sinais clínicos de doenças infecciosas e inflamatórias (Fig. 4-14).
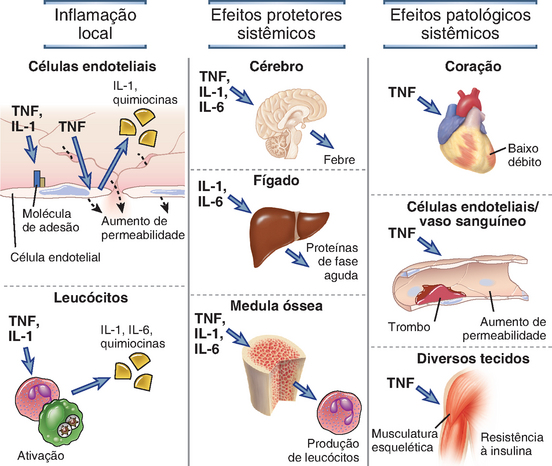
FIGURA 4-14 Ações locais e sistêmicas das citocinas na inflamação. O TNF, a IL-1 e a IL-6 desempenham múltiplos efeitos inflamatórios locais e sistêmicos. O TNF e a IL-1 agem sobre leucócitos e o endotélio, induzindo inflamação aguda, e também induzem a expressão de IL-6 por leucócitos e outros tipos celulares. O TNF, a IL-1 e a IL-6 medeiam os efeitos protetores sistêmicos da inflamação, incluindo a febre, a síntese de proteínas de fase aguda pelo fígado e o aumento da produção de leucócitos pela medula óssea. O TNF sistêmico pode provocar anomalias patológicas que levam ao choque séptico, incluindo redução da função cardíaca, trombose, extravasamento capilar e anomalias metabólicas em virtude da resistência à insulina.
• TNF, IL-1 e IL-6 agem no hipotálamo, induzindo o aumento da temperatura corpórea (febre), e são, portanto, chamados pirógenos endógenos (i. e., agentes causadores de febre produzidos pelo próprio hospedeiro, diferenciando-os do LPS, que era considerado um pirógeno exógeno [derivado de micro-organismos]). Esta distinção tem, principalmente, significado histórico, uma vez que agora sabemos que o LPS induz febre por meio da produção das citocinas TNF e IL-1. O TNF e a IL-1 são pirogênicos em concentrações muito inferiores às de IL-6. A febre resultante da resposta a TNF, IL-1 e IL-6 é mediada pelo aumento da síntese de prostaglandinas por células hipotalâmicas estimuladas por citocinas. Os inibidores da síntese de prostaglandinas, como o ácido acetilsalicílico, reduzem a febre por meio do bloqueio da ação destas citocinas. As vantagens da febre não são bem entendidas, mas podem estar relacionadas ao aumento das funções metabólicas das células imunológicas, à redução das funções metabólicas dos micro-organismos e às alterações do comportamento do hospedeiro febril, que diminuem o risco de piora das infecções e lesões.
• IL-1, TNF e IL-6 induzem a expressão de proteínas de fase aguda pelos hepatócitos, incluindo CRP, SAP e fibrinogênio, que são secretados no sangue. Elevados níveis de proteínas de fase aguda são comumente usados na clínica médica como sinais da presença de infecção ou outros processos inflamatórios. As pentraxinas CRP e SAP desempenham papéis protetores em infecções, como discutimos no início deste capítulo, e o fibrinogênio, um precursor da fibrina, contribui para a homeostasia e o reparo tecidual.
Em infecções graves, o TNF pode ser produzido em grandes quantidades, provocando anomalias sistêmicas clínicas e patológicas. Caso o estímulo para produção do TNF seja suficientemente forte, a quantidade sintetizada pode ser tão grande que a citocina chega à corrente sanguínea e atua em sítios distantes, como um hormônio endócrino (Fig. 4-14). As principais ações sistêmicas do TNF são:
• A inibição da contratibilidade do miocárdio e do tônus da musculatura lisa vascular, causando grande redução na pressão arterial, ou choque.
• Desenvolvimento de trombose intravascular, principalmente devida à perda das propriedades anticoagulantes normais do endotélio. O TNF estimula a expressão de fator tecidual pelas células endoteliais, um potente ativador da coagulação, e inibe a expressão de trombomodulina, um inibidor da coagulação. As alterações endoteliais são exacerbadas pela ativação de neutrófilos, formando tampões vasculares destas células. A capacidade em provocar necrose de tumores, que é a base do nome desta citocina, é resultante, principalmente, da trombose de vasos sanguíneos tumorais.
• A produção prolongada de TNF provoca fadiga de células musculares e adiposas, a chamada caquexia. Esta fadiga é resultante da supressão do apetite e da redução da síntese de lipase lipoproteína, uma enzima necessária à liberação de ácidos graxos das lipoproteínas circulantes, para que eles possam ser usados pelos tecidos.
Uma complicação da sepse grave bacteriana é uma síndrome denominada choque séptico, que pode ser causada pelo LPS liberado por bactérias gram-negativas (sendo, neste caso, chamado de choque endotóxico) ou pelo ácido lipoteicoico de bactérias gram-positivas. O choque séptico é caracterizado por colapso vascular, coagulação intravascular disseminada e alterações metabólicas. Esta síndrome se deve à sinalização por TLR induzida por LPS ou ácido lipoteicoico, que leva à produção de TNF e outras citocinas, incluindo IL-12, IFN-γ e IL-1. A concentração sérica de TNF pode prever o resultado de graves infecções bacterianas. O choque séptico pode ser reproduzido em animais de laboratório por meio da administração de LPS, ácido lipoteicoico ou TNF. Os antagonistas de TNF podem impedir a morte em modelos experimentais, mas ensaios clínicos com anticorpos anti-TNF ou receptores solúveis não mostraram benefícios em pacientes com sepse. A causa desta falha terapêutica não é conhecida, mas pode ser devida ao fato de que outras citocinas provocam as mesmas respostas que o TNF, um exemplo de redundância.
A inflamação aguda pode provocar lesão tecidual, uma vez que os mecanismos efetores que os fagócitos usam para matar os micro-organismos são também altamente tóxicos aos tecidos do hospedeiro. As enzimas proteolíticas e as espécies reativas de oxigênio produzidas por fagócitos que se acumulam no sítio de infecção podem danificar as células do hospedeiro e degradar a matriz extracelular caso sejam geradas em grandes quantidades, principalmente se os micro-organismos resistirem à morte e continuarem a estimular as respostas imunes inatas. Na verdade, muito da patologia associada às infecções se deve às respostas inflamatórias e não aos efeitos tóxicos diretos dos patógenos. A inflamação aguda também provoca dano tecidual em doenças autoimunes, quando neutrófilos e macrófagos se acumulam e são ativados secundariamente à estimulação do sistema imune adaptativo por antígenos próprios (Cap. 14). Como na inflamação induzida pelas infecções, TNF, IL-1, IL-6 e IL-12 são os principais indutores da inflamação em doenças autoimunes. Antagonistas de TNF, IL-1 e IL-12 e anticorpos contra receptores de IL-6 são usados ou estão sendo testados em ensaios clínicos na tentativa de reduzir a inflamação em pacientes portadores de algumas destas doenças, como a artrite reumatoide, a doença intestinal inflamatória e a psoríase.
A RESPOSTA ANTIVIRAL
A principal forma utilizada pelo sistema imune inato no combate às infecções virais é a indução da expressão de interferons do tipo I, cuja ação mais importante é a inibição da replicação viral. No início deste capítulo, discutimos como os diversos receptores de reconhecimento de padrões, incluindo alguns TLR, NLR e RLR, geram sinais que estimulam a expressão gênica de IFN-α e IFN-β em muitos tipos celulares. Os interferons do tipo I são secretados por estas células e atuam em outras células, prevenindo a disseminação da infecção viral. Nesta seção, descreveremos as principais propriedades dos interferons de tipo I e os efeitos antivirais destas citocinas.
Os interferons de tipo I são uma grande família de citocinas estruturalmente similares que medeiam o início da resposta imune inata a infecções virais. O termo interferon é derivado de sua capacidade de interferir com infecções virais. Existem muitos interferons de tipo I, todos com considerável homologia estrutural e codificados por genes de um único agrupamento (cluster) gênico no cromossomo 9. Os mais importantes interferons de tipo I na defesa antiviral são o IFN-α (que, na verdade, inclui 13 diferentes proteínas bastante semelhantes) e o IFN-β, uma proteína única. As células dendríticas plasmocitoides são as principais fontes de IFN-α, mas esta citocina também pode ser produzida por fagócitos mononucleares. O IFN-β é produzido por muitas células. Os mais potentes estímulos à síntese dos interferons de tipo I são os ácidos nucleicos virais. Lembre-se de que os receptores semelhantes a RIG do citosol e os TLRs 3, 7, 8 e 9 das vesículas endossômicas reconhecem ácidos nucleicos virais e iniciam vias de sinalização que ativam a família de fatores de transcrição chamados de fatores reguladores de interferon (IRF), que induzem a expressão gênica dos interferons do tipo I. Na imunidade adaptativa, linfócitos T ativados por antígenos estimulam a síntese de interferons do tipo I por fagócitos mononucleares. O receptor de interferons de tipo I, que se liga a IFN-α e IFN-β, é um heterodímero formado por dois polipeptídeos estruturalmente semelhantes, IFNAR1 e IFNAR2, expressos por todas as células nucleadas. Este receptor ativa os fatores de transcrição STAT1, STAT2 e IRF9, que induzem a expressão de diferentes genes que têm os seguintes efeitos na defesa antiviral (Fig. 4-15):
• Os interferons do tipo I, através de sua interação com o receptor de interferon do tipo I, ativam a transcrição de diversos genes que conferem às células resistência à infecção viral, chamada estado antiviral. Os genes induzidos pelos interferon de tipo I incluem a serina/treonina proteína cinase (PKR) ativada por RNA de dupla fita, que bloqueia a transcrição viral e os eventos de tradução, e a 2′,5′ oligoadenilato sintetase e a RNase L18, 19, que promovem a degradação do RNA viral. A ação antiviral do interferon do tipo I é principalmente parácrina, em que a célula infectada secreta interferon para proteção das células vizinhas que ainda não estão infectadas. O interferon secretado por uma célula infectada pode também atuar de forma autócrina, inibindo a replicação viral naquela célula.
• Os interferons do tipo I sequestram os linfócitos nos gânglios linfáticos, maximizando, assim, a oportunidade de encontro com os antígenos microbianos. O mecanismo deste efeito dos interferons de tipo I é a indução de uma molécula nos linfócitos, chamada CD69, que forma um complexo com o receptor de esfingosina 1-fosfato (S1P), o S1PR1, reduzindo a expressão superficial desta última molécula. Lembre-se do que foi discutido no Capítulo 3: a saída do linfócito dos tecidos linfoides depende da ligação de S1P a S1PR1. Portanto, a redução da expressão de S1PR1 inibe esta saída e mantêm os linfócitos nos órgãos linfoides.
• Os interferons do tipo I aumentam a citotoxicidade das células NK e dos CTL CD8+ e promovem a diferenciação de linfócitos T virgens em linfócitos T auxiliares do subtipo TH1. Estes efeitos dos interferons de tipo I aumentam a imunidade inata e adaptativa contra infecções intracelulares, incluindo vírus e algumas bactérias.
• Os interferons do tipo I regulam positivamente a expressão das moléculas de MHC de classe I e, portanto, aumentam a probabilidade de que as células infectadas por vírus sejam reconhecidas e mortas por CTL CD8+. Os CTL CD8+ vírus-específicos reconhecem peptídeos derivados de proteínas virais ligadas a moléculas de MHC de classe I na superfície das células infectadas (discutiremos os detalhes do reconhecimento do peptídeo-MHC por linfócitos T e da morte de células infectadas mediada por CTL nos Caps. 6 e 10). Portanto, ao aumentar a quantidade de MHC de classe I sintetizada pela célula infectada por vírus, os interferons do tipo I elevam o número de complexos peptídeos virais-MHC de classe I na superfície celular que pode ser visto pelos CTL, desencadeando respostas. O resultado final é a morte das células que sustentam a replicação viral, necessária à erradicação das infecções virais.
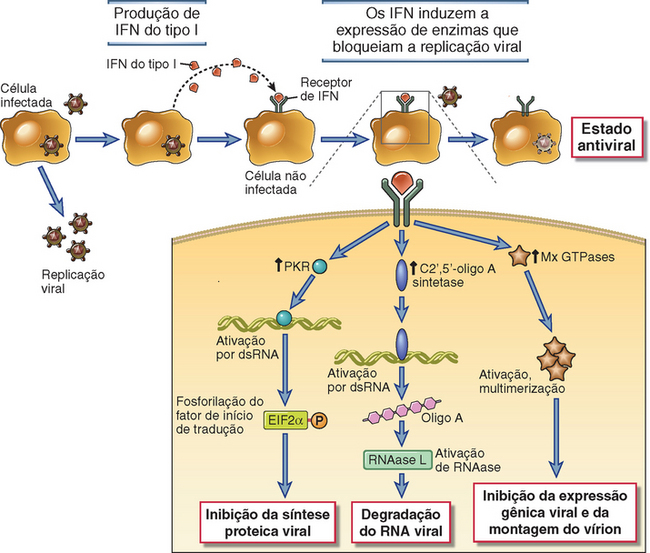
FIGURA 4-15 Ações biológicas dos interferons de tipo I. Os interferons de tipo I (IFN-α, IFN-β) são produzidos por células infectadas por vírus em resposta à sinalização intracelular mediada por TLR e outros sensores de RNA viral. Os interferons de tipo I se ligam a receptores em células vizinhas não infectadas e ativam as vias de sinalização JAK/STAT, que induzem a expressão de genes cujos produtos interferem com a replicação viral. Os interferons de tipo I também se ligam a receptores de células infectadas e induzem a expressão de genes cujos produtos aumentam a suscetibilidade da célula à morte mediada por CTL. PKT, RNA de dupla fita ativados pela proteína cinase.
Assim, as principais atividades do interferon de tipo I são trabalhar em conjunto no combate a infecções virais. Camundongos knockout que não apresentam o receptor de interferons de tipo I são suscetíveis a infecções virais. O IFN-α é clinicamente utilizado como agente antiviral em certas formas de hepatite viral. O IFN-α é também usado no tratamento de alguns tumores, talvez por aumentar a atividade dos CTL ou interferir no crescimento celular. O IFN-β é usado na terapia da esclerose múltipla, mas o mecanismo de seu efeito benéfico nesta doença não é conhecido.
A proteção contra vírus é devida, em parte, à ativação de vias intrínsecas de morte por apoptose em células infectadas e ao aumento da sensibilidade a indutores extrínsecos de apoptose. As células infectadas por vírus, por exemplo, podem perceber a replicação anormal de DNA e a síntese anormal de glicoproteínas, iniciando vias apoptóticas dependentes de p53 ou do retículo endoplasmático, respectivamente. Além disso, as células infectadas por vírus são sensíveis à apoptose induzida por TNF. O TNF abundante é feito por células dendríticas plasmocitoides e macrófagos em resposta às infecções virais, além dos interferons de tipo I. O receptor de TNF de tipo I ativa vias pró-inflamatórias e pró-apoptóticas de morte (Cap. 7). A via dominante que é ativada após a ligação do TNF depende do estado da síntese proteica nas células respondedoras, e a infecção viral pode desviar este equilíbrio em direção à apoptose.
ESTIMULAÇÃO DA IMUNIDADE ADAPTATIVA
A resposta imune inata fornece sinais que induzem, juntamente com antígeno, a proliferação e a diferenciação de linfócitos T e B antígeno-específicos. A função da resposta imune inata não é apenas de fornecer a primeira defesa contra micro-organismos, como também iniciar a resposta imune adaptativa. A ativação de linfócitos requer dois sinais distintos, o primeiro sendo a apresentação do antígeno e o segundo sendo mediado por moléculas que são sintetizadas durante respostas imunes inatas contra micro-organismos ou dirigidas contra células danificadas (Fig. 4-16). Esta ideia é chamada hipótese dos dois sinais de ativação de linfócitos. A necessidade de antígeno (o sinal 1) garante que a resposta imune em desenvolvimento seja específica. A necessidade de outros estímulos desencadeados por reações imunes inatas aos micro-organismos (o sinal 2) garante que as respostas imunes adaptativas sejam induzidas na presença de uma potencial infecção, e não quando os linfócitos reconhecem antígenos inofensivos, incluindo antígenos próprios. As moléculas produzidas durante as reações imunes inatas que atuam como segundos sinais na ativação de linfócitos incluem coestimuladores (para os linfócitos T), citocinas (para linfócitos T e B) e produtos da degradação do sistema complemento (para os linfócitos B). Voltaremos a discutir a natureza dos segundos sinais na ativação de linfócitos nos Capítulos 9 e 11.
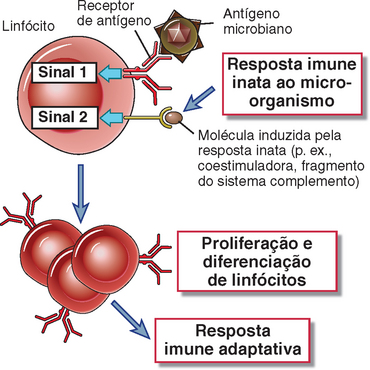
FIGURA 4-16 Estimulação da imunidade adaptativa por respostas imunes inatas. O reconhecimento de antígenos por linfócitos dá o sinal 1 para a ativação destas células, e as moléculas induzidas nas células do hospedeiro durante as respostas imunes inatas aos micro-organismos fornecem o sinal 2. Nessa ilustração, os linfócitos são B, mas os mesmos princípios se aplicam aos linfócitos T. A natureza do segundo sinal é diferente em linfócitos T e B e é descrita nos capítulos seguintes.
Os segundos sinais gerados durante as respostas imunes inatas a diferentes micro-organismos não apenas aumentam a magnitude da resposta imune adaptativa subsequente, mas também influenciam a natureza dessa resposta adaptativa. As principais funções da imunidade mediada por linfócitos T são a ativação de macrófagos para matar micro-organismos intracelulares e a indução de potentes respostas inflamatórias agudas, além daquelas diretamente induzidas pelo sistema imune inato, de modo que um exército suficientemente grande de fagócitos seja chamado ao sítio de infecção. Os agentes infecciosos que interagem com TLR e outros receptores de reconhecimento de padrões tendem a estimular respostas imunes mediadas por linfócitos T. Isto ocorre porque a sinalização destes receptores de reconhecimento de padrões aumenta a capacidade de induzir a diferenciação de linfócitos T CD4+ virgens em células efetoras chamadas TH1 e TH17. As células TH1 produzem a citocina IFN-γ, que pode ativar macrófagos a matar micro-organismos que sobreviveriam no interior das vesículas fagocíticas. As células TH17 produzem a citocina IL-17, que pode induzir um processo inflamatório rico em neutrófilos. A imunidade mediada por células TH1 e TH17 é discutida em detalhes nos Capítulos 9 e 10. Muitos micro-organismos extracelulares que entram na corrente sanguínea ativam a via alternativa do sistema complemento, que, por sua vez, aumenta a produção de anticorpos pelos linfócitos B. Alguns destes anticorpos opsonizam a bactéria e, portanto, promovem sua fagocitose por neutrófilos e macrófagos. A resposta imune humoral, portanto, age na eliminação de micro-organismos extracelulares. O papel do sistema complemento na ativação do linfócito B é discutido no Capítulo 11.
As citocinas produzidas por células durante as respostas imunes inatas aos micro-organismos estimulam a proliferação e a diferenciação de linfócitos durante as respostas imunes adaptativas. Exemplos de citocinas secretadas por células estimuladas por PAMP que agem sobre linfócitos B, linfócitos T CD4+ e linfócitos T CD8+ são dados aqui. Detalhes das respostas de linfócitos a estas citocinas serão discutidos em capítulos posteriores.
• A IL-6 promove a produção de anticorpos por linfócitos B ativados (Cap. 11).
• A IL-1, a IL-6 e a IL-23 estimulam a diferenciação de linfócitos T CD4+ virgens no subtipo TH17 de células efetoras (Cap. 9).
• A IL-12 estimula a diferenciação de linfócitos T CD4+ virgens no subtipo TH1 de células efetoras (Cap. 9).
• A IL-15 promove a sobrevivência de linfócitos T CD8+ de memória.
Os adjuvantes, que são substâncias administradas juntamente com antígenos proteicos purificados para maximizar o desenvolvimento das respostas imunes dependentes de linfócitos T (Cap. 6), agem estimulando as reações imunes inatas no sítio de exposição ao antígeno. Os adjuvantes são empregados na imunologia experimental e em vacinas administradas clinicamente. Muitos adjuvantes de uso experimental são produtos microbianos, como micobactérias mortas e LPS, que estimulam TLR. O único adjuvante rotineiramente usado em vacinas humanas é o alúmen, composto por hidróxido de alumínio ou fosfato de alumínio. Entre seus importantes efeitos, os adjuvantes ativam células dendríticas, que passam a expressar mais moléculas de histocompatibilidade principal que são responsáveis pela apresentação do antígeno (sinal 1) que são reconhecidos pelos linfócitos T, aumenta a expressão de coestimuladores (sinal 2) e citocinas necessárias à ativação do linfócito T e estimula a migração das células dendríticas para os gânglios linfáticos, onde estão os linfócitos T.
MECANISMOS DE RETROALIMENTAÇÃO QUE REGULAM A IMUNIDADE INATA
A magnitude e a duração das respostas imunes inatas são reguladas por diversos mecanismos inibidores de alça de retroalimentação que limitam a possibilidade de ocorrência de danos teciduais. As respostas inflamatórias são extremamente importantes na proteção contra micro-organismos, mas podem causar lesão tecidual e doença. Diversos mecanismos evoluíram para interromper a inflamação, e começam a atuar ao mesmo tempo ou logo após o início do processo inflamatório. Além disso, os estímulos que iniciam muitos destes mecanismos de controle incluem os mesmos PAMP e DAMP que induzem a inflamação. Alguns destes mecanismos de regulação são descritos a seguir.
A IL-10 é a citocina produzida por macrófagos e células dendríticas que também inibem sua ativação. A IL-10 inibe a produção de diversas citocinas inflamatórias por macrófagos ativados e células dendríticas, incluindo IL-1, TNF e IL-12. Uma vez que é produzida por macrófagos e também inibe as funções destas células, a IL-10 é um excelente exemplo de alça de retroalimentação negativa (regulador negativo). Não se sabe exatamente como diferentes estímulos podem agir sobre os macrófagos para induzir a produção de uma citocina reguladora como a IL-10 ou citocinas efetoras como o TNF e a IL-12, ou se os mesmos estímulos provocam a síntese de todas estas citocinas, mas com cinéticas diferentes. A IL-10 é também produzida por alguns tipos celulares não linfoides (p. ex., queratinócitos). O vírus Epstein-Barr contém um gene homólogo à IL-10 humana, e a IL-10 viral desempenha as mesmas atividades que a citocina natural. Isto levanta a intrigante possibilidade de que a aquisição do gene da IL-10 durante a evolução do vírus conferiu a este a capacidade de inibir a imunidade do hospedeiro e, assim, uma vantagem na sobrevivência do indivíduo infectado. A IL-10 é também produzida por linfócitos T reguladores, e discutiremos esta citocina em maiores detalhes, neste contexto, no Capítulo 14.
Fagócitos mononucleares produzem um antagonista natural de IL-1 que é estruturalmente homólogo à citocina e se liga aos mesmos receptores, mas é biologicamente inativo, de modo que age como um inibidor competitivo. Esta molécula é, portanto, chamada antagonista do receptor de IL-1 (IL-1RA). A síntese de IL-1RA é induzida por muitos dos mesmos estímulos que levam à produção de IL-1, e alguns estudos realizados em camundongos deficientes em IL-1RA sugerem que esta citocina inibidora é necessária à prevenção de doenças inflamatórias das articulações e de outros tecidos. A IL-1RA recombinante é um agente eficaz no tratamento da artrite reumatoide sistêmica juvenil e das síndromes febris familiares, em que a produção de IL-1 é desregulada. A regulação da inflamação mediada por IL-1 pode também ocorrer por expressão do receptor de tipo II, que se liga à citocina, mas não transduz o sinal de ativação. A principal função deste receptor pode ser agir como um “sequestrador”, inibindo competitivamente a ligação de IL-1 ao receptor de sinalização de tipo I.
A secreção de citocinas inflamatórias por diversos tipos celulares parece ser regulada pelos produtos de genes autofágicos. A autofagia é um mecanismo pelo qual as células degradam suas próprias organelas, tais como mitocôndrias, sequestrando-as no interior de vesículas ligadas à membrana e fundindo tais vesículas a lisossomos. Este processo requer a ação coordenada de várias proteínas que são codificadas pelos genes autofágicos (Atg). Mutações pontuais em diferentes genes Atg aumentam a secreção de interferons de tipo I, IL-1 e IL-18 por diversos tipos celulares e o desenvolvimento da doença inflamatória intestinal. Os mecanismos pelos quais as proteínas Atg alteram a síntese de citocinas não são bem entendidos, mas há evidências de sua ligação a RLR, com subsequente inibição destes receptores, e de regulação da formação do inflamassomo. O papel das proteínas Atg na regulação de respostas imunes inatas é ainda apoiado pela descoberta de que polimorfismos na Atg humana são associados à doença inflamatória intestinal.
Existem numerosas vias de sinalização de regulação negativa que bloqueiam os sinais de ativação gerados por receptores de reconhecimento de padrões e citocinas inflamatórias. As proteínas supressoras da sinalização por citocinas (SOCS) são inibidoras das vias de sinalização JAK-STAT ligadas aos receptores de citocinas. A sinalização por TLR em macrófagos e células dendríticas induz a expressão das proteínas SOCS, que limitam as respostas destas células a citocinas exógenas, como os interferons de tipo I. Respostas pró-inflamatórias das células à sinalização por TLR são negativamente reguladas por SHP-1, uma fosfatase intracelular que regula negativamente as vias de sinalização linfocitárias dependentes de tirosina cinase. Existem muitos outros exemplos de cinases e fosfatases que inibem a sinalização por TLR, NLR e RLR.
• O sistema imune inato é a primeira linha de defesa do hospedeiro contra micro-organismos. Os mecanismos da imunidade inata já existem antes da exposição aos micro-organismos. Os componentes celulares do sistema imune inato incluem as barreiras epiteliais e os leucócitos (neutrófilos, macrófagos, células NK, linfócitos com receptores de antígeno invariantes e mastócitos).
• O sistema imune inato usa receptores de reconhecimento de padrões associados às células, presentes no plasma, em membranas endossômicas e no citoplasma, para reconhecer estruturas chamadas padrões moleculares associados a patógenos (PAMP). Os PAMP são compartilhados por micro-organismos, mas não são encontrados nas células dos mamíferos, e tendem a ser essenciais à sobrevivência dos micro-organismos, limitando, assim, sua capacidade de evasão à detecção por mutação ou perda da expressão destas moléculas. Além disso, há receptores que reconhecem moléculas sintetizadas pelo hospedeiro, mas cuja expressão ou localização indica dano celular; estas são denominadas padrões moleculares associados a danos (DAMP).
• Os TLR, presentes na superfície celular e em endossomos, são a mais importante família de receptores de reconhecimento de padrões, reconhecendo uma grande variedade de ligantes, incluindo componentes da parede celular bacteriana e ácidos nucleicos microbianos. Há receptores citoplasmáticos de reconhecimento de padrões que detectam moléculas microbianas. Dentre estes receptores, incluem-se os receptores semelhantes a RIG (RLR), que reconhecem o RNA viral, e os receptores semelhantes a NOD (NLR), que detectam constituintes da parede celular bacteriana e também urato de sódio e outros cristais.
• Os receptores de reconhecimento de padrões, incluindo TLR e RLR, ativam os fatores de transcrição NF-κB e AP-1, que induzem a expressão de genes inflamatórios, e os fatores de transcrição IRF, que promovem a expressão de genes dos interferons antivirais de tipo I. O inflamassomo, um complexo especializado formado em resposta a PAMP e DAMP, é composto por um receptor semelhante a NOD, um adaptador e a enzima caspase 1, cuja principal função é a produção de formas ativas das citocinas inflamatórias IL-1 e IL-18.
• Moléculas solúveis capazes de reconhecer padrão e moléculas efetoras são encontradas no plasma, e incluem as pentraxinas (p. ex., CRP), as colectinas (p. ex., MBL) e as ficolinas. Estas moléculas interagem com ligantes microbianos e amplificam a eliminação por mecanismos dependentes ou não do sistema complemento.
• As células NK são linfócitos responsáveis pela defesa contra micro-organismos intracelulares que matam as células infectadas e produzem a citocina ativadora de macrófagos, o IFN-γ. O reconhecimento das células infectadas pelas NK é regulado por uma combinação de receptores de ativação e inibição. Os receptores inibidores reconhecem moléculas de MHC de classe I, uma vez que as células NK não matam células normais do hospedeiro, mas sim células cuja expressão do MHC de classe I é reduzida, como células infectadas por vírus.
• O sistema complemento é formado por diversas proteínas plasmáticas que são ativadas em sequência por clivagem proteolítica, gerando as proteínas C3 e C5, que promovem a inflamação ou opsonizam os micro-organismos, levando à sua fagocitose. A ativação do sistema complemento também gera poros nas membrnas que matam alguns tipos de bactérias. O sistema complemento é ativado nas superfícies microbianas e não em células normais do hospedeiro, já que os micro-organismos não apresentam as proteínas reguladoras que o inibem. Nas respostas imunes inatas, o sistema complemento é ativado principalmente de forma espontânea, em superfícies celulares microbianas, e pela lectina ligante de manose, que, respectivamente, iniciam a via alternativa e a via das lectinas.
• As duas principais funções efetoras da imunidade inata são a indução da inflamação, que envolve o recrutamento de leucócitos capazes de matar os micro-organismos e de moléculas efetoras solúveis do sangue para os tecidos, assim como o bloqueio da infecção viral das células, através das ações antivirais dos interferons de tipo 1. Estes dois tipos de mecanismos efetores são induzidos por PAMP e DAMP, que iniciam vias de sinalização em células teciduais e leucócitos que, por sua vez, ativam fatores de transcrição e levam à expressão de citocinas e outros mediadores inflamatórios.
• Diversas citocinas, produzidas principalmente por macrófagos ativados, medeiam a inflamação. O TNF e a IL-1 ativam células endoteliais, estimulam a produção de quimiocinas e aumentam a produção de neutrófilos pela medula óssea. Estas duas citocinas também induzem a produção de IL-6, e estas três moléculas medeiam efeitos sistêmicos, incluindo a febre e a síntese de proteínas de fase aguda pelo fígado. A IL-12 e a IL-18 estimulam a produção da citocina ativadora de macrófagos IFN-γ por células NK e linfócitos T. Estas citocinas atuam em respostas imunes inatas a diferentes classes de micro-organismos, e algumas (IL-1, IL-6, IL-12, IL-18) modificam as respostas imunes adaptativas subsequentes à resposta imune inata.
• Neutrófilos e monócitos (os precursores dos macrófagos teciduais) migram do sangue para os sítios inflamatórios durante as respostas imunes inatas, devido aos efeitos das citocinas e quimiocinas produzidas por células teciduais estimuladas por PAMP e DAMP.
• Neutrófilos e macrófagos fagocitam micro-organismos e os matam pela produção de ROS, óxido nítrico e enzimas nos fagolisossomos. Os macrófagos também produzem citocinas que estimulam a inflamação e promovem o remodelamento tecidual nos sítios de infecção. Os fagócitos reconhecem e respondem a produtos microbianos por meio de diversos tipos de receptores, incluindo TLR, lectinas de tipo C, receptores scavenger e receptores N-formil met-leu-phe.
• As moléculas produzidas durante as respostas imunes inatas estimulam a imunidade adaptativa e influenciam a natureza das respostas imunes adaptativas. As células dendríticas ativadas por micro-organismos produzem citocinas e coestimuladores que aumentam a ativação de linfócitos T e sua diferenciação em linfócitos T efetores. Fragmentos do sistema complemento gerados pela via alternativa fornecem os segundos sinais para ativação dos linfócitos B e a produção de anticorpos.
• As respostas imunes inatas são reguladas negativamente através de alças de retroalimentação negativa (mecanismos inibitórios) que limitam a ocorrência de danos aos tecidos. A IL-10 é uma citocina produzida por macrófagos e células dendríticas que também inibe sua ativação. A secreção de citocinas inflamatórias é regulada por produtos de genes autofágicos. As vias negativas de sinalização bloqueiam os sinais de ativação gerados pelos receptores de reconhecimento de padrões e pelas citocinas inflamatórias.
Receptores de Reconhecimento de Padrões
Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell. 2006;124:783-801.
Areschoug T, Gordon S. Scavenger receptors: role in innate immunity and microbial pathogenesis. Cellular Microbiology. 2009;11:1160-1169.
Blasius AL, Beutler B. Intracellular Toll-like receptors. Immunity. 2010;32:305-315.
Chen G, Shaw MH, Kim YG, Nuñez G. Nod-like receptors: role in innate immunity and inflammatory disease. Annual Review of Pathology. 2009;4:365-398.
Hornung V, Latz E. Intracellular DNA recognition. Nature Reviews Immunology. 2010;10:123-130.
Ip WK, Takahashi K, Ezekowitz RA, Stuart LM. Mannose- binding lectin and innate immunity. Immunological Reviews. 2009;230:9-21.
Janeway CA, Medzhitov R. Innate immune recognition. Annual Review of Immunology. 2002;20:197-216.
Jeannin P, Jaillon S, Delneste Y. Pattern recognition receptors in the immune response against dying cells. Current Opinions in Immunology. 2008;20:530-537.
Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nature Immunology. 2010;11:373-384.
Meylan E, Tschopp J, Karin M. Intracellular pattern recognition receptors in the host response. Nature. 2006;442:39-44.
Pichlmair A, Reis e Sousa C. Innate recognition of viruses. Immunity. 2007;27:370-383.
Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell. 2010;140:805-820.
Trinchieri G, Sher A. Cooperation of Toll-like receptor signals in innate immune defence. Nature Reviews Immunology. 2007;7:179-190.
Células do Sistema Imune Inato
Dale DC, Boxer L, Liles WC. The phagocytes: neutrophils and monocytes. Blood. 2008;112:935-945.
Lanier LL. NK cell recognition. Annual Review of Immunology. 2005;23:225-274.
Nauseef WM. How human neutrophils kill and degrade microbes: an integrated view. Immunological Reviews. 2007;219:88-102.
Segal AW. How neutrophils kill microbes. Annual Review of Immunology. 2005;23:197-223.
Serbina NV, Jia T, Hohl TM, Pamer EG. Monocyte-mediated defense against microbial pathogens. Annual Review of Immunology. 2008;26:421-452.
Underhill DM, Ozinsky A. Phagocytosis of microbes: complexity in action. Annual Review of Immunology. 2002;20:825-852.
Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. Functions of natural killer cells. Nature Immunology. 2008;9:503-510.
Moléculas Efetoras da Imunidade Inata
Bottazzi B, Doni A, Garlanda C, Mantovani A. An integrated view of humoral innate immunity: pentraxins as a paradigm. Annual Review of Immunology. 2010;28:157-183.
Klotman ME, Chang TL. Defensins in innate antiviral immunity. Nature Reviews Immunology. 2006;6:447-456.
Linden SK, Sutton P, Karlsson NG, Korolik V, McGuckin MA. Mucins in the mucosal barrier to infection. Mucosal Immunology. 2008;1:183-197.
Rock KL, Latz E, Ontiveros F, Kono H. The sterile inflammatory response. Annual Review of Immunology. 2010;28:321-342.
Schroder K, Tschopp J. The inflammasomes. Cell. 2010;140:821-832.
Selsted ME, Ouellette AJ. Mammalian defensins in the antimicrobial immune response. Nature Immunology. 2005;6:551-557.
Sims JE, Smith DE. The IL-1 family: regulators of immunity. Nature Reviews Immunology. 2010;10:89-102.
Van de Wetering JK, van Golde LMG, Batenburg JJ. Collectins: players of the innate immune system. European Journal of Biochemistry. 2004;271:229-249.
Doenças Causadas pela Imunidade Inata
Cinel I, Opal SM. Molecular biology of inflammation and sepsis: a primer. Critical Care Medicine. 2009;37:291-304.
Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis. New England Journal of Medicine. 2003;348:138-150.
Masters SL, Simon A, Aksentijevich I, Kastner DL. Horror autoinflammaticus: the molecular pathophysiology of autoinflammatory disease. Annual Review of Immunology. 2009;27:621-668.
Weighardt H, Holzmann B. Role of Toll-like receptor responses for sepsis pathogenesis. Immunobiology. 2007;212:715-722.