CAPÍTULO 2 Células e Tecidos do Sistema Imune
As células do sistema imune inato e adaptativo normalmente estão presentes como células circulantes no sangue e na linfa, como aglomerados anatomicamente definidos nos órgãos linfoides, e espalhadas praticamente em todos os tecidos. A organização anatômica dessas células e sua capacidade de circular e realizar trocas entre o sangue, a linfa e os tecidos são de importância fundamental para a geração das respostas imunológicas. O sistema imune enfrenta vários desafios para gerar respostas protetoras eficazes contra patógenos. Primeiro, o sistema deve ser capaz de responder rapidamente a um número pequeno de diferentes micro-organismos que podem invadir qualquer local do corpo. Segundo, na resposta imune adaptativa, poucos linfócitos virgens (naives) precisam reconhecer e responder especificamente a qualquer antígeno. Terceiro, os mecanismos efetores do sistema imune adaptativo (anticorpos e células T efetoras) podem ter de localizar e destruir micro-organismos em sítios distantes do local de início da resposta imunológica. A capacidade do sistema imune de enfrentar esses desafios e desempenhar suas funções protetoras de maneira eficaz depende de várias propriedades de suas células e seus tecidos. As principais células e tecidos do sistema imunológico e suas funções importantes são os seguintes:
• Os macrófagos são fagócitos que estão presentes constitutivamente nos tecidos e respondem rapidamente aos micro-organismos que entram nos tecidos.
• Os neutrófilos, um tipo abundante de fagócito, e os monócitos, precursores dos macrófagos teciduais, estão sempre presentes no sangue e podem ser rapidamente transportados para qualquer lugar do corpo.
• Tecidos especializados, denominados órgãos linfoides periféricos, funcionam para concentrar antígenos microbianos que são introduzidos por vias comuns de entrada (pele e tratos gastrointestinal e respiratório). A captura do antígeno e seu transporte para os órgãos linfoides são as primeiras etapas na resposta imune adaptativa. Antígenos que são transportados para os órgãos linfoides são apresentados pelas células apresentadoras de antígeno (APC – antigenpresenting cells) para reconhecimento por linfócitos T específicos.
• Quase todos os tecidos têm células dendríticas que são APC especializadas em capturar antígenos microbianos, transportá-los aos tecidos linfoides e apresentá-los para o reconhecimento por linfócitos T.
• Linfócitos virgens (linfócitos que ainda não entraram em contato com nenhum antígeno) migram para os órgãos linfoides periféricos, onde reconhecem os antígenos e iniciam as respostas imunológicas adaptativas. A anatomia dos órgãos linfoides favorece interações célula-célula que são necessárias para o reconhecimento do antígeno pelos linfócitos e para a ativação de linfócitos virgens, resultando na geração de linfócitos efetores e de memória.
• Linfócitos efetores e de memória circulam no sangue, dirigem-se aos sítios periféricos de entrada do antígeno e são retidos nesses sítios. Isso assegura que a imunidade seja sistêmica (i. e., que mecanismos protetores possam atuar em qualquer local do corpo).
As respostas imunológicas desenvolvem-se em uma sequência de etapas, e em cada uma delas as propriedades específicas das células e dos tecidos do sistema imune desempenham um papel fundamental. Este capítulo descreve células, tecidos e órgãos que compõem o sistema imune. Os padrões de circulação dos linfócitos pelo corpo e os mecanismos de migração dos linfócitos e de outros leucócitos serão descritos no Capítulo 3.
CÉLULAS DO SISTEMA IMUNE
As células que apresentam funções especializadas nas respostas imunes inata e adaptativa são os fagócitos, células dendríticas, linfócitos específicos para determinados antígenos e vários outros leucócitos que atuam para eliminar os antígenos. As células do sistema imune foram brevemente apresentadas no Capítulo 1. Aqui, descreveremos a morfologia e as características funcionais dos fagócitos, outros leucócitos, APC e linfócitos, além da organização dessas células nos tecidos linfoides. A Tabela 2-1 apresenta a quantidade de alguns desses tipos celulares presentes no sangue. Embora a maioria dessas células seja encontrada no sangue, as respostas aos micro-organismos geralmente são localizadas nos tecidos e não refletem alterações no número total de leucócitos circulantes.
TABELA 2-1 Contagens de Células Sanguíneas em Indivíduo Normal
| Número Médio por Microlitro | Faixa Normal | |
|---|---|---|
| Células brancas do sangue (leucócitos) | 7.400 | 4.500-11.000 |
| Neutrófilos | 4.400 | 1.800-7.700 |
| Eosinófilos | 200 | 0-450 |
| Basófilos | 40 | 0-200 |
| Linfócitos | 2.500 | 1.000-4.800 |
| Monócitos | 300 | 0-800 |
Fagócitos
Fagócitos, incluindo neutrófilos e macrófagos, são células cuja função primária é identificar, ingerir e destruir micro-organismos. As respostas funcionais dos fagócitos na defesa do hospedeiro consistem em passos sequenciais: recrutamento das células para os sítios de infecção, reconhecimento e ativação dos fagócitos pelos micro-organismos, ingestão pelo processo de fagocitose e destruição dos micro-organismos. Além disso, por meio do contato direto e da secreção de proteínas, os fagócitos comunicam-se com outras células de tal forma que promovem ou regulam as respostas imunológicas. As funções efetoras dos fagócitos são importantes na imunidade inata, que será discutida no Capítulo 4, e também na fase efetora de algumas respostas imunológicas adquiridas, como discutiremos no Capítulo 10. No presente capítulo descreveremos os aspectos morfológicos dos fagócitos, e faremos uma breve introdução das respostas funcionais de neutrófilos e macrófagos. O papel dos fagócitos nas respostas imunes será discutido em mais detalhes nos capítulos posteriores.
Neutrófilos
Os neutrófilos, também chamados leucócitos polimorfonucleares, constituem a população mais abundante de leucócitos circulantes e medeiam as fases iniciais das reações inflamatórias. Os neutrófilos circulam como células esféricas com diâmetro aproximado de 12 a 15 μm, com numerosas projeções membranosas. O núcleo de um neutrófilo é segmentado em três a cinco lóbulos conectados, daí a expressão leucócito polimorfonuclear (Fig. 2-1A). O citoplasma contém grânulos de dois tipos. A maioria deles corresponde aos grânulos específicos, que são preenchidos por enzimas, tais como lisozima, colagenase e elastase. Esses grânulos não se coram fortemente com corantes básicos (hematoxilina) ou ácidos (eosina), o que distingue os grânulos de neutrófilos daqueles presentes nos outros dois tipos de granulócitos circulantes, chamados basófilos e eosinófilos. Os demais grânulos de neutrófilos, denominados grânulos azurófilos, são lisossomos que contêm enzimas e outras substâncias microbicidas, inclusive defensinas e catelicidinas, que discutiremos no Capítulo 4. Os neutrófilos são produzidos na medula óssea e originam-se de uma linhagem comum com os fagócitos mononucleares. A produção de neutrófilos é estimulada pelo fator estimulador de colônias de granulócitos (G-CSF). Um ser humano adulto produz mais que 1 × 1011 neutrófilos por dia, e cada um circula no sangue apenas por seis horas. Os neutrófilos podem migrar para os sítios de infecção poucas horas após a entrada dos micro-organismos. Se um neutrófilo circulante não for recrutado para um sítio de inflamação nesse período, sofre apoptose e geralmente é fagocitado por macrófagos residentes no fígado ou no baço. Após a entrada nos tecidos, os neutrófilos atuam por algumas horas e em seguida morrem.
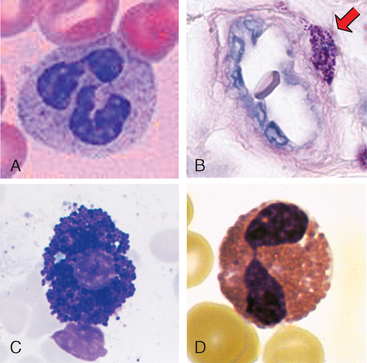
FIGURA 2-1 Morfologia de neutrófilos, mastócitos, basófilos e eosinófilos. A, Micrografia de luz de um neutrófilo sanguíneo corado com Wright-Giemsa mostrando o núcleo multilobado, motivo pelo qual estas células são denominadas leucócitos polimorfonucleares, e os grânulos citoplasmáticos de coloração fraca. B, Micrografia de luz de secção de pele corada com Wright-Giemsa mostrando um mastócito (seta) adjacente a um pequeno vaso sanguíneo, identificado pela hemácia no lúmen. Os grânulos citoplasmáticos no mastócito, que são corados em roxo, são preenchidos por histamina e outros mediadores que atuam nos vasos sanguíneos adjacentes para promover o aumento do fluxo sanguíneo e a saída de proteínas plasmáticas e leucócitos para o tecido. C, Micrografia de luz de um basófilo no sangue corado com Wright-Giemsa mostrando os grânulos citoplasmáticos característicos corados em azul. D, Micrografia de luz de um eosinófilo no sangue corado com Wright-Giemsa mostrando o núcleo segmentado característico e a coloração vermelha dos grânulos citoplasmáticos.
B, (Cortesia de Dr. George Murphy, Department of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.) C, (Cortesia de Dr. Jonathan Hecht, Department of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.)
Fagócitos Mononucleares
O sistema fagocítico mononuclear consiste em células cuja função primária é fagocitose e que desempenham funções centrais tanto na imunidade inata quanto na adquirida. As células do sistema fagocítico mononuclear originam-se de um precursor comum na medula óssea, circulam no sangue, sofrem maturação e tornam-se ativadas em vários tecidos (Fig. 2-2). O tipo celular dessa linhagem, que sai da medula e vai para o sangue periférico, é incompletamente diferenciado e é chamado monócito. Os monócitos têm 10 a 15 μm de diâmetro e apresentam núcleo em forma de feijão e citoplasma finamente granular contendo lisossomos, vacúolos fagocíticos e filamentos de citoesqueleto (Fig. 2-3). Os monócitos são heterogêneos e consistem em pelo menos dois subtipos, distinguíveis pelas proteínas de superfície celular e cinética de migração para os tecidos. Uma população é denominada inflamatória porque é rapidamente recrutada do sangue para os sítios de inflamação tecidual. O outro tipo pode ser a fonte de macrófagos residentes do tecido e algumas células dendríticas.
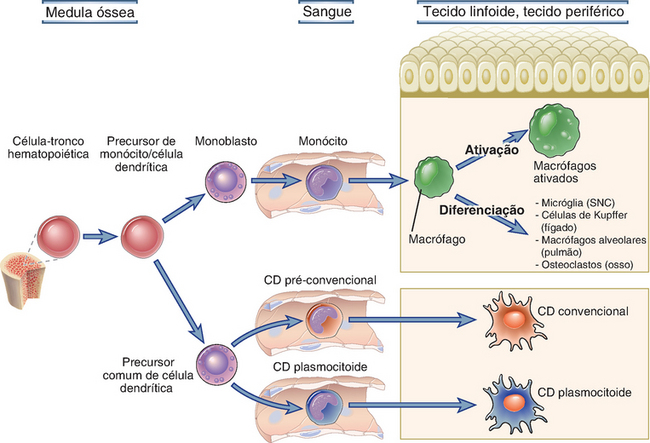
FIGURA 2-2 Maturação de fagócitos mononucleares e células dendríticas. As células dendríticas e os monócitos são derivados de uma célula precursora comum da linhagem mieloide na medula óssea, e a diferenciação em monócitos e células dendríticas é dirigida por citocinas, como o fator estimulador de colônias de monócitos e o ligante de Flt3, respectivamente (não mostrado). As células dendríticas posteriormente diferenciam-se em subpopulações, sendo as principais as células dendríticas convencionais e as células dendríticas plasmocitoides. Algumas células dendríticas podem originar-se de monócitos em tecidos inflamados. Quando os monócitos do sangue são recrutados para os tecidos, essas células tornam-se macrófagos. Os macrófagos de vida longa estão presentes em todos os tecidos do corpo. Existem pelo menos duas populações de monócitos sanguíneos (não mostrado), que são precursores, respectivamente, de macrófagos que se acumulam em resposta a infecções e de macrófagos que estão constitutivamente presentes nos tecidos normais. Os macrófagos em tecidos tornam-se ativados para realizar funções antimicrobianas e de reparo tecidual em resposta a infecções e/ou lesão tecidual. Os macrófagos diferenciam-se em formas especializadas em determinados tecidos. SNC, sistema nervoso central; CD, célula dendrítica.
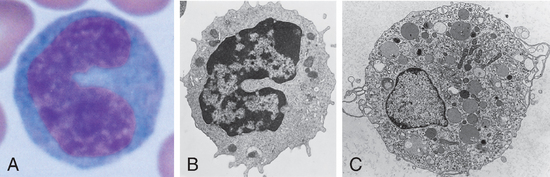
FIGURA 2-3 Morfologia de fagócitos mononucleares. A, Micrografia de luz de um monócito em esfregaço de sangue periférico. B, Micrografia eletrônica de um monócito de sangue periférico. C, Micrografia eletrônica de um macrófago tecidual ativado apresentando vários vacúolos fagocíticos e organelas citoplasmáticas.
B, (Cortesia de Dr. Noel Weidner, Department of Pathology, University of California, San Diego.) C, (De Fawcett DW. Bloom and Fawcett: A Textbook of Histology, 12th ed. Chapman & Hall, New York, 1994. Com gentil permissão de Springer Science and Business Media.)
Uma vez que entram nos tecidos, esses monócitos amadurecem e tornam-se macrófagos. Os macrófagos têm denominações especiais em diferentes tecidos, de acordo com a localização específica. Por exemplo, no sistema nervoso central, são chamados células da micróglia; quando revestem os sinusoides vasculares do fígado, são denominados células de Kupffer; nas vias aéreas pulmonares, são chamados macrófagos alveolares; e fagócitos multinucleados no tecido ósseo são denominados osteoclastos.
Os macrófagos realizam várias funções importantes nas imunidades inata e adquirida.
• Uma das funções principais dos macrófagos na defesa do hospedeiro é a ingestão e morte de micro-organismos. Os mecanismos de morte, discutidos no Capítulo 4, incluem a geração enzimática de espécies reativas de oxigênio e nitrogênio que são tóxicas para os micro-organismos e a digestão proteolítica.
• Além da ingestão de micro-organismos, os macrófagos também ingerem células mortas do hospedeiro como parte do processo de limpeza após infecção ou resolução da lesão tecidual. Por exemplo, essas células fagocitam neutrófilos mortos que se acumulam rapidamente nos sítios de infecção ou de morte tecidual causada por traumatismo ou interrupção do suprimento sanguíneo. Os macrófagos também reconhecem e englobam células apoptóticas antes que elas possam liberar seu conteúdo e induzir respostas inflamatórias. Por toda a parte do corpo e durante a vida de um indivíduo, células indesejadas morrem por apoptose, como parte de muitos processos fisiológicos, tais como desenvolvimento, crescimento e renovação de tecidos saudáveis, e as células mortas devem ser eliminadas pelos macrófagos.
• Macrófagos ativados secretam proteínas, denominadas citocinas, que se ligam aos receptores presentes em outras células instruídas por meio dessa interação a responderem de uma maneira que contribua para a defesa do hospedeiro. Por exemplo, algumas citocinas atuam em células endoteliais que revestem os vasos sanguíneos, aumentando o recrutamento de monócitos do sangue para os sítios de infecção e, assim, amplificando a resposta protetora contra os micro-organismos. Diferentes citocinas estão envolvidas em cada aspecto das respostas imunes. As propriedades gerais e as diferentes classes de citocinas foram discutidas no Capítulo 1.
• Os macrófagos atuam como APC que apresentam antígenos e ativam linfócitos T. Essa função é importante na fase efetora da resposta imune mediada por células T (Cap. 10).
• Outra importante função dos macrófagos é promover o reparo de tecidos lesionados pelo estímulo ao crescimento de novos vasos sanguíneos (angiogênese) e pela síntese de matriz extracelular rica em colágeno (fibrose). Essa função é mediada por citocinas secretadas por macrófagos que atuam em várias células teciduais.
Para realizar suas funções, macrófagos são ativados pelo reconhecimento de diferentes tipos de moléculas microbianas, assim como moléculas do hospedeiro produzidas em resposta às infecções. Essas várias moléculas ativadoras ligam-se aos receptores específicos localizados na superfície ou no interior do macrófago. Exemplos desses receptores são os receptores semelhante a Toll (Toll-like receptors), que são componentes centrais da imunidade inata e serão discutidos em detalhes no Capítulo 4. A ativação de macrófagos também ocorre quando receptores na membrana plasmática se ligam a opsoninas na superfície do micro-organismo. Opsoninas são substâncias que revestem partículas ou células para a fagocitose. Exemplos de receptores de opsoninas são os receptores para componentes do sistema complemento e receptores para Fc de anticorpos, discutidos no Capítulo 12. Na imunidade adaptativa, os macrófagos são ativados por citocinas secretadas e proteínas de membrana de linfócitos T, assunto discutido no Capítulo 10.
Os macrófagos podem adquirir distintas propriedades funcionais, dependendo do tipo de estímulo para a ativação celular. O exemplo mais evidente de resposta de macrófagos a diferentes citocinas é dado por subpopulações de células T. Algumas dessas citocinas ativam macrófagos para se tornarem eficientes na eliminação de micro-organismos, processo denominado ativação clássica. Outras citocinas ativam macrófagos que promovem o remodelamento e o reparo teciduais, processo chamado ativação alternativa. Os detalhes dessas diferentes formas de ativação e as citocinas envolvidas são discutidos no Capítulo 10. Os macrófagos podem assumir diferentes morfologias após ativação por estímulos externos, como micro-organismos. Alguns desenvolvem citoplasma abundante e são chamados células epitelioides por causa de sua semelhança com células epiteliais da pele. Macrófagos ativados podem sofrer fusão para formar células gigantes multinucleadas.
Células semelhantes a macrófagos são filogeneticamente os mediadores mais antigos da imunidade inata. A Drosophila responde à infecção ao cercar micro-organismos com “hemócitos”, que são células similares a macrófagos capazes de fagocitar micro-organismos e delimitar a infecção por induzir a coagulação da hemolinfa circundante. Células similares aos fagócitos foram identificadas também em plantas.
Os macrófagos geralmente respondem aos micro-organismos tão rapidamente quanto os neutrófilos, mas sobrevivem por mais tempo nos sítios de inflamação. Ao contrário dos neutrófilos, os macrófagos não são células em fase terminal de diferenciação. Portanto, macrófagos são as células efetoras dominantes nos estágios mais tardios da resposta imune inata, alguns dias após a infecção.
Mastócitos, Basófilos e Eosinófilos
Mastócitos, basófilos e eosinófilos são três tipos celulares com importantes funções nas imunidades inata e adquirida. Essas células têm uma característica em comum que é a presença de grânulos citoplasmáticos preenchidos por vários mediadores inflamatórios e antimicrobianos. Outro aspecto comum é o seu envolvimento nas respostas imunes que protegem contra helmintos e nas que causam doenças alérgicas. Descreveremos as principais características dessas células nesta seção e discutiremos suas funções em mais detalhes no Capítulo 19.
Mastócitos
Os mastócitos são células provenientes da medula óssea que estão presentes na pele e no epitélio das mucosas e contêm grânulos citoplasmáticos abundantes preenchidos por citocinas, histamina e outros mediadores. O fator de células-tronco (também chamado ligante de c-Kit) é uma citocina essencial para o desenvolvimento dos mastócitos. De modo geral, mastócitos maduros não são encontrados na circulação, mas estão presentes constitutivamente nos tecidos saudáveis, geralmente próximos a pequenos vasos sanguíneos e nervos. Mastócitos humanos variam em sua forma, têm núcleo arredondado e citoplasma contendo grânulos ligados à membrana (Fig. 2-1B). Os grânulos contêm proteoglicanas ácidas que se ligam a corantes básicos. Os mastócitos expressam receptores de membrana para a fração Fc de anticorpos IgE e IgG e geralmente são revestidos por esses anticorpos. Quando os anticorpos presentes na superfície do mastócito se ligam ao antígeno, são induzidos eventos de sinalização intracelular que acarretam a liberação do conteúdo dos grânulos citoplasmáticos para o espaço extracelular. Os conteúdos liberados dos grânulos incluem citocinas e histamina, as quais promovem alterações nos vasos sanguíneos que fazem parte do processo inflamatório. Os mastócitos também expressam outros receptores que reconhecem proteínas do complemento, neuropeptídeos e produtos microbianos. Além disso, essas células são importantes na defesa contra helmintos, mas são também responsáveis pelos sintomas das doenças alérgicas (Cap. 19).
Basófilos
Os basófilos são granulócitos do sangue com muitas semelhanças estruturais e funcionais com os mastócitos. Assim como outros granulócitos, os basófilos são derivados de progenitores da medula óssea (uma linhagem diferente daquela dos mastócitos), sofrem maturação na medula e circulam no sangue. Os basófilos constituem menos de 1% dos leucócitos do sangue (Tabela 2-1), contêm grânulos que se ligam a corantes básicos (Fig. 2-1C) e são capazes de sintetizar vários dos mediadores produzidos pelos mastócitos. Embora não estejam normalmente presentes nos tecidos, essas células podem ser recrutadas para alguns sítios inflamatórios. Tal como os mastócitos, os basófilos expressam receptores para Fc de IgG e IgE e podem ser estimulados pela ligação do antígeno à IgE presente em sua superfície. Em virtude do número baixo de basófilos nos tecidos, sua importância na defesa do hospedeiro e nas reações alérgicas é incerta.
Eosinófilos
Os eosinófilos são granulócitos do sangue que expressam grânulos citoplasmáticos contendo enzimas danosas às paredes celulares de parasitas, mas podem também lesionar tecidos do hospedeiro. Os grânulos dos eosinófilos contêm proteínas básicas que se ligam a corantes ácidos, como a eosina (Fig. 2-1D). Assim como os neutrófilos e basófilos, eosinófilos são células provenientes da medula óssea. GM-CSF, IL-3 e IL-5 promovem a maturação dos eosinófilos de precursores mieloides. Alguns eosinófilos estão presentes normalmente nos tecidos periféricos, especialmente nos revestimentos das mucosas dos tratos respiratório, gastrointestinal e genitourinário, podendo aumentar em número em razão do recrutamento dessas células do sangue em condições inflamatórias.
Células Apresentadoras de Antígeno
Células apresentadoras de antígeno (APC) são populações celulares especializadas em capturar antígenos microbianos e outros antígenos, apresentá-los aos linfócitos e fornecer sinais que estimulem a proliferação e diferenciação desses linfócitos. Por convenção, APC geralmente se refere a uma célula que apresenta antígenos aos linfócitos T. A principal APC envolvida no início das respostas de células T é a célula dendrítica. Macrófagos e células B apresentam antígenos aos linfócitos em diferentes tipos de resposta imune, e um tipo celular especializado chamado célula dendrítica folicular apresenta antígenos aos linfócitos B durante determinada fase da resposta imune humoral. As APC ligam a imunidade inata à imunidade adquirida e, portanto, podem ser consideradas componentes de ambos os sistemas. Além da introdução apresentada aqui, aspectos funcionais das APC serão discutidos em mais detalhes no Capítulo 6.
Células Dendríticas
As células dendríticas são as APC mais importantes para ativação de células T virgens, e desempenham grande papel na resposta imune inata às infecções e na ligação entre imunidades inata e adquirida. São células que têm longas projeções membranosas e capacidade fagocítica, e são amplamente distribuídas nos tecidos linfoides, no epitélio das mucosas e no parênquima dos órgãos (Fig. 2-4). As células dendríticas fazem parte da linhagem mieloide de células hematopoiéticas e originam-se de um precursor que pode também diferenciar-se em monócitos, mas não em granulócitos (Fig. 2-2). A maturação das células dendríticas depende de uma citocina denominada ligante Flt3, que se liga ao receptor do tipo tirosinocinase Flt3 nas células precursoras. De modo similar aos macrófagos, as células dendríticas expressam receptores que reconhecem moléculas tipicamente produzidas por micro-organismos, mas não derivadas de células de mamíferos, e respondem com a produção de citocinas. A maioria das células dendríticas é denominada células dendríticas convencionais. Em resposta à ativação induzida por micro-organismos, as células dendríticas convencionais na pele, na mucosa e no parênquima dos órgãos tornam-se móveis, migram para os gânglios linfáticos e apresentam os antígenos microbianos aos linfócitos T. Portanto, essas células têm funções tanto na imunidade inata como na adquirida e são um elo entre esses dois componentes da defesa do hospedeiro. Uma subpopulação de células dendríticas, chamada células dendríticas plasmocitoides, são respondedoras celulares precoces nas infecções virais. Essas células reconhecem ácidos nucleicos de vírus intracelulares e produzem proteínas solúveis chamadas interferons do tipo I, que têm potentes atividades antivirais. O papel das células dendríticas como mediadoras da imunidade inata e como APC será discutido nos Capítulos 4 e 6, respectivamente.
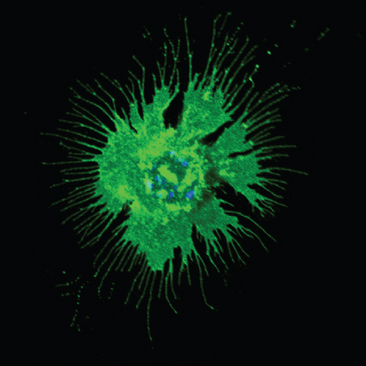
FIGURA 2-4 Uma célula dendrítica. A fotomicrografia de fluorescência mostra uma célula dendrítica derivada da medula óssea, na qual moléculas de MHC de classe II aparecem em verde, detalhando os finos processos citoplasmáticos característicos desse tipo celular, enquanto o núcleo aparece em azul. As moléculas do MHC de classe II são altamente expressas em células dendríticas e são essenciais para as atividades funcionais dessas células (Cap. 6).
(Cortesia de Scott Loughhead e Uli Van Andrian, Harvard Medical School, Boston, Massachusetts.)
Células Apresentadoras de Antígenos para Linfócitos T Efetores
Além das células dendríticas, macrófagos e linfócitos B realizam importantes funções como células apresentadoras de antígenos em respostas mediadas por células T CD4+ auxiliares (T helper). Macrófagos apresentam antígenos para os linfócitos T auxiliares nos sítios de infecção, conduzindo à ativação dessas células e à produção de moléculas para posterior ativação dos macrófagos. Esse processo é importante para a erradicação de agentes infecciosos que são ingeridos pelos fagócitos, mas que resistem à morte; nesses casos, as células T auxiliares intensificam as atividades microbicidas dos macrófagos. As células B apresentam antígenos para as células T auxiliares nos gânglios linfáticos e no baço, o que é uma etapa-chave na cooperação de células T auxiliares com células B na resposta imune humoral aos antígenos proteicos. O papel dos macrófagos e das células B será discutido nos Capítulos 10 e 11. Linfócitos T citotóxicos (CTL, cytotoxic T lymphocytes) são células T CD8+ efetoras que podem reconhecer antígenos em qualquer tipo de célula nucleada e tornar-se ativadas para matar a célula. Por conseguinte, todas as células nucleadas são potencialmente APC para os CTL.
Células Dendríticas Foliculares
As células dendríticas foliculares (follicular dendritic cells – FDC) são células com projeções membranosas encontradas em áreas enriquecidas de células B ativadas, chamadas centros germinativos, nos folículos linfoides dos gânglios linfáticos, do baço e dos tecidos linfoides das mucosas. As FDC não são derivadas de precursoras da medula óssea e não são relacionadas com as células dendríticas que apresentam antígenos aos linfócitos T. As FDC capturam antígenos complexados com anticorpos ou produtos do complemento e apresentam esses antígenos em suas superfícies para reconhecimento pelos linfócitos B. Isso é importante para a seleção de linfócitos B ativados, cujos receptores de antígeno da célula B ligam-se aos antígenos apresentados com alta afinidade (Cap. 11).
Linfócitos
Os linfócitos, principais células da imunidade adquirida, são as únicas células do corpo que expressam receptores de antígeno distribuídos clonalmente, cada qual com uma especificidade distinta para diferentes determinantes antigênicos. Cada clone de linfócitos consiste em uma progênie derivada de uma célula e expressa receptores de antígeno com a mesma especificidade. Por essa razão, diz-se que os receptores de antígeno no sistema imune adaptativo são distribuídos clonalmente. Como discutiremos aqui e nos próximos capítulos, existem milhões de clones de linfócitos no corpo que permitem ao organismo reconhecer e responder a milhões de antígenos estranhos.
O papel dos linfócitos como células que medeiam a imunidade adaptativa foi estabelecido durante décadas de pesquisa por várias linhas de evidência. Um dos indícios iniciais sobre a importância dos linfócitos na imunidade adquirida veio da descoberta de que humanos com imunodeficiências congênitas e adquiridas têm números reduzidos de linfócitos na circulação periférica e nos tecidos linfoides. Além disso, médicos notaram que a depleção de linfócitos com fármacos ou irradiação prejudicava a proteção contra infecções. Experimentos feitos principalmente com camundongos mostraram que a imunidade protetora aos micro-organismos pode ser transferida de animais imunizados para animais virgens apenas por linfócitos ou seus produtos secretados. Experimentos in vitro mostraram que a estimulação de linfócitos com antígenos conduz a respostas que mimetizam muitas das características das respostas imunológicas induzidas em condições fisiológicas in vivo. Após identificação dos linfócitos como mediadores das imunidades humoral e celular, muitas descobertas foram alcançadas rapidamente em relação aos diferentes tipos de linfócitos, suas origens na medula óssea e no timo e as consequências da ausência de cada tipo de linfócito. Essas descobertas foram baseadas em muitas ferramentas, inclusive camundongos geneticamente modificados e reagentes que seletivamente depletavam um ou outro tipo de linfócito. Entre essas descobertas, a mais importante foi que receptores específicos para determinado antígeno, altamente diversos e distribuídos clonalmente, são produzidos por linfócitos, mas não por outros tipos de células. Durante as últimas duas décadas, houve uma enorme expansão de informação sobre os genes, as proteínas e as funções dos linfócitos. É provável que tenhamos mais conhecimento agora sobre os linfócitos do que qualquer outro tipo de célula em toda a Biologia.
Uma das questões mais interessantes sobre os linfócitos tem sido de que maneira o enorme repertório diversificado de receptores de antígeno e, consequentemente, as especificidades são gerados de um pequeno número de genes para esses receptores na linhagem germinativa. Hoje sabe-se que os genes que codificam os receptores de antígenos dos linfócitos são formados pela recombinação de segmentos de DNA durante a maturação dessas células. Esses eventos de recombinação somática ocorrem de forma randômica, resultando na geração de milhões de diferentes genes de receptores e um repertório altamente diverso de especificidades antigênicas entre diferentes clones de linfócitos (Cap. 8).
O número total de linfócitos em um adulto saudável é cerca de 5 × 1011. Desse total, quase 2% estão no sangue, quase 10% na medula óssea, quase 15% nos tecidos linfoides das mucosas dos tratos gastrointestinal e respiratório e quase 65% nos órgãos linfoides (principalmente nos gânglios linfáticos e no baço). Primeiro, descreveremos as propriedades dessas células e, em seguida, a sua organização nos vários tecidos linfoides.
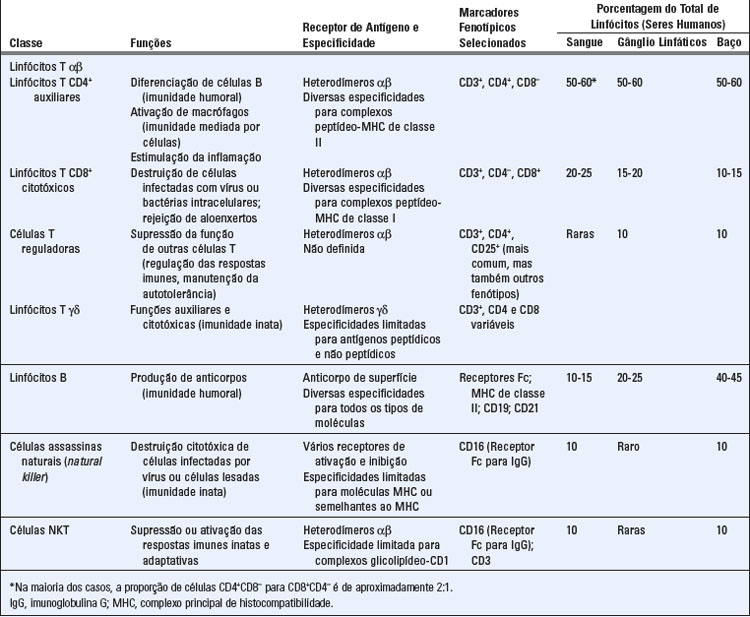
Subtipos de Linfócitos
Os linfócitos consistem em distintos subtipos que diferem nas suas funções e em seus produtos proteicos (Tabela 2-2). As principais classes de linfócitos foram apresentadas no Capítulo 1 (Fig. 1-5). Morfologicamente, todos os linfócitos são similares, e sua aparência não reflete sua heterogeneidade nem suas funções diversas. Os linfócitos B, células que produzem anticorpos, foram assim chamados porque nas aves essas células sofriam maturação em um órgão chamado bursa de Fabricius. Nos mamíferos, não existe um equivalente anatômico da bursa, e os estágios iniciais de maturação das células B ocorrem na medula óssea. Portanto, linfócitos “B” referem-se aos linfócitos derivados da bursa ou linfócitos derivados da medula óssea. Os linfócitos T, mediadores da imunidade celular, foram assim denominados por causa de seus precursores, que se originam na medula óssea, migram e sofrem maturação no timo; linfócitos “T” referem-se aos linfócitos derivados do timo. Os linfócitos B e T consistem em subtipos com distintas características fenotípicas e funcionais. Os principais subtipos de células B são as células B foliculares, células B da zona marginal e células B-1, sendo cada um deles encontrado em distintas localizações anatômicas dentro dos tecidos linfoides. Os dois principais subtipos de células T são os linfócitos T CD4+ auxiliares e linfócitos T CD8+ citotóxicos, que expressam um receptor de antígeno chamado receptor αβ. As células T CD4+ reguladoras representam um terceiro subtipo de células T que expressam o receptor αβ. Outra população de células T, chamada células T γδ, expressa um tipo similar de receptor antigênico, porém estruturalmente distinto. As diferentes funções dessas classes de células B e T serão discutidas nos próximos capítulos.
As principais populações de células B e T expressam conjuntos de receptores antigênicos altamente diversos e clonalmente distribuídos. As subpopulações minoritárias de linfócitos, inclusive células T γδ, células B da zona marginal e células B-1, são restritas quanto ao uso de segmentos de DNA que contribuem para os genes de receptores antigênicos, e, por conseguinte, esses subtipos de linfócitos têm uma diversidade bastante limitada.
Além das células B e T, existem outras populações de células que são denominadas linfócitos com base nos aspectos morfológicos e certos critérios funcionais e moleculares, mas não são prontamente categorizadas como células B ou T. As células assassinas naturais (natural killer − NK), descritas no Capítulo 4, apresentam funções efetoras semelhantes às das CTL, mas seus receptores são distintos daqueles observados em células B ou T e não são codificados por genes recombinados somaticamente. As células NKT representam uma pequena população de linfócitos T e são assim chamadas em razão da expressão de uma molécula de superfície tipicamente encontrada em células NK. Essas células expressam receptores antigênicos αβ que são codificados por genes recombinados somaticamente, mas, assim como as células T γδ e células B-1, perdem diversidade. As células NKT, T γδ e B-1 podem ser consideradas componentes tanto da imunidade inata quanto da adaptativa.
Proteínas de membrana são utilizadas como marcadores fenotípicos para distinguir populações de linfócitos (Tabela 2-2). Por exemplo, a maioria das células T auxiliares expressa uma proteína de superfície chamada CD4 e a maioria das CTL expressa uma proteína de superfície diferente chamada CD8. Essas e muitas outras proteínas de superfície são frequentemente chamadas marcadores, pois identificam e discriminam (“marcam”) diferentes populações celulares. Esses marcadores não permitem apenas distinguir as classes de linfócitos, mas também desempenham diversas funções nas células que os expressam. A maneira mais comum de determinar se um marcador fenotípico de superfície é expresso em uma célula é testar se anticorpos específicos para o marcador ligam-se à superfície da célula. Nesse contexto, os anticorpos são empregados pelos pesquisadores ou pelos médicos como ferramentas analíticas. Há milhares de diferentes preparações de anticorpos específicos para determinada molécula, denominados anticorpos monoclonais, marcados com sondas que podem ser prontamente detectadas nas superfícies celulares pelo uso de instrumentos apropriados (os anticorpos monoclonais serão descritos no Capítulo 5 e os métodos para detecção de anticorpos marcados ligados a células serão discutidos no Apêndice IV). O sistema de grupamentos de diferenciação (cluster of differentiation – CD) é uma maneira universalmente adotada para nomeação de moléculas de superfície celular que são características de determinada linhagem celular ou estágio de diferenciação, e são reconhecidos por anticorpos monoclonais. Portanto, para todas as moléculas de superfície celular bem-definidas estruturalmente utiliza-se uma designação CD numérica (p. ex., CD1, CD2). O Apêndice III apresenta uma lista atualizada dos marcadores CD de leucócitos mencionados neste livro.
Desenvolvimento dos Linfócitos
Após o nascimento do indivíduo, os linfócitos, como todas as células do sangue, originam-se de células-tronco na medula óssea. A origem dos linfócitos de progenitores na medula óssea foi demonstrada primeio por experimentos com quimeras da medula óssea induzidas por radiação. Os linfócitos e seus precursores são radiossensíveis e são destruídos por altas doses de radiação γ. Se um camundongo de uma linhagem isogênica for exposto à radiação e depois receber uma injeção de células da medula óssea ou pequenos números de células-tronco hematopoiéticas de outra linhagem, todos os linfócitos que se desenvolverem subsequentemente serão derivados de células da medula óssea ou das células-tronco hematopoiéticas do doador. Abordagens como essa têm sido úteis para avaliação da maturação de linfócitos e de outras células sanguíneas.
Todos os linfócitos passam por estágios complexos de maturação durante os quais expressam receptores antigênicos e adquirem características funcionais e fenotípicas de células maduras. Os sítios anatômicos nos quais as principais etapas do desenvolvimento de linfócitos ocorrem são denominados órgãos linfoides primários. Eles incluem a medula óssea, na qual os precursores de todos os linfócitos têm origem e as células B amadurecem, e o timo, local de maturação das células T (Fig. 2-5). Os processos de maturação dos linfócitos B e T serão discutidos em mais detalhe no Capítulo 8. As células B e T maduras são chamadas linfócitos virgens (naïve). Após ativação pelo antígeno, os linfócitos sofrem alterações sequenciais no fenótipo e na capacidade funcional.
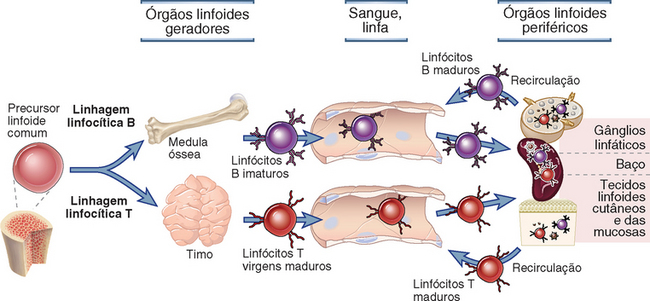
FIGURA 2-5 Maturação de linfócitos. Os linfócitos desenvolvem-se de células-tronco da medula óssea e sofrem maturação nos órgãos linfoides primários (medula óssea e timo para células B e T, respectivamente), e então circulam no sangue para os órgãos linfoides secundários (gânglios linfáticos, baço, tecidos linfoides regionais, tais como os tecidos linfoides associados às mucosas). Células T totalmente maduras deixam o timo, mas células B imaturas deixam a medula óssea e completam sua maturação nos órgãos linfoides secundários. Células completamente maduras podem responder aos antígenos estranhos nesses tecidos linfoides secundários ou retornar pela drenagem linfática para o sangue e recircular por meio de outros órgãos linfoides secundários.
Populações de Linfócitos Distinguidas pela História de Exposição ao Antígeno
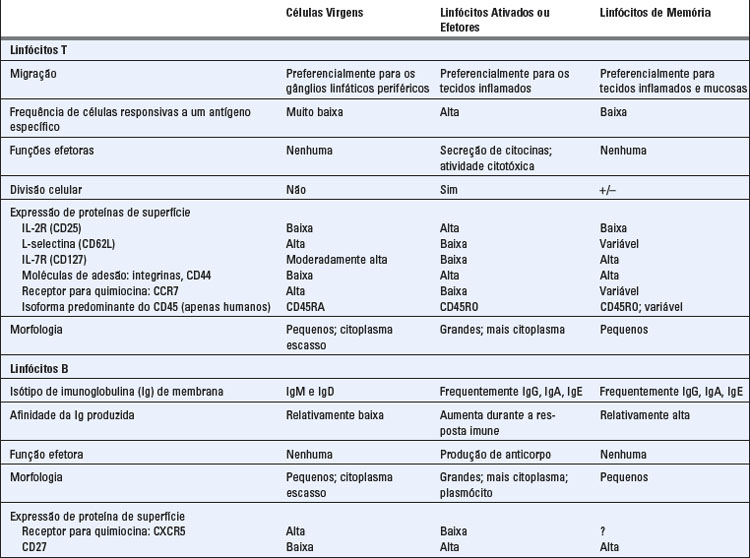
Na resposta imune adaptativa, os linfócitos virgens, que emergem da medula óssea ou do timo, migram para os órgãos linfoides periféricos, onde são ativados pelos antígenos a proliferar e diferenciarem-se em células efetoras e de memória, algumas das quais depois migram para os tecidos (Fig. 2-6). A ativação dos linfócitos segue uma série de etapas sequenciais, começando pela síntese de novas proteínas, tais como citocinas e receptores de citocinas, que são necessárias para muitas das alterações subsequentes. A célula virgem sofre proliferação, resultando em aumento de tamanho do clone específico para determinado antígeno, processo denominado expansão clonal. Em algumas infecções, o número de células T específicas para determinado micro-organismo pode aumentar mais de 50.000 vezes e o número de células B específicas pode aumentar em até 5.000 vezes. Essa rápida expansão clonal de linfócitos específicos para determinado micro-organismo é necessária para fazer frente à capacidade desses patógenos de se replicarem rapidamente. Simultaneamente à expansão clonal, os linfócitos estimulados por antígenos diferenciam-se em células efetoras, cuja função é eliminar o antígeno. Algumas células da progênie de linfócitos B e T estimulados por antígenos diferenciam-se em células de memória de vida longa, cuja função é mediar respostas rápidas e potentes (p. ex., secundárias) em uma eventual reexposição aos antígenos. Distintas populações de linfócitos (virgens, efetoras e memória) estão presentes em vários sítios espalhados pelo corpo, e essas populações podem ser diferenciadas por critérios funcionais e fenotípicos (Tabela 2-3).
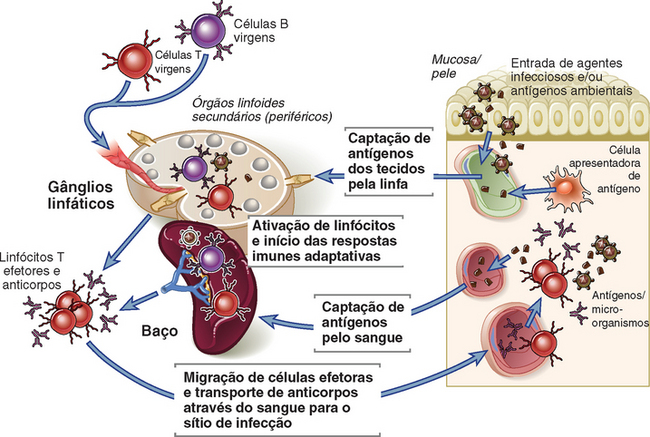
FIGURA 2-6 A anatomia da ativação de linfócitos. As células T virgens que saem do timo e as células B imaturas que saem da medula óssea migram para os órgãos linfoides secundários, que incluem gânglios linfáticos e baço. Nesses locais, as células B completam a sua maturação; as células B e T virgens ativadas por antígenos sofrem diferenciação para linfócitos efetores e de memória. Alguns linfócitos efetores e de memória migram para os sítios de infecção teciduais periféricos. Anticorpos secretados por células B efetoras no gânglio linfático, no baço e na medula óssea (não mostrado) caem na circulação sanguínea e são transportados para os sítios de infecção.
Os detalhes sobre ativação e diferenciação de linfócitos, assim como as funções de cada uma dessas populações, estão em capítulos posteriores neste livro. Aqui apresentamos um resumo das características fenotípicas de cada população.
Linfócitos Virgens (Naïve)
Os linfócitos virgens são células T ou B maduras que residem nos órgãos linfoides periféricos ou na circulação e que nunca encontraram o antígeno correspondente. (O termo virgem refere-se à ideia de que essas células são imunologicamente inexperientes porque nunca encontraram o antígeno.) Os linfócitos virgens normalmente morrem depois de um a três meses se não reconhecerem o antígeno. Os linfócitos virgens e de memória, discutidos mais adiante, são ambos considerados linfócitos em repouso, pois não estão ativamente em divisão nem estão desempenhando funções efetoras. Os linfócitos B e T virgens (e de memória) não podem ser facilmente distinguidos morfologicamente e ambos são frequentemente vistos como pequenos linfócitos quando observados em esfregaços sanguíneos ou em citometria de fluxo (uma técnica descrita no Apêndice IV). Um pequeno linfócito possui 8 a 10 μm de diâmetro e tem um núcleo grande com heterocromatina densa e uma faixa delgada de citoplasma que contém poucas mitocôndrias, ribossomos e lisossomos, mas sem organelas especializadas visíveis (Fig. 2-7). Antes da estimulação antigênica, os linfócitos virgens estão em estado de repouso ou na fase G0 do ciclo celular. Em resposta ao estímulo, entram na fase G1 do ciclo celular antes de sofrerem divisão. Os linfócitos ativados são maiores (10 a 12 μm de diâmetro), têm mais citoplasma e organelas, além de quantidades aumentadas de RNA citoplasmático, e são denominados grandes linfócitos ou linfoblastos (Fig. 2-7).
FIGURA 2-7 Morfologia dos linfócitos. A, Micrografia de luz de um linfócito em um esfregaço de sangue periférico. B, Micrografia eletrônica de um pequeno linfócito. C, Micrografia de luz de um linfócito grande (linfoblasto). D, Micrografia eletrônica de um linfócito grande (linfoblasto).
A, (Cortesia de Jean Shafer, Department of Pathology, University of California, San Diego. Copyright 1995-2008, Carden Jennings Publishing Co., Ltd.) B, (Cortesia de Dr. Noel Weidner, Department of Pathology, University of California, San Diego.) C, (Cortesia de Jean Shafer, Department of Pathology, University of California, San Diego. Copyright 1995-2008, Carden Jennings Publishing Co., Ltd.) D, (De Fawcett DW. Bloom and Fawcett: A Textbook of Histology, 12th ed. Chapman & Hall, New York, 1994. Com gentil permissão de Springer Science and Business Media.)
A sobrevivência dos linfócitos virgens depende de dois tipos de sinais, alguns dos quais são gerados por receptores de antígeno e outros por citocinas. Postula-se que o receptor antigênico de células B virgens gera sinais de sobrevivência mesmo na ausência do antígeno, e linfócitos T virgens reconhecem vários antígenos próprios “fracamente”, de maneira suficiente para gerar sinais de sobrevivência, mas sem disparar os sinais mais fortes necessários para iniciar a expansão clonal e a diferenciação em células efetoras. A necessidade da expressão do receptor de antígeno para manter a população de linfócitos virgens nos órgãos linfoides periféricos foi demonstrada em estudos realizados com camundongos nos quais os genes que codificam os receptores de antígenos de células B ou T foram deletados após a maturação dos linfócitos (o método utilizado, denominado técnica de recombinase Cre/lox, está descrito no Apêndice IV). Nesses estudos, linfócitos virgens que perderam seus receptores morreram em duas ou três semanas.
As citocinas são também essenciais para a sobrevivência de linfócitos virgens. As células T e B virgens constitutivamente expressam receptores para essas citocinas. A mais importante dessas citocinas é a interleucina 7 (IL-7), que promove sobrevivência, e talvez baixos níveis de divisão celular de células T virgens, e o fator ativador de células B (B cell-activating factor – BAF), pertencente à família do TNF, que é necessário para a sobrevivência de células B virgens.
No estado de repouso, a população de linfócitos virgens é mantida em um número razoavelmente constante, em razão do equilíbrio entre morte espontânea dessas células e a geração de novas células nos órgãos linfoides geradores. Qualquer perda de linfócitos leva a uma proliferação compensatória dos linfócitos remanescentes e a uma produção aumentada nos órgãos geradores. A capacidade da população de linfócitos de “preencher” o espaço disponível é o fenômeno da proliferação homeostática. Se células virgens forem transferidas para um hospedeiro que seja deficiente em linfócitos (dito linfopênico), por causa de defeitos hereditários ou de efeitos de irradiação, os linfócitos transferidos começam a proliferar até que atinjam aproximadamente o número de linfócitos de animais normais. A proliferação homeostática parece ser conduzida pelos mesmos sinais − reconhecimento fraco de alguns antígenos próprios e de citocinas, principalmente IL-7 − que são necessários para a manutenção dos linfócitos virgens.
Linfócitos Efetores
Após ativação dos linfócitos virgens, essas células tornam-se maiores e passam a proliferar, sendo chamadas linfoblastos. Algumas delas diferenciam-se em linfócitos efetores que têm a capacidade de produzir moléculas que atuam para eliminar o antígeno; os linfócitos efetores incluem células T auxiliares, CTL e plasmócitos secretores de anticorpos. As células T auxiliares, que geralmente são CD4+, expressam moléculas de superfície, como ligante de CD40 (CD154), e secretam citocinas que atuam nos macrófagos e linfócitos B, levando à ativação dessas células. Os CTL têm grânulos citoplasmáticos preenchidos com proteínas que, quando liberados, matam as células que os CTL reconhecem, ou seja, geralmente células infectadas por vírus ou células tumorais. Tanto as células T efetoras CD4+ quanto as CD8+ expressam proteínas de superfície indicadoras de ativação recente, inclusive CD25 (um componente do receptor para o fator de crescimento de célula T a IL-2) e padrões alterados de moléculas de adesão (selectinas e integrinas, discutidas no Cap. 3). A maioria dos linfócitos T efetores diferenciados tem vida curta e não é autorrenovável.
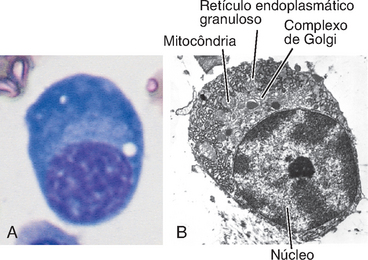
Muitas células B secretoras de anticorpos são morfologicamente identificáveis como plasmócitos. São células que apresentam núcleo característico, citoplasma abundante e denso, retículo endoplasmático granuloso, que é o sítio em que os anticorpos (e outras proteínas) são sintetizados, além de distintos complexos de Golgi perinucleares, em que as moléculas de anticorpos são convertidas em suas formas finais e acondicionadas para serem secretadas (Fig. 2-8). Estima-se que metade ou mais do RNA mensageiro nos plasmócitos codifique anticorpos. Os plasmócitos desenvolvem-se nos órgãos linfoides e nos sítios de resposta imune, e alguns deles migram para a medula óssea, onde podem sobreviver e secretar anticorpos por longos períodos após a indução da resposta imune e mesmo depois da eliminação do antígeno. Células secretoras de anticorpos circulantes, chamadas plasmoblastos, são raras e podem ser precursoras de plasmócitos de vida longa nos tecidos.
Linfócitos de Memória
As células de memória podem sobreviver em um estado funcionalmente quiescente ou de ciclagem lenta por meses ou anos sem a necessidade de estimulação pelo antígeno e provavelmente após eliminação do antígeno. Podem ser identificadas pela expressão de proteínas de superfície que as distinguem dos linfócitos virgens e de células efetoras recém-ativadas, embora ainda não esteja claro quais proteínas de superfície são marcadores definitivos de populações de memória (Tabela 2-3). Os linfócitos B de memória expressam certas classes (isótipos) de Ig de membrana, como IgG, IgE ou IgA, como resultado da mudança de isótipo, enquanto células B virgens expressa somente IgM e IgD (Caps. 5 e 11). Em humanos, a expressão de CD27 é marcador de células B de memória. As células T de memória, como as virgens, mas não as células T efetoras, expressam altos níveis do receptor de IL-7 (CD127). As células T de memória também expressam moléculas de superfície que promovem a sua migração para os sítios de infecção em qualquer lugar do corpo (discutido mais adiante neste capítulo). Em humanos, a maioria das células T virgens expressa a isoforma de 200 kD de uma molécula de superfície chamada CD45 que contém um segmento codificado por um éxon designado A. Essa isoforma de CD45, pode ser reconhecida por anticorpos específicos para um segmento A codificado e é, portanto, chamado CD45RA (“restrito para A”). Por outro lado, a maioria das células T ativadas e de memória expressa uma isoforma de 180 kD, cujo éxon A do RNA foi retirado; essa isoforma é chamada CD45RO. Entretanto, essa forma de distinguir células T virgens de células T de memória não é perfeita, e a interconversão entre as populações CD45RA+ e CD45RO+ já foi registrada.
As células de memória parecem ser heterogêneas e existem subtipos que diferem entre si, principalmente com respeito e às localização e propriedades migratórias. Mais detalhes sobre as células T e B de memória serão discutidos nos Capítulos 9 e 11, respectivamente.
As características que diferenciam os linfócitos virgens, efetores e de memória refletem os diferentes programas de expressão gênica que são regulados por fatores de transcrição e por mudanças epigenéticas estáveis, inclusive metilação do DNA e remodelamento da cromatina. Nossa compreensão a respeito dos determinantes moleculares do fenótipo de linfócito maduro ainda é incompleta e está em desenvolvimento. Por exemplo, um fator de transcrição denominado fator 2 do tipo Kruppel (KLF-2) é necessário para a manutenção do fenótipo de célula T virgem. Os fenótipos de distintos tipos funcionais de células T CD4+ efetoras, chamados células TH1, TH2 e TH17, dependem dos fatores de transcrição T-bet, GATA-3 e RORγT, respectivamente, assim como de mudanças epigenéticas nos loci gênicos de citocinas (Cap. 9). Outros fatores de transcrição são necessários para a manutenção dos fenótipos de células T e B de memória.
ANATOMIA E FUNÇÕES DOS TECIDOS LINFOIDES
Para otimizar as interações celulares necessárias para o reconhecimento do antígeno e para a ativação dos linfócitos nas respostas imunológicas adaptativas, os linfócitos e APC estão localizados e concentrados em tecidos ou órgãos anatomicamente definidos, que também são os sítios para os quais antígenos estranhos são transportados e onde ficam concentrados. Tal compartimentalização anatômica não é fixa, pois, como discutiremos no Capítulo 3, muitos linfócitos recirculam e constantemente podem migrar da circulação para os tecidos e vice-versa.
Os tecidos linfoides são classificados como órgãos geradores, também denominados órgãos linfoide primários ou centrais, nos quais os linfócitos começam a expressar seus receptores de antígenos e atingem a maturidade fenotípica e funcional, e como órgãos linfoides periféricos, também denominados órgãos linfoides secundários, nos quais as respostas dos linfócitos aos antígenos estranhos são iniciadas e desenvolvidas (Fig. 2-5). Entre os órgãos linfoides geradores de mamíferos adultos estão a medula óssea e o timo para as células B e células T, respectivamente. Os linfócitos B amadurecem parcialmente na medula óssea, entram na circulação e então dirigem-se aos órgãos linfoides periféricos, incluindo baço e gânglios linfáticos, onde completam a maturação. Os linfócitos T amadurecem completamente no timo, entram na circulação e vão residir nos órgãos e tecidos linfoides periféricos. Duas importantes funções compartilhadas pelos órgãos geradores são o fornecimento de fatores de crescimento e outros sinais moleculares necessários para a maturação dos linfócitos e para a apresentação de antígenos próprios para reconhecimento e seleção dos linfócitos em fase de maturação (Cap. 8). Os órgãos e tecidos periféricos incluem os gânglios linfáticos, o baço, o sistema imune cutâneo e o sistema imune de mucosas. Além disso, agregados de linfócitos pouco definidos são encontrados no tecido conjuntivo e praticamente em todos os órgãos, exceto no sistema nervoso central. Todos os órgãos linfoides periféricos também compartilham funções comuns, incluindo o fato de serem o sítio principal onde ocorre a apresentação dos antígenos e a existência de linfócitos virgens respondedores no mesmo local, de modo que as respostas imunes adaptativas possam ser iniciadas. Outra característica dos órgãos linfoides secundários é a segregação anatômica de linfócitos B e T, exceto em momentos específicos, quando é necessária a interação entre essas células.
Medula Óssea
A medula óssea é o sítio de geração da maioria das células sanguíneas circulantes, inclusive hemácias, granulócitos e monócitos, e também o sítio dos eventos iniciais da maturação da célula B. A geração de todas as células sanguíneas, denominada hematopoiese (Fig. 2-9), ocorre inicialmente, durante o desenvolvimento fetal, em ilhotas sanguíneas do saco vitelino e no mesênquima para-aórtico, mudando para o fígado entre o terceiro e o quarto mês de gestação, sendo assumida gradualmente pela medula óssea. Ao nascimento, a hematopoiese está acontecendo principalmente nos ossos por todo o esqueleto, mas vai-se tornando gradualmente restrita à medula dos ossos chatos, de tal modo que, na puberdade, a hematopoiese ocorre principalmente no esterno, nas vértebras, nos ossos ilíacos e nas costelas. A medula vermelha encontrada nesses ossos consiste em uma estrutura reticular esponjosa localizada entre as longas trabéculas. Os espaços nessa estrutura contêm uma rede de sinusoides preenchidos por sangue e revestidos por células endoteliais ligadas a uma membrana basal descontínua. Fora dos sinusoides estão grupos de precursores de células sanguíneas em vários estágios de desenvolvimento, assim como células adiposas maduras. Os precursores de células sanguíneas amadurecem e migram pelas membranas basais dos sinusoides e entre as células endoteliais para entrarem no ambiente intravascular. Quando a medula óssea é lesionada ou quando ocorre uma demanda excepcional na produção de novas células sanguíneas, o fígado e o baço frequentemente tornam-se os locais preferenciais de hematopoiese extramedular.
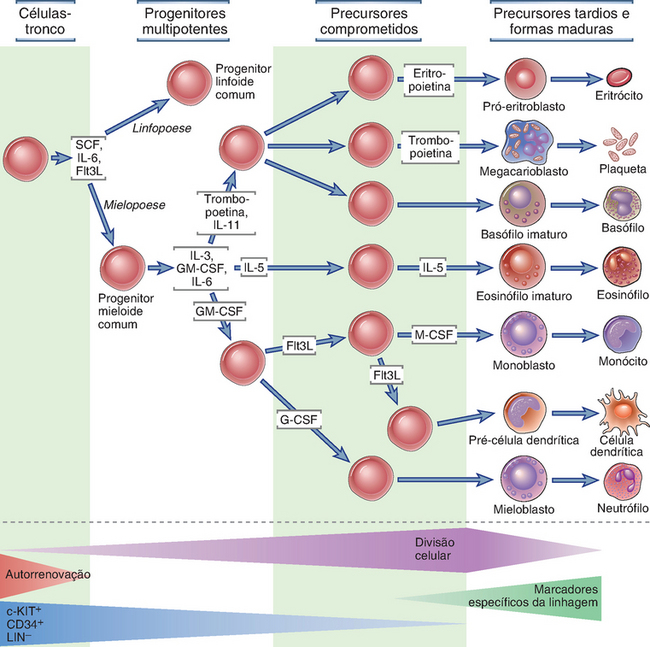
FIGURA 2-9 Hematopoiese. O desenvolvimento das diferentes linhagens de células sanguíneas está representado nesta “árvore hematopoiética”. Também estão descritas as principais citocinas envolvidas na maturação das diferentes linhagens. O desenvolvimento dos linfócitos que formam o precursor linfoide comum está descrito adiante neste capítulo e no Capítulo 8, Figura 8-2. SCF, fator de célula-tronco; Flt3L, ligante de Flt3; G-CSF, fator estimulador de colônias de granulócitos; GM-CSF, fator estimulador de colônias de granulócitos e macrófagos; LIN−, negativo para marcadores específicos para determinada linhagem; M-CSF, fator estimulador de colônias de macrófagos.
Eritrócitos, granulócitos, monócitos, células dendríticas, plaquetas, linfócitos B e T e células NK originam-se da célula-tronco hematopoiética (hematopoietic stem cell – HSC) na medula óssea (Fig. 2-9). As HSC são pluripotentes, o que significa que uma única HSC pode gerar todos os diferentes tipos de células sanguíneas maduras. As HSC também são autorrenováveis, pois a cada momento sofrem divisão e pelo menos uma célula-filha mantém as propriedades de célula-tronco, enquanto a outra pode se diferenciar em uma linhagem específica (chamada divisão assimétrica). As HSC podem ser identificadas pela presença de marcadores de superfície, inclusive as proteínas CD34 e c-Kit, e a ausência de marcadores específicos de linhagens diferenciadas. As HSC são mantidas dentro de nichos anatômicos microscópicos especializados na medula. Nesses sítios, as células do estroma não hematopoiéticas fornecem sinais através do contato célula-célula e também através de fatores solúveis necessários para a contínua divisão das HSC. As HSC dão origem a dois tipos de células multipotentes, o progenitor linfoide comum e o progenitor mieloide comum. O progenitor linfoide comum é a fonte de precursores de linhagem comprometida com as células T, B e NK. A maioria das etapas na maturação de células B ocorre na medula óssea, mas os eventos finais podem ocorrer depois que as células deixam a medula e entram nos órgãos linfoides secundários, particularmente no baço. A maturação da célula T ocorre totalmente no timo e, portanto, requer que progenitores linfoides comuns ou alguma progênie pouco diferenciada dessas células migrem para fora da medula e entrem no sangue e, em seguida, dirijam-se para o timo. Acredita-se que a maturação da célula NK ocorra totalmente na medula óssea. Os progenitores mieloides comuns dão origem aos progenitores de linhagem única comprometidos com as linhagens eritroide, megacariocítica, granulocítica e monocítica, que originarão células maduras, respectivamente eritrócitos, plaquetas, granulócitos (neutrófilos, eosinófilos, basófilos) e monócitos. A maior parte das células dendríticas origina-se da linhagem monocítica.
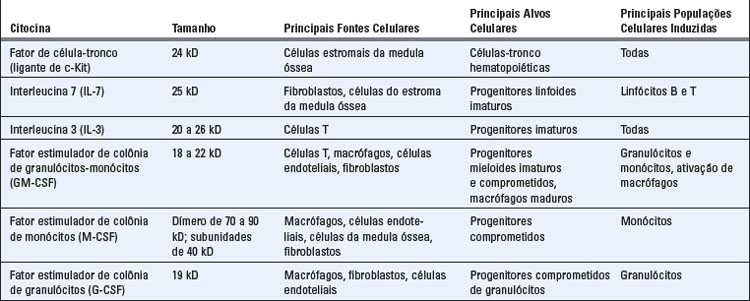
A proliferação e a diferenciação das células precursoras na medula óssea são estimuladas por citocinas (Fig. 2-9). Muitas dessas citocinas são chamadas fatores estimuladores de colônias, pois foram originalmente analisadas pela sua capacidade de estimular o crescimento e o desenvolvimento de várias colônias leucocíticas ou eritroides derivadas da medula óssea. As citocinas hematopoiéticas são produzidas por células do estroma e macrófagos na medula óssea, fornecendo assim o ambiente adequado para a hematopoiese. São produzidas também por linfócitos T estimulados por antígeno e macrófagos ativados por citocinas ou ativados por micro-organismos, formando um mecanismo para suprir os leucócitos que são consumidos durante as reações inflamatórias e imunológicas. Os nomes e as propriedades das principais citocinas hematopoiéticas estão listados na Tabela 2-4.
Além das células-tronco autorrenováveis e sua progênie em diferenciação, a medula contém numerosos plasmócitos secretores de anticorpos. Esses plasmócitos são gerados nos tecidos linfoides periféricos como consequência da estimulação antigênica de células B, depois migram para a medula, onde podem sobreviver e continuar a produzir anticorpos por muitos anos. Alguns linfócitos T de memória de longa duração também migram e podem se estabelecer na medula óssea.
Timo
O timo é o sítio de maturação da célula T. É um órgão bilobado situado no mediastino anterior. Cada lobo é dividido em múltiplos lóbulos por septos fibrosos, e cada lóbulo consiste em um córtex externo e uma medula interna (Fig. 2-10). O córtex contém uma coleção densa de linfócitos T, e a medula, de coloração mais clara, tem uma população mais dispersa de linfócitos. Os macrófagos derivados da medula óssea e as células dendríticas são quase exclusivamente encontrados na medula. Já as células epiteliais, que têm citoplasma abundante, estão espalhadas pelo timo. As células epiteliais corticais produzem IL-7, uma citocina necessária para o início do desenvolvimento da célula T. Um subtipo de células epiteliais encontradas apenas na medula, chamado células epiteliais medulares tímicas (thymic medullary epithelial cells – TMEC), desempenha um papel especial na apresentação de antígenos próprios para as células T em desenvolvimento e na deleção de células T autorreativas. Esse é um dos mecanismos que asseguram a autotolerância do sistema imune, um assunto abordado em detalhes no Capítulo 14. A medula tímica contém estruturas chamadas corpúsculos de Hassall, que são compostos de espirais compactadas de células epiteliais que podem ser remanescentes de células em degeneração. O timo tem um rico suprimento sanguíneo e vasos linfáticos eferentes que drenam para os gânglios linfáticos do mediastino. O componente epitelial do timo é derivado de invaginações do ectoderme no pescoço e no tórax do embrião em desenvolvimento, formando estruturas chamadas bolsas branquiais. Células dendríticas, macrófagos e precursores de linfócitos são derivados da medula óssea.
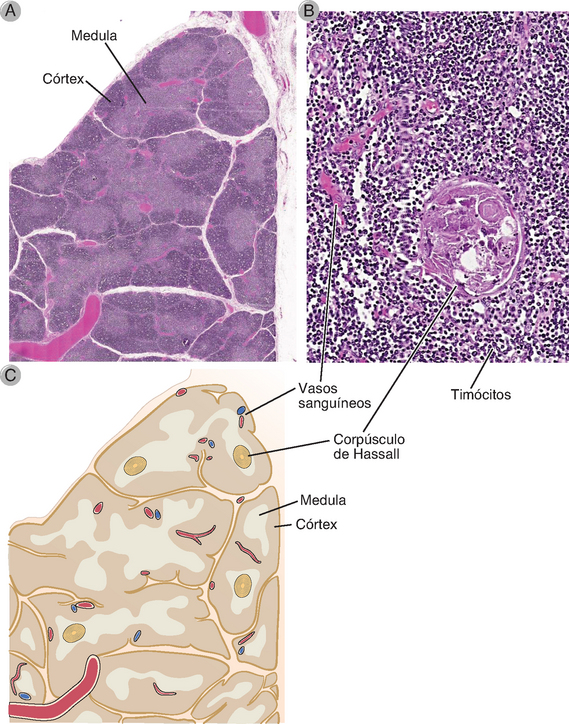
FIGURA 2-10 Morfologia do timo. A, Micrografia de luz em pequeno aumento de um lobo do timo mostrando o córtex e a medula. O córtex externo, de coloração azul-escura, e a medula interna, em azul-claro, são evidentes. B, Micrografia de luz em maior aumento da medula tímica. As inúmeras células pequenas coradas em azul são células T em desenvolvimento chamadas timócitos, e a estrutura rósea maior é um corpúsculo de Hassall, tipicamente presente na medula tímica, porém sua função é pouco conhecida. C, Diagrama esquemático do timo ilustrando uma porção de um lobo dividido em múltiplos lóbulos por trabéculas fibrosas.
Indivíduos que desenvolvem a síndrome de DiGeorge apresentam deficiência de células T em razão de mutações nos genes necessários para o desenvolvimento no timo. Na linhagem de camundongos “nude”, amplamente utilizada em pesquisa de imunologia, uma mutação no gene que codifica um fator de transcrição causa uma falha na diferenciação de certos tipos de células epiteliais que são necessários para o desenvolvimento normal do timo e dos folículos pilosos. Consequentemente, esses camundongos não têm células T nem pelos.
Os linfócitos no timo, também chamados timócitos, são linfócitos T em vários estágios de maturação. Acredita-se que as células comprometidas com a linhagem de células T desenvolvem-se na medula óssea de células progenitoras linfoides comuns, que entram na circulação e alcançam o córtex tímico pelos vasos sanguíneos. A maturação no timo começa então no córtex e conforme os timócitos vão amadurecendo, migram em direção à medula, de modo que a medula contém a maioria das células T maduras. Somente as células T maduras saem do timo e entram no sangue e nos tecidos linfoides periféricos. Os detalhes da maturação dos timócitos estão descritos no Capítulo 8.
O Sistema Linfático
O sistema linfático, que consiste em vasos especializados que drenam os líquidos dos tecidos para os gânglios linfáticos e desses para o sangue, é essencial para a homeostase dos líquidos teciduais e das respostas imunológicas (Fig. 2-11). O líquido intersticial é formado constitutivamente em todos os tecidos vascularizados pelo movimento de um filtrado do plasma para fora dos capilares, e a taxa de formação local desse líquido pode aumentar drasticamente quando o tecido está lesionado ou infectado. A pele, os epitélios e os órgãos parenquimatosos contêm numerosos capilares linfáticos que absorvem esse líquido dos espaços entre as células teciduais. Os capilares linfáticos são canais vasculares de fundo cego revestidos por células endoteliais sobrepostas, sem as junções intercelulares justapostas ou membrana basal típicas de vasos sanguíneos. Esses capilares linfáticos distais permitem a captura livre do líquido intersticial, e o arranjo em sobreposição das células endoteliais, bem como as válvulas unidirecionais no interior dos lúmens, impedem o refluxo do líquido. O líquido absorvido, chamado linfa, uma vez na circulação linfática, é bombeado para vasos linfáticos progressivamente maiores, por meio da contração da musculatura lisa perilinfática e da pressão exercida pelo movimento dos tecidos musculoesqueléticos. Esses vasos confluem para os linfáticos aferentes, que drenam a linfa para os gânglios linfáticos. E o líquido é conduzido para fora dos gânglios linfáticos pelos linfáticos eferentes. Como os gânglios linfáticos estão conectados em série por meio dos vasos linfáticos, linfático eferente saindo de um pode servir como vaso aferente para outro. O vaso linfático eferente na extremidade de uma cadeia de gânglios linfáticos une-se a outros, desembocando, em última instância, em um grande vaso linfático chamado ducto torácico. A linfa do ducto torácico é esvaziada no interior da veia cava superior, devolvendo assim o líquido à corrente sanguínea. Os vasos linfáticos do tronco superior direito, do braço direito e da lateral direita da cabeça drenam para o ducto linfático direito, que também drena para a veia cava superior. Diariamente, cerca de 2 L de linfa retornam dessa maneira para a circulação, e a ruptura do sistema linfático pode levar rapidamente a um edema tecidual.
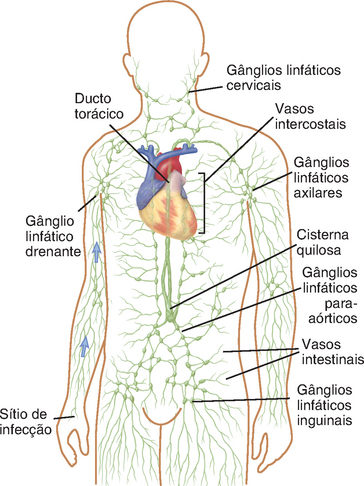
FIGURA 2-11 O sistema linfático. Os vasos linfáticos principais que drenam para a veia cava inferior (e para a veia cava superior, não mostrada) e os grupos de gânglios linfáticos estão ilustrados. Os antígenos são capturados do sítio de infecção; pelos vasos linfáticos entram no gânglio linfático drenante para o qual esses antígenos são transportados e no qual a resposta imuno será iniciada.
O sistema linfático capta antígenos microbianos do sítio de entrada e transporta-os aos gânglios linfáticos, onde podem deflagrar a resposta imune adaptativa. Na maioria das vezes, os micro-organismos entram no corpo através da pele e dos tratos gastrointestinal e respiratório. Todos esses tecidos são revestidos por epitélios que contêm células dendríticas, e todas são drenadas por vasos linfáticos. As células dendríticas capturam alguns antígenos microbianos e entram nos vasos linfáticos. Outros micro-organismos e antígenos solúveis são captados diretamente pelos vasos linfáticos independentemente das células dendríticas. Além disso, mediadores inflamatórios solúveis, como as quimiocinas, são produzidos nos sítios de infecção e entram nos vasos linfáticos. Os gânglios linfáticos estão interpostos ao longo da circulação linfática e funcionam como filtros que testam os antígenos solúveis e aqueles associados a células dendríticas na linfa antes de chegarem ao sangue, permitindo dessa maneira que os antígenos sejam encontrados pelo sistema imune adaptativo.
Gânglios Linfáticos
Os gânglios linfáticos são órgãos linfoides secundários vascularizados e encapsulados, com características anatômicas que favorecem o início das respostas imunes adaptativas para antígenos transportados dos tecidos pelos linfáticos (Fig. 2-12). Os gânglios linfáticos estão situados ao longo dos vasos linfáticos por todo o corpo e, dessa maneira, têm acesso aos antígenos encontrados nos epitélios e provenientes do líquido intersticial na maioria dos tecidos. Um gânglio linfático é envolto por uma cápsula fibrosa, sob a qual há um sistema sinusoide revestido por células reticulares, entremeado por fibrilas de colágeno e outras proteínas da matriz extracelular, e preenchido com linfa, macrófagos, células dendríticas e outros tipos celulares. Os linfáticos aferentes desembocam no seio subcapsular (marginal), do qual a linfa é drenada diretamente para o seio medular conectado, e sai do gânglio linfático pelos vasos linfáticos eferentes. Sob a parte interna do seio subcapsular está o córtex, rico em linfócitos. O córtex externo contém agregados de células denominados folículos. Alguns folículos contêm áreas centrais chamadas centros germinativos, que se apresentam mais claros quando são empregadas colorações histológicas convencionais. Os folículos sem centros germinativos são chamados folículos primários e aqueles com centros germinativos são os folículos secundários. O córtex ao redor dos folículos é chamado de córtex parafolicular ou paracórtex, e é organizado em cordões, que são regiões com uma complexa microanatomia de proteínas da matriz, fibras, linfócitos, células dendríticas e fagócitos mononucleares.
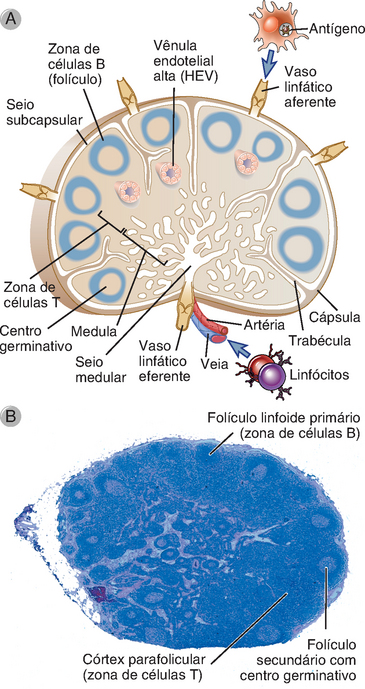
FIGURA 2-12 Morfologia de um gânglio linfático. A, Diagrama esquemático de um gânglio linfático ilustrando as zonas ricas em células T e células B e as rotas de entrada de linfócitos e do antígeno (capturado por uma célula dendrítica). B, Micrografia de luz de um gânglio linfático ilustrando as zonas de células T e células B.
(Cortesia de Dr. James Gulizia, Department of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.)
Organização Anatômica dos Linfócitos B e T
Os linfócitos B e T localizam-se em regiões distintas do córtex dos gânglios linfáticos, cada região com sua própria arquitetura de fibras reticulares e células do estroma (Figs. 2-13 e 2-14). Os folículos são as zonas da célula B localizadas no córtex do gânglio linfático e estão organizadas ao redor das FDC, que apresentam processos interdigitantes formando uma densa rede reticular. Os folículos primários contêm a maioria dos linfócitos B virgens maduros. Os centros germinativos desenvolvem-se em resposta à estimulação antigênica. São sítios de notável proliferação de células B, seleção de células B produtoras de anticorpos de alta afinidade e geração de células B de memória e plasmócitos de longa vida. Os linfócitos T estão principalmente localizados mais centralmente em relação aos folículos, nos cordões paracorticais. Essas zonas ricas em célula T contêm uma rede de células reticulares fibroblásticas (fibroblastic reticular cells – FRC) arranjadas para formar a camada externa de estruturas tubulares chamadas condutos de FRC. Os condutos têm diâmetro que varia de 0,2 a 3 μm e contêm arranjos organizados de moléculas de matriz extracelular, inclusive feixes paralelos de fibras de colágeno embebidas em uma rede de microfibras de fibrilina, delimitados por uma membrana basal produzida por uma contínua bainha de FRC. Esses condutos começam no seio subcapsular e estendem-se tanto para os vasos linfáticos do seio medular como para os vasos sanguíneos corticais, denominados vênulas endoteliais altas (high endothelial venules – HEV). As células T virgens entram nas zonas de células T através das HEV, como será descrito em detalhes no Capítulo 3. As células T são densamente acondicionadas ao redor dos condutos no córtex do gânglio linfático. A maioria (quase 70%) das células T corticais são células T CD4+ auxiliares, entremeadas por células CD8+ relativamente esparsas. Essas proporções podem mudar drasticamente durante o curso de uma infecção. Por exemplo, durante uma infecção viral, pode-se observar um aumento acentuado no número de células T CD8+. As células dendríticas também estão concentradas no paracórtex dos gânglios linfáticos, muitas delas estreitamente associadas aos condutos de FRC.
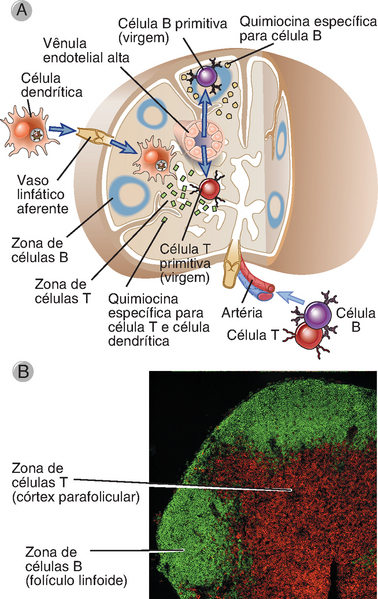
FIGURA 2-13 Segregação de células B e células T no gânglio linfático. A, O diagrama esquemático ilustra o caminho pelo qual linfócitos T e B migram para diferentes áreas de um gânglio linfático. Os linfócitos entram pela artéria e alcançam uma vênula endotelial alta, mostrada em uma secção. Os linfócitos virgens são direcionados para diferentes áreas do gânglio linfático por quimiocinas que são produzidas nessas áreas e que se ligam seletivamente a ambos os tipos celulares. Também está ilustrada a migração de células dendríticas, que capturam antígenos nos sítios de entrada, entram pelos vasos linfáticos aferentes e dirigem-se para as áreas do gânglio linfático ricas em células T. B, Nesta secção de um gânglio linfático, os linfócitos B, localizados nos folículos, estão corados em verde; as células T, no córtex parafolicular, estão em vermelho. O método utilizado para corar essas células é chamado imunofluorescência (Apêndice IV para detalhes). Segregação anatômica de células T e B é observada também no baço (Fig. 2-15).
(Cortesia de Drs. Kathryn Pape e Jennifer Walter, University of Minnesota School of Medicine, Minneapolis.)
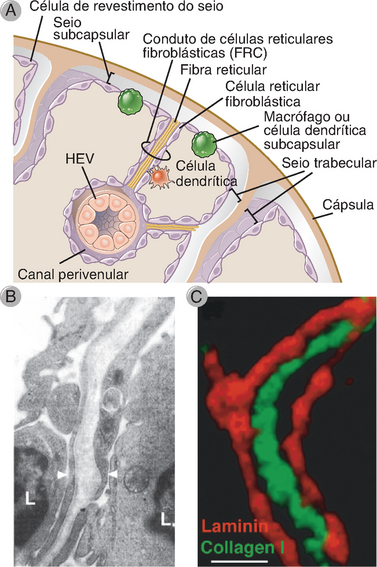
FIGURA 2-14 Microanatomia do córtex do gânglio linfático. A, Representação esquemática da microanatomia de um gânglio linfático representando o trajeto da linfa do seio subcapsular, passando através do conduto de células fibrorreticulares, até chegar no canal perivenular ao redor da vênula de endotélio alto (HEV). B, Micrografia eletrônica de transmissão de um conduto de FRC cercado por células reticulares fibroblásticas (pontas de seta) e linfócitos adjacentes (L). C, Imunofluorescência de um conduto de FRC formado pela proteína da membrana basal laminina (vermelho) e fibrilas de colágeno (verde).
B, (De Gretz JE, CC Norbury, AO Anderson, AEI Proudfoot e S Shaw. Lymph-borne chemokines and other low molecular weight molecules reach high endothelial venules via specialized conduits while a functional barrier limits access to the lymphocyte microenvironments in lymph node cortex. The Journal of Experimental Medicine 192:1425-1439, 2000.) C, (De Sixt M, K Nobuo, M Selg, T Samson, G Roos, DP Reinhardt, R Pabst, M Lutz e L Sorokin. The conduit system transports soluble antigens from the afferent lymph to resident dendritic cells in the T cell area of the lymph node. Immunity 22:19-29, 2006. Copyright © 2005 by Elsevier Inc.)
A segregação anatômica dos linfócitos B e T em áreas distintas dos gânglios linfáticos depende das citocinas que são secretadas pelas células do estroma do gânglio linfático em cada área e que direcionam a migração dos linfócitos (Fig. 2-13). Os linfócitos T e B virgens entram no gânglio linfático por uma artéria, e chegam ao estroma do órgão através das HEV, que estão localizadas no centro dos cordões corticais, deixando assim a circulação sistêmica. As citocinas que determinam em que local as células B e T residirão no gânglio linfático são do tipo quimiocinas (citocinas quimioatrativas), as quais se ligam aos receptores de quimiocinas nos linfócitos. As quimiocinas incluem uma grande família de citocinas de 8 a 10 kD que estão envolvidas em uma grande variedade de funções de motilidade celular relacionadas com o desenvolvimento, a manutenção da arquitetura tecidual e respostas imunológicas e inflamatórias. As propriedades gerais das quimiocinas e seus receptores serão discutidos no Capítulo 3. As células T virgens expressam um receptor denominado CCR7, que se liga às quimiocinas CCL19 e CCL21 produzidas por células do estroma nas zonas de células T do gânglio linfático. Essas quimiocinas atraem as células T virgens, atraindo-as do sangue, através das HEV, para a zona de células T. As células dendríticas que drenam para o gânglio linfático através dos vasos linfáticos também expressam CCR7, e esse é motivo pelo qual elas migram do seio subcapsular para a mesma área dos gânglios linfáticos para a qual migram as células T virgens (Cap. 6). As células B virgens expressam outro receptor de quimiocina, CXCR5, que reconhece uma quimiocina, CXCL13, produzida somente nos folículos por FDC. Portanto, as células B são atraídas para os folículos, que são as zonas de células B dos gânglios linfáticos. Outra citocina (que não é uma quimiocina), denominada linfotoxina, tem um papel na estimulação da produção de CXCL13, particularmente nos folículos. Vários estudos realizados em camundongos têm caracterizado as funções das quimiocinas e outras citocinas na regulação da localização dos linfócitos nos órgãos linfoides e na formação desses órgãos. Por exemplo, camundongos knockout para CXCR5, ou seja, sem a capacidade de expressar esse receptor, perdem os folículos contendo célula B nos gânglios linfáticos e no baço. De maneira similar, camundongos knockout para CCR7 não têm as zonas de células T.
O desenvolvimento dos gânglios linfáticos, assim como de outros órgãos e tecidos linfoides periféricos, requer as ações coordenadas de várias citocinas, quimiocinas, fatores de transcrição e células indutoras do tecido linfoide. Durante a vida fetal, as células indutoras do tecido linfoide, que são as células de origem hematopoiética com aspectos fenotípicos tanto de linfócitos como de células NK, estimulam o desenvolvimento dos gânglios linfáticos e outros órgãos e tecidos linfoides secundários. Essa função é mediada por várias proteínas expressas pelas células indutoras, como as citocinas linfotoxina-α (LTα) e linfotoxina-β (LTβ), que são as mais amplamente estudadas. Camundongos knockout que perdem ambas as citocinas não desenvolvem gânglios linfáticos nem tecidos linfoides no intestino. O desenvolvimento da polpa branca esplênica também é desorganizado nesses camundongos. A LTβ produzida pelas células indutoras atua nas células do estroma em diferentes localizações do órgão linfoide secundário em desenvolvimento, e essas células do estroma são ativadas para produzir as quimiocinas CXCL13 ou CXCL19 e CCL21. Em áreas em que CXCL13 é induzida, células B circulantes são recrutadas para o interior dos folículos de células B nascentes; e nas áreas em que CCL19 e CCL21 são induzidas, células T e células dendríticas são recrutadas para formar as zonas de células T. Existem várias outras proteínas expressas por células indutoras de tecido linfoide que são necessárias para sua função, inclusive fatores de transcrição, mas suas funções na organogênese linfoide não foram ainda bem definidas.
A segregação anatômica das células T e B assegura que cada população de linfócito esteja em estreito contato com as APC apropriadas, isto é, células T com células dendríticas e células B com FDC. Além disso, em razão dessa precisa segregação, as populações de células T e B são mantidas separadas até o momento de interagirem de modo funcional. Como veremos no Capítulo 11, após estimulação pelos antígenos, as células T e B perdem sua restrição anatômica e começam a migrar em direção umas às outras. As células T ativadas podem migrar tanto em direção aos folículos para auxiliar as células B como entrar na circulação e sair do gânglio linfático, enquanto as células B ativadas migram para os centros germinativos e, ao diferenciarem-se em plasmócitos, podem povoar a medula óssea.
Transporte de Antígenos pelos Gânglios Linfáticos
Substâncias originárias da linfa que entram no seio subcapsular do gânglio linfático são separadas pelo tamanho molecular e apresentadas aos diferentes tipos celulares para iniciarem diferentes tipos de resposta imune. O assoalho do seio subcapsular é construído de tal forma que permite o contato das células no seio ou a migração para o córtex subjacente, mas impede o movimento de moléculas solúveis na linfa, bloqueando a passagem livre para o córtex. Vírus e outros antígenos de alto peso molecular são capturados pelos macrófagos do seio, podendo também ser reconhecidos pelos linfócitos B corticais situados logo abaixo do seio cortical. Essa é a primeira etapa nas respostas dos anticorpos a esses antígenos. Antígenos solúveis de baixo peso molecular são transportados para fora do seio pelos condutos de FRC, e passam para as células dendríticas residentes corticais localizadas próximas aos condutos. As células dendríticas residentes estendem seus prolongamentos por entre as células que revestem os condutos e no interior do lúmen, e capturam e promovem pinocitose dos antígenos solúveis que estão transitando no lúmen dos condutos. A contribuição dessa via de apresentação do antígeno pode ser importante para o início das respostas imunológicas de células T para alguns antígenos microbianos, mas respostas mais intensas e duradouras requerem o transporte dos antígenos para os gânglios linfáticos pelas células dendríticas teciduais, como será discutido no Capítulo 6. Além dos antígenos, há evidências de que mediadores inflamatórios solúveis, como quimiocinas e outras citocinas, são transportados na linfa que flui pelos condutos; alguns desses mediadores podem atuar sobre células dendríticas e outros podem ser chegar às HEV para as quais os condutos drenam. Essa é uma maneira possível pela qual a inflamação tecidual pode ser percebida no gânglio linfático e, assim, influir no recrutamento e na ativação dos linfócitos ali presentes.
Baço
O baço é um órgão altamente vascularizado cujas principais funções são retirar da circulação células sanguíneas lesionadas e senescentes e partículas (como imunocomplexos e micro-organismos opsonizados), além de iniciar as respostas imunológicas adaptativas aos antígenos capturados do sangue. O baço pesa 150 g no adulto e está localizado no quadrante superior esquerdo do abdome. O parênquima esplênico é anatomica e funcionalmente dividido em polpa vermelha, composta principalmente de sinusoides vasculares preenchidos por sangue, e polpa branca, rica em linfócitos. O sangue entra no baço por uma artéria esplênica única, que perfura a cápsula no hilo e divide-se progressivamente em ramos menores que permanecem cercados por trabéculas fibrosas protetoras e de sustentação (Fig. 2-15). Alguns dos ramos arteriolares da artéria esplênica terminam em sinusoides vasculares extensos, que formam a polpa vermelha, são circundados por macrófagos e preenchidos por inúmeros eritrócitos. Os sinusoides terminam em vênulas que drenam para a veia esplênica, que transporta o sangue para fora do baço e para dentro da circulação porta. Os macrófagos da polpa vermelha servem como um importante filtro para o sangue, removendo micro-organismos, células lesionadas, assim como células e micro-organismos recobertos por anticorpos (opsonizados). Indivíduos que perdem o baço são altamente suscetíveis a infecções por bactérias encapsuladas, como pneumococos e meningococos. Tais micro-organismos são normalmente eliminados por opsonização e fagocitose, e fica bastante prejudicada na ausência do baço.
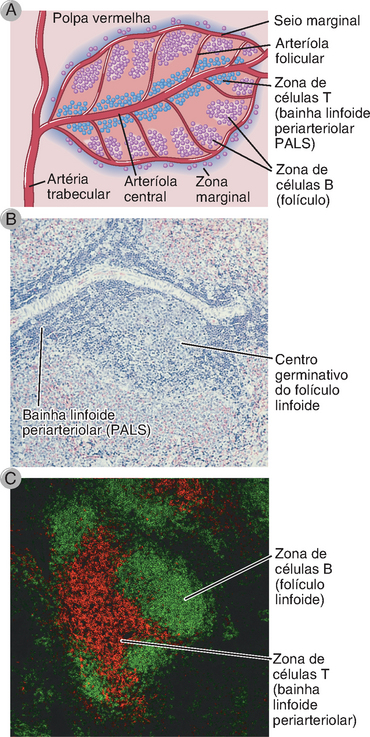
FIGURA 2-15 Morfologia do baço. A, Diagrama esquemático do baço ilustrando as zonas de células T e B, que compõem a polpa branca. B, Fotomicrografia de uma secção de baço humano mostrando uma artéria trabecular com bainha linfoide periarteriolar e um folículo linfoide com um centro germinativo. Essas áreas são cercadas pela polpa vermelha, rica em sinusoides vasculares. C, Demonstração imuno-histoquímica de zonas de células T e B no baço, ilustradas em uma secção da região ao redor de uma arteríola. Células T na bainha linfoide periarteriolar estão coradas em vermelho e as células B no folículo estão coradas em verde.
(Cortesia de Drs. Kathryn Pape e Jennifer Walter, University of Minnesota School of Medicine, Minneapolis.)
A função da polpa branca é promover as respostas imunes adaptativas contra antígenos provenientes do sangue. A polpa branca consiste em conjuntos de linfócitos densamente agrupados e que aparecem como nódulos brancos contra o fundo da polpa vermelha. A polpa branca é organizada ao redor das artérias centrais, que são ramos da artéria esplênica, distintos dos ramos que formam os sinusoides vasculares. Os vários ramos menores das artérias centrais atravessam uma área rica em linfócitos e drenam para o seio marginal. Uma região de células especializadas cercando o seio marginal, chamada zona marginal, forma um limite entre a polpa vermelha e a polpa branca. A arquitetura da polpa branca é análoga à organização descrita para os gânglios linfáticos, com zonas de células T e células B segregadas. No baço de camundongos, as artérias centrais são envoltas por linfócitos, a maioria dos quais são células T. Por causa da sua localização anatômica, os morfologistas chamam essas zonas ricas em células T de bainhas linfoides periarteriolares. Folículos ricos em células B ocupam o espaço entre o seio marginal e a bainha periarteriolar. Assim como nos gânglios linfáticos, as áreas de células T no baço contêm uma rede de complexos condutos compostos de proteínas da matriz revestidas por células tipo FRC, embora haja diferenças ultraestruturais entre os condutos dos gânglios linfáticos e do baço. A zona marginal situada por fora do seio marginal é uma região distinta, composta por células B e macrófagos especializados. As células B da zona marginal são funcionalmente distintas das células B foliculares, e têm um repertório limitado de especificidades antigênicas. A arquitetura da polpa branca é mais complexa em humanos do que em camundongos, ambos com zonas marginais interna e externa e uma zona perifolicular. Os antígenos no sangue são levados ao seio marginal por células dendríticas circulantes ou são encontrados pelos macrófagos na zona marginal. Os arranjos anatômicos das APC, das células B e das células T na polpa branca esplênica promovem as interações necessárias para o desenvolvimento eficiente da resposta imune humoral, como discutiremos no Capítulo 11. A segregação dos linfócitos T nas bainhas linfoides periarteriolares e das células B nos folículos e zonas marginais é um processo altamente regulado, dependente da produção de diferentes citocinas e quimiocinas pelas células do estroma nessas diferentes áreas. A quimiocina CXCL13 e seu receptor CXCR5 são necessários para a migração da célula B para os folículos, enquanto CCL19 e CCL21 e o seu receptor CCR7 são necessários para a migração de células T virgens para o interior da bainha periarteriolar. A produção dessas quimiocinas pelas células do estroma é estimulada pela citocina linfotoxina.
Sistemas Imunológicos Regionais
Cada barreira epitelial principal do corpo, inclusive a pele, a mucosa gastrointestinal e a mucosa brônquica, tem seu próprio sistema de gânglios linfáticos, estruturas linfoides não encapsuladas e células imunes de distribuição difusa, que trabalham de modo coordenado para fornecer respostas imunológicas especializadas contra patógenos que entram por essas barreiras. O sistema imunológico cutâneo tem evoluído para responder a uma grande variedade de desafios ambientais. Os componentes do sistema imunológico associados à mucosa gastrointestinal e brônquica são denominados tecidos linfoides associados à mucosa (mucosa-associated lymphoid tissue – MALT) e estão envolvidos em respostas imunológicas para antígenos ingeridos e inalados. A pele e o MALT contêm uma grande quantidade de células das imunidades inata e adquirida. As características específicas desses sistemas imunológicos regionais serão abordadas no Capítulo 13.
• A organização anatômica das células e dos tecidos do sistema imunológico é essencial para a geração de respostas imunes inata e adquirida eficazes. Essa organização permite o rápido direcionamento de células efetoras da imunidade inata, incluindo neutrófilos e monócitos, para os sítios de infecção e permite que um pequeno número de linfócitos específicos para qualquer antígeno consiga localizar e responder eficazmente a tal antígeno independentemente do local em que ele é introduzido no corpo.
• As células que realizam a maioria das funções efetoras das imunidades inata e adquirida são os fagócitos (incluindo neutrófilos e macrófagos), APC (incluindo macrófagos e células dendríticas) e linfócitos.
• Os neutrófilos, leucócitos sanguíneos mais abundantes que apresentam núcleo segmentado multilobado característico e inúmeros grânulos lisossômicos citoplasmáticos, são rapidamente recrutados para os sítios de infecção e de lesão tecidual, nos quais realizam as funções fagocíticas.
• Os monócitos são os precursores circulantes dos macrófagos teciduais. Todos os tecidos contêm macrófagos residentes, que são células fagocíticas que ingerem e matam micro-organismos e células mortas do hospedeiro e secretam citocinas e quimiocinas que promovem o recrutamento dos leucócitos do sangue.
• As APC apresentam os antígenos para o reconhecimento pelos linfócitos e promovem a ativação dessas células. As APC incluem células dendríticas, fagócitos mononucleares e FDC.
• Linfócitos B e T expressam receptores altamente diversificados e específicos para determinado antígeno. São as células responsáveis pela especificidade e pela memória das respostas imunológicas adaptativas. As células NK são uma classe distinta de linfócitos que não expressam esses receptores de antígenos, mas apresentam funções importantes na imunidade inata. Muitas moléculas de superfície são diferencialmente expressas em diferentes subtipos de linfócitos, assim como em outros leucócitos, e são nomeadas de acordo com a nomenclatura CD.
• Os linfócitos B e T têm origem de um precursor comum na medula óssea. O desenvolvimento da célula B ocorre todo na medula óssea, enquanto os precursores de células T migram e sofrem maturação no timo. Após maturação, as células B e T deixam a medula óssea e o timo, entram na circulação sistêmica e vão povoar os órgãos linfoides periféricos.
• As células B e T virgens são linfócitos maduros que não foram estimulados pelo antígeno. Quando encontram o antígeno, sofrem diferenciação em linfócitos efetores com funções nas respostas imunológicas protetoras. Os linfócitos B efetores são células secretoras de anticorpos. As células T efetoras incluem as células T CD4+ auxiliares, secretoras de citocinas, e as CD8+ CTL.
• Parte dos progenitores de linfócitos B e T ativados por antígenos sofre diferenciação para células de memória que sobrevivem por longos períodos em um estado quiescente. Essas células de memória são responsáveis pelas respostas rápidas e aumentadas às exposições subsequentes do antígeno.
• Os órgãos do sistema imunológico podem ser divididos em órgãos geradores (medula óssea e timo), nos quais ocorre a maturação dos linfócitos, e os órgãos periféricos (gânglios linfáticos e baço), nos quais os linfócitos virgens são ativados por antígenos.
• A medula óssea contém as células-tronco para todas as células do sangue, inclusive os linfócitos, e é o sítio de maturação de todas essas células, exceto as células T, que sofrem maturação no timo.
• O líquido extracelular (linfa) é constantemente drenado dos tecidos pelos vasos linfáticos para os gânglios linfáticos e por fim para o sangue. Antígenos microbianos são transportados em forma solúvel ou dentro das células dendríticas na linfa para os gânglios linfáticos, onde são reconhecidos por linfócitos.
• Os gânglios linfáticos são órgãos linfoides secundários encapsulados, localizados por todo o corpo ao longo dos linfáticos, onde as células B e T virgens encontram os antígenos que foram coletados pela linfa dos tecidos periféricos. O baço é um órgão encapsulado localizado na cavidade abdominal, em que as células sanguíneas senescentes ou opsonizadas são removidas da circulação, e no qual os linfócitos respondem aos antígenos de origem sanguínea. Tanto os gânglios linfáticos como a polpa branca do baço são organizados em zona de células B (os folículos) e zonas de células T. As áreas de células T também são os sítios de residência das células dendríticas maduras, que são APC especializadas na ativação de células T virgens. As FDC residem nas áreas de células B e servem para ativar as células B durante as respostas imunológicass humorais aos antígenos proteicos. O desenvolvimento dos tecidos linfoides secundários depende de citocinas e de células indutoras nos gânglios linfáticos.
Células do Sistema Imunológico
Geissmann F, Manz MG, Jung S, Sieweke MH, Merad M, Ley K. Development of monocytes, macrophages, and dendritic cells. Science. 2010;327:656-661.
Schluns KS, Lefrancois L. Cytokine control of memory T-cell development and survival. Nature Reviews Immunology. 2003;3:269-279.
Surh CD, Sprent J. Homeostasis of naive and memory T cells. Immunity. 2008;29:848-862.
Tecidos do Sistema Imunológico
Lane P, Kim M-Y, Withers D, Gaspal F, Bekiaris V, Desanti G, Khan M, McConnell F, Anderson G. Lymphoid tissue inducer cells in adaptive CD4 T cell dependent responses. Seminars in Immunology. 2008;20:159-163.
Mebius RE, Kraal G. Structure and function of the spleen. Nature Reviews Immunology. 2005;5:606-616.
Mueller SN, Germain RN. Stromal cell contributions to the homeostasis and functionality of the immune system. Nature Reviews Immunology. 2009;9:618-629.
Ruddle NH, Akirav EM. Secondary lymphoid organs: responding to genetic and environmental cues in ontogeny and the immune response. Journal of Immunology. 2009;183:2205-2212.
Von Andrian UH, Mempel TR. Homing and cellular traffic in lymph nodes. Nature Reviews Immunology. 2003;3:867-878.