CAPÍTULO 6 Moléculas do Complexo Principal de Histocompatibilidade e Apresentação do Antígeno aos Linfócitos T
As principais funções dos linfócitos T consistem em erradicar as infecções por micro-organismos intracelulares e em ativar outras células, como os macrófagos e os linfócitos B. Para desempenhar essas funções, as células T precisam superar vários desafios.
• Existe um número muito pequeno de células T virgens (naïve) específicas para qualquer antígeno determinado, e esse pequeno número deve ser capaz de localizar o antígeno estranho, reagir contra ele e eliminá-lo. A resolução desse problema exige um sistema especializado para a captura do antígeno e o seu transporte até os órgãos onde as respostas das células T podem ser iniciadas. As células especializadas que capturam e que apresentam os antígenos e ativam os linfócitos T são denominadas células apresentadoras de antígenos (APC). Entre essas células, as células dendríticas são particularmente importantes na ativação das células T virgens, evento crítico para iniciar as respostas imunes celulares.
• Os linfócitos devem ser capazes de combater os patógenos em qualquer região do corpo, independentemente do local de entrada dos patógenos. As células T detectam antígenos em todas as regiões do corpo ao transitar por todos os órgãos linfoides secundários como parte de sua recirculação (Cap. 2). Para facilitar as respostas imunes, as células dendríticas, que são encontradas em todos os tecidos, capturam os antígenos e migram até as mesmas regiões dos órgãos linfoides onde se localizam as células T recirculantes, maximizando, assim, a probabilidade de encontro das células T de determinada especificidade com o antígeno relevante.
• As funções de alguns tipos de linfócitos T exigem a sua interação com outras células do sistema imune, que podem incluir células dendríticas, macrófagos e linfócitos B. Outros tipos de linfócitos T devem ser capazes de interagir com qualquer célula infectada do hospedeiro. Para assegurar a interação das células T apenas com outras células do hospedeiro, e não diretamente com micro-organismos, os receptores de antígenos das células T são desenhados para reconhecer antígenos apresentados por moléculas de superfície da célula do hospedeiro, e não diretamente antígenos presentes nos micro-organismos ou antígenos que estão livres na circulação ou nos líquidos extracelulares. Isso contrasta notavelmente com os linfócitos B, cujos receptores de antígenos e produtos secretados, os anticorpos, são capazes de reconhecer antígenos presentes nas superfícies microbianas e antígenos solúveis, bem como antígenos associados a células. A tarefa de apresentar antígenos associados a células do hospedeiro para o seu reconhecimento por células T CD4+ e CD8+ é desempenhada por proteínas especializadas, denominadas moléculas do complexo principal de histocompatibilidade (MHC), que são expressas na superfície das células do hospedeiro.
• Diferentes células T devem ser capazes de responder a diferentes antígenos microbianos em diferentes compartimentos celulares. Por exemplo, a defesa contra vírus na circulação deve ser mediada por anticorpos, e a produção dos anticorpos mais efetivos requer a participação das células T CD4+ auxiliares (helper). Entretanto, se o mesmo vírus infectar uma célula tecidual, ele se torna inacessível ao anticorpo, e a sua erradicação exige que os linfócitos T citotóxicos (CTL) CD8+ matem as células infectadas para eliminar o reservatório da infecção. Essa separação de respostas ótimas ocorre porque as APC processam antígenos de modo diferente, dependendo de sua localização (extracelular e intracelular, respectivamente) e os apresentam a diferentes classes de células T. A tarefa de capturar os antígenos presentes em vários compartimentos anatômicos e apresentá-los a diferentes populações de células T também é desempenhada por moléculas do MHC.
Por conseguinte, a captura do antígeno e a sua apresentação às células T é um processo especializado e primorosamente coordenado, com muitas implicações funcionais importantes. A elucidação da biologia celular e da base molecular desse processo complexo foi uma façanha fascinante, que abrange não apenas a biologia fundamental, mas também os detalhes estruturais finos. Neste capítulo, descreveremos a maneira pela qual os antígenos são capturados e apresentados às células T. No Capítulo 7, descreveremos os receptores de antígenos das células T, e nos Capítulos 9 e 10, discutiremos a ativação e as funções efetoras dos linfócitos T.
PROPRIEDADES DOS ANTÍGENOS RECONHECIDOS PELOS LINFÓCITOS T
Nossa compreensão atual sobre o reconhecimento dos antígenos pelas células T representa o apogeu de uma ampla gama de estudos que se iniciou na pesquisa da natureza dos antígenos que estimulam a imunidade celular. Os primeiros estudos mostraram que as formas físico-químicas dos antígenos que são reconhecidas pelas células T diferem daquelas identificadas pelos linfócitos B e anticorpos, e esse conhecimento levou à descoberta do papel do MHC no reconhecimento dos antígenos pelas células T. Várias características do reconhecimento de antígenos são exclusivas dos linfócitos T (Tabela 6-1).
TABELA 6-1 Características dos Antígenos Reconhecidos por Linfócitos T
| Características dos Antígenos Reconhecidos pelas Células T | Explicação |
|---|---|
| A maioria das células T reconhece peptídeos, mas não outras moléculas. | Apenas os peptídeos ligam-se a moléculas do MHC. |
| As células T reconhecem peptídeos lineares e não determinantes de conformação de antígenos proteicos. | Os peptídeos lineares ligam-se a fendas das moléculas do MHC, e ocorre perda da conformação da proteína durante a geração desses peptídeos. |
| As células T reconhecem antígenos associados a células, e não antígenos solúveis. | Os receptores de células T só reconhecem estruturas semelhantes ao MHC, e as moléculas do MHC são proteínas de membrana que exibem peptídeos ligados de modo estável sobre a superfície celular. |
| As células T CD4+ e CD8+ reconhecem preferencialmente antígenos provenientes dos reservatórios extracelulares e citosólicos, respectivamente. | As vias de montagem das moléculas do MHC asseguram que as moléculas da classe II irão apresentar peptídeos que derivam de proteínas extracelulares e que são captados em vesículas das APC, enquanto as moléculas de classe I apresentam peptídeos de proteínas citosólicas; CD4 e CD8 ligam-se a regiões não polimórficas das moléculas do MHC de classe II e classe I, respectivamente. |
A maioria dos linfócitos T reconhece apenas peptídeos lineares curtos, e, com efeito, essas células são específicas para sequências de aminoácidos de peptídeos, enquanto as células B são capazes de reconhecer peptídeos, proteínas, ácidos nucleicos, carboidratos, lipídeos e pequenas substâncias químicas. Consequentemente, as respostas imunes mediadas por células T são habitualmente induzidas por antígenos proteicos estranhos (a fonte natural de peptídeos estranhos), enquanto as respostas imunes humorais são induzidas por antígenos proteicos e não proteicos. Algumas células T são específicas para pequenos químicos (haptenos), como o dinitrofenol, o urushiol do toxicodendro e os β-lactâmicos dos antibióticos da penicilina. Nessas situações, é provável que os haptenos se liguem a proteínas próprias e que os peptídeos conjugados com hapteno sejam reconhecidos pelas células T. A especificidade das células T para peptídeos é verdadeira para as células CD4+ e CD8+; como discutiremos no final deste capítulo, existem algumas populações pequenas de células T que têm a capacidade de reconhecer antígenos não proteicos.
O motivo pelo qual as células T só reconhecem peptídeos deve-se ao fato de que os receptores de antígenos das células T CD4+ e CD8+ são específicos para antígenos apresentados por moléculas do MHC, e essas moléculas podem ligar-se a peptídeos, mas não a outras estruturas químicas (Fig. 6-1). Por conseguinte, toda célula T é específica para uma combinação de resíduos de aminoácidos de um antígeno peptídico com porções da molécula do MHC. Conforme discutido adiante, as moléculas do MHC são altamente polimórficas, e as variações observadas nas moléculas do MHC entre indivíduos influenciam tanto a ligação dos peptídeos quanto o reconhecimento pelas células T. Uma única célula T pode reconhecer um peptídeo específico exibido por apenas uma entre o grande número de diferentes moléculas existentes do MHC. Esse fenômeno é denominado restrição do MHC, e a sua base molecular será descrita posteriormente neste capítulo.
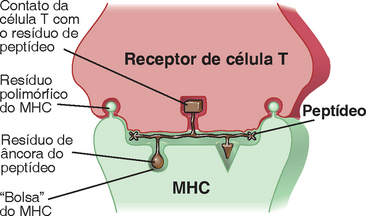
FIGURA 6-1 Modelo de reconhecimento de um complexo peptídeo-MHC pela célula T. Essa ilustração esquemática mostra a ligação de uma molécula do MHC a um peptídeo e a sua apresentação, bem como o reconhecimento pelo receptor da célula T de dois resíduos polimórficos da molécula do MHC e um resíduo do peptídeo.
Começaremos a discussão da apresentação de antígenos com a descrição do modo pelo qual as APC capturam antígenos e os transportam até as células T.
CAPTURA DO ANTÍGENO E FUNÇÕES DAS CÉLULAS APRESENTADORAS DE ANTÍGENOS
O reconhecimento de que várias outras células, que não são as células T, são necessárias para apresentar antígenos aos linfócitos T foi inicialmente obtido a partir de estudos em modelos experimentais nos quais antígenos proteicos marcados, capazes de induzir respostas das células T, eram injetados em camundongos para identificar que células iriam ligar (e, consequentemente, reconhecer) esses antígenos. O resultado surpreendente foi que os antígenos injetados estavam associados principalmente a células não T. Esse tipo de experimento foi rapidamente seguido de outros estudos mostrando que os antígenos proteicos que estavam fisicamente associados a macrófagos eram muito mais imunogênicos, em uma base molar, do que os mesmos antígenos injetados na forma solúvel em camundongos. Nesses experimentos preliminares, as populações de macrófagos estudadas provavelmente incluíram células dendríticas, visto que, conforme discutido adiante, as células T virgens são mais bem ativadas por células dendríticas. Experimentos subsequentes com cultura de células mostraram que as células T CD4+ purificadas eram incapazes de responder a antígenos proteicos, enquanto respondiam de modo satisfatório após a adição às culturas de células não T, como células dendríticas ou macrófagos. Esses resultados levaram ao conceito de que uma etapa essencial na indução de uma resposta das células T consiste na apresentação do antígeno aos linfócitos T por outras células, dando origem a designação de células apresentadoras de antígenos (APC – antigen presenting cells). As primeiras APC identificadas foram macrófagos, e as células T que responderam foram definidas como células CD4+ auxiliares. Logo ficou claro que várias populações celulares, descritas adiante, podem funcionar como APC em diferentes situações. Por convenção, a APC continua sendo o termo empregado para referir-se a células especializadas que apresentam antígenos aos linfócitos T CD4+. Como veremos posteriormente neste capítulo, todas as células nucleadas podem apresentar antígenos proteicos aos linfócitos T CD8+, e essas células não são denominadas APC.
Começaremos nossa discussão sobre algumas das propriedades gerais das APC para os linfócitos T CD4+.
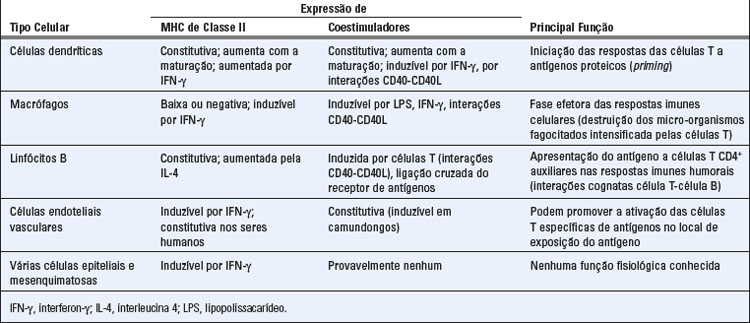
• Diferentes tipos de células atuam como APC para ativar células T virgens e células T efetoras previamente diferenciadas (Fig. 6-2 e Tabela 6-2). As células dendríticas constituem as APC mais efetivas para ativar as células T virgens e, portanto, iniciar respostas das células T. Os macrófagos e os linfócitos B também atuam como APC, porém principalmente para células T CD4+ auxiliares previamente ativadas, e não para células T virgens. Suas funções como APC são descritas mais adiante, neste capítulo, e de modo mais detalhado nos Capítulos 10 e 11. As células dendríticas, os macrófagos e os linfócitos B expressam moléculas do MHC de classe II e outras moléculas envolvidas na estimulação das células T e, portanto, são capazes de ativar os linfócitos T CD4+. Por esse motivo, esses três tipos de células foram denominados APC profissionais; entretanto, esse termo é algumas vezes empregado para referir-se apenas às células dendríticas, visto que elas constituem o único tipo celular cuja função consiste em capturar e apresentar antígenos e as únicas APC a ter a capacidade de iniciar respostas primárias das células T.
• As APC apresentam complexos de peptídeo-MHC para reconhecimento pelas células T e também fornecem estímulos adicionais às células T, que são necessários para as respostas completas das células T. Esses estímulos, algumas vezes denominados “segundos sinais”, são mais importantes para a ativação das células T virgens do que para células efetoras e de memória previamente ativadas. As moléculas das APC ligadas à membrana que servem para ativar as células T são denominadas coestimuladores, visto que atuam em conjunto com o antígeno na estimulação das células T. As APC também secretam citocinas, que podem desempenhar funções críticas na diferenciação das células T em células efetoras. Esses coestimuladores e citocinas são descritos no Capítulo 9.
• A função de apresentação do antígeno das APC é intensificada pela exposição a produtos microbianos. Esta é uma razão pela qual o sistema imune responde melhor a micro-organismos do que a substâncias não microbianas inócuas. As células dendríticas e os macrófagos expressam receptores semelhantes a Toll (Toll-like receptors) e outros sensores microbianos (Cap. 4), que respondem à presença de micro-organismos aumentando a expressão das moléculas do MHC e dos coestimuladores, o que eleva a eficiência da apresentação do antígeno e ativação das APC, com produção de citocinas. Todos esses eventos amplificam a capacidade das APC de induzir as respostas das células T. Além disso, as células dendríticas que são ativadas por micro-organismos expressam receptores de quimiocinas que estimulam a sua migração até os locais onde se encontram as células T. A indução de respostas ótimas das células T aos antígenos proteicos purificados requer a administração dos antígenos com substâncias denominadas adjuvantes. Os adjuvantes são produtos de micro-organismos, como micobactérias mortas (usadas experimentalmente) ou estruturas micro-organismos-símiles, que aumentam a expressão dos coestimuladores e citocinas, bem como as funções de apresentação de antígenos das APC (Cap. 9).
• As APC que apresentam antígenos às células T também recebem sinais desses linfócitos que intensificam a sua função de apresentação de antígenos. Em particular, as células T CD4+ que são ativadas pelo reconhecimento do antígeno e coestimulação expressam moléculas de superfície, tais como a molécula denominada ligante do CD40 (CD154), que se liga ao CD40 nas células dendríticas e macrófagos, enquanto as células T secretam citocinas, como o interferon-γ (IFN-γ), que se ligam a seus receptores nas APC. A combinação dos sinais bioquímicos deflagrados via CD40 e citocinas ativa as APC, resultando num aumento da capacidade de processar e apresentar antígenos, de expressar coestimuladores e de secretar citocinas que ativam as células T. Essa interação bidirecional entre APC que apresentam o antígeno e linfócitos T que o reconhecem atua como alça de retroalimentação positiva, que desempenha um importante papel na maximização da resposta imune (Cap. 9).
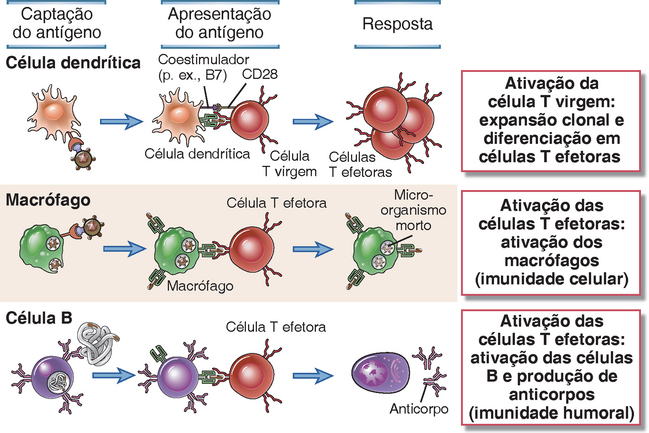
FIGURA 6-2 Funções de diferentes células apresentadoras de antígenos. Os três tipos principais de APC para as células T CD4+ têm como função exibir antígenos em diferentes estágios e em diferentes tipos de respostas imunes. Observe que as células T efetoras ativam macrófagos e linfócitos B pela produção de citocinas e pela expressão de moléculas de superfície, que serão descritas em capítulos subsequentes.
Papel das Células Dendríticas na Captura e Apresentação do Antígeno
As respostas primárias das células T CD4+ são iniciadas nos órgãos linfoides periféricos para os quais os antígenos proteicos são transportados após a sua coleta a patir de sua porta de entrada (Fig. 6-3). As vias comuns de entrada dos antígenos estranhos, como os micro-organismos, no hospedeiro consistem na pele e nos epitélios dos sistemas gastrointestinal e respiratório. Além disso, antígenos microbianos podem estar presentes em qualquer tecido que tenha sido colonizado ou infectado por micro-organismos. A pele, os epitélios das mucosas e os órgãos parenquimatosos contêm numerosos capilares linfáticos que drenam a linfa desses locais para os gânglios linfáticos regionais. Alguns antígenos são transportados na linfa pelas APC, principalmente células dendríticas, que capturam o antígeno e entram nos vasos linfáticos, enquanto outros antígenos podem estar na forma livre. Por conseguinte, a linfa contém uma amostra de todos os antígenos solúveis e associados a células presentes nos tecidos infectados. Os antígenos são concentrados nos gânglios linfáticos, que estão interpostos ao longo dos vasos linfáticos e que atuam como filtros que coletam a linfa antes de alcançar o sangue (Cap. 2). De forma semelhante, os antígenos que entram na corrente sanguínea podem ser coletados pelo baço.
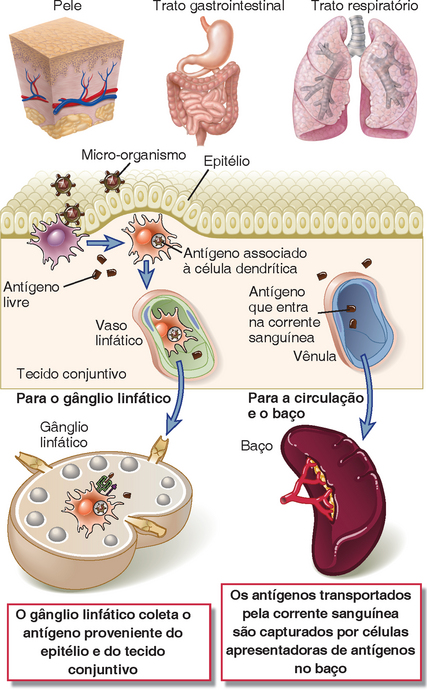
FIGURA 6-3 Vias de entrada do antígeno. Os antígenos microbianos costumam entrar pela pele e pelos tratos gastrointestinal e respiratório, onde são capturados por células dendríticas e transportados até os gânglios linfáticos regionais. Os antígenos que entram na corrente sanguínea são captados por APC no baço.
As células destinadas a capturar, transportar e apresentar os antígenos às células T são as células dendríticas. Em seguida, descreveremos as principais características e funções dessas células na iniciação das respostas das células T.
Morfologia e Populações de Células Dendríticas
As células dendríticas (CD) são encontradas nos órgãos linfoides, nos epitélios da pele e dos tratos gastrointestinal e respiratório, bem como no interstício da maioria dos órgãos parenquimatosos. Essas células (introduzidas no Cap. 2) são identificadas morfologicamente pelas suas projeções membranosas ou semelhantes a espinhos (Fig. 6-4). Acredita-se que todas as CD surgem de precursores da medula óssea, e a maioria está relacionada, quanto à sua linhagem, aos fagócitos mononucleares (Fig. 2-2). Foram identificados vários subtipos de CD, que podem ser diferenciados pela expressão de vários marcadores de superfície celular e que podem desempenhar funções diferentes nas respostas imunes. Os dois tipos principais são denominados CD convencionais e as CD plasmocitoides (Tabela 6-3).
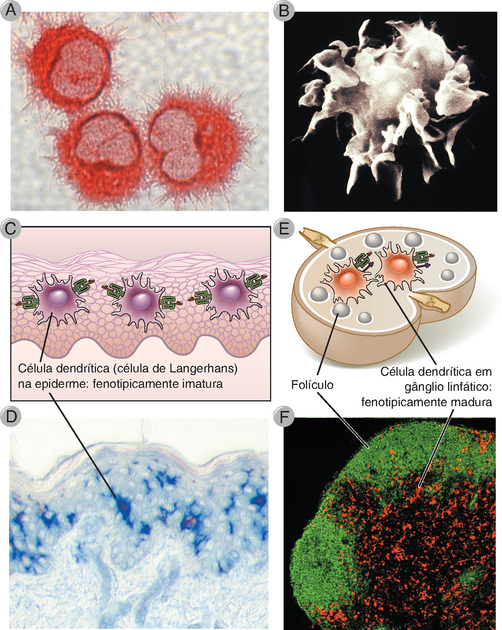
FIGURA 6-4 Células dendríticas. A, Micrografia óptica de células dendríticas cultivadas, derivadas de precursores da medula óssea. B, Micrografia eletrônica de varredura de uma célula dendrítica, mostrando as extensas projeções da membrana. C, D, Células dendríticas na pele, ilustradas de modo esquemático (C) e em um corte da pele (D) marcada com um anticorpo específico para as células de Langerhans (que aparecem em azul nessa coloração imunoenzimática). E, F, Células dendríticas em um gânglio lnfático, ilustrado de modo esquemático (E), e em um corte de gânglio linfático de camundongo (F) marcado com anticorpos marcados com fluorescência contra células B nos folículos (verde) e células dendríticas na zona de células T (vermelho). (A, B e D, cortesia de Dr. Y-J Liu, M.D. Anderson Cancer Center, Houston, Texas; F cortesia das Dras. Kathryn Pape e Jennifer Walter, University of Minnesota School of Medicine, Minneapolis.)
TABELA 6-3 Os Principais Subtipos de Células Dendríticas
| Característica | Células Dendríticas Convencionais (Mieloides) | Células Dendríticas Plasmocitoides |
|---|---|---|
| Marcadores de superfície | ||
| Fatores de crescimento para geração in vitro | GM-CSF, ligante de Flt3 | Ligante de Flt3 |
| Expressão de receptores semelhantes a Toll (TLR) | TLR, 4, 5, 8 altos | TLR 7, 9 altos |
| Principais citocinas produzidas | TNF, IL-6 | Interferon tipo I |
| Principais funções postuladas | Indução de respostas das células T contra a maioria dos antígenos | Imunidade inata e indução das respostas das células T contra vírus |
Foram descritos outros subtipos de células dendríticas com base na expressão de vários marcadores de superfície (como CD4, CD8 e CD11b) ou na sua migração dos locais teciduais (células dendríticas do tipo Langerhans dos epitélios e células dendríticas intersticiais dos tecidos). Observe que todas as CD expressam moléculas do MHC de classe II. Alguns pesquisadores também descrevem células dendríticas derivadas dos monócitos, que podem ser geradas de monócitos circulantes cultivados com várias citocinas e que podem desenvolver-se in vivo durante reações inflamatórias.
• As CD convencionais, anteriormente denominadas CD mieloides, foram inicialmente identificadas pela sua morfologia e capacidade de estimular respostas intensas das células T. Constituem o subtipo de CD mais numeroso nos órgãos linfoides. As CD convencionais derivam de progenitores da medula óssea, podem ser obtidas a partir de células da medula óssea ou do sangue, incluindo monócitos circulantes, e dão origem à população tecidual residente de CD. Com a sua ativação pelo encontro com micro-organismos ou citocinas, as CD nos epitélios e nos tecidos amadurecem e migram para gânglios linfáticos drenantes (regionais), onde iniciam as respostas das células T (Fig. 6-4). As CD convencionais derivadas de tecidos são também classificadas algumas vezes no tipo de células de Langerhans, representando as CD nos epitélios e nos gânglios linfáticos que drenam a pele, e no tipo intersticial/dérmico, representando as CD na maioria dos outros tecidos. Os protótipos das CD epiteliais são as células de Langerhans da epiderme. Em virtude de seus longos processos citoplasmáticos, as células de Langerhans ocupam até 25% da área de superfície da epiderme, embora constituam menos de 1% da população celular local (Fig. 6-4). As CD nos epitélios intestinais parecem emitir processos que atravessam as células epiteliais e projetam-se na luz, onde podem atuar na captura de antígenos microbianos. Foi descrita uma população de CD convencionais que expressam o marcador de células T CD8 em camundongos (todavia, esse marcador não demarca um subtipo de CD nos seres humanos). As CD8+ foram também denominadas CD linfoides, devido à suspeita de que elas se desenvolvem de progenitores linfoides comuns; todavia, na atualidade, sabe-se que elas provêm de precursores mieloides, e o termo CD linfoide geralmente não é utilizado. Foram descritos outros subtipos de CD convencionais, porém as suas funções ainda não foram definidas.
• As CD plasmocitoides assemelham-se morfologicamente aos plasmócitos e só adquirem a morfologia e as propriedades funcionais de CD após a sua ativação. Desenvolvem-se na medula óssea de um precursor, que também dá origem às CD convencionais e são encontradas no sangue e, em pequenos números, nos órgãos linfoides, particularmente nas zonas de células T do baço e dos gânglios linfáticos. A principal função das CD plasmocitoides é a secreção de grandes quantidades de interferons tipo I em resposta a infecções virais (Cap. 4). Essas células também desempenham um papel na apresentação de antígenos aos linfócitos T.
As CD que migram dos tecidos para os gânglios linfáticos também podem ser caracterizadas como células imaturas ou maduras. Muitas CD que normalmente residem nos órgãos linfoides e em tecidos não linfoides, incluindo os epitélios, parecem estar, na ausência de infecção ou de inflamação, em um estado imaturo, isto é, capaz de capturar antígenos, porém incapaz de ativar as células T. Essas CD podem atuar na apresentação de autoantígenos às células T autorreativas, causando, assim, a inativação ou morte das células T ou gerando células T reguladoras. Esses mecanismos são importantes para a manutenção da autotolerância e prevenção da autoimunidade (Cap. 14). Conforme discutido adiante, as CD que encontraram micro-organismos sofrem maturação e funcionam para apresentar os antígenos às células T e ativá-las.
Captura e Transporte do Antígeno pelas Células Dendríticas
As CD que residem nos epitélios e nos tecidos capturam antígenos proteicos e os transportam até os gânglios linfáticos regionais (drenantes) (Fig. 6-5). As CD em repouso (imaturas) expressam receptores de membrana, como lectinas do tipo C, que se ligam aos micro-organismos. As CD utilizam esses receptores para a captura e endocitose dos micro-organismos e seus antígenos e, em seguida, para o processamento das proteínas ingeridas em peptídeos capazes de se ligar a moléculas do MHC. Além da endocitose mediada por receptor e fagocitose, as CD podem ingerir antígenos por micropinocitose e macropinocitose, processos que não envolvem receptores de reconhecimento específicos, mas que capturam qualquer material que possa se encontrar na fase líquida na vizinhança das CD. Ao mesmo tempo, verifica-se o desenvolvimento de uma resposta imune inata durante a qual os produtos microbianos são reconhecidos por receptores semelhantes a Toll e outros sensores microbianos nas CD e outras células. As CD são ativadas por esses sinais e por citocinas, como o fator de necrose tumoral (TNF), que são produzidas em resposta aos micro-organismos. As CD ativadas (também denominadas CD maduras) perdem a sua aderência aos epitélios ou tecidos e migram para os gânglios linfáticos. As CD também começam a expressar um receptor de quimiocinas, denominado CCR7, que é específico para duas quimiocinas, CCL19 e CCL21, que são produzidas nas zonas de células T dos gânglios linfáticos. Essas quimiocinas atraem as CD que transportam antígenos microbianos para dentro das zonas de células T dos gânglios linfáticos regionais. As células T virgens também expressam CCR7, e esta é a razão pela qual as células T virgens migram para as mesmas regiões dos gânglios linfáticos onde estão concentradas as CD que transportam antígenos (Cap. 3). A colocalização das CD que transportam antígenos e das células T virgens maximiza a probabilidade do encontro do antígeno com células T que possuem receptores para este antígeno. A maturação também converte as CD, de células cuja função é capturar antígenos, em células capazes de apresentar antígenos às células T virgens e ativá-las. As CD maduras expressam altos níveis de moléculas do MHC com peptídeos ligados, bem como coestimuladores necessários para a ativação das células T. Por conseguinte, quando essas células tornam-se residentes nos gânglios linfáticos, elas já se desenvolveram em APC potentes com a capacidade de ativar os linfócitos T. As células T virgens que recirculam através dos gânglios linfáticos encontram essas APC, e as células T que são específicas para os complexos de peptídeo-MHC apresentados são ativadas. Esta é a etapa inicial na indução das respostas das células T a antígenos proteicos.
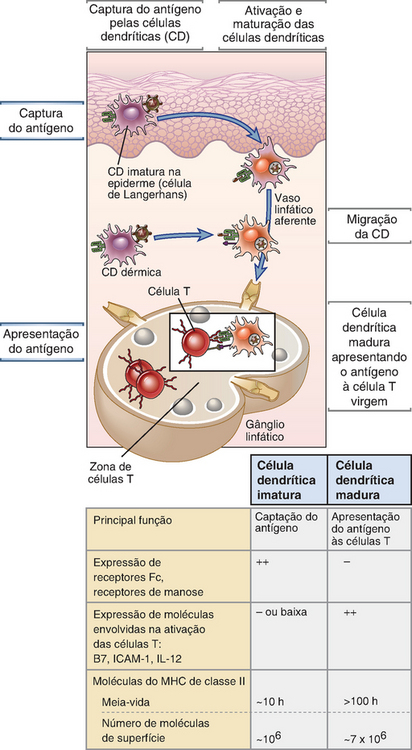
FIGURA 6-5 Papel das células dendríticas na captura e apresentação de antígenos. As células dendríticas imaturas na pele (células de Langerhans) ou na derme (CD dérmicas) capturam antígenos que entram pela epiderme e os transportam até os gânglios linfáticos regionais. Durante essa migração, as células dendríticas amadurecem e transformam-se em APC eficientes. A tabela fornece um resumo de algumas das alterações observadas durante a maturação das células dendríticas, que são importantes no desempenho das funções dessas células.
Os antígenos também podem ser transportados até os órgãos linfoides na forma solúvel. As CD residentes nos gânglios linfáticos e no baço podem capturar antígenos transportados na linfa e no sangue, respectivamente, e também são estimuladas a amadurecer pelos produtos microbianos. Quando a linfa entra em um gânglio linfático através de um vaso linfático aferente, ela drena no seio subcapsular, e parte da linfa entra nos condutos de células reticulares e fibroblastos que se originam do seio e atravessam o córtex (Cap. 2). Uma vez nos condutos, os antígenos de baixo peso molecular podem ser capturados por CD cujos processos se interdigitam entre as células reticulares. Outros antígenos no seio subcapsular são captados por macrófagos e CD, que transportam os antígenos no córtex. As células B no gânglio linfático também podem reconhecer e internalizar antígenos solúveis. As CD, os macrófagos e as células B que capturaram antígenos proteicos podem então processá-los e apresentá-los a células T virgens e a células T efetoras que foram geradas por estimulação antigênica prévia.
A coleta e a concentração de antígenos estranhos nos gânglios linfáticos são suplementadas por duas outras adaptações anatômicas que desempenham funções semelhantes. Em primeiro lugar, as superfícies de mucosas dos sistemas gastrointestinal e respiratório, além de serem drenadas por capilares linfáticos, contêm coleções especializadas de tecido linfoide secundário que podem coletar diretamente o conteúdo luminal desses órgãos, tendo então acesso ao material antigênico. Entre esses órgãos linfoides da mucosa, os mais bem caracterizados são as placas de Peyer do íleo e as tonsilas faríngeas (Cap. 13). Em segundo lugar, a corrente sanguínea é monitorada por APC no baço à procura de quaisquer antígenos que tenham alcançado a circulação. Esses antígenos podem alcançar o sangue diretamente dos tecidos ou por meio da linfa do ducto torácico.
Função Apresentadora de Antígenos das Células Dendríticas
Muitos estudos realizados in vitro e in vivo estabeleceram que a indução das respostas imunes primárias dependentes de células T a antígenos proteicos requer a presença de CD para capturar os antígenos e apresentá-los às células T. Isso foi demonstrado pela primeira vez para as respostas das células T CD4+; todavia, hoje, sabe-se que isso também se aplica às células T CD8+.
As CD possuem várias propriedades que fazem delas as APC mais eficientes para a iniciação de respostas de células T virgens.
• As CD estão estrategicamente localizadas em regiões comuns de entrada de micro-organismos e antígenos estranhos (nos epitélios) e em tecidos que podem ser colonizados por micro-organismos.
• As CD expressam receptores que as capacitam capturar micro-organismos e responder a eles.
• Essas células migram dos epitélios e tecidos preferencialmente para as zonas de células T dos gânglios linfáticos, através dos quais circulam os linfócitos T virgens à procura de antígenos estranhos.
• As CD maduras expressam altos níveis de complexos de peptídeo-MHC, de coestimuladores e citocinas, todos os quais são necessários para ativar os linfócitos T virgens.
As CD podem ingerir células infectadas e apresentar os antígenos dessas células aos linfócitos T CD8+. As CD são as melhores APC para induzir as respostas primárias das células T CD8+, porém isso representa um problema especial, visto que os antígenos reconhecidos por esses linfócitos podem ser produzidos por qualquer tipo de célula infectada por um vírus, não necessariamente CD. Algumas CD especializadas têm a capacidade de ingerir células infectadas por vírus ou fragmentos celulares e apresentar antígenos dessas células aos linfócitos T CD8+. Esse processo é denominado apresentação cruzada (cross-priming) e é descrito mais adiante, neste capítulo.
Funções de Outras Células Apresentadoras de Antígenos
Embora as CD tenham uma função crítica na iniciação de respostas primárias das células T, outros tipos celulares também são APC importantes em diferentes situações (Fig. 6-2 e Tabela 6-2).
• Nas respostas imunes celulares, os macrófagos apresentam os antígenos dos micro-organismos fagocitados a células T efetoras, que respondem ativando os macrófagos a matar os micro-organismos. Esse processo é fundamental na imunidade celular e na hipersensibilidade do tipo tardia (Cap. 10). Os monócitos circulantes são capazes de migrar para qualquer local de infecção e inflamação, onde se diferenciam em macrófagos e fagocitam e destroem os micro-organismos. As células T CD4+ reconhecem antígenos microbianos apresentados pelos macrófagos e fornecem sinais que intensificam as atividades microbicidas desses macrófagos.
• Nas respostas imunes humorais, os linfócitos B internalizam antígenos proteicos e apresentam peptídeos derivados dessas proteínas às células T auxiliares. Essa função de apresentação do antígeno pelas células B é essencial para a produção de anticorpos dependentes de células T auxiliares (Cap. 11).
• Todas as células nucleadas podem apresentar peptídeos derivados de antígenos proteicos citosólicos aos linfócitos T CD8+. Todas as células nucleadas são suscetíveis a infecções virais e a mutações que produzem câncer. Por conseguinte, é importante que o sistema imune seja capaz de reconhecer antígenos citosólicos, como antígenos virais e proteínas que sofrem mutação, em qualquer tipo de célula. Os CTL CD8+ constituem a população de células que reconhecem esses antígenos e que eliminam as células nas quais os antígenos são produzidos. Os micro-organismos fagocitados também podem ser reconhecidos pelos CTL CD8+ se esses micro-organismos ou seus antígenos escaparem das vesículas fagocíticas para o citosol.
• Nos seres humanos, as células endoteliais vasculares expressam moléculas do MHC de classe II e podem apresentar antígenos às células T do sangue circulante que ficaram aderentes à parede do vaso. Isso pode contribuir para o recrutamento e a ativação de células T efetoras nas reações imunes celulares (Cap. 10). As células endoteliais nos enxertos também constituem alvos das células T que reagem contra antígenos do enxerto (Cap. 16). Várias células epiteliais e mesenquimatosas podem expressar moléculas do MHC de classe II em resposta à citocina IFN-γ. A importância fisiológica da apresentação de antígenos por essas populações de células ainda não está esclarecida. Como a maioria não expressa coestimuladores e não é eficiente no processamento de proteínas em peptídeos de ligação do MHC, é pouco provável que possam ter uma contribuição significativa para a maioria das respostas de células T. As células epiteliais do timo expressam constitutivamente moléculas do MHC e desempenham um papel crítico na apresentação de complexos de peptídeo-MHC às células T em maturação no timo, como parte dos processos de seleção que configuram o repertório de especificidades das células T (Cap. 8).
O COMPLEXO PRINCIPAL DE HISTOCOMPATIBILIDADE (MHC)
Descoberta do MHC
A descoberta do papel fundamental do MHC no reconhecimento dos antígenos pelas células T CD4+ e T CD8+ revolucionou o campo da imunologia e preparou o caminho para a nossa atual compreensão da ativação e das funções dos linfócitos.
O MHC do Camundongo (Complexo H-2)
O MHC foi descoberto em estudos sobre transplante de tecidos, bem antes da elucidação da estrutura e função das moléculas do MHC. Sabia-se que os tecidos, como a pele, quando trocados entre animais não idênticos eram rejeitados, enquanto os mesmos enxertos entre gêmeos idênticos eram aceitos. Esse resultado mostrou que genes herdados deviam estar envolvidos no processo de rejeição dos tecidos. Na década de 1940, para analisar a base genética da rejeição de enxertos, George Snell e colegas produziram cepas de camundongos endogâmicos por meio de acasalamento repetido entre irmãos. Os camundongos endogâmicos são homozigotos para cada lócus genético (i. e., expressam apenas um alelo de cada gene, mesmo nos genes polimórficos), e cada camundongo de uma cepa endogâmica é geneticamente idêntico (singênico) a qualquer outro camundongo da mesma cepa (i. e., todos expressam os mesmos alelos). Diferentes cepas podem expressar alelos diferentes, e diz-se que são alogênicas entre si. Ao acasalar cepas congênitas de camundongos que rejeitavam enxertos de outras cepas, mas que eram idênticos para todos os outros genes, esses pesquisadores mostraram que uma única região genética é primariamente responsável pela rápida rejeição dos enxertos teciduais, e essa região foi denominada lócus principal de histocompatibilidade (histo, tecido). O lócus particular que foi identificado nos camundongos pelo grupo de Snell foi ligado a um gene no cromossomo 17, que codifica um antígeno de grupo sanguíneo, denominado antígeno II, razão pela qual essa região foi denominada histocompatibilidade-2 ou, simplesmente, H-2. Inicialmente, acreditou-se que esse lócus continha um único gene que controlava a compatibilidade tecidual. Entretanto, ocorreram eventos ocasionais de recombinação dentro do lócus H-2 durante o acasalamento de diferentes cepas, indicando que continha, na realidade, vários genes diferentes, porém estreitamente ligados, muitos dos quais estavam envolvidos na rejeição de enxertos. A região genética que controlava a rejeição de enxertos e continha vários genes ligados foi denominada complexo principal de histocompatibilidade. Embora não fosse conhecido na época dos experimentos de Snell, a rejeição de transplantes é, em grande parte, um processo mediado pelas células T (Cap. 16), e, por conseguinte, não é surpreendente que exista uma relação entre os genes do MHC, que codificam as moléculas do MHC de ligação de peptídeos que reconhecem as células T, e a rejeição aos enxertos.
O MHC Humano (HLA)
O MHC humano foi descoberto como resultado da procura de moléculas de superfície celular em um indivíduo, que seriam reconhecidas como estranhas por outro indivíduo. Essa tarefa tornou-se possível quando Jean Dausset, Jan van Rood e seus colegas descobriram que indivíduos que haviam recebido múltiplas transfusões de sangue e pacientes submetidos a transplantes renais apresentavam anticorpos que reconheciam células dos doadores de sangue ou de rim, enquanto mulheres multíparas produziam anticorpos circulantes que reconheciam as células paternas. As proteínas reconhecidas por esses anticorpos são denominadas antígenos leucocitários humanos (HLA) (leucocitário pelo fato de que os anticorpos foram testados pela sua ligação aos leucócitos de outros indivíduos, e antígenos pelo fato de as moléculas serem reconhecidas por anticorpos). Análises subsequentes mostraram que, como nos camundongos, a herança de alelos HLA particulares constitui um importante determinante da aceitação ou rejeição a um enxerto (Cap. 16). Os estudos bioquímicos realizados forneceram um resultado satisfatório, mostrando que as proteínas H-2 do camundongo e as proteínas HLA tinham estruturas essencialmente idênticas. Com base nesses resultados, chegou-se à conclusão de que os genes que determinam o destino dos tecidos enxertados estão presentes em todas as espécies de mamíferos e são homólogos aos genes H-2 identificados pela primeira vez em camundongos; são os denominados genes do MHC. Outros genes polimórficos que contribuem, em menor grau, para a rejeição de enxertos são denominados genes de histocompatibilidade menor; retornaremos a eles no Capítulo 16, quando iremos discutir a imunologia dos transplantes.
Genes da Resposta Imune
Durante quase 20 anos após a descoberta do MHC, seu único papel documentado era a rejeição de enxertos. Esse aspecto intrigava os imunologistas, visto que o transplante não é um fenômeno natural, e não havia motivos para que um conjunto de genes fosse preservado ao longo da evolução se a sua única função consistia em controlar a rejeição de enxertos de tecidos estranhos. Nas décadas de 1960 e 1970, foi descoberto que os genes do MHC são de suma importância para todas as respostas imunes a antígenos proteicos. Baruj Benacerraf, Hugh McDevitt e seus colegas verificaram que cepas endogâmicas de cobaias e camundongos diferiam na sua capacidade de produzir anticorpos contra alguns polipeptídeos sintéticos, sendo a responsividade herdada como traço mendeliano dominante. Os genes envolvidos foram denominados genes da resposta imune (Ir), e foi constatado que todos eram mapeados no MHC. Na atualidade, sabemos que os genes Ir são, de fato, os genes do MHC que codificam moléculas do MHC, que diferem na sua capacidade de ligação e apresentação de peptídeos derivados de vários antígenos proteicos. As cepas que respondem, isto é, as que podem desencadear respostas imunes a determinado antígeno polipeptídico, herdam alelos do MHC cujos produtos podem ligar-se a peptídeos derivados desses antígenos, formando complexos de peptídeo-MHC que podem ser reconhecidos pelas células T auxiliares. Em seguida, essas células T ajudam as células B a produzir anticorpos. As cepas que não respondem expressam moléculas do MHC que não são capazes de ligar-se a peptídeos derivados do antígeno polipeptídico, e, por conseguinte, essas cepas não podem gerar células T auxiliares nem anticorpos específicos contra o antígeno. Posteriormente, foi também constatado que muitas doenças autoimunes estão associadas à herança de determinados alelos do MHC, colocando definitivamente esses genes no centro dos mecanismos que controlam as respostas imunes. Esses estudos forneceram o estímulo para a realização de análises mais detalhadas dos genes e proteínas do MHC.
O Fenômeno de Restrição do MHC
A prova formal de que o MHC está envolvido no reconhecimento de antígenos pelas células T veio da demonstração experimental da restrição do MHC por Rolf Zinkernagel e Peter Doherty. Em seu estudo clássico, publicado em 1974, esses pesquisadores examinaram o reconhecimento de células infectadas por vírus por CTL específicos para determinados vírus em camundongos endogâmicos. Se houver infecção de um camundongo por um vírus, os CTL CD8+ específicos para o vírus desenvolvem-se no animal. Esses CTL reconhecem e matam as células infectadas pelo vírus apenas se as células infectadas expressarem alelos das moléculas do MHC que são reconhecidas no animal onde foram gerados os CTL (Fig. 6-6). Através do uso de cepas congênitas de MHC de camundongos (camundongos que eram idênticos em cada lócus genético, exceto o MHC), foi demonstrado que os CTL e a célula-alvo infectada devem derivar de camundongos que compartilham um alelo do MHC da classe I. Por conseguinte, o reconhecimento de antígenos específicos para CTL CD8+ é restrito aos alelos próprios do MHC da classe I. Experimentos subsequentes demonstraram que as respostas dos linfócitos T CD4+ auxiliares a antígenos são autorrestritas pelo MHC de classe II.
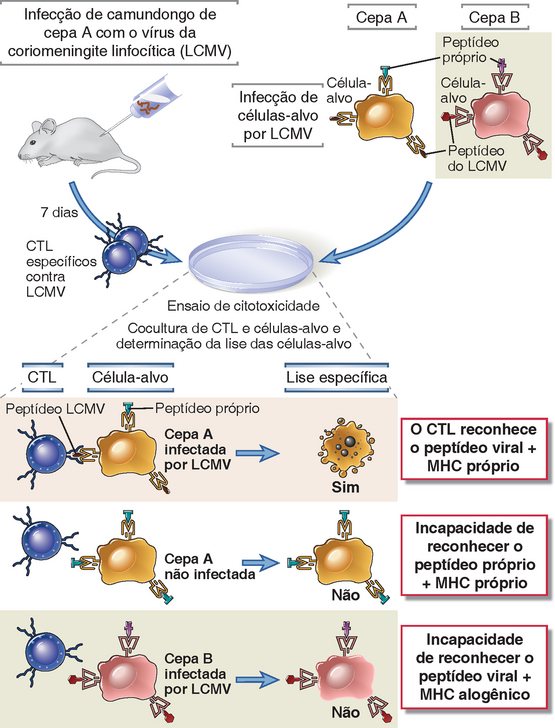
FIGURA 6-6 Demonstração experimental do fenômeno de restrição do MHC dos linfócitos T. Os linfócitos T citotóxicos (CTL) específicos de vírus, gerados em camundongos de cepa A infectados por vírus, matam apenas as células-alvo singênicas (cepa A) infectadas por aquele vírus. Os CTL não matam alvos de cepa A não infectados (que expressam peptídeos próprios, mas não peptídeos virais) ou alvos de cepa B infectados (que expressam diferentes alelos MHC em comparação com a cepa A). Com o uso de cepas congênitas de camundongos, que diferem apenas nos loci do MHC de classe I, foi provado que o reconhecimento do antígeno por CTL CD8+ é autorrestrito pelo MHC de classe I.
Continuaremos nossa discussão do MHC com a descrição das propriedades dos genes e suas proteínas, e concluiremos com a descrição de como essas proteínas ligam-se a antígenos estranhos e os apresentam.
Genes do MHC
O lócus do MHC contém dois tipos de genes do MHC polimórficos, os genes do MHC de classe I e de classe II, que codificam dois grupos de proteínas estruturalmente distintas, porém homólogas, e outros genes não polimórficos, cujos produtos estão envolvidos na apresentação do antígeno (Fig. 6-7). As moléculas do MHC de classe I apresentam peptídeos e são reconhecidas pelas células T CD8+, enquanto as moléculas do MHC de classe II apresentam peptídeos às células T CD4+; cada um desses tipos de células T desempenha diferentes funções na proteção contra micro-organismos.
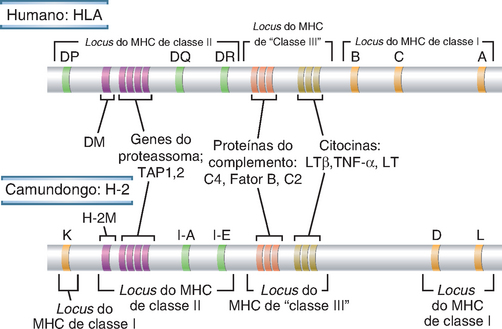
FIGURA 6-7 Mapas esquemáticos dos loci do MHC humano e do camundongo. A organização básica dos genes nos loci do MHC é semelhante nos seres humanos e nos camundongos. Os tamanhos dos genes e dos segmentos de DNA intervenientes não estão em escala. Os loci de classe II são mostrados como blocos isolados, porém cada lócus consiste em vários genes. O lócus do MHC de classe III refere-se a genes que codificam moléculas diferentes das que apresentam peptídeos; esse termo não é usado comumente.
Os genes do MHC são expressos de modo codominante em cada indivíduo. Em outras palavras, para um determinado gene do MHC, cada indivíduo expressa os alelos que são herdados de cada um dos pais. Para o indivíduo, isso maximiza o número de moléculas do MHC disponíveis para ligação de peptídeos para apresentação às células T.
Os genes do MHC de classes I e II são os genes mais polimórficos presentes no genoma. Os estudos sobre o MHC de camundongos foram realizados com um número limitado de cepas. Embora se tenha constatado que os genes do MHC de camundongos eram polimórficos, apenas cerca de 20 alelos de cada gene do MHC foram identificados nas cepas endogâmicas de camundongos disponíveis. Os estudos sorológicos humanos foram conduzidos em populações exogâmicas. Uma característica notável que surgiu dos estudos sobre os genes do MHC humano é a extensão sem precedente e inesperada de seu polimorfismo. O número total de alelos HLA na população é estimado em cerca de 3.500, com mais de 250 alelos apenas para o lócus HAL-B apenas. A sequência molecular demonstrou que um único alelo HLA sorologicamente definido, pode, na realidade, consistir em múltiplas variantes que diferem apenas ligeiramente. Por conseguinte, o polimorfismo é ainda maior do que o previsto pelos estudos sorológicos. Como será discutido mais adiante neste capítulo, os resíduos polimórficos das células do MHC determinam a especificidade de ligação ao peptídeo e o reconhecimento do antígeno pela célula T, levando a questionar por que os genes do MHC são polimórficos. A presença de múltiplos alelos MHC na população assegura que pelo menos alguns indivíduos em uma população serão capazes de reconhecer antígenos proteicos produzidos por praticamente qualquer micro-organismo, reduzindo, assim, a possibilidade de que um único patógeno possa escapar das defesas do hospedeiro em todos os indivíduos de determinada espécie.
Lócus do MHC Humano e de Camundongo
Nos seres humanos, o MHC localiza-se no braço curto do cromossomo 6 e ocupa um grande segmento de DNA, que se estende por cerca de 3.500 quilobases (kb). (Para comparação, um grande gene humano pode estender-se por até 50 a 100 kb, e o tamanho do genoma completo da bactéria Escherichia coli é de aproximadamente 4.500 kb.) Em termos genéticos clássicos, o lócus do MHC estende-se por cerca de 4 centimorgans, o que significa que ocorrem cruzamentos dentro do MHC com uma frequência de cerca de 4% a cada meiose. A Figura 6-8 mostra um mapa molecular do MHC humano.
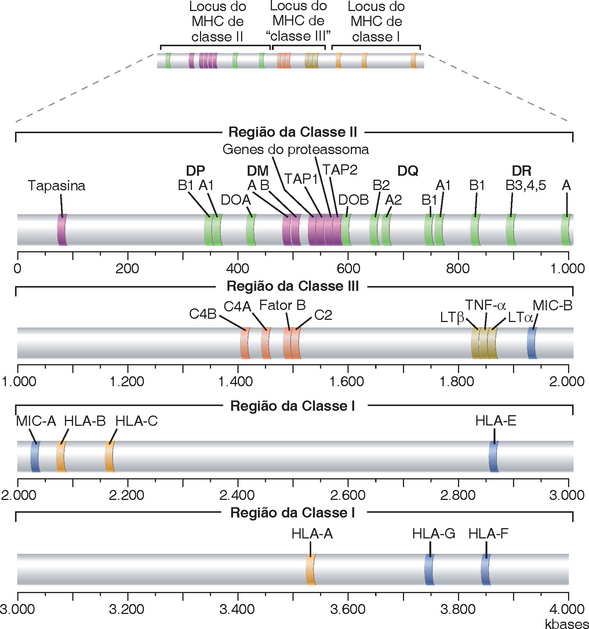
FIGURA 6-8 Mapa do MHC humano. Os genes localizados dentro do lócus do MHC humano estão ilustrados. Além dos genes do MHC de classe I e classe II, os genes HLA-E, HLA-F e HLA-G e os genes MIC codificam moléculas semelhantes à classe I, muitas das quais são reconhecidas pelas células NK; os genes C4, C2 e do fator B codificam proteínas do complemento; tapasina, DM, DO, TAP e o proteassoma codificam proteínas envolvidas no processamento do antígeno; LTα, LTβ e TNF codificam citocinas. Muitos pseudogenes e genes, cujos papéis nas respostas imunes ainda não estão estabelecidos, estão localizados no complexo HLA, porém não estão ilustrados para simplificação do mapa.
Os genes HLA da classe I humanos foram definidos pela primeira vez por abordagens sorológicas (ligação de anticorpos). Existem três genes do MHC da classe I, denominados HLA-A, HLA-B e HLA-C, que codificam três moléculas do MHC da classe I com os mesmos nomes. Os genes do MHC da classe I foram identificados pela primeira vez com o uso de ensaios nos quais as células T de um indivíduo seriam ativadas por células de outro indivíduo (a denominada reação linfocitária mista; Cap. 16). Existem três loci de genes HLA da classe II, denominados HLA-DP, HLA-DQ e HLA-DR. Cada molécula do MHC de classe II é composta de um heterodímero de polipeptídeos α e β, e os loci DP, DQ e DR contêm, cada um deles, genes separados denominados A ou B, que codificam as cadeias α e β, respectivamente. Mais recentemente, foram utilizados métodos de sequenciamento do DNA para definir com mais precisão os genes do MHC e suas diferenças entre os indivíduos. A nomenclatura do lócus HLA leva em consideração o enorme polimorfismo (variação entre indivíduos) identificado por métodos sorológicos e moleculares. Por conseguinte, com base na moderna tipagem molecular, os alelos individuais podem ser denominados HLA-A*0201, referindo-se ao subtipo 01 do HLA-A2, ou HLA-DRB1*0401, referindo-se ao subtipo 01 do alelo DR4 no gene B1, e assim por diante.
O MHC do camundongo, localizado no cromossomo 17, ocupa cerca de 2.000 kb do DNA, e os genes estão organizados em uma sequência ligeiramente diferente do gene do MHC humano. Um dos genes da classe I do camundongo (H-2K) é centromérico para a região de classe II, porém os outros genes da classe I são teloméricos para a região de classe II. Existem três genes do MHC de classe I do camundongo, denominados H-2K, H-2D e H-2L, que codificam três proteínas diferentes do MHC da classe I: K, D e L. Esses genes são homólogos aos genes HLA-A, B e C humanos. Os alelos do MHC de determinadas cepas endogâmicas de camundongos são designados por letras em minúscula (p. ex., a, b), denominados para todo o conjunto de genes do MHC da cepa de camundongo onde foram identificados pela primeira vez. No linguajar característico de geneticistas de camundongos, o alelo do gene H-2K em uma cepa com o MHC tipo k é denominado Kk (pronunciado K de k), enquanto o alelo do gene H-2K em uma cepa com MHC do tipo d é denominado Kd (K de d). Emprega-se uma terminologia semelhante para os alelos H-2D e H-2L. Os camundongos apresentam dois loci do MHC de classe II denominados I-A e I-E, que codificam as moléculas I-A e I-E, respectivamente. Localizam-se nas sub-regiões A e E da região Ir do MHC, e foi constatado serem os genes Ir discutidos anteriormente. Os genes de classe II do camundongo são homólogos aos genes HLA-DP, DQ e DR humanos. O alelo I-A encontrado na cepa endogâmica de camundongo com os alelos Kk e Dk é denominado I-Ak (pronunciado I A de k). Uma terminologia semelhante é utilizada para o alelo I-E. Como nos seres humanos, existem, na realidade, dois genes diferentes, designados como A e B, nos loci I-A e I-E que codificam as cadeias α e β de cada molécula do MHC de classe II.
O conjunto de alelos do MHC presente em cada cromossomo é denominado haplótipo MHC. Por exemplo, um haplótipo HLA de um indivíduo pode ser HLA-A2, HLA-B5, HLA-DR3 e assim por diante. Naturalmente, todos os indivíduos heterozigotos possuem dois haplótipos HLA. Os camundongos endogâmicos, por serem homozigotos, apresentam um único haplótipo. Por conseguinte, o haplótipo de um camundongo H-2d é H-2Kd I-Ad I-Ed Dd Ld.
Expressão das Moléculas do MHC
Como as moléculas do MHC são necessárias para apresentar antígenos aos linfócitos T, a expressão dessas proteínas em uma célula determina se antígenos estranhos (p. ex., microbianos) naquela célula serão reconhecidos pelas células T. Existem várias características importantes da expressão das moléculas do MHC que contribuem para o seu papel na proteção do indivíduo contra diversas infecções microbianas.
As moléculas de classe I são expressas de modo constitutivo em praticamente todas as células nucleadas, enquanto as moléculas de classe II são expressas apenas nas células dendríticas, nos linfócitos B, nos macrófagos e em alguns outros tipos celulares. Esse padrão de expressão do MHC está ligado às funções das células T restritas à classe I e à classe II. A função efetora dos CTL CD8+ restritos à classe I consiste em eliminar as células infectadas por micro-organismos intracelulares, como os vírus, bem como tumores que expressam antígenos tumorais. A expressão das moléculas do MHC de classe I nas células nucleadas proporciona um sistema de apresentação para antígenos virais e tumorais. Por sua vez, os linfócitos T CD4+ auxiliares restritos à classe II desempenham um conjunto de funções que exigem o reconhecimento do antígeno apresentado por um número mais limitado de tipos celulares. Em particular, as células T CD4+ virgens precisam reconhecer antígenos que são capturados e apresentados pelas células dendríticas nos órgãos linfoides. Os linfócitos T CD4+ auxiliares diferenciados funcionam principalmente para ativar (ou auxiliar) os macrófagos a eliminar os micro-organismos extracelulares que foram fagocitados e para ativar os linfócitos B a produzir anticorpos que também eliminam micro-organismos extracelulares. As moléculas de classe II são expressas principalmente nesses tipos celulares e proporcionam um sistema de apresentação de peptídeos derivados de micro-organismos e proteínas extracelulares.
A expressão das moléculas do MHC é aumentada pelas citocinas produzidas durante as respostas imunes tanto inatas quanto adaptativas (Fig. 6-9). Na maioria dos tipos celulares, os interferons IFN-α, IFN-β e IFN-γ aumentam o nível de expressão das moléculas de classe I. Os interferons são citocinas produzidas durante a fase inicial da resposta imune inata a numerosos vírus (Cap. 4). Por conseguinte, as respostas imunes inatas a vírus aumentam a expressão das moléculas do MHC que apresentam antígenos virais às células T específicas para vírus. Este é um dos mecanismos pelos quais a imunidade inata estimula respostas imunes adaptativas.
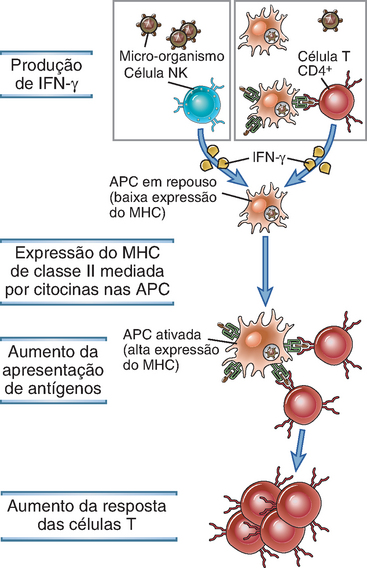
FIGURA 6-9 Aumento da expressão do MHC de classe II pelo IFN-γ. O IFN-γ, que é produzido por células NK e por outros tipos celulares durante as reações imunes inatas a micro-organismos ou por células T durante reações imunes adaptativas, estimula a expressão do MHC de classe II nas APC, aumentando, assim, a ativação das células T CD4+. O IFN-γ e os interferons tipo I exercem um efeito semelhante sobre a expressão das moléculas do MHC de classe I e a ativação das células T CD8+.
A expressão das moléculas de classe II também é regulada por citocinas e por outros sinais em diferentes células. O IFN-γ é a principal citocina envolvida na estimulação da expressão das moléculas de classe II nas APC, como células dendríticas e macrófagos (Fig. 6-9). O IFN-γ pode ser produzido pelas células NK durante as reações imunes inatas e por células T ativadas por antígenos durante reações imunes adaptativas. A capacidade do IFN-γ de aumentar precocemente a expressão do MHC da classe II sobre as APC constitui um mecanismo de amplificação da imunidade adaptativa. Conforme assinalado anteriormente, a expressão das moléculas da classe II também aumenta em resposta a sinais dos receptores semelhantes a Toll que respondem a componentes microbianos, promovendo, assim, a apresentação de antígenos microbianos. Os linfócitos B expressam constitutivamente moléculas de classe II e podem aumentar a sua expressão em resposta ao reconhecimento de antígenos e citocinas produzidos pelas células T auxiliares, intensificando, assim, a apresentação de antígenos às células auxiliares (Cap. 11). O IFN-γ também aumenta a expressão das moléculas do MHC nas células endoteliais vasculares e em outros tipos celulares não imunes; o papel dessas células na apresentação do antígeno aos linfócitos T não está bem esclarecido. Algumas células, como os neurônios, nunca parecem expressar moléculas de classe II. As células T humanas ativadas, mas não as de camundongos, expressam moléculas de classe II após a sua ativação; entretanto, ainda não foi identificada nenhuma citocina envolvida nessa resposta, e o seu significado funcional é desconhecido.
A taxa de transcrição constitui o principal determinante do nível de síntese e expressão de moléculas do MHC na superfície celular. As citocinas intensificam a expressão do MHC ao estimular a transcrição dos genes de classes I e II em uma ampla variedade de tipos celulares. Esses efeitos são mediados pela ligação de fatores de transcrição ativados por citocinas a sequências do DNA nas regiões promotoras dos genes do MHC. Vários fatores de transcrição podem ser montados, e esses fatores ligam-se a uma proteína denominada ativador da transcrição de classe II (CIITA), e todo o complexo liga-se ao promotor de classe II e promove uma transcrição eficiente. Ao manter o complexo de fatores de transcrição unido, o CIITA atua como um regulador mestre da expressão dos genes de classe II. O CIITA é sintetizado em resposta ao IFN-γ, o que explica como essa citocina aumenta a expressão das moléculas do MHC da classe II. Foram identificadas mutações em vários desses fatores de transcrição como causa de doenças por imunodeficiência humana associadas à expressão deficiente das moléculas do MHC. Dentre elas, a doença mais bem estudada é a síndrome do linfócito nu (Cap. 20). Os camundongos knockout que carecem do CIITA também exibem uma redução ou ausência de expressão da classe II nas células dendríticas e nos linfócitos B e uma incapacidade do IFN-γ de induzir a classe II em todos os tipos celulares.
A expressão de muitas das proteínas envolvidas no processamento e na apresentação de antígenos é regulada de modo coordenado. Por exemplo, o IFN-γ aumenta a transcrição não apenas dos genes das classes I e II, mas também de vários genes cujos produtos são necessários para a montagem do MHC de classe I e a apresentação de peptídeos, como genes que codificam o transportador TAP e algumas das subunidades de proteassomas, conforme discutido adiante neste capítulo.
Moléculas do MHC
Os estudos bioquímicos das moléculas do MHC culminaram na descrição das estruturas cristalinas das porções extracelulares das moléculas de classes I e II humanas. Posteriormente, muitas moléculas do MHC ligadas a peptídeos foram cristalizadas e analisadas de modo detalhado. Esse conhecimento foi extremamente proveitoso e, por causa dele, foi possível entender como as moléculas do MHC apresentam peptídeos. Nesta seção, resumiremos em primeiro lugar as características bioquímicas funcionalmente importantes que são comuns às moléculas do MHC de classes I e II. Em seguida, iremos descrever as estruturas das proteínas das classes I e II, assinalando as suas semelhanças e diferenças importantes (Tabela 6-4).
TABELA 6-4 Características das Moléculas do MHC de Classes I e II
| Característica | MHC de Classe I | MHC de Classe II |
|---|---|---|
| Cadeias polipeptídicas | α e β | |
| Localizações dos resíduos polimórficos | Domínios α1 e α2 | Domínios α1 e β1 |
| Sítio de ligação do correceptor da célula T | Ligação de CD8 à região α3 | Ligação de CD4 à região β2 |
| Local da fenda de ligação de peptídeos | Acomoda peptídeos de 8 a 11 resíduos | Acomoda peptídeos de 10 a 30 resíduos ou mais |
| Nomenclatura | ||
| Humano | HLA-A, HLA-B, HLA-C | HLA-DR, HLA-DQ, HLA-DP |
| Camundongo | H-2K, H-2D, H-2L | I-A, I-E |
Propriedades Gerais das Moléculas do MHC
Todas as moléculas do MHC compartilham certas características estruturais, que são críticas para a sua função na apresentação de peptídeos e no reconhecimento de antígenos pelos linfócitos.
• Cada molécula do MHC consiste em uma fenda ou sulco de ligação de peptídeo extracelular, seguida de domínios semelhantes à imunoglobulina (Ig) e domínios transmembrana e citoplasmático. As moléculas de classe I são compostas de uma cadeia polipeptídica codificada nos loci MHC e de uma segunda cadeia que não é codificada pelos loci MHC, enquanto as moléculas de classe II são compostas de duas cadeias polipeptídicas codificadas pelos loci MHC. Apesar dessa diferença, as estruturas tridimensionais globais das moléculas de ambas as classes são semelhantes.
• Os resíduos de aminoácidos polimórficos das moléculas do MHC estão localizados na fenda de ligação aos peptídeos e adjacentes a ela. Essa fenda é formada pelo enovelamento da porção aminoterminal das proteínas codificadas pelo MHC e é composta de um par de hélices α que repousam sobre uma base constituída de uma lâmina β-pregueada de oito fitas. Os resíduos polimórficos, que correspondem aos aminoácidos que variam entre diferentes alelos do MHC, estão localizados dentro e ao redor dessa fenda. Essa porção da molécula do MHC liga-se a peptídeos para apresentá-los às células T, e os receptores de antígenos das células interagem com o peptídeo apresentado e com as hélices α das moléculas do MHC (Fig. 6-1). Devido à variabilidade dos aminoácidos nessa região, as diferentes moléculas do MHC ligam-se e apresentam diferentes peptídeos, que são reconhecidos especificamente pelos receptores de antígenos de diferentes células T.
• Os domínios não polimórficos semelhantes à Ig das moléculas do MHC contêm sítios de ligação para as moléculas CD4 e CD8 das células T. As moléculas CD4 e CD8 são expressas em subpopulações distintas de linfócitos T maduros e participam, juntamente com os receptores de antígenos, no reconhecimento indireto dos antígenos: isto é, as moléculas CD4 e CD8 são “correceptores” das células T (Cap. 7). A molécula CD4 liga-se seletivamente a moléculas do MHC de classe II, enquanto a CD8 liga-se a moléculas de classe I. Esta é a razão pela qual as células T CD4+auxiliares reconhecem moléculas do MHC da classe II que apresentam peptídeos, enquanto as células T CD8+ reconhecem moléculas do MHC da classe I com peptídeos ligados. Dito de outra forma, as células T CD4+ são restritas ao MHC de classe II, enquanto as células T CD8+ são restritas ao MHC de classe I.
Moléculas do MHC de Classe I
As moléculas de classe I consistem em duas cadeias polipeptídicas ligadas de modo não covalente: uma cadeia α de 44 a 47 kD codificada pelos loci MHC (ou cadeia pesada) e uma subunidade de 12 kD não codificada pelos loci MHC, denominada β2-microglobulina (Fig. 6-10). Cada cadeia α está orientada de tal modo que cerca de três quartos do polipeptídeo completo estendem-se no meio extracelular, um pequeno segmento hidrofóbico atravessa a membrana celular, e os resíduos carboxil-terminais estão localizados no citoplasma. Os segmentos α1 e α2 aminoterminais (N-terminais) da cadeia α, constituídos, cada um, de aproximadamente 90 resíduos de comprimento, interagem para formar uma plataforma de lâmina β-pregueada antiparalela contendo oito fitas que sustentam duas fitas paralelas de hélice α. Isso forma a fenda de ligação de peptídeos das moléculas de classe I. Seu tamanho é grande o suficiente (∼25 Å × 10 Å × 11 Å) para ligar peptídeos de 8 a 11 aminoácidos em uma conformação estendida e flexível. As extremidades da fenda de ligação de peptídeos das moléculas de classe I são fechadas, de modo que não pode haver acomodação de peptídeos maiores. Por conseguinte, as proteínas globulares nativas precisam ser “processadas” para gerar fragmentos pequenos o suficiente para ligar-se às moléculas do MHC e serem reconhecidas pelas células T (descritas mais adiante). Os resíduos polimórficos das moléculas de classe I estão confinados aos domínios α1 e α2, onde contribuem para as variações entre diferentes alelos de classe I na ligação de peptídeos e no reconhecimento pelas células T (Fig. 6-11). O segmento α3 da cadeia α se dobra para formar um domínio de Ig, cuja sequência de aminoácidos é conservada em todas as moléculas de classe I. Esse segmento contém o sítio de ligação para a molécula CD8. Na extremidade carboxil-terminal do segmento α3, existe uma extensão de aproximadamente 25 aminoácidos hidrofóbicos, que atravessam a dupla camada lipídica da membrana plasmática. Imediatamente depois, são encontrados cerca de 30 resíduos localizados no citoplasma, que incluem um agrupamento de aminoácidos básicos que interagem com grupos de extremidade de fosfolipídeos do folheto interno da dupla camada lipídica e que ancoram a molécula do MHC na membrana plasmática.
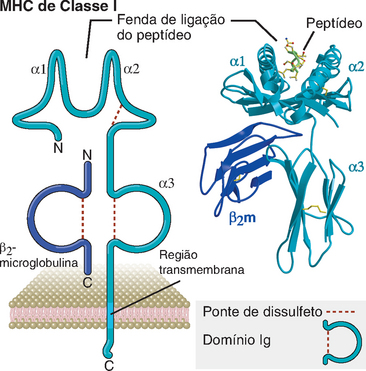
FIGURA 6-10 Estrutura de uma molécula do MHC de classe I. O diagrama esquemático (à esquerda) ilustra as diferentes regiões da molécula do MHC (não desenhado na escala). As moléculas de classe I são compostas de uma cadeia α polimórfica ligada de modo não covalente à β2-microglobulina (β2m) não polimórfica. A cadeia α é glicosilada; os resíduos de carboidratos não são mostrados. O diagrama em formato de fita (à direita) mostra a estrutura da porção extracelular da molécula HLA-B27 ligada a um peptídeo, conforme demonstrado por cristalografia por raios X.
(Cortesia de Dr. P. Bjorkman, California Institute of Technology, Pasadena.)
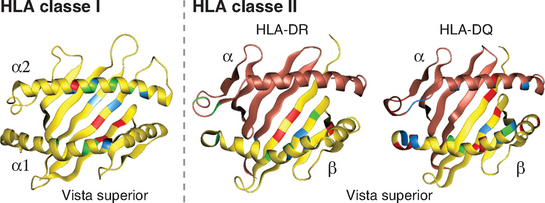
FIGURA 6-11 Resíduos polimórficos das moléculas do MHC. Os resíduos polimórficos das moléculas do MHC de classes I e II estão localizados nas fendas de ligação de peptídeos e nas hélices α ao redor das fendas. As regiões de maior variabilidade entre diferentes alelos HLA estão indicadas em vermelho, as de variabilidade intermediária, em verde, e as de menor variabilidade, em azul.
(Reproduzido com permissão de Margulies DH, K Natarajan, J Rossjohn e J McCluskey. Major histocompatibility complex [MH] molecules: structure, function, and genetics. In WE Paul [ed]: Fundamental Immunology, 6th ed. Lippincott Williams & Wilkins, Philadelphia, 2008.)
A β2-microglobulina, a cadeia leve das moléculas de classe I, é codificada por um gene fora dos loci MHC e seu nome deriva de sua mobilidade eletroforética (β2), tamanho (micro) e solubilidade (globulina). A β2-microglobulina interage de modo não covalente com o domínio α3 da cadeia α. À semelhança do segmento α3, a β2-microglobulina é estruturalmente homóloga a um domínio de Ig e é constante entre todas as moléculas de classe I.
A molécula de classe I totalmente montada é um heterotrímero, que consiste em uma cadeia α, β2-microglobulina e um peptídeo antigênico ligado; a expressão estável das moléculas de classe I na superfície celular exige a presença de todos os três componentes do heterotrímero. A razão disso é que a interação da cadeia α com a β2-microglobulina é estabilizada pela ligação de antígenos peptídicos à fenda formada pelos segmentos α1 e α2; por sua vez, a ligação do peptídeo é fortalecida pela interação da β2-microglobulina com a cadeia α. Como os peptídeos antigênicos são necessários para estabilizar as moléculas do MHC, apenas as moléculas do MHC carregadas de peptídeos potencialmente úteis são expressas na superfície celular.
Os indivíduos são, em sua maioria, heterozigotos para os genes do MHC e, portanto, expressam seis moléculas diferentes de classe I em cada célula, contendo cadeias α codificadas pelos dois alelos herdados (pai e mãe) dos genes HLA-A, HLA-B e HLA-C.
Moléculas do MHC de Classe II
As moléculas do MHC de classe II são compostas de duas cadeias polipeptídicas associadas de forma não covalente, uma cadeia α de 32 a 34 kD e uma cadeia β de 29 a 32 kD (Fig. 6-12). Diferentemente das moléculas de classe I, os genes que codificam ambas as cadeias das moléculas de classe II são polimórficos e estão presentes no lócus do MHC II.
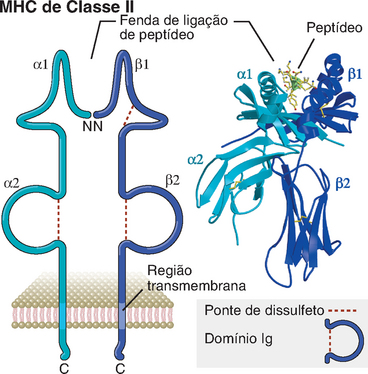
FIGURA 6-12 Estrutura de uma molécula do MHC de classe II. O diagrama esquemático (à esquerda) ilustra as diferentes regiões da molécula do MHC (não desenhada em escala). As moléculas de classe II são compostas de uma cadeia α polimórfica ligada de modo não covalente a uma cadeia β polimórfica. Ambas as cadeias são glicosiladas; os resíduos de carboidratos não estão representados. O diagrama em forma de fita (à direita) mostra a estrutura da porção extracelular da molécula HLA-DR1 com um peptídeo ligado, conforme demonstrado por cristalografia por raio X.
(Cortesia de Dr. P. Bjorkman, California Institute of Technology, Pasadena.)
Os segmentos α1 e β1 aminoterminais das cadeias de classe II interagem para formar a fenda de ligação de peptídeos, que é estruturalmente semelhante à fenda das moléculas de classe I. Quatro fitas no assoalho da fenda e uma fita das paredes α-helicoidais são formadas pelo segmento α1, enquanto as outras quatro fitas do assoalho e da segunda parede são formadas pelo segmento β1. Os resíduos polimórficos estão localizados nos segmentos α1 e β1, dentro e ao redor da fenda de ligação de peptídeos, como nas moléculas de classe I (Fig. 6-11). Nas moléculas de classe II dos seres humanos, a maior parte do polimorfismo está na cadeia β. Nas moléculas de classe II, as extremidades da fenda de ligação de peptídeos estão abertas, permitindo a ligação de peptídeos de 30 ou mais resíduos.
Os segmentos α2 e β2 das moléculas de classe II, à semelhança do segmento α3 e da β2-microglobulina de classe I, enovelam-se em domínios de Ig e não são polimórficos, isto é, não variam entre alelos de um determinado gene de classe II. O segmento β2 das moléculas de classe II contém o sítio de ligação de CD4, semelhante ao sítio de ligação de CD8 no segmento α3 da cadeia pesada de classe I. Em geral, as cadeias α de um lócus do MHC de classe II (p. ex., DR) emparelham-se mais frequentemente com cadeias β do mesmo lócus e, menos comumente, com cadeias β de outros loci (p. ex., DQ, DP). As extremidades carboxil-terminais dos segmentos α2 e β2 continuam-se em regiões de conexão curta, seguidas de extensões de aproximadamente 25 aminoácidos de resíduos transmembrana hidrofóbicos. Em ambas as cadeias, as regiões transmembrana terminam em grupos de resíduos de aminoácidos básicos, seguidos de caudas citoplasmáticas hidrofílicas curtas.
A molécula de classe II totalmente montada é um heterotrímero que consiste em uma cadeia α, uma cadeia β e um peptídeo antigênico ligado; a expressão estável das moléculas de classe II na superfície celular requer a presença de todos os três componentes do heterotrímero. À semelhança das moléculas de classe I, isso assegura que as moléculas do MHC que terminam na superfície celular sejam aquelas que estão desempenhando a função normal de apresentação de peptídeos.
Os seres humanos herdam de cada um dos pais um gene DPA1 e um gene DPB1, que codificam, respectivamente, as cadeias α e β de uma molécula de HLA-DP; um gene DQA1 e um gene DQB1; e um gene DRA1, um gene DRB1 e um gene DRB duplicado separado, que pode codificar os alelos DRB3, 4 ou 5. Por conseguinte, cada indivíduo heterozigoto herda seis ou oito alelos do MHC de classe II, três ou quatro de cada progenitor (um conjunto de cada de DP e DQ, e um ou dois de DR). Tipicamente, não há muita recombinação entre genes de loci diferentes (i. e., DRα com DQβ, e assim por diante), e cada haplótipo tende a ser herdado como uma unidade isolada. Entretanto, como alguns haplótipos contêm loci DRB extras que produzem cadeias β que são montadas com DRα, e algumas moléculas DQα codificadas em um cromossomo podem associar-se a moléculas DQβ produzidas do outro cromossomo, o número total de moléculas de classe II expressas pode ser consideravelmente maior que seis.
Ligação dos Peptídeos às Moléculas do MHC
Com o reconhecimento de que a imunogenicidade das proteínas depende da capacidade de apresentação de seus peptídeos por moléculas do MHC, foram dedicados esforços consideráveis para elucidar a base molecular das interações peptídeo-MHC e as características dos peptídeos que possibilitam a sua ligação às moléculas do MHC. Esses estudos usaram ensaios funcionais de células T auxiliares e de CTL que respondem às APC incubadas com diferentes peptídeos, bem como em estudos de ligação diretos de moléculas do MHC purificadas com peptídeos marcados radioativamente ou fluorescentes em solução por métodos como a diálise de equilíbrio e a filtração em gel. A análise dos complexos peptídeo-MHC por cristalografia de raios X forneceu informações definitivas sobre o modo pelo qual os peptídeos ocupam as fendas das moléculas do MHC e sobre os resíduos de cada um que participa dessa ligação. Na seção seguinte, resumiremos as principais características das interações entre peptídeos e moléculas do MHC das classes I ou II.
Características das Interações Peptídeo-MHC
As moléculas do MHC exibem ampla especificidade para a ligação de peptídeos, em contraste com a especificidade fina do reconhecimento de antígenos pelos receptores de antígenos dos linfócitos. Existem várias características importantes nas interações entre moléculas do MHC e peptídeos antigênicos.
• Cada molécula do MHC de classe I ou classe II possui uma única fenda de ligação de peptídeo, que se liga a um peptídeo de cada vez; entretanto, cada molécula do MHC pode ligar-se a muitos peptídeos diferentes. Uma das primeiras linhas de evidências que sustentam essa conclusão foi o resultado experimental em que diferentes peptídeos que se ligam à mesma molécula do MHC podem inibir competitivamente a apresentação um do outro, implicando que existe apenas uma única fenda de ligação de peptídeo em cada molécula do MHC. A solução das estruturas cristalinas das moléculas do MHC das classes I e II confirmou a presença de uma única fenda de ligação de peptídeos nessas moléculas (Figs. 6-10 e 6-12). Não é surpreendente que uma única molécula do MHC possa ligar múltiplos peptídeos, visto que cada indivíduo contém apenas algumas moléculas diferentes do MHC (6 moléculas de classe I e mais de 10 a 20 moléculas de classe II em um indivíduo heterozigoto), e essas moléculas devem ser capazes de apresentar peptídeos provenientes do enorme número de antígeno proteicos aos quais um indivíduo é provavelmente exposto.
• Os peptídeos que se ligam às moléculas do MHC compartilham características estruturais que promovem essa interação. Uma dessas características é o tamanho do peptídeo — as moléculas de classe I podem acomodar peptídeos com comprimento de 8 a 11 resíduos, enquanto as moléculas de classe II ligam-se a peptídeos com 10 a 30 resíduos ou mais de comprimento, sendo o comprimento ótimo de 12 a 16 resíduos. Além disso, os peptídeos que se ligam a uma determinada forma alélica de uma molécula do MHC contêm resíduos de aminoácidos que permitem interações complementares entre os peptídeos e a molécula do MHC alélica. Os resíduos de um peptídeo que se ligam a moléculas do MHC são distintos daqueles que são reconhecidos pelas células T.
• As moléculas do MHC adquirem sua carga de peptídeos durante a biossíntese e montagem no interior das células. Por conseguinte, as moléculas do MHC exibem peptídeos derivados de micro-organismos que estão dentro das células do hospedeiro, e esta é a razão pela qual as células T restritas ao MHC reconhecem micro-organismos associados a células e são os mediadores da imunidade a micro-organismos intracelulares. É importante assinalar que as moléculas do MHC de classe I adquirem peptídeos de proteínas citosólicas, enquanto as moléculas de classe II adquirem peptídeos de proteínas em vesículas intracelulares. Os mecanismos e a importância desses processos são discutidos posteriormente, neste capítulo.
• A associação de peptídeos antigênicos com as moléculas do MHC é uma interação saturável, com velocidade de desligamento muito lenta. Em uma célula, várias chaperonas e enzimas facilitam a ligação dos peptídeos às moléculas do MHC (descritas mais adiante). Uma vez formados, os complexos de peptídeo-MHC são, em sua maioria, estáveis, e a cinética das constantes de dissociação são indicativas de meias-vidas longas, que variam de horas a muitos dias. Essa taxa de degradação extraordinariamente lenta da dissociação dos peptídeos das moléculas do MHC permite que, após uma molécula do MHC ter adquirido um peptídeo, ela apresentará esse peptídeo por um tempo longo o suficiente para maximizar a probabilidade de determinada célula T encontrar o peptídeo que ela reconhece, iniciando uma resposta.
• Um número muito pequeno de complexos de peptídeo-MHC é capaz de ativar linfócitos T específicos. Como as APC apresentam continuamente peptídeos derivados de todas as proteínas que elas encontram, apenas uma fração muito pequena dos complexos de peptídeo-MHC na superfície celular conterá o mesmo peptídeo. Foi estimado que apenas 100 complexos de determinado peptídeo com uma molécula do MHC de classe II na superfície de uma APC são capazes de iniciar uma resposta específica das células T. Isso representa menos de 0,1% do número total de moléculas de classe II provavelmente presentes na superfície da APC.
• As moléculas do MHC de um indivíduo não discriminam entre peptídeos estranhos (p. ex., aqueles derivados de proteínas microbianas) e peptídeos derivados das proteínas do indivíduo (antígenos próprios). Por conseguinte, as moléculas do MHC apresentam tanto peptídeos próprios quanto peptídeos estranhos, e as células T examinam esses peptídeos apresentados quanto à presença de antígenos estranhos. Com efeito, se os peptídeos normalmente apresentados pelas APC forem purificados, verifica-se que a maioria deriva de proteínas próprias. A incapacidade das moléculas do MHC de discriminar entre antígenos próprios e antígenos estranhos levanta duas questões. Em primeiro lugar, como uma célula T pode reconhecer e ser ativada por qualquer antígeno estranho se normalmente todas as APC exibem principalmente complexos de peptídeo próprio-MHC? Conforme assinalado anteriormente, a resposta é que as células T são notavelmente sensíveis e, para serem ativadas, precisam reconhecer especificamente um número muito pequeno de complexos de peptídeo-MHC. Consequentemente, um antígeno recém-introduzido pode ser processado em peptídeos que carregam moléculas do MHC da APC em número suficiente para ativar células T específicas para este antígeno, embora a maioria das moléculas do MHC esteja ocupada por peptídeos próprios. Em segundo lugar, se o indivíduo processa suas próprias proteínas e as apresenta em associação com suas próprias moléculas do MHC, por que normalmente não desenvolvemos respostas imunes contra as proteínas próprias? A resposta a essa pergunta é que os complexos de peptídeo próprio-MHC são formados, mas não induzem autoimunidade, visto que as células T específicas para esses complexos são eliminadas ou inativadas. Por conseguinte, as células T normalmente não podem responder a antígenos próprios (Cap. 14).
Base Estrutural da Ligação de Peptídeos às Moléculas do MHC
A ligação de peptídeos às moléculas do MHC é uma interação não covalente mediada por resíduos tanto nos peptídeos quanto nas fendas das moléculas do MHC. Como veremos adiante, os antígenos proteicos são clivados proteoliticamente nas APC, gerando os peptídeos que serão ligados e apresentados pelas moléculas do MHC. Esses peptídeos ligam-se às fendas das moléculas do MHC em uma conformação estendida. Uma vez ligados, os peptídeos e suas moléculas de água associadas ocupam as fendas, estabelecendo contatos extensos com os resíduos de aminoácidos que formam as fitas β-pregueadas do assoalho e as hélices α das paredes da fenda (Fig. 6-13). No caso das moléculas do MHC de classe I, a associação de um peptídeo ao sulco do MHC depende da ligação da extremidade N-terminal de carga positiva e da extremidade C-terminal de carga negativa do peptídeo à molécula do MHC por interações eletrostáticas. Na maioria das moléculas do MHC, as fitas β do assoalho da fenda contêm “bolsas”. Muitas moléculas de classe I possuem uma bolsa hidrofóbica, que reconhece um dos seguintes aminoácidos hidrofóbicos — valina, isoleucina, leucina ou metionina — na extremidade C-terminal do peptídeo. Algumas moléculas de classe I têm predileção por um resíduo básico (lisina ou arginina) na extremidade C-terminal. Além disso, outros resíduos de aminoácidos de um peptídeo podem conter cadeias laterais que se encaixam em bolsas específicas e ligam-se a aminoácidos complementares na molécula do MHC através de interações eletrostáticas (pontes de sal com carga), ligação de hidrogênio ou interações de van der Waals. Esses resíduos do peptídeo são denominados resíduos âncora, visto que contribuem principalmente com a maior parte das interações favoráveis da ligação (i. e., eles ancoram o peptídeo na fenda da molécula do MHC). Cada peptídeo ligado ao MHC habitualmente contém apenas um ou dois resíduos de âncora, e isso presumivelmente permite uma maior variabilidade nos outros resíduos do peptídeo, que são os resíduos reconhecidos por células T específicas. No caso de alguns peptídeos que se ligam às moléculas do MHC, particularmente moléculas de classe II, as interações específicas dos peptídeos com os lados helicoidais α da fenda do MHC também contribuem para a ligação do peptídeo através da formação de pontes de hidrogênio ou interações com cargas. As moléculas do MHC de classe II acomodam peptídeos maiores do que as moléculas de classe I. Esses peptídeos mais longos estendem-se em ambas as extremidades além do assoalho do sulco.
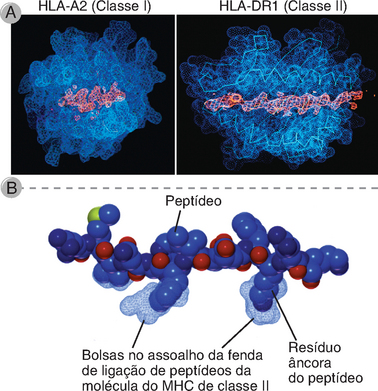
FIGURA 6-13 Ligação de peptídeo às moléculas do MHC. A, Essas duas vistas superiores da estrutura cristalina das moléculas do MHC mostram como os peptídeos ficam localizados nas fendas de ligação de peptídeos. A molécula de classe I mostrada é a HLA-A2, e a molécula de classe II é a HLA-DR1. A fenda da molécula de classe I está fechada, enquanto a da molécula da classe II está aberta. Em consequência, as moléculas de classe II acomodam peptídeos mais longos do que as moléculas de classe I. B, A vista lateral de um corte de um peptídeo ligado a uma molécula do MHC de classe II mostra como os resíduos do peptídeo servem de âncora para prendê-lo nas bolsas da fenda da molécula do MHC.
A, (Reimpresso com permissão de Macmillian Publishers Ltd. de Bjorkman PJ, MA Saper, B Samraoui, WS Bennett, JL Strominger, e DC Wiley. Structure of the human class I histocompatibility antigen HLA-A2. Nature 329:506-512, 1987; e Brown J, TS Jardetzky, JC Gorga, LJ Stern, RG Urban, JL Strominger, e DC Wiley. Three-dimensional structure of the human class II histocompatibility antigen HLA-DR1. Nature 364:33-39, 1993.) B, (De Scott CA, PA Peterson, L Teyton, e IA Wilson. Crystal structures of two I-Ad-peptide complexes reveal that high affinity can be achieved without large anchor residues. Immunity 8:319-329, 1998. Copyright 1998, com autorização de Elsevier Science.)
Como muitos dos resíduos dentro e ao redor da fenda de ligação de peptídeos das moléculas do MHC são polimórficos (i. e., diferem entre vários alelos do MHC), diferentes alelos favorecem a ligação de diferentes peptídeos. Esta é a base estrutural da função dos genes do MHC como “genes da resposta imune”; somente os animais que expressam alelos do MHC capazes de ligar-se a determinado peptídeo e apresentá-lo às células T podem responder àquele peptídeo.
Os receptores de antígenos das células T reconhecem tanto o peptídeo antigênico quanto as moléculas do MHC, sendo o peptídeo responsável pela especificidade fina do reconhecimento do antígeno, enquanto os resíduos do MHC são responsáveis pela restrição das células T ao MHC. Uma parte do peptídeo ligado é exposta na parte superior aberta da fenda da molécula do MHC, e as cadeias laterais de aminoácidos dessa porção do peptídeo são reconhecidas pelos receptores de antígenos de células T específicas. O mesmo receptor de células T também interage com resíduos polimórficos das hélices α da própria molécula do MHC (Fig. 6-1). Previsivelmente, as variações no antígeno peptídico ou na fenda de ligação de peptídeos da molécula do MHC alterarão a apresentação daquele peptídeo ou o seu reconhecimento pelas células T. Com efeito, pode-se aumentar a imunogenicidade de um peptídeo ao incorporar um resíduo que fortalece a ligação do antígeno às moléculas do MHC comumente herdadas em uma população.
Como as moléculas do MHC podem ligar apenas peptídeos, e a maioria dos antígenos consiste em grandes proteínas, devem existir maneiras pelas quais essas proteínas são convertidas em peptídeos. Essa conversão, que é denominada processamento do antígeno, constitui o foco do restante deste capítulo.
PROCESSAMENTO DOS ANTÍGENOS PROTEICOS
As vias de processamento do antígeno convertem os antígenos proteicos presentes no citosol ou internalizados do meio extracelular em peptídeos que são transportados até as moléculas do MHC para apresentação aos linfócitos T (Fig. 6-14). Os mecanismos de processamento do antígeno destinam-se a gerar peptídeos que possuem as características estruturais necessárias para a sua associação às moléculas do MHC e para transportar esses peptídeos até o local onde as moléculas do MHC com fendas de ligação de peptídeo estão disponíveis. A ligação do peptídeo às moléculas do MHC ocorre antes da expressão desta na superfície celular e constitui um componente integral da biossíntese e montagem das moléculas do MHC. De fato, conforme assinalado anteriormente, a associação do peptídeo é necessária para a montagem estável e a expressão superficial das moléculas do MHC de classes I e II.
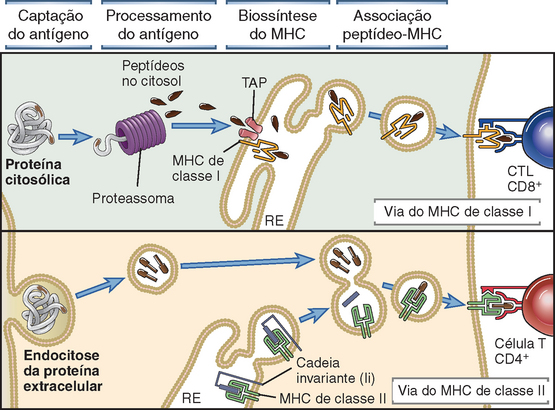
FIGURA 6-14 Vias de processamento e apresentação do antígeno. Na via do MHC de classe I (painel superior), os antígenos proteicos no citosol são processados por proteassomas, e os peptídeos são transportados até o retículo endoplasmático (RE), onde se ligam a moléculas do MHC de classe I. Na via do MHC de classe II (painel inferior), os antígenos proteicos extracelulares sofrem endocitose em vesículas, onde os antígenos são processados, e os peptídeos ligam-se a moléculas do MHC de classe II. Os detalhes dessas vias de processamento estão nas Figuras 6-16 e 6-17.
Os antígenos proteicos que estão presentes no citosol (habitualmente sintetizado na célula) geram peptídeos associados à classe I, que são reconhecidos pelas células T CD8+, enquanto os antígenos internalizados do meio extracelular para dentro das vesículas das APC geram peptídeos que são apresentados por moléculas do MHC de classe II e reconhecidos pelas células T CD4+. Os diferentes destinos dos antígenos citosólicos e vesiculares são devidos às vias segregadas de biossíntese e de montagem das moléculas do MHC de classes I e II (Fig. 6-14 e Tabela 6-5). Essa diferença fundamental entre antígenos citosólicos e vesiculares foi demonstrada experimentalmente pela análise da apresentação do mesmo antígeno introduzido de diferentes maneiras nas APC (Fig. 6-15). Se um antígeno proteico for introduzido no citoplasma das APC como produto de um gene transfectado (modificado, de tal modo que o seu produto proteico não possa entrar na via secretória) ou introduzido diretamente no citoplasma das APC por choque osmótico, ele é apresentado na forma de peptídeos associados à classe I, que são reconhecidos pelas células T CD8+. Por sua vez, se a mesma proteína for adicionada na forma solúvel às APC e sofrer endocitose para dentro das vesículas dessas APC, ela é subsequentemente apresentada como peptídeos associados à classe II e reconhecida por células T CD4+ específicas de antígenos.
TABELA 6-5 Características Comparativas das Vias de Processamento e Apresentação do Antígeno do MHC de Classe I e Classe II
| Característica | Via do MHC de Classe I | Via do MHC de Classe II |
|---|---|---|
| Composição do complexo peptídeo- MHC estável | Cadeia α polimórfica, β-microglobulina, peptídeo | Cadeias α e β polimórficas, peptídeo |
 |
 |
|
| Tipos de APC | Todas as células nucleadas | Células dendríticas, fagócitos mononucleares, linfócitos B; células endoteliais, epitélio do timo |
| Células T responsivas | Células T CD8+ | Células T CD4+ |
| Fonte de antígenos proteicos | Proteínas citosólicas (principalmente sintetizadas na célula; podem entrar no citosol pelos fagossomas) | Proteínas endossômicas e lisossômicas (principalmente internalizadas do meio extracelular) |
| Enzimas responsáveis pelo carregamento de peptídeos do MHC | Proteassoma citosólico | Proteases endossômicas e lisossômicas (p. ex., catepsinas) |
| Local de encaixe de peptídeos ao MHC | Retículo endoplasmático | Compartimento vesicular especializado |
| Moléculas envolvidas no transporte de peptídeos e disponíveis para as moléculas do MHC | Chaperonas, TAP no RE | Chaperonas no RE; cadeia invariante no RE, Golgi e MIIC/CIIV; DM |
APC, célula apresentadora de antígenos; CIIV, vesícula de classe II; RE, retículo endoplasmático; MHC, complexo principal de histocompatibilidade; MIIC, compartimento do MHC de classe II; TAP, transportador associado ao processamento de antígenos.
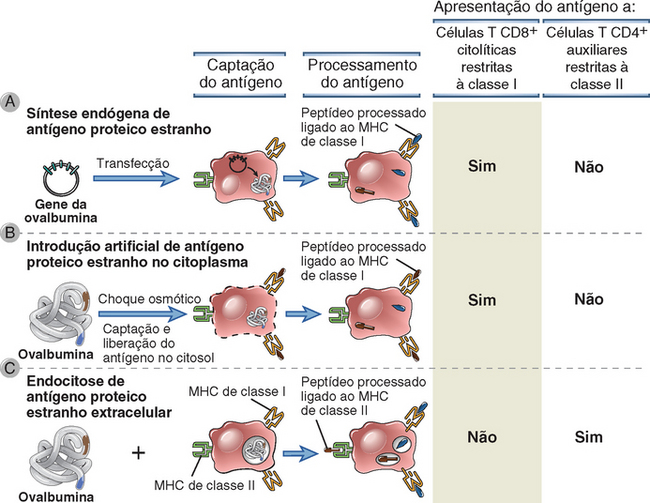
FIGURA 6-15 Demonstração experimental da apresentação dos antígenos citosólicos e extracelulares. Quando um antígeno proteico clássico, a ovalbumina, é sintetizado no meio intracelular como resultado de transfecção de seu gene modificado para a ausência de sequências de sinais N-terminais (A), ou quando é introduzido no citoplasma através de membranas que se tornaram permeáveis por choque osmótico (B), os peptídeos derivados da ovalbumina são apresentados em associação com moléculas do MHC de classe I. Quando a ovalbumina é adicionada como antígeno extracelular a uma APC que expressa moléculas do MHC de ambas as classes, I e II, os peptídeos derivados da ovalbumina são apresentados apenas em associação com moléculas de classe II (C). A resposta medida dos CTL restritos à classe I consiste na eliminação das APC, e a resposta medida das células T auxiliares restritas à classe II consiste na secreção de citocinas.
Descreveremos em primeiro lugar essas duas vias de processamento do antígeno e, em seguida, a sua importância funcional.
Via do MHC de Classe I para Processamento e Apresentação das Proteínas Citosólicas
Os peptídeos associados ao MHC de classe I são produzidos pela degradação proteolítica das proteínas citosólicas e são, em seguida, transportados para o retículo endoplasmático (RE) e ligados às moléculas de classe I recém-sintetizadas. Essa sequência de eventos está ilustrada na Figura 6-16, e as etapas individuais são descritas a seguir.
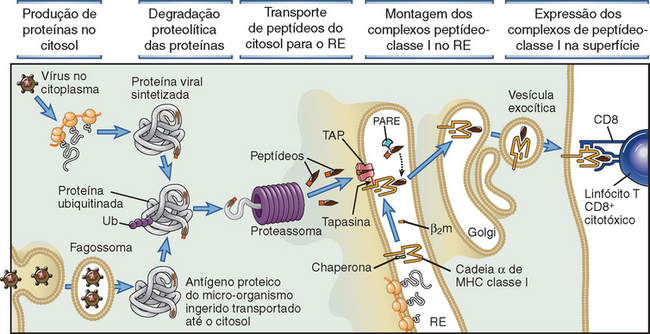
FIGURA 6-16 A via de apresentação de antígenos do MHC de classe I. Os estágios no processamento das proteínas citosólicas são descritos no texto. PARE, peptidase associada ao retículo endoplasmático; RE, retículo endoplasmático; β2m, β2-microglobulina; TAP, transportador associado ao processamento de antígeno; Ub, ubiquitina.
Fontes de Antígenos Proteicos Citosólicos
Os antígenos proteicos citosólicos são sintetizados, em sua maioria, dentro das células, e alguns deles são fagocitados e transportados para o citosol. Os antígenos estranhos no citosol podem ser produtos de vírus ou de outros micro-organismos intracelulares que infectam essas células. Nas células tumorais, vários genes que sofreram mutação ou hiperexpressão podem produzir antígenos proteicos que são reconhecidos por CTL restritos à classe I (Cap. 17). Os peptídeos que são apresentados em associação a moléculas de classe I também podem derivar de micro-organismos e outros antígenos particulados que são internalizados em fagossomos, mas que escapam para o citosol. Alguns micro-organismos são capazes de lesionar as membranas dos fagossomos e criar poros através dos quais eles e seus antígenos escapam para o citosol. Por exemplo, as cepas patogênicas de Listeria monocytogenes produzem uma proteína, denominada listeriolisina, que permite o escape das bactérias das vesículas para o citosol. (Esse escape constitui um mecanismo que as bactérias podem ter desenvolvido para resistir à destruição pelos mecanismos microbicidas dos fagócitos, cuja maior parte está concentrada em fagolisossomos.) Uma vez no citosol, os antígenos dos micro-organismos fagocitados são processados como outros antígenos citosólicos. Nas células dendríticas, alguns antígenos que são ingeridos dentro de vesículas entram na via da classe I citosólica, no processo denominado apresentação cruzada, que é descrita mais adiante. Outras fontes importantes de peptídeos no citosol são proteínas enoveladas incorretamente no RE, que são translocadas para o citosol e degradadas como outras proteínas citosólicas; esse processo é denominado degradação associado ao RE.
Digestão Proteolítica de Proteínas Citosólicas
O principal mecanismo para a geração de peptídeos de antígenos proteicos citosólicos consiste em proteólise pelo proteassoma. Os proteassomas são grandes complexos enzimáticos multiproteicos, com ampla variedade de atividade proteolítica, que são encontrados no citoplasma e nos núcleos da maioria das células. O proteassoma aparece como um cilindro composto de uma série empilhada de dois anéis β internos e dois anéis α externos, sendo cada anel constituído de sete subunidades, com uma estrutura semelhante a um capuz em ambas as extremidades do cilindro. As proteínas nos anéis α externos são estruturais e carecem de atividade proteolítica; nos anéis β internos, três das sete subunidades (β1, β2 e β5) constituem os sítios catalíticos para proteólise.
O proteassoma desempenha uma função de manutenção básica nas células através da degradação de numerosas proteínas danificadas ou inadequadamente enoveladas. A síntese proteica ocorre normalmente em uma velocidade rápida, com incorporação de cerca de seis a oito resíduos de aminoácidos a cada segundo no processo de alongamento das cadeias. O processo está sujeito a erro, e estima-se que cerca de 20% das proteínas recém-sintetizadas não estejam adequadamente enoveladas. Esses produtos ribossômicos defeituosos, bem como proteínas inúteis mais velhas, constituem alvos de degradação proteassômica através da ligação covalente de várias cópias de um pequeno polipeptídeo, denominado ubiquitina. As proteínas ubiquitinadas, com cadeias de quatro ou mais ubiquitinas, são reconhecidas pelo capuz do proteassoma e, em seguida, desdobradas, a ubiquitina é removida, e as proteínas são “estendidas em fio” através dos proteassomas, onde são degradadas em peptídeos. O proteassoma possui ampla especificidade de substrato e pode gerar uma ampla variedade de peptídeos das proteínas citosólicas (todavia, em geral, ele não degrada as proteínas totalmente em aminoácidos). É interessante assinalar que, em células tratadas com a citocina IFN-γ, ocorre aumento na transcrição e síntese de três novas subunidades catalíticas do proteassoma, conhecidas como β1i, β2i e β5i, que substituem as três subunidades catalíticas do anel β do proteassoma. Isso resulta em uma mudança de especificidade de substrato do proteassoma, de modo que os peptídeos produzidos contêm habitualmente aminoácidos hidrofóbicos carboxil-terminais, como leucina, valina, isoleucina e metionina, ou resíduos básicos, como lisina ou arginina. Esses tipos de extremidades C-terminais são típicos de peptídeos que são transportados na via de classe I e que se ligam a moléculas de classe I. Trata-se de um mecanismo pelo qual IFN-γ aumenta a apresentação de antígenos, enquanto outro mecanismo consiste no aumento na expressão de moléculas do MHC (Fig. 6-9). Por conseguinte, os proteassomas são excelentes exemplos de organelas cuja função celular básica foi adaptada para um papel especializado na apresentação de antígenos.
Alguns antígenos proteicos aparentemente não necessitam de ubiquitinação nem de proteassomas para a sua apresentação pela via do MHC de classe I e, presumivelmente, são degradados por proteases citosólicas. Além disso, as sequências de sinais das proteínas direcionadas para a membrana e proteínas destinadas a serem secretadas são habitualmente clivadas por peptidase de sinal e degradadas proteoliticamente logo após a sua síntese e translocação para o RE. Esse processamento do RE gera peptídeos de ligação de classe I sem a necessidade de proteólise no citosol.
Transporte de Peptídeos do Citosol para o Retículo Endoplasmático
Os peptídeos gerados no citosol são translocados por um transportador especializado para o RE, onde moléculas do MHC de classe I recém-sintetizadas estão disponíveis para a ligação dos peptídeos. Como os peptídeos antigênicos destinados a se ligarem às moléculas da classe I são gerados no citosol mas as moléculas do MHC de classe I são sintetizadas no RE, é necessário um mecanismo para o transporte dos peptídeos citosólicos para dentro do RE. Esse transporte é mediado por uma proteína dimérica, denominada transportador associado ao processamento de antígeno (TAP), que é homóloga à família do transportador ABC de proteínas que medeiam o transporte de compostos de baixo peso molecular dependente de ATP através das membranas celulares. A proteína TAP localiza-se na membrana do RE, onde medeia o transporte ativo dependente de ATP de peptídeos do citosol para dentro da luz do RE. Embora o heterodímero de TAP tenha uma ampla gama de especificidades, ele transporta melhor peptídeos cujo comprimento varia de 8 a 16 aminoácidos e que contêm extremidades carboxil-terminais básicas (nos seres humanos) ou hidrofóbicas (nos seres humanos e em camundongos). Conforme assinalado anteriormente, trata-se das características dos peptídeos que são gerados no proteassoma e são capazes de ligar-se às moléculas do MHC de classe I.
No lado luminal da membrana do RE, a proteína TAP associa-se a uma proteína denominada tapasina, que também possui afinidade por moléculas do MHC de classe I recém-sintetizadas e não ocupadas (com as fendas vazias). Por conseguinte, a tapasina faz com que o transportador TAP forme um complexo com as moléculas do MHC de classe I que estão aguardando a chegada de peptídeos.
Montagem dos Complexos Peptídeo-MHC de Classe I no Retículo Endoplasmático
Os peptídeos translocados para dentro do RE ligam-se a moléculas do MHC de classe I que estão associadas ao dímero TAP através da tapasina. A síntese e a montagem das células de classe I envolvem um processo de múltiplas etapas, em que a ligação do peptídeo desempenha um papel-chave. As cadeias α de classe I e a β2-microglobulina são sintetizadas no RE. O enovelamento apropriado das cadeias α nascentes é auxiliado por proteínas chaperonas, como a chaperona de membrana calnexina e a chaperona luminal calreticulina. No interior do RE, os dímeros de classe I recém-formados e não ocupados permanecem ligados ao complexo TAP. As moléculas do MHC de classe I não ocupadas, a tapasina e o TAP fazem parte de um complexo maior de carregamento de peptídeo no RE, que também inclui a calnexina, a calreticulina e a oxidorredutase Erp57, todas as quais contribuem para a montagem e o carregamento das moléculas de classe I. Os peptídeos que entram no RE através do TAP e aqueles produzidos no RE, como peptídeos de sinal, frequentemente são reduzidos ao tamanho apropriado para ligação ao MHC pela aminopeptidase residente no RE, PARE. O peptídeo é então capaz de se ligar à fenda da molécula de classe I adjacente. Uma vez carregadas com o peptídeo, as moléculas do MHC de classe I deixam de ter afinidade pela tapasina, de modo que o complexo peptídeo-classe I é liberado da tapasina e pode sair do RE e ser transportado até a superfície da célula. Na ausência de peptídeo ligado, muitos dos dímeros de cadeia α-β2 microglobulina recém-formados são instáveis e não podem ser transportados eficientemente do RE para o Golgi. Esses complexos do MHC de classe I não ocupados e inadequadamente enovelados são transportados para o citosol e degradados em proteassomas.
Os peptídeos transportados para dentro do RE ligam-se preferencialmente a moléculas do MHC de classe I, mas não de classe II, por dois motivos. Em primeiro lugar, as moléculas de classe I recém-sintetizadas estão fixadas na face luminal do complexo TAP e capturam peptídeos rapidamente, à medida que estes são transportados para dentro do RE pelo TAP. Em segundo lugar, conforme discutido adiante, no RE, as fendas de ligação de peptídeos das moléculas de classe II recém-sintetizadas são bloqueadas pela Ii associada.
Expressão dos Complexos Peptídeo-MHC de Classe I na Superfície
As moléculas do MHC de classe I com peptídeos ligados são estruturalmente estáveis e são expressas na superfície celular. Os complexos de peptídeo-MHC de classe I estáveis que foram produzidos no RE movem-se através do complexo de Golgi e são transportados até a superfície da célula por vesículas exocíticas. Uma vez expressos na superfície celular, os complexos de peptídeo-classe I podem ser reconhecidos por células T CD8+ específicas de antígenos peptídicos, enquanto o correceptor CD8 desempenha um papel essencial através de sua ligação a regiões não polimórficas da molécula de classe I. Em capítulos posteriores, voltaremos a discutir o papel dos CTL restritos à classe I na imunidade protetora. Diversos vírus desenvolveram mecanismos que interferem na montagem e acoplamento de peptídeos às moléculas de classe I, ressaltando a importância dessa via na imunidade antiviral (Cap. 15).
Via do MHC de Classe II para Processamento e Apresentação de Proteínas Vesiculares
A geração de peptídeos associados ao MHC de classe II de antígenos endocitosados envolve a degradação proteolítica das proteínas internalizadas em vesículas endocíticas e a ligação de peptídeos a moléculas do MHC de classe II nessas vesículas. Essa sequência de eventos está ilustrada na Figura 6-17, e cada uma de suas etapas é descrita a seguir.
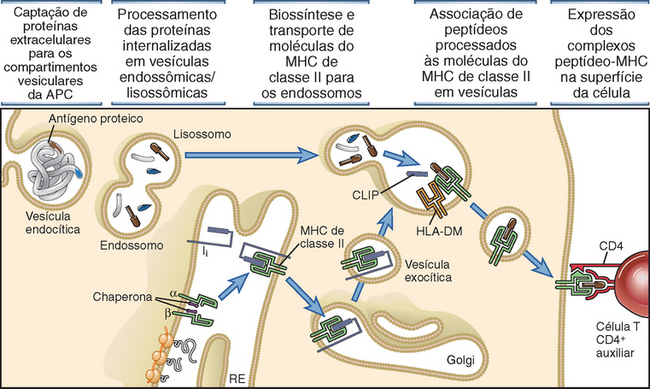
FIGURA 6-17 A via de apresentação de antígenos do MHC de classe II. Os estágios no processamento dos antígenos extracelulares são descritos no texto. CLIP, peptídeo da cadeia invariante associado à classe II; RE, retículo endoplasmático; Ii, cadeia invariante.
Geração de Proteínas Vesiculares
Os peptídeos associados à classe II derivam, em sua maioria, de antígenos proteicos que são capturados do meio extracelular e internalizados em endossomos por APC especializadas. As etapas iniciais na apresentação de um antígeno proteico extracelular consistem na ligação do antígeno nativo a uma APC e na sua internalização. Diferentes APC podem ligar-se a antígenos proteicos de diversas maneiras e com eficiência e especificidade variáveis. As células dendríticas e os macrófagos expressam uma variedade de receptores de superfície, que reconhecem estruturas compartilhadas por numerosos micro-organismos (Cap. 4). Essas APC utilizam os receptores para ligar e internalizar eficientemente os micro-organismos. Os macrófagos também expressam receptores para as porções Fc dos anticorpos, bem como receptores para a proteína do complemento C3b, que se ligam a antígenos com anticorpos ou proteínas do complemento fixados e intensificam a sua internalização. Outro exemplo de receptores específicos nas APC é a imunoglobulina de superfície nas células B, que, em virtude de sua alta afinidade por antígenos, é capaz de mediar efetivamente a internalização de proteínas presentes em concentrações muito baixas no líquido extracelular (Cap. 11).
Após a sua internalização, os antígenos proteicos passam a se localizar dentro de vesículas intracelulares delimitadas por membrana, denominadas endossomos. A via endossômica de trânsito das proteínas intracelulares comunica-se com lisossomos, que consistem em vesículas mais densas delimitadas por membrana e contendo enzimas. Um subgrupo de endossomos tardios ricos em MHC de classe II desempenha um papel especial no processamento e na apresentação do antígeno pela via da classe II, que será descrito posteriormente. Os micro-organismos particulados são internalizados em vesículas denominadas fagossomos, que podem se fundir com os lisossomos, produzindo vesículas denominadas fagolisossomos ou lisossomos secundários. Alguns micro-organismos, como micobactérias e Leishmania, podem sobreviver e até mesmo sofrer replicação dentro dos fagossomos ou endossomos, proporcionando uma fonte persistente de antígenos em compartimentos vesiculares.
Outras proteínas além daquelas ingeridas do meio extracelular também podem entrar na via do MHC de classe II. Algumas moléculas de proteína destinadas à secreção podem entrar nas mesmas vesículas que as moléculas do MHC de classe II e podem ser processadas, em lugar de serem secretadas. Com menos frequência, proteínas citoplasmáticas e da membrana podem ser processadas e apresentadas por moléculas de classe II. Em alguns casos, isso pode resultar da digestão enzimática do conteúdo citoplasmático, designada como autofagia. Nessa via, as proteínas citoplasmáticas são capturadas dentro de vesículas delimitadas por membrana, denominadas autofagossomos; essas vesículas fundem-se com os lisossomos, e as proteínas citoplasmáticas são proteoliticamente degradadas. Os peptídeos produzidos por essa via podem ser transportados até o mesmo compartimento vesicular de classe II do que os peptídeos derivados de antígenos ingeridos. A autofagia é basicamente um mecanismo para degradação das proteínas celulares e a reciclagem de seus produtos como fontes de nutrientes durante épocas de estresse. Participa também na destruição dos micro-organismos intracelulares, que estão encerrados em vesículas e que são transportados até os lisossomos. Por conseguinte, é previsível que os peptídeos gerados por autofagia sejam apresentados para reconhecimento das células T. Alguns peptídeos que estão associados a moléculas de classe II derivam de proteínas da membrana, que podem ser recicladas na mesma via endocítica das proteínas extracelulares. Por conseguinte, até mesmos os vírus, que se replicam no citoplasma das células infectadas, podem produzir proteínas que são degradadas em peptídeos que entram na via do MHC de classe II de apresentação de antígenos. Isso pode constituir um mecanismo para a ativação das células T auxiliares CD4+ específicas de antígenos virais.
Digestão Proteolítica das Proteínas em Vesículas
As proteínas internalizadas sofrem degradação enzimática nos endossomos tardios e lisossomos, gerando peptídeos que também são capazes de ligar-se às fendas de ligação de peptídeos das moléculas do MHC de classe II. A degradação dos antígenos proteicos em vesículas é um processo ativo mediado por proteases que possuem pH ácido ótimo. As proteases mais abundantes dos endossomos tardios são catepsinas, que são tiol e aspartil proteases com ampla especificidade de substrato. Várias catepsinas contribuem para a geração de peptídeos para a via da classe II. As proteínas parcialmente degradadas ou clivadas ligam-se às fendas de extremidades abertas das moléculas de MHC de classe II e, em seguida, são reduzidas enzimaticamente a seu tamanho final. Os estudos de imunomicroscopia eletrônica e fracionamento subcelular definiram um subgrupo de endossomos tardios ricos em moléculas de classe II, que desempenham um importante papel na apresentação de antígenos (Fig. 6-18). Nos macrófagos e nas células B humanas, é denominado compartimento MHC de classe II do MHC ou MIIC. (Em algumas células B murinas, foi identificada uma organela semelhante contendo moléculas de classe II, que foi denominada vesícula de classe II.) O MIIC possui um aspecto multilamelar característico na microscopia eletrônica. É importante assinalar que ele contém todos os componentes necessários para a associação peptídeo-classe II, incluindo as enzimas que degradam antígenos proteicos, as moléculas de classe II e duas moléculas envolvidas no carregamento de peptídeos das moléculas de classe II, a cadeia invariante e a HLA-DM, cujas funções são descritas posteriormente.
FIGURA 6-18 Morfologia das vesículas endossômicas ricas em MHC de classe II. A, Imunomicrografia eletrônica de um linfócito B que internalizou albumina sérica bovina em endossomas precoces (marcados com partículas de ouro de 5 nm, seta) e que contém moléculas do MHC de classe II (marcadas com partículas de ouro de 10 nm, cabeças das setas) em MIIC. A albumina internalizada finalmente alcança as MIIC. B, Imunomicrografia eletrônica de uma célula B mostrando a localização das moléculas do MHC de classe II e DM em MIIC (estrelas) e cadeia invariante concentrada no complexo de Golgi (G). Neste exemplo, não existe praticamente nenhuma cadeia invariante detectada na MIIC, presumivelmente por que foi clivada para gerar CLIP.
A, (De Kleijmeer MJ, S Morkowski, JM Griffith, AY Rudensky e HJ Geuze. Major histocompatibility complex class II compartments in human and mouse B lymphoblasts represent conventional endocytic compartments. Reproduzido do The Journal of Cell Biology 139:639-649, 1997, com permissão de copyright da The Rockefeller University Press.) B, (Cortesia de Drs. H. J. Geuze e M. Kleijmeer, Department of Cell Biology, Utrecht University. The Netherlands.)
Biossíntese e Transporte das Moléculas do MHC de Classe II para os Endossomos
As moléculas do MHC de classe II são sintetizadas no RE e transportadas até os endossomos com uma proteína associada, a cadeia invariante (Ii), que ocupa as fendas de ligação de peptídeos das moléculas de classe II recém-sintetizadas (Fig. 6-19). As cadeias α e β das moléculas do MHC de classe II são sintetizadas de modo coordenado e associam-se umas às outras no RE. Os dímeros de classe II nascentes são estruturalmente instáveis, e o seu dobramento e montagem são auxiliados por chaperonas residentes no RE, como a calnexina. Uma proteína denominada cadeia invariante (Ii) promove o enovelamento e a montagem das moléculas de classe II e dirige as moléculas de classe II recém-formadas até os endossomos tardios e lisossomos, onde proteínas internalizadas foram proteoliticamente degradadas em peptídeos. A Ii é um trímero composto de três subunidades de 30 kD, três das quais se ligam a um heterodímero αβ de classe II recém-sintetizado de modo a bloquear a fenda de ligação de peptídeos e impedir que ela aceite qualquer peptídeo. Em consequência, as moléculas do MHC de classe II não podem se ligar a peptídeos que elas encontram no RE nem apresentá-los, possibilitando, assim, a associação desses peptídeos às moléculas de classe I (descritas anteriormente). As moléculas do MHC de classe II são transportadas em vesículas exocíticas até a superfície celular. Durante essa passagem, as vesículas que transportam moléculas de classe II do RE encontram-se e fundem-se com as vesículas endocíticas que contêm antígenos internalizados e processados. Consequentemente, as moléculas de classe II encontram peptídeos antigênicos que foram gerados por proteólise das proteínas que sofreram endocitose, e a associação peptídeo-MHC ocorre nas vesículas.
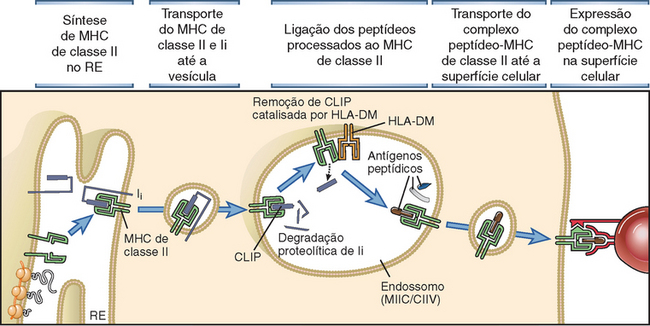
FIGURA 6-19 As funções da cadeia invariante associada ao MHC de classe II e HLA-DM. As moléculas de classe II com cadeia invariante ligada ou CLIP são transportadas em vesículas, onde Ii é degradada, e o CLIP remanescente é removido pela ação de DM. Os peptídeos antigênicos gerados nas vesículas são então capazes de ligar-se a moléculas de classe II. Outra proteína semelhante à classe II, denominada HLA-DO, pode regular a remoção do CLIP catalisado por DM. CIIV, vesícula de classe II.
Associação dos Peptídeos Processados às Moléculas do MHC de Classe II em Vesículas
No interior das vesículas endossômicas, a Ii dissocia-se das moléculas do MHC de classe II pela ação combinada de enzimas proteolíticas e da molécula HLA-DM, e os peptídeos antigênicos são então capazes de ligar-se às fendas de ligação de peptídeos disponíveis das moléculas de classe II (Fig. 6-19). Como a Ii bloqueia o acesso à fenda de ligação de peptídeos de uma molécula do MHC de classe II, ela precisa ser removida antes da formação de complexos de peptídeos e moléculas de classe II. As mesmas enzimas proteolíticas, como as catepsinas, que geram peptídeos de proteínas internalizadas podem atuar sobre a Ii, degradando-a e deixando apenas um remanescente de 24 aminoácidos, denominado cadeia peptídica invariante associada à classe II (CLIP), que se encontra situado na fenda de ligação de peptídeos da mesma maneira que outros peptídeos ligam-se a moléculas do MHC de classe II. Em seguida, o CLIP precisa ser removido para que a fenda se torne acessível aos peptídeos antigênicos produzidos a partir de proteínas extracelulares. Essa remoção é efetuada pela ação de uma molécula denominada HLA-DM (ou H-2M no camundongo), que é codificada dentro do MHC, possui uma estrutura semelhante àquela das moléculas do MHC de classe II e está colocalizada como moléculas de classe II no compartimento endossômico MIIC. As moléculas de HLA-DM diferem das moléculas do MHC de classe II em vários aspectos; não são polimórficas e não são expressas na superfície celular. A molécula HLA-DM atua como trocador de peptídeo, facilitando a remoção do CLIP e a adição de outros peptídeos a moléculas do MHC de classe II.
Uma vez o CLIP tenha sido removido, os peptídeos gerados por proteólise dos antígenos proteicos internalizados são capazes de ligar-se a moléculas do MHC de classe II. A molécula HLA-DM pode acelerar a taxa de ligação de peptídeos a moléculas de classe II. Como as extremidades da fenda de ligação de peptídeos do MHC de classe II estão abertas, os grandes peptídeos podem ligar-se e, em seguida, podem ser “reduzidos” por enzimas proteolíticas ao tamanho apropriado para o seu reconhecimento pelas células T. Portanto, os peptídeos que são realmente apresentados pelas moléculas do MHC de classe II na superfície celular têm habitualmente um comprimento de 10 a 30 aminoácidos e foram tipicamente gerados por essa etapa de redução.
Expressão dos Complexos Peptídeo-MHC de Classe II na Superfície Celular
As moléculas do MHC de classe II são estabilizadas pelos peptídeos ligados, e os complexos peptídeo-classe II estáveis são transportados até a superfície da APC, onde são apresentados para o seu reconhecimento por células T CD4+. Acredita-se que o transporte de complexos MHC de classe II-peptídeo até a superfície celular ocorra por fusão de extensões vesiculotubulares do lisossomo com a membrana plasmática, resultando na liberação dos complexos de MHC de classe II transportados na superfície celular. Uma vez expressos na superfície das APC, os complexos peptídeo-classe II são reconhecidos por células T CD4+ específicas para antígenos proteicos, e, nesse processo, o correceptor CD4 desempenha um papel essencial através de sua ligação a regiões não polimórficas da molécula de classe II. É interessante ressaltar que, enquanto as moléculas de classe II carregadas de peptídeos deslocam-se dos endossomos tardios e lisossomos até a superfície celular, outras moléculas envolvidas na apresentação de antígenos, como DM, permanecem dentro das vesículas e não são expressas na membrana plasmática. O mecanismo desse trânsito seletivo não é conhecido.
Apresentação Cruzada
Algumas células dendríticas têm a capacidade de capturar e de ingerir células infectadas por vírus ou células tumorais e apresentar os antígenos virais ou tumorais a linfócitos T CD8+ virgens (Fig. 6-20). Nessa via, os antígenos ingeridos são transportados das vesículas até o citosol, pelo qual os peptídeos entram na via da classe I. Conforme discutido anteriormente, a maioria das proteínas ingeridas não entra na via da classe I citosólica de apresentação de antígenos. Essa permissividade do transporte de proteínas das vesículas endossômicas para o citosol é exclusiva das células dendríticas. (Ao mesmo tempo, as células dendríticas podem apresentar peptídeos associados ao MHC de classe II gerados nas vesículas às células T CD4+ auxiliares, que frequentemente são necessárias para induzir uma resposta completa das células CD8+ [Cap. 9]). Esse processo é denominado apresentação cruzada ou cross-priming para indicar que um tipo celular (a célula dendrítica) pode apresentar antígenos de outra célula (a célula infectada por vírus ou a célula tumoral) e ativar (prime) as células T específicas para esses antígenos. O processo de apresentação cruzada parece violar a regra segundo a qual os antígenos vesiculares são apresentados ligados às moléculas do MHC de classe II, enquanto os antígenos citosólicos estão ligados às moléculas de classe I. Todavia, trata-se de uma função normal das células dendríticas, visto que as células dendríticas podem ativar células T CD8+ virgens, mesmo se os antígenos sejam produzidos em células incapazes de apresentar o antígeno, contanto que as células que contêm antígenos possam ser internalizadas por células dendríticas em vesículas.
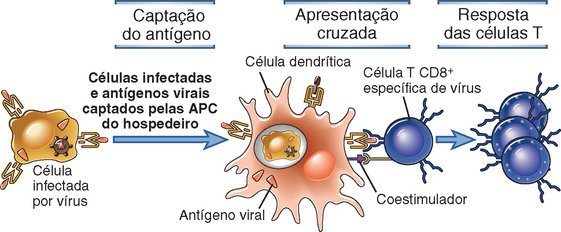
FIGURA 6-20 Apresentação cruzada de antígenos às células T CD8+. As células infectadas por micro-organismos intracelulares, como vírus, são ingeridas por células dendríticas, e os antígenos dos agentes infecciosos são processados e apresentados em associação a moléculas do MHC de classe I às células T CD8+. Por conseguinte, as células dendríticas são capazes de apresentar antígenos vesiculares endocitosados pela via da classe I. Observe que as mesmas APC de apresentação cruzada podem apresentar antígenos associados ao MHC de classe II do micro-organismo para reconhecimento por células T CD4+ auxiliares.
A apresentação cruzada envolve a fusão de fagossomos contendo os antígenos ingeridos com o RE. Em seguida, as proteínas ingeridas são translocadas do RE para o citosol por vias pouco definidas, que lembram a degradação associada ao RE. As proteínas inicialmente internalizadas no fagossomo são, portanto, transportadas até o compartimento (citosol) onde ocorre normalmente a proteólise para a via da classe I. Por conseguinte, essas proteínas fagocitadas sofrem degradação proteassômica, e os peptídeos derivados são transportados de volta pelo TAP no RE, onde são montados com moléculas do MHC de classe I recém-sintetizadas, conforme descrito para a via da classe I convencional.
Importância Fisiológica da Apresentação de Antígenos Associada ao MHC
Até o momento, discutimos a especificidade dos linfócitos T CD4+ e CD8+ para os antígenos proteicos estranhos associados ao MHC e os mecanismos pelos quais são produzidos complexos de peptídeos e moléculas do MHC. Nesta seção, consideraremos como o papel central do MHC na apresentação de antígenos influencia a natureza das respostas das células T a diferentes antígenos e os tipos de antígenos reconhecidos pelas células T.
Natureza das Respostas das Células T
A apresentação de proteínas citosólicas versus vesiculares pelas vias do MHC de classe I ou de classe II, respectivamente, determina quais os subtipos de células T que responderão aos antígenos encontrados nesses dois reservatórios de proteínas e está estreitamente ligada às funções dessas células (Fig. 6-21). Os antígenos com síntese endógena, como as proteínas virais e tumorais, localizam-se no citoplasma e são reconhecidos por CTL CD8+ restritos à classe I, que eliminam as células que produzem os antígenos intracelulares. Por sua vez, os antígenos extracelulares habitualmente são captados em vesículas endossômicas e ativam células T CD4+ restritas à classe II, visto que as proteínas vesiculares são processadas em peptídeos de ligação da classe II. As células T CD4+ atuam como células auxiliares para estimular as células B a produzirem anticorpos e os macrófagos a intensificarem a sua atividade fagocítica, ambos os mecanismos atuam para eliminar os antígenos extracelulares. Por conseguinte, os antígenos de micro-organismos que residem em diferentes locais celulares estimulam seletivamente as respostas das células T que são mais efetivas na eliminação desse tipo de micro-organismo. Isso é particularmente importante uma vez que os receptores de antígenos dos CTL e das células T auxiliares são incapazes de distinguir entre micro-organismos extracelulares e intracelulares. Através da segregação de peptídeos derivados desses tipos de micro-organismos, as moléculas do MHC orientam os subtipos de células T CD4+ e CD8+ a responderem aos micro-organismos que podem ser mais bem atacados por cada um desses subtipos.
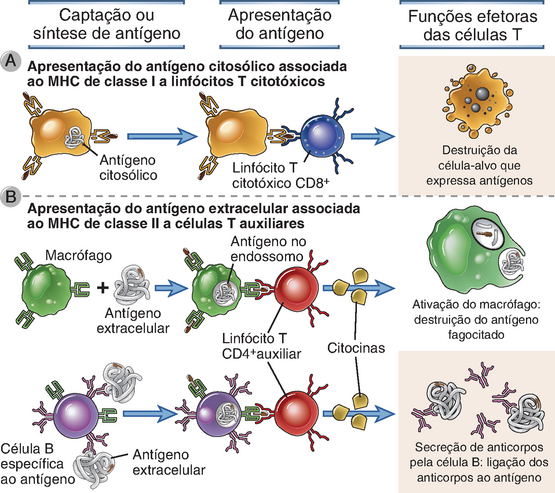
FIGURA 6-21 Apresentação dos antígenos extracelulares e citosólicos a diferentes subtipos de células T. A, Os antígenos citosólicos são apresentados por células nucleadas aos CTL CD8+, que eliminam (lisam) as células que expressam antígenos. B, Os antígenos extracelulares são apresentados por macrófagos ou por linfócitos B aos linfócitos T CD4+auxiliares, que ativam os macrófagos ou as células B e eliminam os antígenos extracelulares.
Imunogenicidade dos Antígenos Proteicos
As moléculas do MHC determinam a imunogenicidade dos antígenos proteicos de duas maneiras relacionadas.
• Os epítopos de proteínas complexas que induzem as melhores respostas das células T são os peptídeos gerados por proteólise nas APC e que se ligam com maior afinidade às moléculas do MHC. Se um indivíduo for imunizado com um antígeno proteico, a maioria das células T que respondem é, em muitos casos, específica para apenas uma ou algumas sequências de aminoácidos lineares do antígeno. Essas sequências são denominadas epítopos imunodominantes ou determinantes. As proteases envolvidas no processamento de antígenos produzem uma variedade de peptídeos das proteínas naturais, e apenas alguns desses peptídeos possuem as características que permitem a sua ligação às moléculas do MHC presentes em cada indivíduo (Fig. 6-22). É importante definir a base estrutural da imunodominância, visto que isso pode possibilitar a manipulação eficiente do sistema imune com peptídeos sintéticos. Uma aplicação desse conhecimento é o desenvolvimento de vacinas. Por exemplo, uma proteína viral pode ser analisada quanto à presença de sequências de aminoácidos que formariam epítopos imunodominantes típicos capazes de ligar-se com alta afinidade a moléculas do MHC. Peptídeos sintéticos contendo esses epítopos podem constituir vacinas efetivas para desencadear respostas das células T contra o peptídeo viral expresso em uma célula infectada. Por sua vez, alguns indivíduos não respondem às vacinas (como a vacina de antígeno de superfície do vírus da hepatite B), presumivelmente pelo fato de que suas moléculas HLA são incapazes de ligar-se aos principais peptídeos do antígeno e apresentá-los.
• A expressão de determinados alelos do MHC de classe II em um indivíduo determina a sua capacidade de responder a antígenos específicos. Conforme discutido anteriormente, os genes da resposta imune (Ir) que controlam as respostas humorais são genes do MHC de classe II. Eles influenciam a resposta imune, visto que várias moléculas alélicas do MHC de classe II diferem na sua capacidade de ligar-se a diferentes peptídeos antigênicos e, portanto, estimular células T auxiliares específicas.
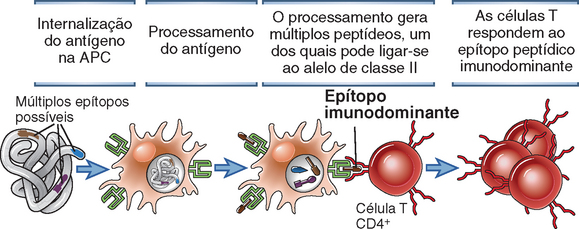
FIGURA 6-22 Imunodominância dos peptídeos. Os antígenos proteicos são processados para gerar múltiplos peptídeos; os peptídeos imunodominantes são aqueles que se ligam melhor às moléculas do MHC de classe I e de classe II disponíveis. A ilustração mostra um antígeno extracelular gerando um peptídeo de ligação à classe II, porém isso também se aplica aos peptídeos dos antígenos citosólicos que são apresentados por moléculas do MHC de classe I.
APRESENTAÇÃO DE ANTÍGENOS NÃO PROTEICOS A SUBTIPOS DE CÉLULAS T
Várias populações menores de células T são capazes de reconhecer antígenos não proteicos sem a participação de moléculas do MHC de classe I ou classe II. Por conseguinte, essas populações representam exceções à regra segundo a qual as células T só podem reconhecer peptídeos associados ao MHC. Entre essas populações, as mais bem definidas são as células NKT e as células T γδ.
As células NKT expressam marcadores que são característicos das células assassinas naturais (natural killer − NK) e dos linfócitos T e expressam receptores de células T αβ com diversidade muito limitada (Cap. 10). As células NKT reconhecem lipídeos e glicolipídeos apresentados pela molécula do MHC “não clássica” semelhante à classe I, denominada CD1. Existem várias proteínas CD1 expressas nos seres humanos e nos camundongos. Embora suas vias de transporte intracelular possam diferir de modo sutil, todas as moléculas CD1 ligam-se a peptídeos e os apresentam por uma única via. As moléculas CD1 recém-sintetizadas captam lipídeos celulares e os transportam até a superfície celular. Da superfície celular, os complexos CD1-lipídeos sofrem endocitose em endossomos ou lisossomos, onde os lipídeos que foram ingeridos do meio externo são capturados, e os novos complexos CD1-lipídeos retornam à superfície celular. Por conseguinte, as moléculas CD1 adquirem antígenos lipídicos que sofreram endocitose durante a reciclagem e os apresentam sem processamento aparente. As células NKT que reconhecem os antígenos lipídicos podem desempenhar um papel na defesa contra micro-organismos, particularmente micobactérias (que são ricas em componentes lipídicos).
As células T γδ constituem uma pequena população de células T que expressam proteínas receptoras antigênicas que se assemelham àquelas das células T CD4+ e CD8+, mas que não são idênticas (Cap. 10). As células T γδ reconhecem muitos tipos diferentes de antígenos, incluindo algumas proteínas e lipídeos, bem como pequenas moléculas fosforiladas e alquil aminas. Esses antígenos não são apresentados por moléculas do MHC, e as células γδ não são restritas ao MHC. Não se sabe se existe a necessidade de um tipo celular particular ou sistema de apresentação de antígenos distinto para a apresentação de antígenos a essas células.
• As células T reconhecem antígenos apenas na forma de peptídeos apresentados pelos produtos dos genes do MHC na superfície das APC. Os linfócitos T CD4+auxiliares reconhecem antígenos em associação aos produtos gênicos do MHC de classe II (reconhecimento restrito ao MHC de classe II), enquanto aos CTL CD8+ reconhecem antígenos em associação aos produtos gênicos de classe I (reconhecimento restrito ao MHC de classe I).
• As APC especializadas, como células dendríticas, macrófagos e linfócitos B, capturam antígenos proteicos extracelulares, os internalizam e os processam, e apresentam peptídeos associados à classe II a células T CD4+. As células dendríticas são as APC mais eficientes para iniciar respostas imunes primárias através da ativação de células T virgens, enquanto os macrófagos e os linfócitos B apresentam antígenos a células T auxiliares diferenciadas na fase efetora da imunidade celular e respostas imunes humorais, respectivamente. Todas as células nucleadas podem apresentar peptídeos associados à classe I derivados de proteínas citosólicas, como antígenos virais e tumorais, às células T CD8+.
• Os loci MHC são uma grande região genética que codifica as moléculas do MHC de classes I e II, bem como outras proteínas. Os genes do MHC são altamente polimórficos. As moléculas do MHC de classe I são compostas de uma cadeia α (ou pesada) em um complexo não covalente com um polipeptídeo não polimórfico, denominado β2-microglobulina. As moléculas de classe II contêm duas cadeias polimórficas codificadas pelos loci MHC, uma cadeia α e uma cadeia β. Ambas as classes de moléculas do MHC consistem em uma fenda extracelular de ligação de peptídeos, uma região não polimórfica semelhante à Ig, uma região transmembrana e uma região citoplasmática. A fenda de ligação de peptídeos das moléculas do MHC possui lados α-helicoidais e um assoalho de lâminas β-pregueadas antiparalelas de oito fitas. A fenda de ligação de peptídeos das moléculas de classe I é formada pelos segmentos α1 e α2 da cadeia α, enquanto a das moléculas de classe II é formada pelos segmentos α1 e β1 das duas cadeias. Os domínios semelhantes à Ig das moléculas de classe I e classe II contêm os sítios de ligação para os correceptores das células T, CD8 e CD4, respectivamente. Os resíduos polimórficos das moléculas do MHC estão localizados no domínio de ligação de peptídeos.
• A função das moléculas de classe I e de classe II codificadas pelos loci MHC consiste na ligação dos antígenos peptídicos e na sua apresentação para reconhecimento por linfócitos T específicos de antígenos. Os antígenos peptídicos associados às moléculas de classe I são reconhecidos por células T CD8+, enquanto os antígenos peptídicos associados à classe II são reconhecidos por células T CD4+. As moléculas do MHC ligam-se apenas a um peptídeo de cada vez, e todos os peptídeos que se ligam a determinada molécula do MHC compartilham padrões estruturais comuns. Cada molécula do MHC possui ampla especificidade para peptídeos e pode ligar-se a múltiplos peptídeos que apresentam características estruturais comuns, como os resíduos de âncora.
• A fenda de ligação de peptídeos das moléculas de classe I pode acomodar peptídeos com comprimento de 6 a 16 resíduos de aminoácidos, enquanto a fenda das moléculas de classe II possibilita a ligação de peptídeos maiores (com comprimento de até 30 resíduos de aminoácidos ou mais). Alguns resíduos polimórficos do MHC determinam as especificidades de ligação para peptídeos através da formação de estruturas, denominadas bolsas, que interagem com resíduos complementares no peptídeo ligado, denominados resíduos de âncora. Outros resíduos polimórficos do MHC e alguns resíduos do peptídeo não estão envolvidos na ligação às moléculas do MHC, mas à formação da estrutura reconhecida pelas células T.
• As moléculas de classe I são expressas em todas as células nucleadas, enquanto as moléculas de classe II são expressas principalmente em APC especializadas, como células dendríticas, macrófagos e linfócitos B, e em alguns outros tipos celulares, incluindo células endoteliais e células epiteliais do timo. A expressão dos produtos dos genes do MHC é aumentada por estímulos inflamatórios e imunológicos, particularmente por citocinas como o IFN-γ, que estimulam a transcrição dos genes do MHC.
• O processamento do antígeno refere-se à conversão de proteínas nativas em peptídeos associados ao MHC. Esse processo consiste na introdução dos antígenos proteicos exógenos em vesículas das APC, ou na síntese de antígenos no citosol, degradação proteolítica dessas proteínas em peptídeos, ligação dos peptídeos a moléculas do MHC e apresentação dos complexos de peptídeo-MHC na superfície das APC para o seu reconhecimento pelas células T. Por conseguinte, as proteínas tanto extracelulares quanto intracelulares são captadas por essas vias de processamento de antígenos, e os peptídeos derivados tanto das proteínas normais próprias do hospedeiro quanto de proteínas estranhas são apresentados por moléculas do MHC para vigilância pelos linfócitos T.
• Para a apresentação de antígenos associados à classe I, as proteínas citosólicas são degradadas proteolicamente no proteassoma, gerando peptídeos com características que possibilitam a sua ligação a moléculas de classe I. Esses peptídeos são transportados do citoplasma até o RE por um transportador dependente de ATP, denominado TAP. Os dímeros de MHC de classe I-β2-microglobulina recém-sintetizados no RE estão associados ao complexo TAP e recebem peptídeos transportados no RE. Os complexos estáveis de moléculas do MHC de classe I com peptídeos ligados saem do RE, passam pelo complexo de Golgi e dirigem-se até a superfície celular.
• Para a apresentação de antígenos associados à classe II, as proteínas extracelulares são internalizadas em endossomos, onde elas sofrem clivagem proteolítica por enzimas que atuam em pH ácido. As moléculas do MHC de classe II recém-sintetizadas, associadas à Ii, são transportadas do RE para as vesículas endossômicas. Nessas vesículas, a Ii sofre clivagem proteolítica, e um pequeno remanescente peptídico da Ii, denominado CLIP, é removido da fenda de ligação de peptídeos da molécula do MHC por moléculas DM. Os peptídeos que foram gerados das proteínas extracelulares ligam-se então à fenda disponível da molécula do MHC de classe II, e o complexo trimérico (cadeias α e β do MHC de classe II e peptídeo) desloca-se até a superfície da célula, onde é apresentado.
• Essas vias de apresentação de antígenos restritos ao MHC asseguram que a maioria das células do corpo seja rastreada quanto à possível presença de antígenos estranhos. As vias também garantem que as proteínas de micro-organismos extracelulares produzam preferencialmente peptídeos ligados às moléculas do MHC de classe II para reconhecimento pelas células T CD4+ auxiliares, que ativam mecanismos efetores para a eliminação dos antígenos extracelulares. Por sua vez, as proteínas sintetizadas por micro-organismos intracelulares (citosólicos) geram peptídeos ligados a moléculas do MHC de classe I para reconhecimento pelos CTL CD8+, que atuam para eliminar células que abrigam infecções intracelulares. A imunogenicidade dos antígenos proteicos estranhos depende da capacidade das vias de processamento de antígenos de gerar peptídeos a partir dessas proteínas, que sejam capazes de ligar-se a moléculas próprias do MHC.
O Papel das Células Dendríticas na Captura e Apresentação do Antígeno
Bousso P. T-cell activation by dendritic cells in the lymph node: lessons from the movies. Nature Reviews Immunology. 2008;8:675-684.
Heath WR, Carbone FR. Dendritic cell subsets in primary and secondary T cell responses at body surfaces. Nature Immunology. 2009;10:1237-1244.
Kurts C, Robinson BW, Knolle PA. Cross-priming in health and disease. Nature Reviews Immunology. 2010;10:403-414.
Lin ML, Zhan Y, Villadangos JA, Lew AM. The cell biology of cross-presentation and the role of dendritic cell subsets. Immunology and Cell Biology. 2008;86:353-362.
López-Bravo M, Ardavín C. In vivo induction of immune responses to pathogens by conventional dendritic cells. Immunity. 2008;29:343-351.
Reis, Sousa C. Dendritic cells in a mature age. Nature Reviews Immunology. 2006;6:476-483.
Segura E, Villadangos JA. Antigen presentation by dendritic cells in vivo. Current Opinion in Immunology. 2009;21:105-110.
Estrutura dos Genes e das Moléculas do MHC e Complexos de Peptídeo-MHC
Bjorkman PJ, Saper MA, Samraoui B, Bennett WS, Strominger JL, Wiley DC. Structure of the human class I histocompatibility antigen HLA-A2. Nature. 1987;329:506-512.
Horton R, Wilming L, Rand V, et al. Gene map of the extended human MHC. Nature Reviews Genetics. 2004;5:889-899.
Klein J, Sato A. The HLA system. New England Journal of Medicine. 2000;343:702-709. and 782-786
Madden DR. The three dimensional structure of peptide-MHC complexes. Annual Review of Immunology. 1995;13:587-622.
Marrack P, Scott-Browne JP, Dai S, Gapin L, Kappler JW. Evolutionarily conserved amino acids that control TCR-MHC interaction. Annual Review of Immunology. 2008;26:171-203.
Mazza C, Malissen B. What guides MHC-restricted TCR recognition? Seminars in Immunology. 2007;19:225-235.
Reith W, Leibundgut-Landmann S, Waldburger JM. Regulation of MHC class II gene expression by the class II transactivator. Nature Reviews Immunology. 2005;5:793-806.
Processamento dos Antígenos Proteicos e Apresentação dos Antígenos Peptídicos Associado ao MHC
Bryant PW, Lennon-Dumenil AM, Fiebiger E, Lagaudriere-Gesbert C, Ploegh HL. Proteolysis and antigen presentation by MHC class II molecules. Advances in Immunology. 2002;80:71-114.
Chapman HA. Endosomal proteases in antigen presentation. Current Opinion in Immunology. 2006;18:78-84.
Purcell AW, Elliott T. Molecular machinations of the MHC-I peptide loading complex. Current Opinion in Immunology. 2008;20:75-81.
Ramachandra L, Simmons D, Harding CV. MHC molecules and microbial antigen processing in phagosomes. Current Opinion in Immunology. 2009;21:98-104.
Rocha N, Neefjes J. MHC class II molecules on the move for successful antigen presentation. EMBO Journal. 2008;27:1-5.
Rock KL, York IA, Goldberg AL. Post-proteasomal antigen processing for major histocompatibility class I presentation. Nature Immunology. 2004;5:670-677.
Stern LJ, Potolicchio I, Santambrogio L. MHC class II compartment subtypes: structure and function. Current Opinion in Immunology. 2006;18:64-69.
Trombetta ES, Mellman I. Cell biology of antigen processing in vitro and in vivo. Annual Review of Immunology. 2005;23:975-1028.
Vyas JM, Van der Veen AG, Ploegh HL. The known unknowns of antigen processing and presentation. Nature Reviews Immunology. 2008;8:607-618.
Yewdell JW, Bennink JR. Immunodominance in major histocompatibility class I–restricted T lymphocyte responses. Annual Review of Immunology. 1999;17:51-88.
Yewdell JW, Haeryfar SM. Understanding presentation of viral antigens to CD8+ T cells in vivo: the key to rational vaccine design. Annual Review of Immunology. 2005;23:651-682.
Apresentação “Não Clássica” de Antígenos
Cohen NR, Garg S, Brenner MB. Antigen presentation by CD1: lipids, T cells, and NKT cells in microbial immunity. Advances in Immunology. 2009;102:1-94.
Salio M, Silk JD, Cerundolo V. Recent advances in processing and presentation of CD1 bound lipid antigens. Current Opinion in Immunology. 2010;22:81-88.