CAPÍTULO 5 Anticorpos e Antígenos
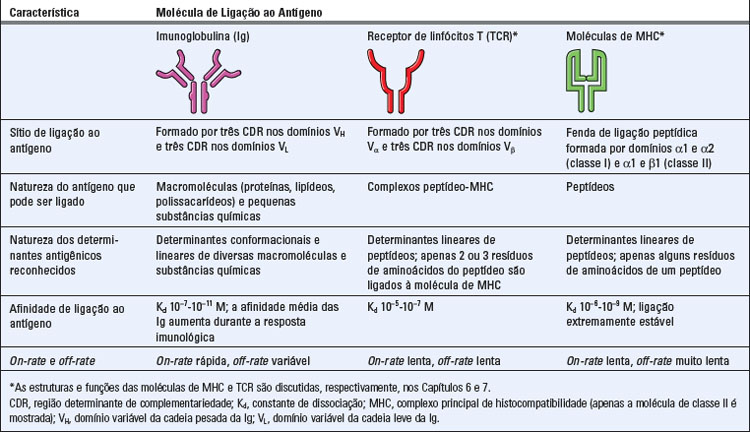
Os anticorpos são proteínas circulantes produzidas pelos vertebrados em resposta à exposição a estruturas não próprias conhecidas como antígenos. Os anticorpos são incrivelmente diversos e específicos em sua capacidade de reconhecimento de estruturas moleculares não próprias e são os mediadores primários da imunidade humoral contra todas as classes de micro-organismos. O eficaz tratamento da difteria, por Emil von Behring e Shibasaburo Kitasato, em 1890, com soro de animais imunizados com a forma atenuada da toxina diftérica, estabeleceu o papel protetor das proteínas circulantes, levando ao nascimento da imunologia moderna. As proteínas circulantes que medeiam estas respostas protetoras foram inicialmente chamadas de antitoxinas. Ao se perceber que proteínas similares podiam ser geradas contra muitas substâncias, não apenas toxinas microbianas, tais moléculas receberam a denominação geral de anticorpos. As substâncias que geram tais anticorpos ou são por estes reconhecidas foram, então, chamadas de antígenos. Os anticorpos, as moléculas do complexo principal de histocompatibilidade (MHC) (Cap. 6) e os receptores de antígenos dos linfócitos T (Cap. 7) são as três classes de moléculas usadas pelo sistema imune adaptativo para a ligação a antígenos (Tabela 5-1). Destas três, os anticorpos reconhecem a maior gama de estruturas antigênicas, mostrando sua maior capacidade de discriminação de diferentes antígenos, e se ligam a estes com maior afinidade. Os anticorpos representam o primeiro dos três tipos de moléculas de ligação a antígenos a ser descoberto e caracterizado. Começamos, portanto, nossa discussão sobre como o sistema imune reconhece, especificamente, os antígenos pela descrição da estrutura e das propriedades de ligação a antígenos dos anticorpos.
TABELA 5-1 Características da Ligação ao Antígeno pelas Moléculas Reconhecedoras de Antígenos do Sistema Imune
Os anticorpos podem existir em duas formas: ligados a membranas na superfície de linfócitos B, atuando como receptores de antígenos, e anticorpos secretados, que residem na circulação, nos tecidos e nas mucosas, onde neutralizam toxinas, impedem a entrada e a disseminação de patógenos e eliminam micro-organismos. O reconhecimento do antígeno pelos anticorpos ligados à membrana em linfócitos B virgens (naïve) ativa estas células, iniciando a resposta imune humoral. Os anticorpos são também produzidos em forma secretada por linfócitos B estimulados por antígenos. Na fase efetora da imunidade humoral, estes anticorpos secretados se ligam a antígenos e, através do desencadeamento de diversos mecanismos efetores, os eliminam. A eliminação de antígenos frequentemente exige a interação dos anticorpos a outros componentes do sistema imune, como proteínas do sistema complemento e células, incluindo fagócitos e eosinófilos. Dentre as funções efetoras mediadas por anticorpos, estão a neutralização dos micro-organismos ou produtos microbianos tóxicos, a ativação do sistema complemento, a opsonização de patógenos, aumentando a fagocitose, a citotoxicidade mediada por células dependente de anticorpos, em que os anticorpos marcam células infectadas para sua lise por células do sistema imune inato, e a ativação de mastócitos mediada por anticorpos, que elimina vermes parasitas. Estas funções dos anticorpos são descritas, em detalhes, no Capítulo 12. Neste capítulo, discutiremos as características estruturais dos anticorpos responsáveis pelo reconhecimento de antígenos e pelas funções efetoras.
Os linfócitos B são as únicas células que sintetizam moléculas de anticorpos. Estas células expressam uma forma integral de membrana da molécula de anticorpo em sua superfície, que atua como seus receptores de antígenos. Após a exposição a um antígeno, as células B se diferenciam em plasmócitos, que secretam anticorpos. Formas secretadas de anticorpos se acumulam no plasma (a porção fluida do sangue), nas secreções mucosas e no líquido intersticial de tecidos.
Após a coagulação do sangue ou do plasma, os anticorpos permanecem no fluido residual denominado soro. O soro não possui fatores de coagulação, mas contém todas as demais proteínas encontradas no plasma. Qualquer amostra de soro que contenha moléculas de anticorpo passíveis de detecção é comumente chamada de antissoro. O estudo dos anticorpos e de suas reações com antígenos é, portanto, classicamente denominado sorologia. A concentração sérica de moléculas de anticorpo específicas para um dado antígeno é geralmente estimada pela determinação de quantas diluições seriadas do soro devem ser feitas até que a ligação não possa mais ser observada. Soros com elevada concentração de anticorpos específicos para um dado antígeno são ditos de alto título.
Um indivíduo adulto saudável de 70 kg produz cerca de 2 a 3 g de anticorpos por dia. Quase dois terços destas moléculas são de um anticorpo chamado IgA, que é produzido por linfócitos B ativados e plasmócitos nas paredes dos tratos respiratório e gastrointestinal e transportado através de células epiteliais de mucosa até o lúmen destes tratos. A grande quantidade de IgA produzida reflete as grandes áreas superficiais destes órgãos.
ESTRUTURA DO ANTICORPO
A compreensão da estrutura dos anticorpos propiciou importantes esclarecimentos acerca de sua função. A análise da estrutura do anticorpo também permitiu a caracterização final da organização dos genes de receptores de antígenos em linfócitos B e T e a elucidação dos mecanismos de diversidade imunológica, que serão debatidas em maior profundidade no Capítulo 8.
Os primeiros estudos acerca da estrutura dos anticorpos eram baseados em imunoglobulinas purificadas do sangue de indivíduos imunizados contra vários antígenos. Por meio desta abordagem, não era possível definir a estrutura dos anticorpos com precisão, já que o soro contém uma mistura de diferentes imunoglobulinas produzidas por muitos clones de linfócitos B, podendo, cada um, responder a porções diferentes (epítopos) de um antígeno (os assim chamados anticorpos policlonais). Uma grande inovação na obtenção de anticorpos cujas estruturas eram passíveis de elucidação foi a descoberta de que muitos pacientes com mieloma múltiplo, um tumor de plasmócitos produtores de anticorpos monoclonais, tendem a apresentar grandes quantidades de moléculas de imunoglobulina bioquimicamente idênticas (sintetizadas pelo clone neoplásico) no sangue e na urina. Os imunologistas descobriram que estes anticorpos podiam ser purificados quanto à sua homogeneidade e analisados. O reconhecimento de que as células do mieloma produzem imunoglobulinas monoclonais levou ao desenvolvimento de uma técnica extremamente poderosa de síntese de anticorpos monoclonais, descritos mais adiante neste capítulo. A disponibilidade de populações homogêneas de anticorpos e plasmócitos produtores de anticorpos monoclonais permitiu a realização de análises estruturais detalhadas e da clonagem molecular dos genes de cada uma destas imunoglobulinas, que ainda são alguns dos maiores avanços em nossa compreensão do sistema imunológico.
Características Gerais da Estrutura dos Anticorpos
Proteínas plasmáticas ou séricas são tradicionalmente separadas por características de solubilidade em albuminas e globulinas, podendo ainda ser mais extensamente diferenciadas por sua migração em um campo elétrico, em um processo denominado eletroforese. A maioria dos anticorpos é encontrada no terceiro grupo de migração mais rápida, sendo denominados gamaglobulinas, devido à terceira letra do alfabeto grego. Outro nome comum dos anticorpos é imunoglobulinas (Ig), que se refere à porção responsável pela imunidade da fração gamaglobulina. Os termos imunoglobulina e anticorpo são usados como sinônimos ao longo deste livro.
Todas as moléculas de anticorpos compartilham as mesmas características estruturais básicas, mas apresentam enorme variabilidade na região de ligação aos antígenos. Esta variabilidade das regiões de ligação com os antígenos é responsável pela capacidade de diferentes anticorpos se ligarem a um número elevado de antígenos estruturalmente diversos. Acredita-se que exista um milhão ou mais de diferentes moléculas de anticorpos em cada indivíduo (teoricamente, o repertório total de anticorpos pode chegar a mais de 1011 diferentes moléculas), cada uma com sequências únicas de aminoácidos em seus sítios de combinação ao antígeno. As funções efetoras e as propriedades físico-químicas comuns dos anticorpos são associadas às regiões que não se ligam ao antígeno, que apresentam relativamente pouca variação entre as diferentes moléculas.
Uma molécula de anticorpo apresenta estrutura central simétrica, composta por duas cadeias leves idênticas e duas cadeias pesadas idênticas (Fig. 5-1). As cadeias leves e pesadas contêm uma série de unidades homólogas repetidas, cada uma com cerca de 110 resíduos de aminoácidos de comprimento, que se dobra independentemente em uma forma globular denominada domínio Ig. Um domínio Ig apresenta duas camadas de lâminas β-pregueadas, sendo cada camada composta por três a cinco fitas de cadeias polipeptídicas antiparalelas (Fig. 5-2). As duas camadas são unidas por uma ponte de dissulfeto, e as fitas de cada lâmina β são conectadas por alças curtas. Os aminoácidos de algumas alças são mais variáveis, sendo extremamente importantes para o reconhecimento do antígeno, como será discutido a seguir.
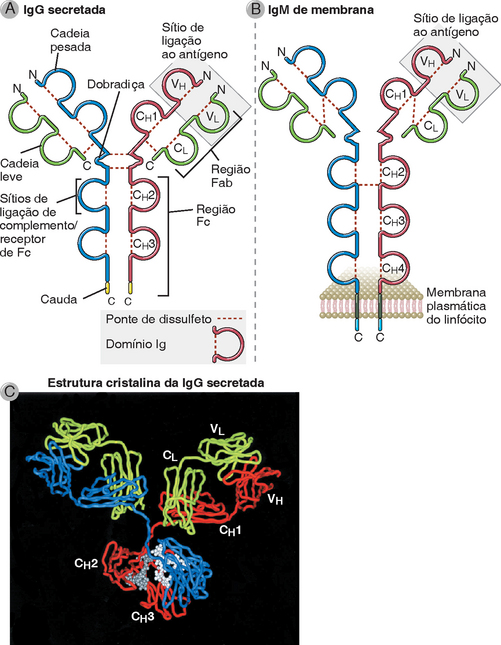
FIGURA 5-1 Estrutura de uma molécula de anticorpo. A, Diagrama esquemático da molécula secretada de IgG. O sítio de ligação ao antígeno é formado pela justaposição dos domínios VL e VH. As regiões da cadeia pesada terminam nas caudas. As localizações dos sítios de ligação de proteínas do sistema complemento e do receptor de Fc nas regiões constantes da cadeia pesada são aproximações. B, Diagrama esquemático da molécula de IgM ligada à membrana na superfície de um linfócito B. A molécula de IgM apresenta mais um domínio CH do que a de IgG, e a forma de membrana do anticorpo possui porções C-terminais transmembranas e citoplasmáticas que ancoram a molécula na membrana plasmática. C, Estrutura da molécula humana de IgG, revelada por cristalografia por raios X. Neste diagrama de fita da molécula secretada de IgG, as cadeias pesadas são mostradas em azul e vermelho, e as cadeias leves, em verde; os carboidratos são mostrados em cinza.
(Cortesia de Dr. Alex McPherson, University of California, Irvine.)
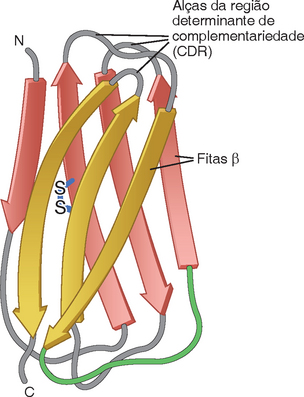
FIGURA 5-2 Estrutura de um domínio de Ig. Cada domínio é composto por duas fitas β antiparalelas, mostradas em amarelo e vermelho, formando duas lâminas β-pregueadas, unidas por uma ponte de dissulfeto. Um esquema do domínio C é mostrado, contendo três e quatro fitas β em duas lâminas. Note que as alças que conectam as fitas β são, às vezes, adjacentes em uma mesma lâmina pregueada; ocasionalmente, porém, as alças representam conexões entre duas lâminas diferentes, formando um domínio Ig. Três alças de cada domínio variável contribuem para a ligação ao antígeno e são denominadas regiões determinantes de complementariedade (CDR).
As cadeias pesadas e as cadeias leves são compostas por regiões aminoterminais variáveis (V), que participam do reconhecimento de antígenos, e regiões carboxiterminais constantes (C); as regiões C das cadeias pesadas medeiam as funções efetoras das moléculas de anticorpo. Nas cadeias pesadas, a região V é composta por um domínio Ig e a região C, por três ou quatro domínios Ig. Cada cadeia leve é composta por um domínio Ig da região C e um domínio Ig da região V. As regiões variáveis são assim chamadas por conterem áreas de variabilidade na sequência de aminoácidos, que diferem os anticorpos sintetizados por um clone de linfócito B dos anticorpos produzidos por outros clones. A região V de uma cadeia pesada (VH) e a região V da cadeia leve (VL) formam o sítio de ligação ao antígeno (Fig. 5-1). Uma vez que a unidade estrutural central de cada molécula de anticorpo contém duas cadeias pesadas e duas cadeias leves, cada imunoglobulina apresenta pelo menos dois sítios de ligação ao antígeno. Os domínios da região C são separados do sítio de ligação ao antígeno e não participam do reconhecimento desta molécula. As regiões C da cadeia pesada interagem com outras moléculas efetoras e células do sistema imune e, portanto, medeiam a maioria das funções biológicas dos anticorpos. Além disso, as cadeias pesadas podem apresentar duas formas, conforme sua extremidade carboxiterminal: uma forma da cadeia pesada ancora anticorpos ligados à membrana na superfície dos linfócitos B e a outra forma é secretada quando associada a cadeias leves de Ig. As regiões C das cadeias leves não participam de funções efetoras nem são diretamente ligadas a membranas celulares.
As cadeias leves e pesadas são covalentemente ligadas por pontes dissulfeto formadas entre resíduos de cisteína presentes nas terminações carboxil da cadeia leve e do domínio CH1 da cadeia pesada. Interações não covalentes entre os domínios VL e VH e entre os domínios CL e CH1 podem também contribuir para a associação de cadeias leves e pesadas. As duas cadeias pesadas de cada molécula de anticorpo são também covalentemente ligadas por pontes dissulfeto. Em anticorpos IgG, estas pontes são formadas entre resíduos de cisteína nas regiões CH2, próximas à região conhecida como dobradiça (descrita a seguir). Em outros isótopos, as pontes dissulfeto podem estar localizadas em outras áreas. Interações não covalentes (p. ex., entre os terceiros domínios CH [CH3]) podem também atuar no pareamento das cadeias pesadas.
As associações entre as cadeias das moléculas de anticorpos e as funções das diferentes regiões das imunoglobulinas foram deduzidas pela primeira vez por experimentos realizados por Rodney Porter, em que a IgG de coelhos era clivada por enzimas proteolíticas em fragmentos com propriedades estruturais e funcionais distintas. Nas moléculas de IgG, a região mais estendida da “dobradiça”, entre os domínios CH1 e CH2 da cadeia pesada, é o segmento mais suscetível à clivagem proteolítica. Quando a IgG de coelhos é tratada com a enzima papaína, sob condições de proteólise limitada, há clivagem da molécula na região da dobradiça, formando três segmentos (Fig. 5-3A). Dois destes segmentos são idênticos um ao outro e compostos pela cadeia leve completa (VL e CL) associada a um fragmento VH-CH1 da cadeia pesada. Estes fragmentos mantêm a capacidade de se ligar a antígenos, já que cada um contém um par de domínios VL e VH, sendo denominados Fab (fragmento de ligação ao antígeno). O terceiro segmento é composto por dois peptídeos idênticos ligados por pontes dissulfeto, contendo os domínios CH2 e CH3 da cadeia pesada. Este segmento da IgG apresenta propensão à autoassociação e a se cristalizar em treliça, sendo, portanto, denominado Fc (fragmento cristalizável). Quando a pepsina (em vez da papaína) é usada para clivar a IgG de coelho sob condições de proteólise limitada, a molécula é partida na região distal à dobradiça, gerando um fragmento de ligação ao antígeno, chamado F(ab’)2, sem afetar a dobradiça nem as pontes dissulfeto intercadeias (Fig. 5-3B).
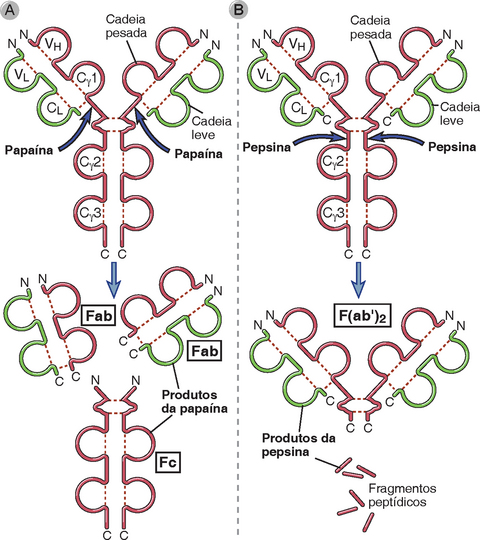
FIGURA 5-3 Fragmentos proteolíticos de uma molécula de IgG. As moléculas de IgG são clivadas pelas enzimas papaína (A) e pepsina (B) nos sítios indicados pelas setas. A digestão por papaína permite a separação das duas regiões de ligação ao antígeno (os fragmentos Fab) da porção da molécula de IgG se liga a proteínas do sistema complemento e a receptores de Fc (o fragmento Fc). A pepsina gera um único fragmento bivalente de ligação ao antígeno, F(ab′)2.
Os resultados da proteólise limitada com papaína ou pepsina de outros isótipos além da IgG, ou da IgG de outras espécies que não o coelho, nem sempre ocorrem como anteriormente descrito. No entanto, a organização básica da molécula de Ig que Porter deduziu de seus experimentos é comum a todos os anticorpos de todos os isótipos e a todas as espécies animais. Na verdade, estes experimentos de proteólise forneceram a primeira evidência de que as funções de reconhecimento de antígenos e as funções efetoras das moléculas de imunoglobulina são espacialmente segregadas.
Muitas outras proteínas do sistema imune, assim como outras proteínas que não têm relação com a imunidade, apresentam domínios com a estrutura dobrada da Ig – ou seja, duas lâminas β-pregueadas, unidas por uma ponte de dissulfeto. Embora tal estrutura em domínios tenha evoluído muito antes do desenvolvimento dos vertebrados, diz-se que todas as moléculas que a contêm essa estrutura pertencem à superfamília Ig, e acredita-se que todos os segmentos gênicos que codificam os domínios Ig destas moléculas evoluíram de um gene ancestral. Os domínios Ig são classificados como símile a V ou símile a C, com base em sua homologia aos domínios V ou C das imunoglobulinas. Os domínios V são formados por um polipeptídeo mais longo do que os domínios C, e contêm duas fitas β a mais no sanduíche de lâminas β. Um terceiro tipo de domínio Ig, denominado C2 ou H, apresenta comprimento similar àquele apresentado por domínios C, mas possui sequências características de domínios V e C. Exemplos de membros da superfamília Ig relevantes ao sistema imunológico são mostrados na Figura 5-4.
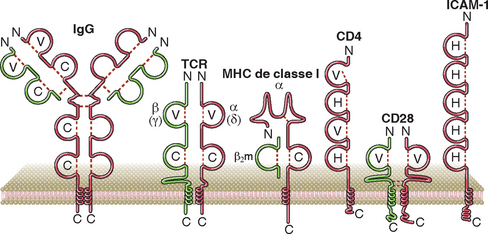
FIGURA 5-4 Exemplos de proteínas da superfamília Ig no sistema imune. Dentre os exemplos, incluem-se a molécula de IgG ligada à membrana, o receptor de linfócitos T, a molécula de MHC de classe I, um correceptor dos linfócitos T, a molécula CD4, o CD28, um receptor coestimulador de linfócitos T, e a molécula de adesão ICAM-1.
Características Estruturais das Regiões Variáveis dos Anticorpos
A maioria das diferenças de sequência e da variabilidade entre diferentes anticorpos é confinada a três curtos segmentos localizados na região V da cadeia pesada e a três curtos segmentos localizados na região V da cadeia leve. Estes segmentos são conhecidos como segmentos hipervariáveis, e correspondem a três alças protrusas que conectam fitas adjacentes das lâminas β que formam os domínios V das cadeias proteicas pesadas e leves das Ig (Fig. 5-5). Cada região hipervariável apresenta cerca de 10 resíduos de aminoácidos de comprimento, e sua posição é mantida pelas sequências estruturais mais conservadas que formam o domínio Ig da região V. Os mecanismos genéticos que geram a variabilidade de aminoácidos são discutidos no Capítulo 8. Em uma molécula de anticorpo, as três regiões hipervariáveis do domínio VL e as três regiões hipervariáveis do domínio VH são unidas, formando a superfície de ligação ao antígeno. As alças hipervariáveis podem ser imaginadas como dedos saindo de cada domínio variável; a união de três dedos da cadeia pesada e três dedos da cadeia leve forma o sítio de ligação ao antígeno (Fig. 5-6). Uma vez que estas sequências formam uma superfície que é complementar à estrutura tridimensional do antígeno ligado, as regiões hipervariáveis são também denominadas regiões determinantes de complementariedade (CDR). Da porção aminoterminal de VL ou VH, estas regiões são denominadas CDR1, CDR2 e CDR3. Os CDR3 dos segmentos VH e VL são os mais variáveis dentre estas regiões. Como será discutido no Capítulo 8, existem mecanismos especiais de geração de maior diversidade na sequência de CDR3 do que em CDR1 e CDR2. As diferenças sequenciais entre os CDR de diferentes moléculas de anticorpos contribuem para a formação de superfícies de interação distintas e, portanto, para a geração das especificidades de cada anticorpo. A capacidade de dobramento da região V em um domínio Ig é determinada, principalmente, pelas sequências conservadas das regiões estruturais adjacentes aos CDR. O confinamento da variabilidade sequencial a três segmentos curtos permite a manutenção da estrutura básica de todos os anticorpos, apesar da variabilidade existente entre as diferentes moléculas de imunoglobulina.
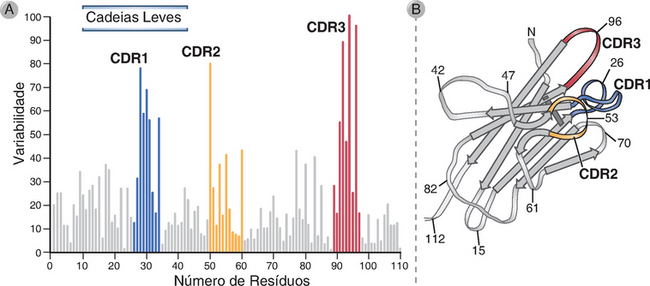
FIGURA 5-5 Regiões hipervariáveis das moléculas de imunoglobulina. A, Gráfico de Kabat-Wu da variabilidade de aminoácido em moléculas de anticorpo. O histograma mostra a extensão da variabilidade, definida como o número de diferenças em cada resíduo de aminoácido entre diversas cadeias leves independentemente sequenciadas de Ig em relação ao número de resíduos de aminoácidos da porção aminoterminal. Este método de análise, desenvolvido por Elvin Kabat e Tai Te Wu, indica que os resíduos mais variáveis são agrupados em três regiões “hipervariáveis”, mostradas em azul, amarelo e vermelho, correspondendo a CDR1, CDR2 e CDR3, respectivamente. As três regiões hipervariáveis são também encontradas nas cadeias pesadas. B, Projeção tridimensional das alças hipervariáveis do CDR no domínio V da cadeia leve. A região V da cadeia leve é mostrada com as alças dos CDR1, CDR2 e CDR3 coloridas em azul, amarelo e vermelho, respectivamente. Estas alças correspondem às regiões hipervariáveis no gráfico de variabilidade mostrado em A. As regiões hipervariáveis da cadeia pesada (não mostradas) estão também localizadas nas três alças, e todas as seis alças são justapostas na molécula de anticorpo, formando a superfície de ligação ao antígeno (Fig. 5-6).
(Cortesia de Dr. E. A. Kabat, Department of Microbiology, Columbia University College of Physicians and Surgeons, New York.)
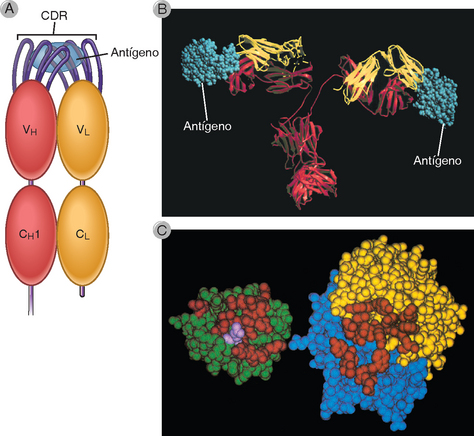
FIGURA 5-6 Ligação de um antígeno a um anticorpo. A, Desenho esquemático das regiões determinantes de complementariedade (CDR) que geram o sítio de ligação ao antígeno. Os CDR da cadeia pesada e da cadeia leve são alças que se projetam da superfície de dois domínios V e que, combinadas, criam a superfície de ligação ao antígeno. B, Este modelo de um antígeno proteico globular (lisozima de ovo de galinha) ligado a uma molécula de anticorpo mostra como o sítio de ligação ao antígeno pode acomodar macromoléculas solúveis em sua conformação nativa (dobrada). As cadeias pesadas do anticorpo são mostradas em vermelho, as cadeias leves, em amarelo e o antígeno, em azul. C, Vista das superfícies de interação entre a lisozima de ovo de galinha (em verde) e o fragmento Fab de um anticorpo monoclonal antilisozima de ovo de galinha (VH em azul e VL em amarelo). Os resíduos da lisozima de ovo de galinha e do fragmento Fab que interagem uns com os outros são mostrados em vermelho. Um importante resíduo de glutamina na lisozima (em magenta) se encaixa na “fenda” do anticorpo.
B, (Cortesia de Dr. Dan Vaughn, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.) C, (Reimpresso com permissão de Amit AG, RA Mariuzza, SE Phillips, and RJ Poljak. Three dimensional structure of an antigen antibody complex at 2.8A resolution. Science 233, 747-753, 1986. Copyright 1986 AAAS.)
A ligação do antígeno às moléculas de anticorpo é, principalmente, uma função das regiões hipervariáveis de VH e VL. Análises cristalográficas dos complexos antígenos-anticorpos mostram que os resíduos de aminoácidos das regiões hipervariáveis formam múltiplos contatos com o antígeno ligado (Fig. 5-6). O contato mais extenso é feito com a terceira região hipervariável (CDR3), que é também a mais variável dentre os três CDR. No entanto, a ligação ao antígeno não é apenas uma função dos CDR, e resíduos estruturais também podem fazer contato com o antígeno. Além disso, durante a ligação de alguns antígenos, um ou mais dos CDR podem estar fora da região de contato com a molécula, não participando desta interação.
Características Estruturais das Regiões Constantes dos Anticorpos
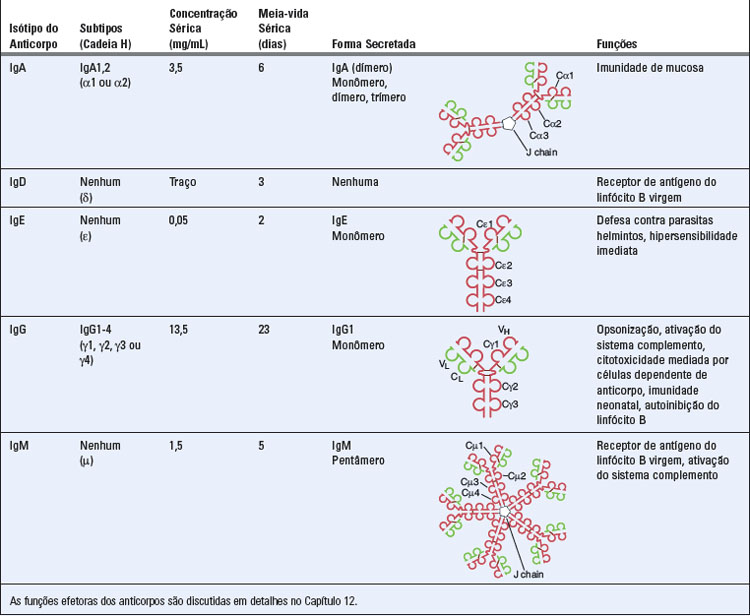
As moléculas de anticorpos podem ser divididas em classes e subclasses distintas com base nas diferenças estruturais de suas regiões C da cadeia pesada. As classes de moléculas de anticorpos são também chamadas isótipos e são denominadas de IgA, IgD, IgE, IgG e IgM (Tabela 5-2). Em seres humanos, os isótipos IgA e IgG podem ainda ser subdivididos em subclasses, ou subtipos, chamadas IgA1 e IgA2, e IgG1, IgG2, IgG3 e IgG4 (em camundongos, que são frequentemente usados no estudo das respostas imunes, o isótipo IgG é dividido em IgG1, IgG2a, IgG2b e IgG3; certas linhagens destes animais, incluindo C57BL/6, não apresentam o gene que codifica IgG2a, mas sintetizam um isótipo similar, chamado IgG2c). As regiões C da cadeia pesada de todas as moléculas de anticorpos de um isótipo ou subtipo apresentam, essencialmente, a mesma sequência de aminoácidos. Esta sequência é diferente em anticorpos de outros isótipos ou subtipos. As cadeias pesadas são designadas pela letra do alfabeto grego que corresponde ao isótipo do anticorpo: a IgA1 contém cadeias pesadas α1; a IgA2, α2; a IgD, δ; a IgE, ε; a IgG1, γ1; a IgG2, γ2; a IgG3, γ3; a IgG4, γ4; e a IgM, μ. Nos anticorpos IgM e IgE dos seres humanos, as regiões C contêm quatro domínios Ig sequenciais (Fig. 5-1). As regiões C da IgG, da IgA e da IgD contêm apenas três domínios Ig. Estes domínios são genericamente designados domínios CH e numerados de forma sequencial, da porção aminoterminal à carboxiterminal (p. ex., CH1, CH2 e assim por diante). Em cada isótipo, estas regiões podem ser designadas de forma mais específica (p. ex., Cγ1 e Cγ2 em IgG).
Diferentes isótipos e subtipos de anticorpos realizam diferentes funções efetoras. Isto se deve ao fato de que a maioria das funções efetoras dos anticorpos é mediada pela ligação das regiões C da cadeia pesada a receptores de Fc em diferentes células, como fagócitos, células NK e mastócitos, e a proteínas plasmáticas, como aquelas do sistema complemento. Isótipos e subtipos de anticorpos apresentam diferentes regiões C e, portanto, ligam-se a diferentes células e/ou moléculas e executam funções efetoras diversas. As funções efetoras mediadas por cada isótipo de anticorpo são listadas na Tabela 5-2 e são discutidas, em mais detalhes, em seções posteriores deste capítulo e no Capítulo 12.
As moléculas de anticorpos são flexíveis, permitindo sua ligação a diferentes formas de antígenos. Todos os anticorpos contêm pelo menos dois sítios de ligação ao antígeno, cada um formado pelo par de domínios VH e VL. Muitas moléculas de Ig podem orientar estes sítios de ligação, de modo que duas moléculas de antígeno em uma superfície planar (p. ex., uma célula) possam ser engajados de uma só vez (Fig. 5-7). Esta flexibilidade é conferida, em grande parte, pela região da dobradiça localizada, em certos isótipos, entre CH1 e CH2. A região da dobradiça apresenta comprimento variável, de 10 a mais de 60 resíduos de aminoácidos, dependendo dos isótipos. Partes desta sequência assumem conformações mais estendidas e flexíveis, permitindo a movimentação molecular entre os domínios CH1 e CH2. Algumas das maiores diferenças entre as regiões constantes das subclasses de IgG são concentradas na região de dobradiça, levando à geração dos diferentes formatos apresentados pelos subtipos destes anticorpos. Além disso, certa flexibilidade das moléculas de anticorpo se deve à capacidade de rotação de cada domínio VH em relação ao domínio CH1 adjacente.
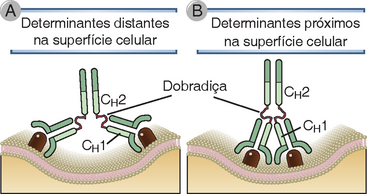
FIGURA 5-7 Flexibilidade da molécula de anticorpo. Os dois sítios de ligação ao antígeno de um monômero de Ig podem, simultaneamente, se ligar a dois determinantes separados por distâncias variáveis. Em A, uma molécula de Ig está ligada a dois determinantes distantes na superfície celular e, em B, o mesmo anticorpo está ligado a dois determinantes próximos. Esta flexibilidade é devida, principalmente, às regiões da dobradiça localizadas entre os domínios CH1 e CH2, que permitem a movimentação independente dos sítios de ligação ao antígeno em relação ao restante da molécula.
Existem duas classes, ou isótipos, de cadeias leves, chamadas κ e λ, que são diferenciadas por suas regiões carboxiterminais constantes (C). Uma molécula de anticorpo apresenta duas cadeias leves idênticas κ ou duas cadeias leves idênticas λ. Em seres humanos, cerca de 60% das moléculas de anticorpo apresentam cadeias leves κ e cerca de 40%, cadeias leves λ. Alterações significativas nesta relação podem ser observadas em pacientes com tumores de linfócitos B, uma vez que muitas células neoplásicas, por serem derivadas de um clone de linfócito B, produzem uma única espécie de moléculas de anticorpo, todas com a mesma cadeia leve. Na verdade, a alteração na relação entre a frequência de células produtoras de cadeias leves κ e λ costuma ser clinicamente empregada no diagnóstico de linfomas de células B. Em camundongos, os anticorpos contendo cadeias κ são cerca de 10 vezes mais abundantes do que aqueles portadores de cadeias λ. Diferentemente do observado nos isótipos de cadeia pesada, não existem diferenças conhecidas entre a função de anticorpos contendo cadeias κ ou λ.
Anticorpos secretados e associados à membrana apresentam diferentes sequências de aminoácidos na porção carboxiterminal da região C da cadeia pesada. Na forma secretada, encontrada no sangue e em outros fluidos extracelulares, a porção carboxiterminal é hidrofílica. Nos anticorpos ligados à membrana, o segmento carboxiterminal apresenta uma α-hélice hidrofóbica e um segmento intracelular de carga positiva, que auxiliam a ancoragem da proteína na membrana (Fig. 5-8). Nas moléculas de IgM e de IgD de membrana, a porção citoplasmática da cadeia pesada é curta, contendo apenas três resíduos de aminoácidos; na IgG e na IgE de membrana, esta área é ligeiramente maior, possuindo até 30 resíduos de aminoácidos.
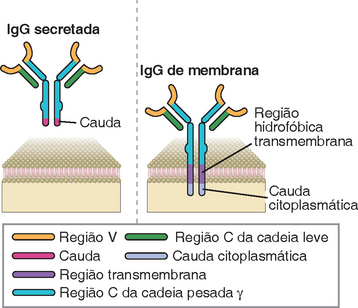
FIGURA 5-8 Formas de membranas e secretadas das cadeias pesadas de Ig. As formas de membrana das cadeias pesadas de Ig, mas não as formas secretadas, contêm regiões transmembrana formadas por resíduos hidrofóbicos de aminoácidos e domínios citoplasmáticos significativamente diferentes entre os vários isótipos. A porção citoplasmática da forma membranar da cadeia μ contém apenas três resíduos, enquanto a região citoplasmática das cadeias pesadas de IgG (cadeias pesadas γ) contém de 20 a 30 resíduos. As formas secretadas dos anticorpos acabam na região C-terminal da cauda, que também difere entre os isótipos: a cadeia μ apresenta cauda longa (com 21 resíduos), que participa da formação do pentâmero, enquanto a IgG possui cauda curta (3 resíduos).
As IgG e IgE secretadas e todas as moléculas de Ig de membrana, independentemente do isótipo, são monoméricas em relação à unidade estrutural básica do anticorpo (i. e., contêm duas cadeias pesadas e duas cadeias leves). Por outro lado, as IgM e IgA de mucosa secretadas formam complexos multiméricos, em que duas ou mais das unidades estruturais básicas do anticorpo, isto é, contendo quatro cadeias, são covalentemente unidas. Nesse sentido, a IgM pode ser secretada como pentâmeros e hexâmeros formados pelas unidades básicas de quatro cadeias, enquanto IgA é frequentemente secretada como dímero. Estes complexos são formados por interações entre as regiões chamadas mais terminais da cauda (região chamada Fc), que estão localizadas nas porções carboxiterminais das formas secretadas das cadeias pesadas μ e α (Tabela 5-2). As moléculas multiméricas de IgM e IgA também apresentam um polipeptídeo de 15 kD denominado cadeia de junção (J), que forma pontes de dissulfeto com as caudas e estabiliza os complexos multiméricos, além de auxiliar no transporte desses multímeros através de epitélios, da porção basolateral à luminal. Como veremos mais adiante, as formas multiméricas dos anticorpos se ligam aos antígenos com maior avidez do que as formas monoméricas, mesmo quando os dois tipos de imunoglobulinas contêm fragmentos Fab que se unem ao antígeno igualmente bem.
Anticorpos de diferentes espécies diferem entre si quanto às regiões C e partes estruturais das regiões V. Portanto, quando moléculas de Ig de uma espécie são introduzidas em animais de outra espécie (p. ex., anticorpos séricos equinos ou anticorpos monoclonais de camundongos injetados em seres humanos), o aceptor (nesse caso, o homem) monta uma resposta imune e sintetiza anticorpos direcionados, em grande parte, às regiões C da Ig administrada. Esta resposta frequentemente cria uma enfermidade chamada doença do soro (Cap. 18) e, assim, limita muito a capacidade de tratamento de indivíduos com anticorpos produzidos por outras espécies. Grandes esforços foram empreendidos na solução deste problema, através da criação de anticorpos monoclonais, e esta questão é discutida, em maior profundidade, mais à frente. Diferenças sequenciais menores são observadas em anticorpos provenientes de diferentes indivíduos, mesmo naqueles pertencentes à mesma espécie, refletindo polimorfismos hereditários nos genes que codificam as regiões C das cadeias pesadas e leves das Ig. Quando uma variante polimórfica encontrada em alguns indivíduos da mesma espécie pode ser reconhecida por um anticorpo, é denominada alótipo, e o anticorpo que reconhece um determinante alotípico é chamado anticorpo antialotípico. As diferenças observadas entre as regiões V dos anticorpos são relacionadas aos CDR e constituem os idiótipos dos anticorpos. Um anticorpo que reconhece algumas diferenças dos CDR de outro anticorpo é, portanto, chamado um anticorpo anti-idiotípico. Segundo interessantes teorias, os indivíduos produzem anticorpos anti-idiotípicos contra seus próprios anticorpos, que controlam as respostas imunes, mas existem poucas evidências que sustentem a importância deste possível mecanismo de regulação imunológica.
Anticorpos Monoclonais
Um tumor de plasmócitos (mieloma ou plasmocitoma) é monoclonal e, portanto, produz anticorpos de uma única especificidade. Na maioria dos casos, a especificidade do anticorpo derivado do tumor não é conhecida, de modo que este não pode ser usado na detecção ou ligação a moléculas de interesse. No entanto, a descoberta de anticorpos monoclonais produzidos por estes tumores originou a ideia da possibilidade de síntese de anticorpos monoclonais similares, de qualquer especificidade desejada, por células imortalizadas produtoras de anticorpos de um animal imunizado com um antígeno conhecido. A técnica empregada foi descrita por Georges Kohler e Cesar Milstein, em 1975, e provou ser um dos mais valiosos avanços em toda a pesquisa científica e medicina clínica. Este método é baseado na fusão de linfócitos B de um animal imunizado (geralmente um camundongo) com uma linhagem celular de mieloma e no cultivo das células em condições nas quais as células normais, não fundidas, e tumorais não podem sobreviver (Fig. 5-9). As células fundidas resultantes são denominadas hibridomas; cada hibridoma produz apenas uma Ig. Os anticorpos secretados por muitos clones de hibridomas são separados conforme sua ligação ao antígeno de interesse, e este único clone, com a especificidade desejada, é selecionado e expandido. Os produtos destes clones são anticorpos monoclonais, específicos para um único epítopo de um antígeno, ou mistura de antígenos, usado na identificação das células secretoras de Ig.
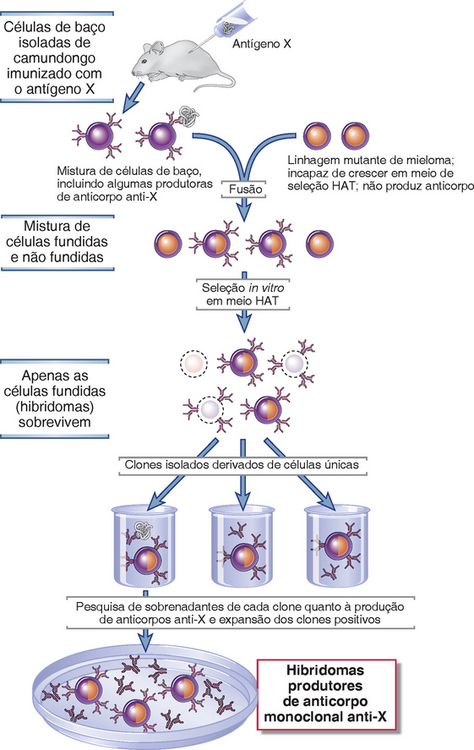
FIGURA 5-9 A geração de anticorpos monoclonais. Neste procedimento, células de baço de um camundongo que foi imunizado com um antígeno conhecido ou uma mistura de antígenos conhecidos são fundidas com uma linhagem celular de mieloma deficiente em enzimas, usando substâncias químicas como polietieleno glicol para facilitar a fusão das membranas plasmáticas e a formação de células híbridas que retêm muitos cromossomos dos dois tipos celulares originais. O mieloma empregado não secreta suas próprias Ig. Estas células híbridas são, então, colocadas em um meio de seleção que permite a sobrevivência apenas dos híbridos imortalizados; estas células híbridas são cultivadas em clones celulares únicos e analisadas quanto à secreção do anticorpo de interesse. O meio de seleção contém hipoxantina, aminopterina e timidina e é, portanto, denominado HAT. A maioria das células apresenta duas vias de síntese de purina, a via de novo, que precisa de tetra-hidrofolato, e a via secundária, que usa a enzima hipoxantina-guanina fosforribosiltransferase (HGPRT). Células de mieloma que não possuem HGPRT são usadas na fusão, e normalmente sobrevivem utilizando a síntese de novo de purina. Na presença de aminopterina, o tetra-hidrofolato não é sintetizado, danificando a síntese de novo de purina e também a biossíntese de pirimidina, por geração de TMP de dUMP. As células híbridas recebem HGPRT dos esplenócitos e apresentam a capacidade de proliferação incontrolável do mieloma; caso recebam hipoxantina e timidina, estas células pode sintetizar DNA na ausência de tetra-hidrofolato. Assim, apenas células híbridas sobrevivem no meio HAT.
Os anticorpos monoclonais possuem muitas aplicações práticas na pesquisa e no diagnóstico e na terapia médica. Algumas de suas aplicações comuns são:
• A identificação de marcadores fenotípicos únicos a determinados tipos celulares. A base da moderna classificação dos linfócitos e de outros leucócitos é o reconhecimento de populações celulares por meio de anticorpos monoclonais específicos. Estes anticorpos têm sido usados na definição dos grupamentos (clusters) de diferenciação (CD) de diversos tipos celulares (Cap. 2).
• Imunodiagnóstico. O diagnóstico de muitas doenças infecciosas e sistêmicas é baseado na detecção de determinados antígenos ou anticorpos na circulação ou em tecidos, através da utilização de anticorpos monoclonais em imunoensaios (Apêndice IV).
• Detecção de tumores. Anticorpos monoclonais específicos contra tumores são usados na detecção de neoplasias por técnicas de diagnóstico por imagem e coloração de tecidos com imunoglobulinas marcadas.
• Terapia. Os avanços da pesquisa médica levaram à identificação de células e moléculas envolvidas na patogênese de muitas doenças. Os anticorpos monoclonais, por sua grande especificidade, podem ser direcionados a tais células e moléculas. Hoje, diversos anticorpos monoclonais são usados no tratamento de doenças (Tabela 5-3). Alguns exemplos desta aplicação são os anticorpos contra a citocina chamada fator de necrose tumoral (TNF), usados no tratamento da artrite reumatoide e de outras doenças inflamatórias, os anticorpos contra CD20 para tratamento das leucemias de linfócitos B e depleção de linfócitos B em portadores de certas doenças autoimunes, os anticorpos contra o receptor do fator de crescimento epidérmico de tipo 2 para erradicação das células do câncer de mama, os anticorpos contra o fator de crescimento endotelial vascular (a citocina promotora da angiogênese) em pacientes com câncer de cólon e assim por diante.
• Análise funcional de moléculas secretadas ou ancoradas à superfície celular. Na pesquisa biológica, os anticorpos monoclonais que se ligam às moléculas de superfície celular e estimulam ou inibem dadas funções celulares são ferramentas valiosíssimas na definição dos papéis destas moléculas, incluindo receptores para antígenos. Os anticorpos monoclonais são também bastante usados na purificação de populações celulares selecionadas de misturas complexas, facilitando o estudo das propriedades e funções destas células.
TABELA 5-3 Anticorpos Monoclonais de Significado Terapêutico
| Alvo | Efeito | Doenças |
|---|---|---|
| CD20 | Depleção de linfócitos B | Artrite reumatoide, esclerose múltipla, outras doenças autoimunes |
| VEGF | Bloqueio da angiogênese tumoral | Câncer de mama, câncer de cólon |
| HER2/Neu | Depleção de células tumorais com amplificação de HER2 | Câncer de mama |
| TNF | Inibição da inflamação mediada pelos linfócitos T | Artrite reumatoide, doença de Crohn |
Uma das limitações ao uso de anticorpos monoclonais em terapias é o fato de que tais imunoglobulinas são mais facilmente produzidas por meio da imunização de camundongos; no entanto, pacientes tratados com anticorpos monoclonais murinos podem sintetizar anticorpos contra a Ig destes animais, em uma reação denominada resposta humana antianticorpo de camundongo. Estes anticorpos anti-Ig eliminam o anticorpo monoclonal administrado e também podem provocar a doença do soro. Técnicas de engenharia genética são usadas para expandir a utilidade dos anticorpos monoclonais. O DNA complementar (cDNA) que codifica as cadeias polipeptídicas de um anticorpo monoclonal pode ser isolado do hibridoma, e estes genes podem ser manipulados in vitro. Como anteriormente discutido, apenas pequenas porções da molécula de anticorpo são responsáveis pela ligação ao antígeno; o restante da molécula pode ser visto como estrutural. Esta organização estrutural permite que segmentos de DNA que codificam o sítio de ligação ao antígeno de um anticorpo monoclonal murino sejam “costurados” ao cDNA que codifica a proteína (Ig) humana do mieloma, criando um gene híbrido. Quando expressa, a proteína híbrida resultante, que retém a especificidade antigênica do anticorpo monoclonal murino original, mas apresenta estrutura central de Ig humana, é denominada anticorpo humanizado. Anticorpos humanizados apresentam menor probabilidade de serem vistos como “estranhos” ao corpo humano e estimularem respostas antianticorpo do que os monoclonais de camundongos.
SÍNTESE, MONTAGEM E EXPRESSÃO DAS MOLÉCULAS DE IG
As cadeias pesadas e leves de imunoglobulinas, como muitas das proteínas secretadas e de membrana, são sintetizadas por ribossomos ligados à membrana celular em retículos endoplasmáticos rugosos. A proteína é translocada ao retículo endoplasmático, e as cadeias pesadas de Ig são N-glicosiladas durante o processo de translocação. O enovelamento adequado das cadeias pesadas de Ig e sua montagem com as cadeias leves são regulados por proteínas residentes no retículo endoplasmático, chamadas chaperoninas. Estas proteínas, que incluem a calnexina e uma molécula denominada BiP (proteína de ligação), se unem aos polipeptídeos recém-sintetizados da Ig, garantindo que sejam retidas ou degradadas, a não ser que dobradas e montadas da maneira adequada em moléculas completas de Ig. A associação covalente das cadeias pesadas e leves, estabilizada pela formação de pontes de dissulfeto, é parte do processo de montagem e também ocorre no retículo endoplasmático. Depois da montagem, as moléculas de Ig são liberadas das chaperoninas, transportadas até as cisternas do complexo de Golgi, onde os carboidratos são modificados, e, então, enviadas à membrana plasmática em vesículas. Os anticorpos expressos na membrana são ancorados à bicamada de fosfolipídeos, e a forma secretada é transportada para fora da célula.
A maturação dos linfócitos B a partir de progenitores da medula óssea é acompanhada por alterações específicas na expressão do gene da Ig, resultando na produção de moléculas de anticorpos em diferentes formas (Fig. 5-10). A primeira célula na linhagem dos linfócitos B a produzir polipeptídeos de Ig, chamada pré-linfócito B, sintetiza a cadeia pesada μ. Estas cadeias μ se associam a proteínas denominadas cadeias leves substitutivas, formando o receptor do pré-linfócito B; pequenas quantidades deste receptor são expressas na superfície celular. Linfócitos B imaturos e maduros produzem cadeias leves κ ou λ, que se associam às proteínas μ para formar as moléculas de IgM. Os linfócitos B maduros coexpressam em suas superfícies a IgM e a IgD (cadeias pesadas μ e δ associadas a cadeias leves κ ou λ). Estas Ig de membrana atuam como receptores de superfície celular que reconhecem antígenos e iniciam o processo de ativação do linfócito B. O receptor do pré-linfócito B e o receptor de antígeno do linfócito B são associados, de modo não covalente, a duas outras proteínas integrantes da membrana, Igα e Igβ, que desempenham funções de sinalização e são essenciais à expressão de superfície de IgM e IgD. Os eventos moleculares e celulares ocorridos durante a maturação do linfócito B que baseiam estas alterações na expressão de anticorpos são discutidos, em detalhes, no Capítulo 8.
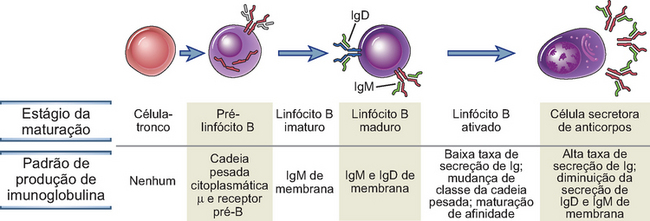
FIGURA 5-10 Expressão de Ig durante a maturação do linfócito B. Os estágios de maturação do linfócito B são mostrados, assim como as alterações associadas à produção das cadeias pesadas e leves da Ig. As cadeias pesadas da IgM são mostradas em vermelho, as cadeias pesadas da IgD, em azul, e as cadeias leves, em verde. Os eventos moleculares que acompanham estas alterações são discutidos nos Capítulos 8 e 11.
Quando linfócitos B maduros são ativados por antígenos e outros estímulos, diferenciam-se em células secretoras de anticorpos. Este processo é também acompanhado por alterações no padrão de produção de Ig. Uma destas alterações é a maior produção da forma secretada da Ig em relação à forma ligada à membrana. Esta alteração ocorre durante o processamento pós-transcrição e será discutida no Capítulo 11. A segunda alteração é a expressão de outros isótipos de cadeia pesada além de IgM e IgD. Este processo, chamado mudança (switching) de isótipo (ou classe) da cadeia pesada, é descrito mais adiante, neste capítulo, e em maiores detalhes no Capítulo 11, quando discutiremos a ativação do linfócito B.
Meia-vida dos Anticorpos
Diferentes isótipos de anticorpos apresentam meias-vidas bastante variáveis na circulação. A meia-vida da IgE é muito curta, de cerca de 2 dias, na circulação (embora a IgE ligada à célula e associada a seu receptor de alta afinidade nos mastócitos apresente meia-vida muito longa; veja o Cap. 19). A IgA circulante apresenta meia-vida de cerca de 3 dias, e a IgM circulante, de aproximadamente 4 dias. Por sua vez, moléculas circulantes de IgG têm meia-vida de cerca de 21 a 28 dias.
A longa meia-vida da IgG é atribuída à sua capacidade de ligação a receptores de Fc específicos, denominados receptores neonatais de Fc (FcRn), que também estão envolvidos no transporte da IgG da circulação materna através da barreira placentária e na transferência da IgG materna pelo intestino dos neonatos. O FcRn é estruturalmente similar às moléculas de MHC de classe I, mas não apresenta a fenda de ligação peptídica e, em determinados tecidos, como a placenta e o intestino neonatal, transporta as moléculas de IgG através das células, sem enviá-las aos lisossomos. Em vertebrados adultos, o FcRn é encontrado na superfície de células endoteliais (e de outros tipos celulares) e se liga à IgG micropinocitada em endossomos ácidos. O FcRn não direciona a IgG para os lisossomos, mas a sequestra por um período e, então, a devolve à circulação, ao voltar à superfície celular, liberando-a em pH neutro (Fig. 5-11). Este sequestro intracelular da IgG por períodos significativos impede que sua degradação seja tão rápida quanto a das demais proteínas séricas, incluindo outros isótipo de anticorpos, e, assim, a meia-vida da IgG é relativamente longa. Esta maior meia-vida da IgG é usada para conferir vantagens terapêuticas a certas proteínas administradas, através da produção de proteínas fundidas, contendo a parte biologicamente ativa da molécula e a porção Fc da IgG. Uma proteína fundida usada com fins terapêuticos é o TNFR-Ig, composto por um domínio extracelular do receptor de tipo II do TNF e um domínio Fc de IgG; esta molécula é empregada no tratamento de certas doenças autoimunes, como a artrite reumatoide e a psoríase, por bloquear as ações inflamatórias do TNF. Outra proteína fundida terapeuticamente utilizada é o CTLA4-Ig, que contém o domínio extracelular do receptor inibidor de CTLA-4 e a porção Fc da IgG humana; esta proteína é também usada no tratamento da artrite reumatoide e pode ser empregada como imunossupressor (Fig. 9-7, Cap. 9).
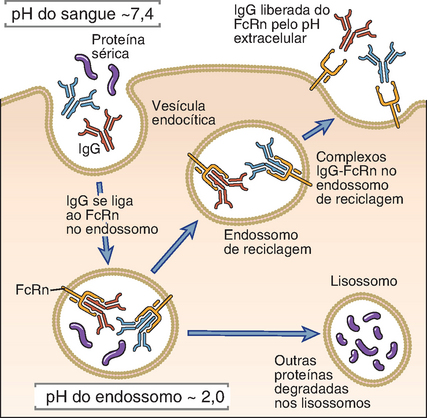
FIGURA 5-11 O FcRn contribui para a longa meia-vida das moléculas de IgG. Moléculas de IgG micropinocitadas por células endoteliais se ligam ao FcRn, um receptor de IgG, no ambiente ácido dos endossomos. Nas células endoteliais, o FcRn sequestra as moléculas de IgG e as libera quando as vesículas se fundem à superfície celular, expondo os complexos FcRn-IgG ao pH neutro.
LIGAÇÃO ENTRE ANTICORPOS E ANTÍGENOS
Todas as funções dos anticorpos são dependentes de sua capacidade de ligação específica a antígenos. A seguir, discutiremos a natureza dos antígenos e seu reconhecimento pelos anticorpos.
Características dos Antígenos Biológicos
Um antígeno é qualquer substância que pode ser especificamente ligada a uma molécula de anticorpo ou receptor de linfócitos T. Os anticorpos podem reconhecer como antígenos quase todos os tipos de moléculas biológicas, incluindo metabólitos intermediários simples, açúcares, lipídeos, autacoides e hormônios, assim como macromoléculas, como carboidratos complexos, fosfolipídeos, ácidos nucleicos e proteínas. Os linfócitos T, por sua vez, reconhecem principalmente peptídeos (Cap. 6).
Embora todos os antígenos sejam reconhecidos por linfócitos ou anticorpos específicos, apenas alguns antígenos são capazes de ativar os linfócitos. As moléculas que estimulam as respostas imunológicas são denominadas imunógenos. Somente macromoléculas são capazes de estimular linfócitos B, iniciando respostas imunes humorais, uma vez que a ativação desta célula requer a ligação cruzada (cross-linking) de múltiplos receptores de antígeno com os seus respectivos antígenos proteicos, para estimulação de linfócitos T auxiliares (helper). Pequenas substâncias químicas, como o dinitrofenol, podem se ligar a anticorpos e são, portanto, antígenos, mas não são capazes de ativar, sozinhos, os linfócitos B (i. e., não são imunogênicos). Para a geração de anticorpos específicos a tais pequenas substâncias químicas, os imunologistas geralmente ligam diversas cópias desses pequenos químicos a uma proteína ou um polissacarídeo antes da imunização. Nestes casos, a molécula pequena é chamada hapteno, e a molécula grande à qual é conjugada é denominada carreador. Um complexo hapteno-carreador, diferentemente do hapteno livre, pode atuar como imunógeno (Cap. 11).
Macromoléculas, como proteínas, polissacarídeos e ácidos nucleicos, são geralmente muito maiores do que a região de ligação ao antígeno de uma molécula de anticorpo (Fig. 5-6). Portanto, qualquer anticorpo se liga apenas a uma porção da macromolécula, que é chamada determinante ou epítopo. Estas duas palavras são sinônimas, sendo usadas de forma intercambiáveis neste livro. As macromoléculas geralmente contêm múltiplos determinantes, alguns dos quais podem ser repetidos, e cada um, por definição, pode se ligar a um anticorpo. A presença de múltiplos determinantes idênticos em um antígeno é referida como polivalência ou multivalência. Muitas proteínas globulares não apresentam múltiplos epítopos idênticos e não são polivalentes, a não ser que estejam agregadas. No caso dos polissacarídeos e ácidos nucleicos, muitos epítopos idênticos podem ser espaçados regularmente, e estas moléculas são ditas polivalentes. Superfícies celulares, incluindo micro-organismos, frequentemente apresentam grupos polivalentes de determinantes antigênicos proteicos ou de carboidratos. Os antígenos polivalentes podem induzir a agregação de receptores de linfócito B e, assim, iniciar o processo de ativação desta célula (Cap. 7).
A disposição espacial dos diferentes epítopos em uma única molécula proteica pode influenciar a ligação dos anticorpos de diversas formas. Quando os determinantes são bem separados, duas ou mais moléculas de anticorpos podem ser ligadas a um mesmo antígeno proteico, sem influenciar as demais; tais determinantes são considerados não sobrepostos. Caso dois determinantes sejam próximos um ao outro, a ligação do anticorpo ao primeiro determinante pode provocar interferência estérica na ligação da imunoglobulina ao segundo; tais determinantes são considerados sobrepostos. Em raros casos, a ligação de um anticorpo pode levar à alteração conformacional da estrutura do antígeno, influenciando, de maneira positiva ou negativa, a ligação de um segundo anticorpo a outro sítio da proteína, através de outros meios que não o impedimento estérico. Tais interações são denominadas efeitos alostéricos.
Qualquer formato ou superfície da molécula que pode ser reconhecido por um anticorpo constitui um determinante antigênico ou epítopo. Determinantes antigênicos podem ser delineados em qualquer tipo de composto, incluindo, mas não se restringindo a carboidratos, proteínas, lipídeos e ácidos nucleicos. No caso das proteínas, a formação de alguns determinantes depende apenas da estrutura primária, e a formação dos demais reflete a estrutura terciária ou conformação da molécula (Fig. 5-12). Epítopos formados por diversos resíduos de aminoácidos adjacentes são denominados determinantes lineares. O sítio de ligação de um anticorpo ao antígeno pode, de modo geral, acomodar um determinante linear formado por cerca de seis aminoácidos. Caso os determinantes lineares estejam na superfície externa ou em uma região da conformação estendida de uma proteína nativa dobrada, podem ser acessíveis aos anticorpos. Mais frequentemente, os determinantes lineares podem ser inacessíveis na conformação nativa, e surgir somente quando a proteína é desnaturada. Por sua vez, os determinantes conformacionais são formados por resíduos de aminoácidos que não estão em sequência, mas passam a ser espacialmente justapostos na proteína dobrada. Anticorpos específicos a certos determinantes lineares, assim como anticorpos específicos a determinantes conformacionais, podem ser usados, respectivamente, para verificar se a proteína foi desnaturada ou está em sua conformação nativa. As proteínas podem ser sujeitas a modificações como glicosilação, fosforilação, ubiquitinação, acetilação e proteólise. Estas modificações, por alterarem a estrutura da proteína, podem gerar novos epítopos. Tais epítopos são denominadas determinantes neoantigênicos, e também podem ser reconhecidos por anticorpos específicos.
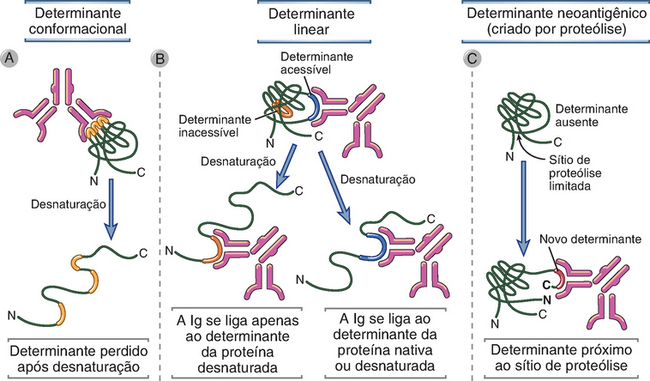
FIGURA 5-12 A natureza dos determinantes antigênicos. Os determinantes antigênicos (mostrados em laranja, vermelho e azul) podem depender do enovelamento (conformação) da proteína, assim como de sua estrutura primária. Alguns determinantes são acessíveis em proteínas nativas e perdidos após desnaturação (A), enquanto outros são expostos apenas quando a proteína é desnaturada (B). Os neodeterminantes são originários de modificações pós-sintéticas, como a clivagem de pontes peptídicas (C).
Base Estrutural e Química da Ligação ao Antígeno
Os sítios de ligação aos antígenos de muitos anticorpos são superfícies planas que podem acomodar epítopos conformacionais de macromoléculas, permitindo a ligação das imunoglobulinas a macromoléculas extensas (Fig. 5-6). Os seis CDR, três da cadeia pesada e três da cadeia leve, se espalham, formando uma superfície ampla. Superfícies amplas similares de ligação são características dos sítios de ligação dos receptores de linfócitos T. Por sua vez, moléculas de MHC contêm fendas de ligação ao antígeno que acomodam pequenos peptídeos. Em diversos anticorpos específicos para pequenas moléculas, como monossacarídeos e fármacos, o antígeno é ligado na fenda gerada pela posição próxima dos CDR em domínios VL e VH.
O reconhecimento do antígeno pelo anticorpo envolve a formação de uma ligação não covalente e reversível. Diversos tipos de interações não covalentes podem contribuir para a ligação do antígeno ao anticorpo, incluindo forças eletrostáticas, pontes de hidrogênio, forças de van der Waals e interações hidrofóbicas. A relativa importância de cada uma destas interações depende das estruturas do sítio de ligação de cada anticorpo e do determinante antigênico. A força da ligação entre um único sítio de combinação de um anticorpo e um epítopo do antígeno é chamada afinidade do anticorpo. A afinidade é comumente representada pela constante de dissociação (Kd), que indica a facilidade de separação do complexo antígeno-anticorpo em seus constituintes. Uma Kd baixa indica maior afinidade de interação, uma vez que uma menor concentração de antígeno ou de anticorpo é necessária à formação do complexo. A Kd dos anticorpos produzidos em respostas imunológicas humorais comuns geralmente varia de cerca de 10−7 M a 10−11 M. O soro de indivíduos imunizados contêm combinações de anticorpos com diferentes afinidades pelo antígeno, dependendo, principalmente, da sequência de aminoácidos dos CDR.
Uma vez que a região da dobradiça dos anticorpos confere flexibilidade a estas moléculas, uma única imunoglobulina pode se ligar a um único antígeno multivalente por mais de um sítio de ligação. Na IgG e na IgE, esta união pode envolver, no máximo, dois sítios de ligação, um em cada Fab. Na IgM pentamérica, no entanto, um único anticorpo pode se ligar a até 10 diferentes sítios (Fig. 5-13). Os antígenos polivalentes apresentam mais que uma cópia de um dado determinante. Embora a afinidade de cada sítio de ligação ao antígeno seja a mesma em cada epítopo do antígeno polivalente, a força da ligação do anticorpo ao antígeno deve considerar a interação de todos os sítios a todos os epítopos disponíveis. Esta força geral de ligação é chamada avidez e é muito maior do que a afinidade de cada sítio de ligação ao antígeno. Assim, uma molécula de IgM de baixa afinidade ainda é capaz de se ligar intensamente ao antígeno polivalente, já que as várias interações de afinidade (até 10 por molécula de IgM) podem gerar uma interação de alta avidez. Isto ocorre porque um anticorpo com múltiplos sítios de ligação apresenta pelo menos um sítio fisicamente ligado ao antígeno por um período maior do que um anticorpo com apenas dois sítios de ligação; neste último, a probabilidade de que o antígeno “caia” do anticorpo é maior, e, portanto, a avidez pelo antígeno é menor, embora cada fragmento Fab ou ambas as formas possam apresentar afinidades equivalentes pelo antígeno.
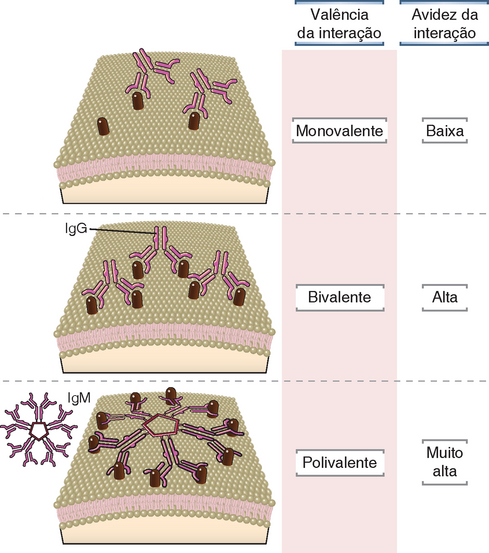
FIGURA 5-13 Valência e avidez das interações entre anticorpos e antígenos. Antígenos monovalentes, ou epítopos distantes uns dos outros em superfícies celulares, interagem com um único sítio de ligação de uma molécula de anticorpo. Embora a afinidade desta interação possa ser alta, a avidez total pode ser relativamente baixa. Quando determinantes repetidos em uma superfície celular são suficientemente próximos, ambos os sítios de ligação ao antígeno de uma única molécula de IgG podem se ligar, gerando uma interação bivalente de maior avidez. A região da dobradiça da molécula de IgG permite a alteração conformacional necessária à ligação simultânea dos dois sítios. As moléculas de IgM apresentam 10 sítios de ligação ao antígeno idênticos, que podem, em teoria, se ligar simultaneamente a 10 determinantes repetidos na superfície celular, gerando uma interação polivalente e de alta avidez.
Antígenos polivalentes são importantes na ativação do linfócito B, como anteriormente discutido. As interações polivalentes entre antígenos e anticorpos também possuem significado biológico importante, uma vez que muitas funções efetoras das imunoglobulinas são mais bem desencadeadas quando duas ou mais moléculas de anticorpos são aproximadas pela ligação a tais antígenos. Caso um antígeno polivalente seja combinado a um anticorpo específico em um tubo de ensaio, os dois interagirão, formando um complexo imune (Fig. 5-14). Como discutido nos Capítulos 12 e 18, os complexos imunes podem também conter fragmentos de proteínas do sistema complemento. Em concentração correta, na chamada zona de equivalência, anticorpos e antígenos formam uma extensa rede de ligações cruzadas, de modo que muitas, ou mesmo todas, as moléculas de antígenos e anticorpos são reunidas em grandes redes. Os complexos imunes podem ser dissociados em agregados menores, seja por aumento da concentração do antígeno, de modo que as moléculas antigênicas livres desloquem aquelas ligadas ao anticorpo (zona de excesso de antígeno), ou por aumento da concentração de anticorpo, fazendo com que as imunoglobulinas livres desloquem as ligadas aos determinantes antigênicos (zona de excesso de anticorpo). Caso a zona de equivalência seja atingida in vivo, há a formação de grandes complexos imunes na circulação. Os complexos imunes presos ou formados em tecidos podem iniciar uma reação inflamatória, provocando doenças de complexos imunes (Cap. 18).
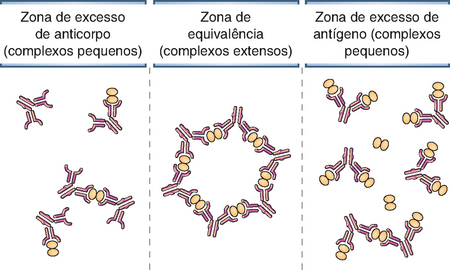
FIGURA 5-14 Complexos antígeno-anticorpo. O tamanho dos complexos antígeno-anticorpo (complexos imunes) é uma função das concentrações relativas de antígeno e anticorpo. Complexos extensos são formados em altas concentrações de antígenos e anticorpos multivalentes e determinam o que chamamos de zona de equivalência; os complexos são menores quando há relativo excesso de antígeno ou anticorpo.
RELAÇÕES ENTRE ESTRUTURA E FUNÇÃO NAS MOLÉCULAS DE ANTICORPOS
Muitas características estruturais dos anticorpos são críticas para sua capacidade de reconhecimento de antígenos e o desempenho de suas funções efetoras. Na seção a seguir, resumimos como a estrutura dos anticorpos auxilia suas funções.
Características Relacionadas ao Reconhecimento do Antígeno
Os anticorpos são capazes de reconhecer, de forma específica, uma grande variedade de antígenos, com diversas afinidades. Todas as características de reconhecimento do antígeno refletem as propriedades das regiões V da imunoglobulina.
Especificidade
Anticorpos podem ser muito específicos para os antígenos, distinguindo-os por pequenas diferenças em sua estrutura química. Os clássicos experimentos realizados por Karl Landsteiner no final da década de 1920 e no início dos anos 1930 demonstraram que os anticorpos sintetizados em resposta a um hapteno aminobenzeno com metassubstituição do grupo sulfona se ligam fortemente ao hapteno em si, mas pouco ou nada a todos os demais isômeros orto ou parassubstituídos. Estes antígenos são estruturalmente similares, e diferem apenas quanto ao grupo sulfona do anel benzênico.
A grande especificidade dos anticorpos se aplica ao reconhecimento de todas as classes de moléculas. Os anticorpos, por exemplo, podem distinguir dois determinantes lineares proteicos que diferem somente em uma única substituição aminoácida que pouco interfere na estrutura secundária. Uma vez que os constituintes bioquímicos de todos os organismos vivos são fundamentalmente similares, este alto grau de especificidade é necessário, de modo que os anticorpos gerados em resposta aos antígenos de um micro-organismo geralmente não reagem com moléculas próprias de estrutura similar ou com antígenos de outros micro-organismos. No entanto, alguns anticorpos produzidos contra um antígeno podem se ligar a antígenos diferentes, mas estruturalmente similares. Este fenômeno é chamado reatividade cruzada. Os anticorpos que são sintetizados em resposta a um antígeno microbiano às vezes reagem de forma cruzada com antígenos próprios, e isto pode ser a base de certas doenças imunes (Cap. 18).
Diversidade
Como anteriormente discutido neste capítulo, um indivíduo é capaz de sintetizar um enorme número de anticorpos estruturalmente distintos, talvez mais do que 1011, cada um com uma especificidade diferente. A capacidade apresentada pelos anticorpos de qualquer indivíduo de se ligar de forma específica a um grande número de diferentes antígenos reflete a diversidade das imunoglobulinas, e a coleção completa de anticorpos com diferentes especificidades representa o repertório total de anticorpos. Os mecanismos genéticos que geram tal repertório ocorrem exclusivamente em linfócitos. Esta diversidade é gerada pela recombinação aleatória de um conjunto limitado de sequências de DNA de linhagem germinativa, formando genes funcionais que codificam as regiões V das cadeias pesadas e leves, assim como pela adição de sequências nucleotídeas durante o processo de recombinação. Estes mecanismos são discutidos, em detalhes, no Capítulo 8. Milhões de variações estruturais resultantes são concentradas nas regiões hipervariáveis das cadeias pesadas e leves e, portanto, determinam a especificidade aos antígenos.
Maturação de Afinidade
A capacidade de neutralização de toxinas e agentes infecciosos apresentados pelos anticorpos é dependente de sua forte ligação. Como discutimos, tal ligação é conseguida por meio de interações de alta afinidade e alta avidez. O mecanismo de geração de anticorpos de alta afinidade envolve a ocorrência de alterações sutis na estrutura das regiões V das imunoglobulinas durante as respostas imunológicas humorais dependentes de linfócitos T a antígenos proteicos. Estas alterações são provocadas por um processo de mutação somática nos linfócitos B estimulados por antígenos, gerando novas estruturas nos domínios V, sendo que alguns se ligam aos antígenos com maior afinidade que os domínios V originais (Fig. 5-15). Tais linfócitos B produtores de anticorpos de maior afinidade têm preferência na ligação aos antígenos e, devido à seleção, passam a ser os clones dominantes a cada exposição subsequente ao antígeno. Este processo, denominado maturação de afinidade, aumenta a afinidade de ligação média dos anticorpos aos antígenos durante a evolução da resposta imune humoral. Assim, um anticorpo produzido durante a resposta imune primária a um antígeno proteico frequentemente apresenta Kd de 10−7 a 10−9 M; nas respostas secundárias, a afinidade aumenta, e a Kd chega a 10−11 M ou até menos. Os mecanismos de mutação somática e maturação de afinidade são discutidos no Capítulo 11.
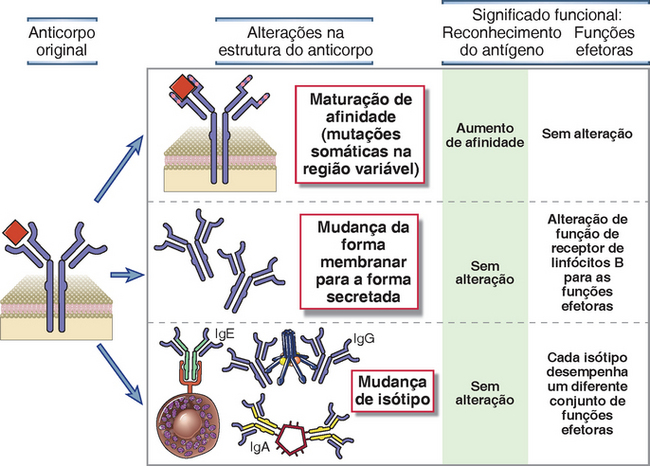
FIGURA 5-15 Alterações na estrutura do anticorpo durante respostas imunes humorais. A ilustração mostra as alterações na estrutura dos anticorpos que podem ser produzidas pela progênie de linfócitos B ativados (um clone) e as modificações de sua função. Durante a maturação da afinidade, as mutações da região V (indicadas por pontos vermelhos) geram alterações na afinidade sem alterar as funções efetoras dependentes da região C. Os linfócitos B ativados podem desviar a produção de anticorpos ligados à membrana, contendo regiões transmembranas e citoplasmáticas, para a síntese de imunoglobulinas secretadas. Anticorpos secretados podem ou não apresentar mutações no gene V (i.e., a secreção de imunoglobulinas ocorre antes e depois da maturação de afinidade). Na mudança de isótipo, a região C é alterada (indicada pela mudança de cor, de roxo para verde ou amarelo), mas não há modificações na região V de ligação ao antígeno. A mudança de isótipo é observada em anticorpos ligados à membrana e secretados. A base molecular destas alterações é discutida no Capítulo 11.
Características Relacionadas às Funções Efetoras
Muitas das funções efetoras das imunoglobulinas são mediadas pelas porções Fc destas moléculas, e isótipos de anticorpos que diferem quanto a tais regiões Fc desempenham funções distintas. Anteriormente mencionamos que as funções efetoras dos anticorpos requerem a ligação das regiões C da cadeia pesada, que formam as porções Fc, a outras células e proteínas plasmáticas. A IgG, por exemplo, recobre micro-organismos, tornando-os alvos da fagocitose por neutrófilos e macrófagos. Isto ocorre porque a molécula de IgG ligada ao antígeno é capaz de se unir, por meio de sua região Fc, a receptores de Fc (FcR) específicos para a cadeia pesada α expressos em neutrófilos e macrófagos. Por sua vez, a IgE se liga a mastócitos, desencadeando sua desgranulação, uma vez que tais células expressam FcR específicos para a IgE. Outro mecanismo efetor da imunidade humoral dependente de Fc é a ativação da via clássica do sistema complemento. Este sistema gera mediadores inflamatórios e promove a fagocitose e a lise de micro-organismos. A via clássica do sistema complemento é iniciada pela ligação de uma proteína denominada C1q a porções Fc de IgG ou IgM complexadas ao antígeno. Os FcR e sítios de ligação ao complemento dos anticorpos são encontrados nos domínios C da cadeia pesada de diferentes isótipos (Fig. 5-1). A estrutura e as funções dos FcR e das proteínas do sistema complemento são discutidas em detalhes no Capítulo 12.
As funções efetoras dos anticorpos são iniciadas apenas por moléculas que já se ligaram a antígenos, e não por Ig livres. Isto ocorre porque a ligação de duas ou mais regiões Fc de anticorpos adjacentes é necessária ao desencadeamento de diversos sistemas efetores, tais como ativação das proteínas do sistema complemento e fagocitose mediada pelo FcR (Cap. 12). A necessidade da presença de moléculas antigênicas ligadas aos anticorpos faz com que as funções efetoras sejam especificamente direcionadas à eliminação de antígenos que são reconhecidos por imunoglobulinas; já anticorpos livres circulantes desencadeiam respostas efetoras ineficientes e inadequadas.
Alterações nos isótipos de anticorpos durante respostas imunes humorais influenciam como e onde estas eliminaram o antígeno. Depois da estimulação por um antígeno, um único clone de linfócitos B pode produzir anticorpos de diferentes isótipos que, ainda assim, apresentam domínios V idênticos e, portanto, especificidade idêntica ao antígeno. Linfócitos B virgens, por exemplo, sintetizam simultaneamente IgM e IgD, que atuam como receptores de membrana para os antígenos. Quando tais linfócitos B são ativados por antígenos estranhos, geralmente de origem microbiana, podem passar por um processo chamado mudança (ou switch) de isótipo (ou classe), em que um tipo de região CH, e portanto um isótipo de anticorpo, produzido pelo linfócito B é alterado, mas as regiões V e a especificidade, não (Fig. 5-15). Devido à mudança de classe, diferentes progênies dos linfócitos B que originalmente expressavam IgM e IgD podem sintetizar isótipos e subtipos mais adequados à eliminação do antígeno. Uma resposta de anticorpo contra muitas bactérias e vírus, por exemplo, é dominada por IgG, que promove a fagocitose dos micro-organismos, enquanto a resposta a helmintos é composta principalmente por IgE, que auxilia a destruição dos parasitas. A mudança para o isótipo IgG também prolonga a eficácia das respostas imunes humorais, dada a maior meia-vida destas imunoglobulinas. Os mecanismos e o significado funcional da mudança de classe são discutidos no Capítulo 11.
As regiões C da cadeia pesada dos anticorpos também determinam a distribuição tecidual das moléculas de imunoglobulinas. Como já mencionado, depois que os linfócitos B são ativados, há uma perda gradual da expressão de anticorpos ligados à membrana e maior expressão de imunoglobulinas como proteínas secretadas (Fig. 5-15). A IgA pode ser secretada de forma eficiente através de epitélios de mucosa e é a principal classe de anticorpo encontrada nas secreções das mucosas e no leite materno (Cap. 13). Os neonatos são protegidos de infecções por anticorpos IgG adquiridos de suas mães através da placenta, durante a gestação, e através do intestino, logo após o nascimento. Esta transferência da IgG materna é mediada pela receptor neonatal de Fc (FcRn), anteriormente descrito como o receptor responsável pela maior meia-vida da IgG.
• Anticorpos, ou imunoglobulinas, compõem uma família de glicoproteínas estruturalmente similares produzidas em formas ligadas à membrana ou secretadas por linfócitos B.
• Anticorpos ligados à membrana atuam como receptores que medeiam a ativação de linfócitos B desencadeada por antígenos.
• Anticorpos secretados atuam como mediadores da imunidade humoral específica, participando de diversos mecanismos efetores que eliminam os antígenos ligados.
• As regiões de ligação ao antígeno da molécula de anticorpo são altamente variáveis, e qualquer indivíduo pode produzir mais de 1011 diferentes anticorpos, cada um com especificidade antigênica distinta.
• Todos os anticorpos apresentam uma estrutura principal simétrica comum, composta por duas cadeias pesadas idênticas covalentemente unidas e duas cadeias leves idênticas, cada uma ligada a uma cadeia pesada. Cada cadeia é formada por dois ou mais domínios Igs enovelados independentemente, com cerca de 110 aminoácidos, contendo sequências conservadas e pontes de dissulfeto intracadeias.
• Os domínios N-terminais das cadeias pesadas e leves formam as regiões V das moléculas de anticorpos, que diferem entre imunoglobulinas de diferentes especificidades. As regiões V das cadeias pesadas e leves contêm três regiões hipervariáveis separadas, de cerca de 10 aminoácidos, que são espacialmente montadas para formar o sítio de ligação ao antígeno da molécula de anticorpo.
• Os anticorpos são classificados em diferentes isótipos e subtipos com base em diferenças nas regiões C da cadeia pesada, que são compostas por três ou quatro domínios Ig; tais classes e subclasses apresentam diferentes propriedades funcionais. As classes de anticorpo são denominadas IgM, IgD, IgG, IgE e IgA. As cadeias leves de uma única imunoglobulina são do mesmo isótipo, κ ou λ, que apresenta diferentes domínios C.
• A maioria das funções efetoras dos anticorpos é mediada pelas regiões C das cadeias pesadas, mas tais funções são desencadeadas pela ligação de antígenos a sítios espacialmente distantes, na região V.
• Os anticorpos monoclonais são produzidos por um único clone de linfócitos B e reconhecem um único determinante antigênico. Estes anticorpos podem ser gerados em laboratório e são bastante usados em pesquisas, diagnósticos e tratamentos.
• Os antígenos são substâncias especificamente ligadas por anticorpos ou receptores de linfócitos T. Os antígenos que se ligam a anticorpos representam uma grande variedade de moléculas biológicas, incluindo açúcares, lipídeos, carboidratos, proteínas e ácidos nucleicos. Receptores de antígenos dos linfócitos T, por outro lado, reconhecem apenas antígenos peptídicos.
• Antígenos macromoleculares contêm múltiplos epítopos, ou determinantes, sendo que cada um pode ser reconhecido por um anticorpo. Epítopos lineares de antígenos proteicos são compostos por uma sequência de aminoácidos adjacentes, enquanto os determinantes conformacionais são formados pelo enovelamento da cadeia polipeptídica.
• A afinidade de interação entre o sítio de combinação de uma única molécula de anticorpo e um único epítopo é geralmente representada pela constante de dissociação (Kd), calculada com base em dados sobre esta ligação. Antígenos polivalentes contêm múltiplos epítopos idênticos aos quais moléculas idênticas de anticorpos podem se ligar. Os anticorpos pode se ligar a dois ou, no caso da IgM, até 10 epítopos idênticos simultaneamente, aumentando a avidez da interação anticorpo-antígeno.
• As concentrações relativas de antígenos polivalentes e anticorpos podem favorecer a formação de complexos imunes, que podem se depositar em tecidos e provocar danos.
• A ligação do anticorpo ao antígeno pode ser altamente específica, distinguindo pequenas diferenças nas estruturas químicas. Reações cruzadas, em que dois ou mais antígenos podem ser ligados ao mesmo anticorpo, também podem ser observadas.
• Diversas alterações na estrutura dos anticorpos sintetizados por um clone de linfócitos B podem ocorrer durante uma resposta imune. A princípio, os linfócitos B produzem apenas imunoglobulinas ligadas à membrana, mas, em linfócitos B ativados e plasmócitos, a síntese de anticorpos solúveis, com a mesma especificidade antigênica que a imunoglobulina de membrana, é estimulada. Alterações no uso de segmentos gênicos da região C, sem modificações das regiões V, são a base da mudança de isótipo, com mudança das funções efetoras, mas não da especificidade. Mutações pontuais nas regiões V de um anticorpo específico a um antígeno aumentam a afinidade pela molécula (maturação de afinidade).
Estrutura e Função dos Anticorpos
Danilova N, Amemiya CT. Going adaptive: the saga of antibodies. Annals of the New York Academy of Sciences. 2009;1168:130-155.
Fagarasan S. Evolution, development, mechanism and function of IgA in the gut. Current Opinion in Immunology. 2008;20:170-177.
Harris LJ, Larsen SB, McPherson A. Comparison of intact antibody structures and their implications for effector functions. Advances in Immunology. 1999;72:191-208.
Law M, Hengartner L. Antibodies against viruses: passive and active immunization. Current Opinion in Immunology. 2008;20:486-492.
Mascola JR, Montefiori DC. The role of antibodies in HIV vaccines. Annual Review of Immunology. 2010;28:413-444.
Stanfield RL, Wilson IA. Structural studies of human HIV-1 V3 antibodies. Human Antibodies. 2005;14:73-80.
Aplicações Terapêuticas dos Anticorpos
Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nature Reviews Immunology. 2010;10:301-316.
Kohler G, Milstein C. Continuous culture of fused cells secreting antibody of predetermined specificity. Nature. 1975;256:495-497.
Lonberg N. Fully human antibodies from transgenic mouse and phage display platforms. Current Opinion in Immunology. 2008;20:450-459.
Weiner LM, Surana R, Wang S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 2010;10:317-327.