CAPÍTULO 19 Respostas Imunes Dependentes de IgE e Doenças Alérgicas
CARACTERÍSTICAS GERAIS DAS REAÇÕES IMUNES DEPENDENTES DE IgE,
PAPEL DOS MASTÓCITOS, BASÓFILOS E EOSINÓFILOS NA HIPERSENSIBILIDADE IMEDIATA,
REAÇÕES DEPENDENTES DE IgE E DE MASTÓCITOS,
SUSCETIBILIDADE GENÉTICA À HIPERSENSIBILIDADE IMEDIATA,
DOENÇAS ALÉRGICAS EM SERES HUMANOS: PATOGÊNESE E TERAPIA,
OS PAPÉIS DE PROTEÇÃO DAS REAÇÕES IMUNES MEDIADAS POR IgE E MASTÓCITOS,
Uma variedade de doenças humanas são causadas por respostas imunes a antígenos ambientais não microbianos que envolvem células TH2, imunoglobulina E (IgE), mastócitos e eosinófilos. Nestas respostas, os antígenos induzem células CD4+ TH2, que então ajudam as células B a produzir anticorpos IgE específicos para os antígenos e que se ligam a receptores Fc nos mastócitos e nos basófilos. Quando estes anticorpos IgE associados às células fazem ligação cruzada com o antígeno, as células são ativadas para liberar rapidamente uma variedade de mediadores. Estes mediadores provocam coletivamente aumento da permeabilidade vascular, vasodilatação e contração do músculo liso brônquico e visceral. Esta reação é chamada de hipersensibilidade imediata porque começa rapidamente, em poucos minutos de estimulação antigênica (imediata), e tem grandes consequências patológicas (hipersensibilidade). Após a resposta imediata, há um componente inflamatório que se desenvolve de forma mais lenta chamado reação de fase tardia caracterizado pelo acúmulo de neutrófilos, eosinófilos, macrófagos e células CD4+ TH2. Esta última reação é desencadeada pelas citocinas produzidas pelas células TH2 e pelos mastócitos, assim como pelos mediadores lipídicos secretados pelos mastócitos. O termo hipersensibilidade imediata é comumente usado para descrever as reações imediata e de fase tardia combinadas. Na medicina clínica, estas reações são chamadas alergia ou atopia, e as doenças associadas são chamadas doenças alérgicas, atópicas ou de hipersensibilidade imediata. Repetidos ataques destas reações podem levar a doenças alérgicas crônicas, com lesão tecidual e remodelamento. Embora a atopia originalmente significasse “incomum”, agora percebemos que a alergia é o distúrbio mais comum da imunidade, afetando 20% de todos os indivíduos nos Estados Unidos. Este capítulo se concentra em reações imunes mediadas por células TH2, IgE e mastócitos. Começamos resumindo algumas características gerais importantes das reações dependentes das IgE e dos mastócitos e continuamos descrevendo a produção de IgE, a estrutura e as funções dos receptores Fc específicos para IgE, e os mediadores celulares da hipersensibilidade imediata, incluindo os mastócitos, basófilos e eosinófilos. Em seguida descrevemos síndromes clínicas selecionadas que estão associadas às reações dependentes de IgE e de mastócitos e os princípios da terapia para estas doenças. Concluímos com uma discussão sobre o papel fisiológico das reações imunes mediadas por IgE na defesa do hospedeiro.
CARACTERÍSTICAS GERAIS DAS REAÇÕES IMUNES DEPENDENTES DE IgE
Todas as reações alérgicas têm características comuns, embora difiram muito nos tipos de antígenos que provocam estas reações e suas manifestações clínicas e patológicas.
• As marcas características das doenças alérgicas são a ativação das células TH2 e a produção de anticorpo IgE. Embora os indivíduos saudáveis não respondam ou tenham respostas inofensivas de células T e de anticorpos a antígenos ambientais comuns, os indivíduos atópicos desenvolvem respostas fortes de TH2 e produzem IgE na exposição a estas substâncias potencialmente alergênicas.
• A sequência típica de eventos na hipersensibilidade imediata consiste na exposição a um antígeno, ativação das células TH2 e células B específicas para o antígeno, produção de anticorpo IgE, ligação do anticorpo a receptores Fc dos mastócitos, e desencadeamento dos mastócitos através da reexposição ao antígeno, resultando na liberação de mediadores dos mastócitos e subsequente reação patológica (Fig. 19-1). A ligação da IgE aos mastócitos também é chamada de sensibilização porque os mastócitos revestidos por IgE estão prontos para ser ativados no encontro com o antígeno (ou seja, são sensíveis ao antígeno). Descrevemos cada uma destas etapas nas seções seguintes.
• Existe uma forte predisposição genética para o desenvolvimento de atopia. Muitos genes de suscetibilidade estão associados a estes transtornos. Imagina-se que estes genes influenciem diferentes etapas no desenvolvimento e nas reações da hipersensibilidade imediata. Discutiremos alguns dos principais genes de suscetibilidade conhecidos e seus prováveis papéis posteriormente no capítulo.
• Os antígenos que provocam hipersensibilidade imediata, também chamados de alérgenos, são geralmente proteínas ambientais comuns e substâncias químicas que podem modificar as proteínas. Os alérgenos incluem uma grande variedade de moléculas estruturalmente distintas.
• As citocinas produzidas pelas células TH2 são responsáveis por muitas das características da hipersensibilidade imediata. A hipersensibilidade imediata é a desordem prototípica mediada por TH2, em contraste com a hipersensibilidade do tipo tardia, que é a reação imune clássica mediada pela TH1.
• As manifestações clínicas e patológicas da hipersensibilidade imediata consistem na reação vascular e do músculo liso que se desenvolve rapidamente após a exposição repetida ao alérgeno (a reação imediata) e uma reação inflamatória tardia. Todas estas reações podem ser desencadeadas pela ativação de mastócitos mediados por IgE, mas diferentes mediadores são responsáveis por diferentes componentes das reações imediata e de fase tardia. Como os mastócitos estão presentes nos tecidos conjuntivos e sob os epitélios, estes tecidos são os locais mais comuns de reações de hipersensibilidade imediata. Algumas reações de hipersensibilidade imediata podem ser desencadeadas por estímulos não imunológicos, tais como exercícios físicos e a exposição ao frio. Estes estímulos induzem a desgranulação dos mastócitos e a liberação de mediadores sem exposição ao antígeno ou produção de IgE. Estas reações são chamadas de não atópicas.
• Reações de hipersensibilidade imediata se manifestam de diferentes maneiras, dependendo dos tecidos afetados, incluindo erupções cutâneas, sinusite, constrição dos brônquios, dor abdominal, diarreia e choque sistêmico. Na forma sistêmica mais extrema, chamada anafilaxia, os mediadores derivados dos mastócitos podem restringir as vias aéreas até o ponto de asfixia e produzir colapso cardiovascular, levando à morte. (O termo anafilaxia foi cunhado para indicar que os anticorpos, especialmente os anticorpos IgE, poderiam conferir o oposto da proteção [profilaxia] na vida de um indivíduo infeliz.) Voltaremos para a patogênese dessas reações mais adiante neste capítulo.
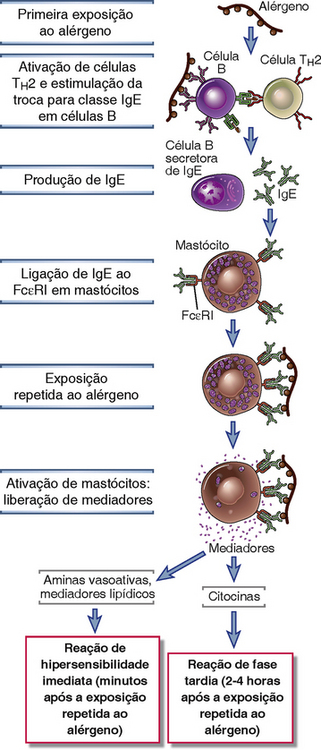
FIGURA 19-1 Sequência de eventos nas reações de hipersensibilidade imediata. As doenças de hipersensibilidade imediata são iniciadas com a introdução de um alérgeno, o que estimula as reações TH2 e a produção de IgE. A IgE sensibiliza os mastócitos se ligando ao FcεRI, e a consequente exposição ao alérgeno ativa os mastócitos para secretar os mediadores que são responsáveis pelas reações patológicas de hipersensibilidade imediata.
Com esta introdução, vamos continuar com uma descrição dos passos no desenvolvimento e nas reações da hipersensibilidade imediata.
PRODUÇÃO DE IgE
Os indivíduos atópicos produzem níveis elevados de IgE em resposta a alérgenos ambientais, enquanto os indivíduos normais geralmente sintetizam outros isótipos de Ig, como IgM e IgG, e apenas pequenas quantidades de IgE. A regulamentação da síntese do IgE depende da propensão de um indivíduo para montar uma resposta de TH2 a alérgenos porque as citocinas derivadas das células TH2 estimulam a mudança do isótipo de cadeia pesada para a classe IgE nas células B. Esta propensão para respostas com TH2 contra determinados antígenos pode ser influenciada por uma variedade de fatores, incluindo genes herdados, a natureza dos antígenos e a história da exposição ao antígeno.
O anticorpo IgE é responsável por sensibilizar os mastócitos e fornecer reconhecimento de antígeno para reações de hipersensibilidade imediata. O IgE é o isótipo de anticorpo que contém a cadeia pesada ε (Cap. 5), e de todos os isótipos de Ig, a IgE é o mais eficiente na ligação aos receptores Fc dos mastócitos e na ativação destas células.
A Natureza dos Alérgenos
Os antígenos que provocam as reações de hipersensibilidade imediata (alérgenos) são proteínas ou substâncias químicas ligadas a proteínas às quais o indivíduo atópico é cronicamente exposto. Os alérgenos típicos incluem as proteínas do pólen, os ácaros da poeira doméstica, pelos de animais, alimentos e produtos químicos como o antibiótico penicilina. Não se sabe por que alguns antígenos induzem respostas fortes de TH2 e reações alérgicas enquanto outros não produzem o mesmo efeito. Duas características importantes de alérgenos são que os indivíduos são expostos a eles repetidamente e, ao contrário dos micro-organismos, eles geralmente não estimulam respostas imunes inatas que são associadas à secreção de citocinas por macrófagos e células dendríticas indutoras de TH1 e TH17. Ativação crônica ou repetida da célula T na ausência de imunidade inata forte pode conduzir as células T CD4+ em direção à via TH2, já que as próprias células T produzem IL-4, a principal citocina indutora de TH2 (Cap. 9).
A propriedade de ser um alergênico também pode residir na natureza química do próprio antígeno. Embora nenhuma característica estrutural das proteínas possa prever definitivamente se elas serão alergênicas, algumas características são tímicas de muitos alérgenos comuns. Estas características incluem baixo para médio peso molecular (5 a 70 kD), estabilidade, glicosilação e alta solubilidade nos fluidos corporais. As respostas anafiláticas aos alimentos são normalmente induzidas por proteínas pequenas altamente glicosiladas. Estas características estruturais provavelmente protegem os antígenos da desnaturação e da degradação no trato gastrointestinal e permitem que eles sejam absorvidos intactos. Curiosamente, muitos alérgenos, tais como a cisteína protease dos ácaros domésticos Dermatophagoides pteronyssinus e a fosfolipase A2 no veneno da abelha, são enzimas, mas a importância da atividade enzimática no desencadeamento das reações de hipersensibilidade imediata não é conhecida.
Como as reações de hipersensibilidade imediata são dependentes das células T CD4+, os antígenos independentes da célula T, tais como os polissacarídeos, não podem provocar estas reações, a menos que se liguem às proteínas. Alguns medicamentos, como a penicilina, muitas vezes, provocam fortes respostas de IgE. Estes fármacos reagem quimicamente com os resíduos de aminoácidos nas próprias proteínas para formar conjugados hapteno-carreador, que estimulam respostas de TH2 e produção de IgE.
A história natural da exposição a antígenos é um importante determinante da quantidade de anticorpos IgE específicos produzidos. A exposição repetida a um determinado antígeno é necessária para o desenvolvimento de uma reação alérgica aquele antígeno, porque a mudança para o isótipo IgE e a sensibilização dos mastócitos com a IgE deve ocorrer antes que uma reação de hipersensibilidade a um antígeno possa ocorrer. Indivíduos com rinite alérgica ou asma geralmente se beneficiam de uma mudança geográfica de residência com uma mudança nos pólens de plantas indígenas, embora os antígenos ambientais na nova residência possam desencadear um retorno eventual dos sintomas. Um exemplo dramático da importância da repetida exposição ao antígeno na doença alérgica é visto nos casos das picadas de abelha. As proteínas nos venenos de insetos geralmente não são motivo de preocupação no primeiro encontro porque um indivíduo atópico não tem anticorpos IgE específicos preexistentes. No entanto, uma resposta IgE pode ocorrer após um único encontro com o antígeno, e uma segunda picada por um inseto da mesma espécie pode induzir a uma anafilaxia fatal! Da mesma forma, exposições a pequenas quantidades de amendoim podem provocar reações fatais em indivíduos previamente sensibilizados.
Ativação de Células TH2
A síntese de IgE é dependente da ativação de células T auxiliares (helper) CD4+ do subgrupo TH2 e sua secreção de IL-4 e IL-13. É provável que as células dendríticas nos epitélios através dos quais os alérgenos entram capturem os antígenos, transportem-nos para os linfonodos de drenagem, processem-nos e apresentem os peptídeos a células T CD4+ virgens (naïve). As células T então se diferenciam em células TH2 e em células T auxiliares foliculares (TFH) que secretam citocinas TH2. Os principais fatores que conduzem à diferenciação das células TH2 são as citocinas, principalmente a IL-4, que pode ser produzida por vários tipos celulares (Cap. 9). Além disso, a citocina linfopoietina estromal tímica, secretada pelas células epiteliais na pele, intestino e pulmões, melhora a capacidade das células dendríticas do tecido para promover a diferenciação de TH2. As células TH2 e TFH então induzem a célula B a mudar para IgE através das ações do ligante CD40 e das citocinas IL-4 e IL-13.
As células TH2 estão envolvidas em outros componentes da reação de hipersensibilidade imediata além de promover a mudança para IgE. A IL-5 secretada pelas células TH2 ativa os eosinófilos, um tipo de célula que é abundante em muitas reações de hipersensibilidade imediata. A IL-13 estimula as células epiteliais (p. ex., nas vias aéreas) para secretar quantidades elevadas de muco, uma produção excessiva de muco também é uma característica comum destas reações. As células TH2 também contribuem para a inflamação da reação de fase tardia, descrita posteriormente.
Consistente com o papel central das células TH2 na hipersensibilidade imediata, os indivíduos atópicos contêm maior número de células T secretoras de IL-4 específicas para alérgenos em seu sangue do que as pessoas não atópicas. Em pacientes atópicos, as células T específicas dos alérgenos também produzem mais IL-4 por célula do que nos indivíduos normais. Em modelos animais, uma doença semelhante a asma humana pode ser induzida pela geração de células TH2 específicas para um antígeno inalado ou pela transferência adotiva destas células em camundongos virgens. O acúmulo de células TH2 é encontrado em locais de reações de hipersensibilidade imediata na pele e na mucosa brônquica.
Ativação de Células B e Troca para IgE
As células B específicas para os alérgenos são ativadas pelas células TH2 e TFH, como em outras respostas de células B dependentes de células T (Cap. 11). Sob a influência do ligante CD40 e das citocinas, principalmente a IL-4, produzidos pelas células T auxiliares, as células B sofrem mudança do isótipo de cadeia pesada e produzem IgE. A IgE circula como um anticorpo bivalente e está normalmente presente no plasma em uma concentração inferior a 1 μg/mL. Em condições patológicas, tais como infecções por helmintos e atopia grave, este nível pode aumentar para mais de 1.000 μg/mL. A IgE específica para alérgeno produzida por plasmoblastos e plasmócitos entram na circulação e se ligam aos receptores Fc nos mastócitos do tecido, de modo que estas células são sensibilizadas e preparadas para reagir a um encontro posterior com o alérgeno. Os basófilos circulantes também são capazes de se ligar à IgE.
PAPEL DOS MASTÓCITOS, BASÓFILOS E EOSINÓFILOS NA HIPERSENSIBILIDADE IMEDIATA
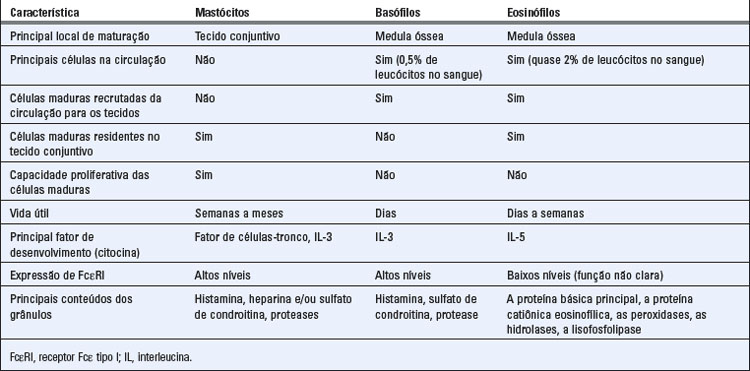
Os mastócitos, basófilos e eosinófilos são as células efetoras das reações de hipersensibilidade imediata e das doenças alérgicas. Embora cada um destes tipos de células tenha características únicas, todos os três tipos contêm grânulos citoplasmáticos cujos conteúdos são os principais mediadores das reações alérgicas, e todos os três tipos de células produzem mediadores lipídicos e citocinas que induzem inflamação. As células TH2 também funcionam como células efetoras de hipersensibilidade imediata; seu papel foi discutido anteriormente. Nesta seção do capítulo, discutimos as propriedades e funções dos mastócitos, basófilos e eosinófilos (Tabela 19-1). Como os mastócitos são o principal tipo de célula responsável pelas reações de hipersensibilidade imediata nos tecidos, grande parte de nossa discussão subsequente se concentra nos mastócitos.
Propriedades dos Mastócitos e dos Basófilos
Todos os mastócitos são derivados de células progenitoras da medula óssea. Normalmente os mastócitos maduros não são encontrados na circulação. Os progenitores migram para os tecidos periféricos como células imaturas e sofrem diferenciação in situ. Os mastócitos maduros são encontrados em todo o corpo, principalmente perto dos vasos sanguíneos (Fig. 19-2A) e nervos e abaixo dos epitélios. Eles também estão presentes nos órgãos linfoides. Os mastócitos humanos variam na forma e têm núcleos arredondados, e o citoplasma contém grânulos ligados à membrana e aos corpos lipídicos. Os grânulos contêm proteoglicanos ácidos que se ligam a corantes básicos.
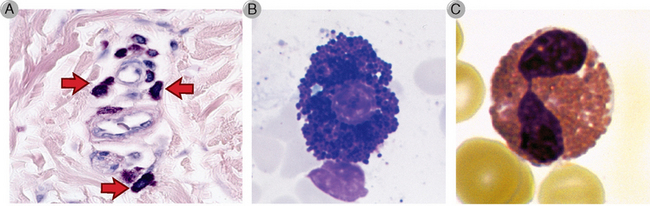
FIGURA 19-2 Morfologia dos mastócitos, basófilos e eosinófilos. Microfotografias dos mastócitos dérmicos perivasculares corados em Wright-Giemsa (A, setas), basófilo do sangue periférico (B) e eosinófilo do sangue periférico (C) são apresentados. Observe a coloração vermelha característica dos grânulos citoplasmáticos no eosinófilo e os grânulos citoplasmáticos corados em azul do basófilo.
(A cortesia de Dr. George Murphy e B e C cortesia de Dr. Jonathan Hecht, Department of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.)
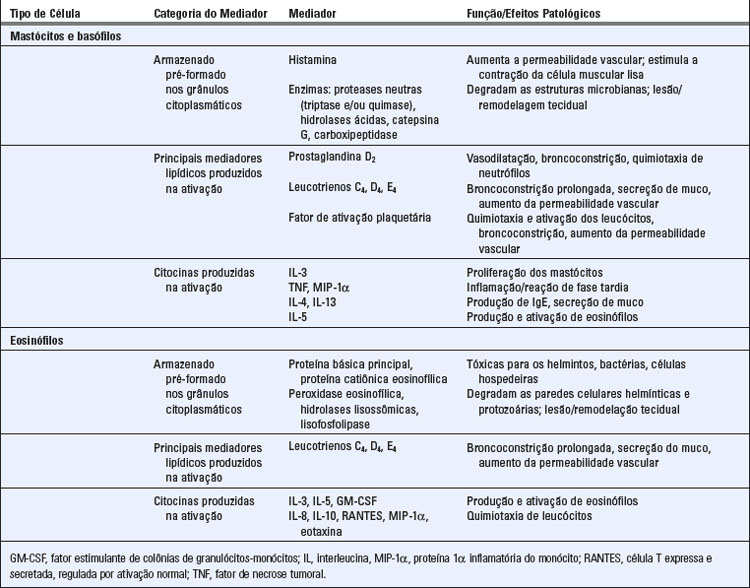
Os mastócito ativados secretam uma variedade de mediadores que são responsáveis pelas manifestações das reações alérgicas (Tabela 19-2). Estes incluem substâncias que são armazenadas em grânulos e liberadas rapidamente quando ativadas, e outras que são sintetizadas quando ativadas. A produção e ações destes mediadores são descritas posteriormente.
Existem populações diferentes de mastócitos que são diferenciadas por suas localizações anatômicas, conteúdo de grânulos e atividades (Tabela 19-3). Nos roedores, os dois principais subgrupos de mastócitos foram descritos, um encontrado na mucosa do trato gastrointestinal e o outro nos tecidos conjuntivos. Os mastócitos da mucosa têm sulfato de condroitina abundante e pouca histamina em seus grânulos. O desenvolvimento dos mastócitos da mucosa in vivo depende da citocina IL-3 produzida pelas células T. Os mastócitos podem ser cultivados da medula óssea dos roedores na presença de IL-3, e estes mastócitos cultivados lembram os mastócitos da mucosa com base no alto conteúdo de grânulos de sulfato de condroitina e baixa concentração de histamina. O homólogo humano dos mastócitos da mucosa é identificado com mais frequência pela presença de triptase e pela ausência de outras proteases nos grânulos. Nos seres humanos, o tipo de mucosa de mastócitos predomina na mucosa intestinal e nos espaços alveolares no pulmão, e sua presença também é dependente da célula T. Os mastócitos do tecido conjuntivo, também identificados pela primeira vez nos roedores, são encontrados no pulmão e na serosa das cavidades do corpo. Os principais proteoglicanos de seus grânulos são a heparina, e produzem grandes quantidades de histamina. Ao contrário dos mastócitos da mucosa, os mastócitos do tecido conjuntivo mostram pouca dependência em relação à célula T. Nos seres humanos, o subgrupo correspondente é identificado pela presença de várias proteases neutras nos grânulos, incluindo a triptase, quimase, protease semelhante à catepsina G e carboxipeptidase. Os mastócitos do tecido conjuntivo humano são encontrados na pele e na submucosa intestinal. Embora a ideia destes subgrupos proporcionasse uma estrutura valiosa para estudos de mastócitos, é claro que as populações não são nem fixas nem claramente separáveis.
Os locais, o conteúdo dos grânulos e a dependência da célula relativa T de diferentes populações de mastócitos sugerem que cada um pode ser importante em um grupo diferente de processos de doenças. É provável que os mastócitos tipo mucosa estejam envolvidos nas doenças de hipersensibilidade imediata dependentes de célula T e de IgE, envolvendo as vias aéreas, como a asma brônquica, e outros tecidos da mucosa. Por sua vez, os mastócitos tipo tecido conjuntivo medeiam as reações de hipersensibilidade imediata na pele.
Os basófilos são granulócitos sanguíneos com semelhanças estruturais e funcionais aos mastócitos. Como outros granulócitos, os basófilos são derivados das células progenitoras da medula óssea (uma linhagem diferente daquela dos mastócitos), amadurecem na medula óssea, e circulam no sangue (Fig. 19-2B). Os basófilos constituem menos de 1% dos leucócitos no sangue. Embora eles normalmente não estejam presentes nos tecidos, os basófilos podem ser recrutados para alguns locais inflamatórios. Os basófilos contêm grânulos que se ligam a corantes básicos, e conseguem sintetizar muitos dos mediadores assim como os mastócitos (consulte a Tabela 19-2). Como os mastócitos, os basófilos expressam o FcεRI, se ligam à IgE, e podem ser desencadeados pelo antígeno que se liga à IgE. Portanto, os basófilos que são recrutados nos locais do tecido onde o antígeno está presente podem contribuir para as reações de hipersensibilidade imediata.
Ligação da IgE aos Mastócitos e Basófilos: o Receptor Fcε
Os mastócitos e basófilos expressam um receptor Fc específico de alta afinidade para cadeias pesadas ε, chamado FcεRI, que se liga à IgE. A IgE, como todos os outros anticorpos, é produzida exclusivamente por células B, mas a IgE funciona como um receptor de antígeno na superfície dos mastócitos e basófilos. Esta função é realizada pela ligação de IgE ao FcεRI nestas células. A afinidade do FcεRI com a IgE é muito alta (constante de dissociação [Kd] de cerca de 1 × 10−10 M), muito maior do que qualquer outro receptor Fc para seu ligante de anticorpos. Portanto, a concentração sérica normal do IgE, apesar de baixa quando comparada a outros isótipos de Ig (menos de 5 × 10−10 M), é suficiente para permitir a ocupação de receptores FcεRI. Além dos mastócitos e basófilos, o FcεRI foi detectado nos eosinófilos, células epidérmicas de Langerhans, alguns macrófagos dérmicos e monócitos ativados. A função do receptor em muitas destas células não está estabelecida.
Cada molécula FcεRI é composta por uma cadeia α que liga a região Fc da IgE e uma cadeia β e duas cadeias γ que são responsáveis pela sinalização (Fig. 19-3). A porção extracelular aminoterminal da cadeia α inclui dois domínios semelhantes à Ig que formam o local de ligação para a IgE. A cadeia β do FcεRI contém um único motivo de ativação baseado na tirosina do imunoreceptor (ITAM) no domínio terminal da carboxila citoplasmática. Os dois polipeptídeos idênticos da cadeia γ estão ligados por uma ponte dissulfeto e são homólogas à cadeia ζ do complexo do receptor do antígeno da célula T (Cap. 7). A porção citoplasmática de cada cadeia γ contém um ITAM. A mesma cadeia γ serve como uma subunidade de sinalização para o FcγRI, FcγRIIIA, e para FcαR e é chamada de cadeia FcR γ (Cap. 12). A fosforilação da tirosina dos ITAM das cadeias β e γ dá início à cascata de sinalização do receptor que é necessário para a ativação dos mastócitos, descrita a seguir. O FcεRI nos eosinófilos e em outros diversos tipos de células não tem a cadeia β, portanto a sinalização é mediada apenas pelas cadeias γ nestas células.
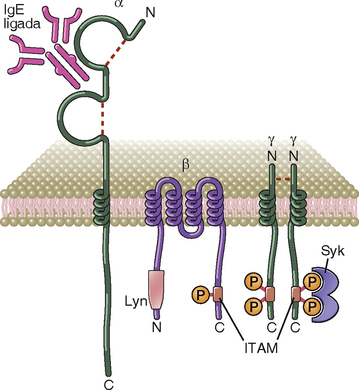
FIGURA 19-3 Estrutura da cadeia polipeptídica do receptor Fc de alta afinidade para IgE (FcεRI). IgE se liga aos domínios semelhantes à Ig da cadeia α. A cadeia β e as cadeias γ mediam a transdução de sinal. As caixas na região citoplasmática das cadeias β e γ são os ITAM, semelhantes àqueles encontrados no complexo do receptor da célula T (Fig. 7-5). A Lyn e a Syk são tirosina cinases que se ligam às cadeias β e γ, e participam em eventos de sinalização. Uma estrutura do modelo de FcεRI é mostrada no Capítulo 12.
A importância do FcεRI nas reações de hipersensibilidade imediata mediadas pela IgE foi demonstrada em camundongos com nocaute (knockout) da cadeia α de FcεRI. Quando estes camundongos recebem injeções intravenosas de IgE específica para um antígeno conhecido seguidas por aquele antígeno, a anafilaxia não se desenvolve ou é leve, enquanto ela é uma reação grave nos camundongos selvagens tratados da mesma maneira. A expressão de FcεRI na superfície dos mastócitos e basófilos é aumentada pela IgE, proporcionando assim um mecanismo para a amplificação das reações mediadas por IgE.
Outro receptor de IgE chamado FcεRII, também conhecido como CD23, é uma proteína relacionada às lectinas do tipo C dos mamíferos, cuja afinidade com a IgE é muito mais baixa do que com o FcεRI. O papel biológico do FcεRII não é conhecido.
Ativação dos Mastócitos
Os mastócitos são ativados pela ligação cruzada de moléculas FcεRI, que ocorre através da ligação de antígenos multivalentes com moléculas de IgE que estão ligadas aos receptores Fc (Fig. 19-4). Em um indivíduo alérgico a um determinado antígeno, uma grande proporção de IgE ligada ao FcεRI na superfície dos mastócitos é específica para aquele antígeno. A exposição ao antígeno realizará ligações cruzadas com moléculas IgE suficientes para desencadear a ativação dos mastócitos. Em contraste, em indivíduos não atópicos, as moléculas de IgE ligadas aos mastócitos são específicas para muitos antígenos diferentes, todos os quais podem ter induzido à produção de baixos níveis de IgE. Portanto, nenhum antígeno único fará ligação cruzada das moléculas IgE em quantidade suficiente para provocar a ativação dos mastócitos.
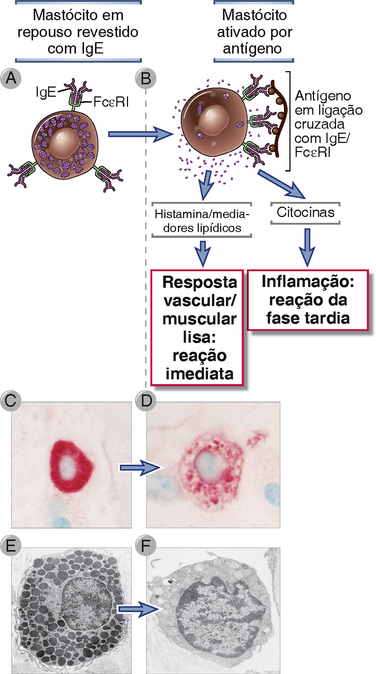
FIGURA 19-4 Ativação dos mastócitos. A ligação do antígeno à IgE produz ligações cruzadas de moléculas de FcεRI nos mastócitos, o que induz à liberação de mediadores que provocam a reação de hipersensibilidade (A, B). Outros estímulos, que incluem o fragmento do complemento C5a, também podem ativar os mastócitos. Uma microfotografia óptica de um mastócito em repouso com grânulos citoplasmáticos em abundância que se coram em púrpura é mostrado em C. Estes grânulos também são vistos na micrografia eletrônica de um mastócito em repouso mostrado em E. Em contraste, os grânulos esgotados de um mastócito ativado são mostrados na microfotografia óptica (D) e na micrografia eletrônica (F).
(Cortesia de Dr. Daniel Friend, Department of Pathology, Brigham and Women’s Hospital and Harvard Medical School, Boston, Massachusetts.)
As reações de hipersensibilidade imediata podem ser imitadas pela injeção de anticorpo anti-IgE ao invés de antígeno. Os anticorpos anti-IgE atuam como um análogo do antígeno e ativam diretamente os mastócitos que ligaram IgE a sua superfície. O uso de anti-IgE para ativar os mastócitos é semelhante ao uso de anticorpos anti-IgM como análogos de antígeno para ativar as células B, exceto no caso dos mastócitos, IgE secretada, produzida pelas células B, é ligada a receptores Fc de alta afinidade na superfície da célula ao invés de ser sintetizada como IgE de membrana. Os anticorpos anti-IgE ativam os mastócitos até em indivíduos normais (não atópicos) porque, conforme mencionado anteriormente, os mastócitos são normalmente revestidos com IgE, que pode fazer ligações cruzadas pelo anti-IgE. Em contraste, um antígeno ativará os mastócitos apenas em indivíduos que são alérgicos aquele antígeno, porque só estas pessoas produzirão IgE específica o suficiente para ser cruzado pelo antígeno. As reações de hipersensibilidade imediata também podem ser imitadas pela injeção de outros agentes que ativam diretamente os mastócitos, como os fragmentos do complemento C5a, C4a e C3a, chamados anafilatoxinas, ou por trauma local, que também provoca a desgranulação dos mastócitos. Por sua vez, estas reações podem ser inibidas por agentes que impedem a ativação dos mastócitos.
A ativação dos mastócitos resulta em três tipos de respostas biológicas: a secreção de conteúdos de grânulos pré-formados por exocitose (desgranulação), síntese e secreção dos mediadores lipídicos, e síntese e secreção de citocinas. As cascatas de sinalização iniciadas pela ligação cruzada de FcεRI mediada por alérgeno são semelhantes aos eventos de sinalização proximais iniciados por ligação de antígeno aos linfócitos (Fig. 19-5 e Cap. 7). A tirosina cinase Lyn é associada constitutivamente à cauda citoplasmática da cadeia β de FcεRI. Na ligação cruzada das moléculas de FcεRI pelo antígeno, a tirosina cinase Lyn fosforila os ITAM nos domínios citoplasmáticos das cadeias β e γ de FcεRI. A tirosina cinase Syk é então recrutada para os ITAM da cadeia γ, torna-se ativada, e fosforila e ativa outras proteínas na cascata de sinalização, incluindo diversas moléculas adaptadoras e enzimas que participam na formação de complexos multicomponentes de sinalização, conforme descrito nas células T. O ligador para a ativação das células T (LAT) é uma das proteínas adaptadoras essenciais envolvidas na ativação dos mastócitos, e uma das enzimas recrutadas para o LAT é a isoforma γ de uma fosfolipase C (PLCγ) específica para o fosfatidilinositol. Uma vez ligada ao LAT, a PLCγ é fosforilada e então catalisa a degradação do bifosfato de fosfatidilinositol para gerar o trifosfato de inositol (IP3) e o diacilglicerol (DAG) (Cap. 7). O IP3 provoca a elevação dos níveis do cálcio citoplasmático, e o DAG ativa a proteína cinase C (PKC). Outra via de ativação da PKC nos mastócitos envolve a tirosina cinase Fyn, que fosforila a proteína adaptadora da proteína 2 semelhante ao ligante associado à Grb-2 (Gab2), que por sua vez se liga a fosfoinositida 3-cinase, levando à ativação da PKC. A fosforilação das cadeias leves de miosina através da PKC ativada leva a desmontagem dos complexos de actina-miosina abaixo da membrana plasmática, permitindo assim que os grânulos entrem em contato com a membrana plasmática.
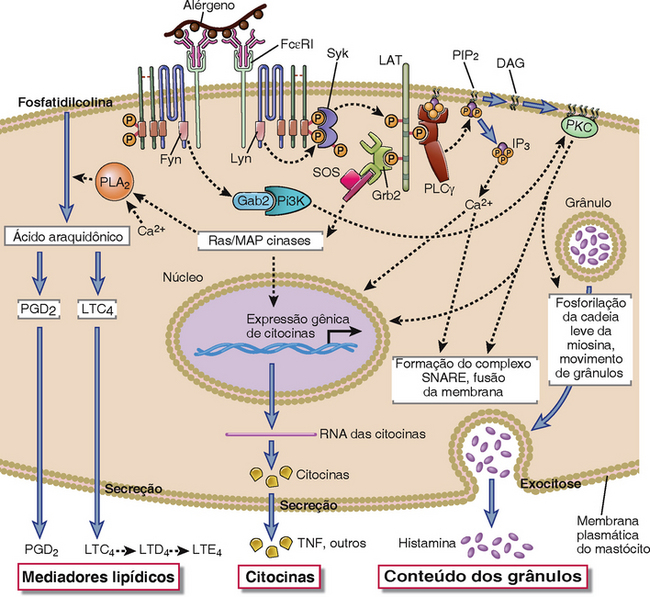
FIGURA 19-5 Eventos bioquímicos da ativação dos mastócitos. Acredita-se que a ligação cruzada da IgE ligada pelo antígeno ative as proteínas tirosina cinases (Syk e Lyn), que por sua vez provoca a ativação de uma cascata de MAP cinases e de uma fosfolipase C específica de fosfatidilinositol (PI-PLCγ). A PI-PLCγ catalisa a liberação de IP3 e DAG de PIP2 da membrana. O IP3 provoca a liberação de cálcio intracelular do retículo endoplasmático. O cálcio e o DAG ativam a PKC, que fosforila os substratos, como a proteína de cadeia leve da miosina e, assim, levam à degradação e à liberação de mediadores pré-formados. O cálcio e as MAP cinases se combinam para ativar a enzima fosfolipase A2 citosólica (PLA2), que inicia a síntese de mediadores lipídicos, incluindo a prostaglandina D2 (PGD2) e o leucotrieno C4 (LTC4).
A membrana dos grânulos dos mastócitos então se funde com a membrana plasmática, um processo que é mediado pelos membros da família das proteínas SNARE, que estão envolvidos em muitos outros eventos de fusão das membranas. Diferentes proteínas SNARE presentes nos grânulos e nas membranas plasmáticas interagem para formar um complexo multimérico que catalisa a fusão. A formação de complexos SNARE é regulada por várias moléculas acessórias, incluindo Rab3 guanosina trifosfatases, e cinases e fosfatases associadas a Rab. Nos mastócitos em repouso, estas moléculas regulatórias inibem a fusão da membrana do grânulo do mastócito com a membrana plasmática. Na ligação cruzada do FcεRI, o aumento resultante das concentrações de cálcio citoplasmático e a ativação da PKC bloqueiam as funções de regulagem das moléculas acessórias. Além disso, as proteínas de sensor de cálcio, chamadas sinaptotagminas, respondem a elevadas concentrações de cálcio, promovendo a formação do complexo de SNARE e a fusão da membrana.
Após a fusão da membrana, os conteúdos dos grânulos dos mastócitos são liberados no meio extracelular. Este processo pode ocorrer dentro de segundos da ligação cruzada do FcεRI, e pode ser visualizado morfologicamente através da perda dos grânulos densos dos mastócitos (Fig. 19-4). As ações biológicas dos mediadores liberados mediante a desgranulação dos mastócitos são descritas posteriormente.
A síntese dos mediadores lipídicos é controlada pela ativação da enzima citosólica fosfolipase A2 (PLA2) (Fig. 19-5). Esta enzima é ativada por dois sinais: cálcio citoplasmático elevado e fosforilação catalisada por uma proteína cinase ativada por mitógeno (MAP) tal como cinase ativada por receptor extracelular (ERK). A ERK é ativada como uma consequência de uma cascata de cinases iniciada através dos receptores ITAM, provavelmente usando os mesmos intermediários das células T (Cap. 7). Uma vez ativada, a PLA2 hidrolisa os fosfolipídios da membrana para liberar os substratos que são convertidos pelas cascatas de enzimas em mediadores finais. O substrato principal é o ácido araquidônico, que é convertido pela ciclooxigenase ou lipoxigenase em diferentes mediadores (discutidos posteriormente).
A produção da citocina por mastócitos ativados é uma consequência da transcrição dos genes de citocina recém-induzidos. Os eventos bioquímicos que regulam a transcrição dos genes de citocina nos mastócitos parecem ser semelhantes aos eventos que ocorrem nas células T. O recrutamento e ativação de diversas moléculas adaptadoras e cinases, em resposta às ligações cruzadas de FcεRI levam à translocação nuclear do fator nuclear das células T ativadas (NFAT) e do fator nuclear κB (NF-κB), bem como da ativação da proteína 1 de ativação (AP-1) pelas proteínas cinases como a c-Jun N-terminal cinase. Estes fatores de transcrição estimulam a transcrição de diversas citocinas (IL-4, IL-5, IL-6, IL-13, e o fator de necrose tumoral [TNF], entre outros) mas, em contraste com as células T, não da IL-2.
A ativação dos mastócitos através da via FcεRI é regulada por vários receptores inibidores, que contém um motivo de inibição baseado na tirosina do imunorreceptor (ITIM) dentro de suas caudas citoplasmáticas (Cap. 7). Um destes receptores inibidores é o FcγRIIB, que se coagrega com o FcεRI durante a ativação dos mastócitos. O ITIM do FcγRIIB é fosforilado pelo Lyn, e isto leva ao recrutamento da fosfatase chamada inositol 5-fosfatase contendo domínio SH2 (SHIP) e inibição de sinalização de FcεRI. Experimentos em camundongos indicam que o FcγRIIB regula a desgranulação dos mastócitos in vivo. Diversos outros receptores inibidores também são expressos nos mastócitos, mas sua importância in vivo ainda não é conhecida.
Os mastócitos podem ser diretamente ativados por uma variedade de substâncias biológicas independente da ligação cruzada mediada por alérgenos do FcεRI, incluindo compostos polibásicos, peptídeos, quimiocinas e anafilatoxinas derivadas do complemento. Estes modos adicionais de ativação dos mastócitos podem ser importantes nas reações de hipersensibilidade imediata sem mediação imune, ou eles podem amplificar as reações mediadas por IgE. Certos tipos de mastócitos ou basófilos podem responder a quimiocinas derivadas dos macrófagos, como a proteína inflamatória dos macrófagos 1α (MIP-1α), produzida como parte da imunidade inata, e às quimiocinas derivadas da célula T, produzidas como parte da imunidade mediada pela célula adaptativa. As anafilatoxinas derivadas do complemento, especialmente a C5a, se ligam aos receptores específicos nos mastócitos e estimulam a desgranulação. Estas quimiocinas e fragmentos do complemento que ativam os mastócitos provavelmente são produzidos em locais de inflamação. Portanto, a ativação dos mastócitos e a liberação dos mediadores podem amplificar as reações inflamatórias independentes de IgE. Os compostos polibásicos, tais como o composto 48/40 e o mastoparan, são usados experimentalmente como estímulos farmacológicos para mastócitos. Estes agentes contêm uma região catiônica adjacente a uma fração hidrofóbica, e eles funcionam ativando as proteínas G.
Muitos neuropeptídeos, incluindo a substância P, somatostatina, e o peptídeo intestinal vasoativo, induzem a liberação de histamina dos mastócitos e podem mediar a ativação dos mastócitos ligados ao sistema neuroendócrino. O sistema nervoso é conhecido por modular reações de hipersensibilidade imediata, e os neuropeptídeos podem estar envolvidos neste efeito. O halo eritematoso produzido na borda da pápula nas reações de hipersensibilidade imediata provocadas é em parte mediado pelo sistema nervoso, conforme mostrado pela observação que é marcadamente diminuída nos locais da pele que não têm inervação. As temperaturas frias e o exercício intenso também podem desencadear a desgranulação dos mastócitos, mas os mecanismos envolvidos não são conhecidos.
Os mastócitos também expressam receptores Fc para cadeias pesadas de IgG, e as células podem ser ativadas por IgG unida pelas ligações cruzadas. Esta reação mediada pela IgG é a explicação provável para a constatação que os camundongos knockout para cadeia ε de Ig não são completamente resistentes à anafilaxia mediada por mastócitos induzidos por antígenos. No entanto, a IgE é o principal isótopo de anticorpo envolvido na maioria das reações de hipersensibilidade imediata.
A ativação dos mastócitos não é um fenômeno de tudo ou nada, e tipos ou níveis diferentes de estímulos podem provocar reações parciais, com a produção de alguns mediadores, mas outros não. Tais variações na ativação e liberação do mediador podem ser responsáveis pelas apresentações clínicas variáveis.
Mediadores Derivados dos Mastócitos
As funções efetoras dos mastócitos são mediadas por moléculas solúveis liberadas das células na ativação (Fig. 19-6 e Tabela 19-2). Estes mediadores podem ser divididos em mediadores pré-formados, que incluem aminas biogênicas e macromoléculas de grânulos, e mediadores recém-sintetizados, que incluem mediadores derivados dos lipídios e citocinas.
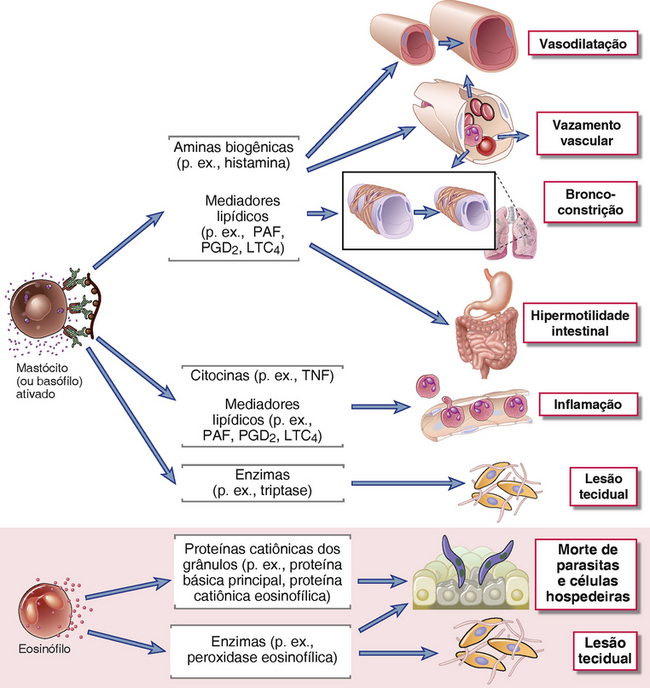
FIGURA 19-6 Efeitos biológicos dos mediadores de hipersensibilidade imediata. Os mediadores dos mastócitos e dos basófilos incluem as aminas biogênicas e as enzimas pré-formadas armazenadas nos grânulos, bem como as citocinas e os mediadores lipídicos, que são em grande parte recém-sintetizados na ativação celular. As aminas biogênicas e os mediadores lipídicos induzem vazamento vascular, broncoconstrição e hipermotilidade intestinal, todos componentes da resposta imediata. As citocinas e os mediadores lipídicos contribuem para a inflamação, que faz parte da reação de fase tardia. As enzimas provavelmente contribuem para a lesão do tecido. Os eosinófilos ativados liberam proteínas catiônicas pré-formadas, bem como enzimas que são tóxicas para parasitas e células hospedeiras. Algumas enzimas dos grânulos dos eosinófilos provavelmente contribuem para a lesão do tecido nas doenças alérgicas crônicas.
Aminas Biogênicas
Muitos dos efeitos biológicos da ativação dos mastócitos são mediados por aminas biogênicas que são armazenadas e liberadas de grânulos citoplasmáticos. As aminas biogênicas, às vezes chamadas de aminas vasoativas, são compostos de baixo peso molecular que contêm um grupo amina. Nos mastócitos humanos, o principal mediador desta classe é a histamina, mas em alguns roedores, a serotonina pode ser de igual ou maior importação. A histamina atua ligando-se aos receptores da célula-alvo, e diferentes tipos de células expressam diferentes classes de receptores de histamina (p. ex., H1, H2, H3) que podem ser distinguidos pela sua sensibilidade aos diferentes inibidores farmacológicos. As ações da histamina são de curta duração, pois a histamina é rapidamente removida do meio extracelular através dos sistemas de transporte específicos para aminas. Na ligação com os receptores celulares, a histamina inicia eventos intracelulares, tais como a quebra do fosfatidilinositol em IP3 e DAG, e estes produtos provocam alterações diferentes em diferentes tipos celulares. A ligação da histamina com o endotélio provoca a contração das células endoteliais, levando ao aumento dos espaços interendoteliais, aumento da permeabilidade vascular e vazamento do plasma dentro dos tecidos. A histamina também estimula as células endoteliais a sintetizar relaxantes da célula muscular lisa vascular, tais como a prostaciclina (PGI2) e o óxido nítrico, que provocam a vasodilatação. Estas ações da histamina produzem a resposta de pápula e halo eritematoso da hipersensibilidade imediata (descritas posteriormente). Os antagonistas do receptor H1 da histamina (comumente chamados de anti-histamínicos) podem inibir a resposta de pápula e halo eritematoso para o alérgeno intradérmico ou anticorpo anti-IgE. A histamina também provoca a constrição do músculo liso intestinal e dos brônquios. Portanto, a histamina pode contribuir para o aumento do peristaltismo e do broncoespasmo associados aos alérgenos ingeridos e inalados, respectivamente. No entanto, em algumas doenças alérgicas, em especial na asma, os anti-histamínicos não são eficazes para suprimir a reação. Além disso, a broncoconstrição na asma é mais prolongada do que são os efeitos da histamina, sugerindo que outros mediadores derivados de mastócitos são importantes em algumas formas de hipersensibilidade imediata.
Enzimas e Proteoglicanos dos Grânulos
As proteases neutras de serina, incluindo a triptase e a quimase, são os constituintes de proteínas mais abundantes de grânulos de secreção de mastócitos e contribuem para o dano dos tecidos nas reações de hipersensibilidade imediata. A triptase está presente em todos os mastócitos humanos e não se sabe estar presente em qualquer outro tipo de célula. Consequentemente, a presença da triptase nos fluidos biológicos humanos é interpretada como um marcador da ativação dos mastócitos. A quimase é encontrada em alguns mastócitos humanos, e sua presença ou ausência é um critério para caracterizar os subgrupos dos mastócitos humanos, conforme discutido anteriormente. As funções destas enzimas in vivo não são conhecidas; no entanto, diversas atividades demonstradas in vitro sugerem efeitos biológicos importantes. Por exemplo, a triptase cliva o fibrinogênio e ativa a colagenase, provocando assim danos nos tecidos, enquanto a quimase, pode converter a angiotensina I em angiotensina II, degradar as membranas basais epidérmicas, e estimular a secreção de muco. Outras enzimas encontradas dentro dos grânulos dos mastócitos incluem a carboxipeptidase A e a catepsina G. Os grânulos dos basófilos também contêm diversas enzimas, algumas das quais são as mesmas que aquelas nos grânulos dos mastócitos, tais como proteases neutras, e outras são encontradas nos grânulos dos eosinófilos, tais como a proteína básica principal e a lisofosfolipase.
Os proteoglicanos, incluindo a heparina e o sulfato de condroitina, também são constituintes importantes tanto dos grânulos dos mastócitos como dos basófilos. Estas moléculas são compostas por um núcleo de polipeptídeo e múltiplas cadeias laterais não ramificadas de glicosaminoglicanos, que conferem uma carga negativa líquida forte para as moléculas. Dentro dos grânulos, os proteoglicanos servem como matrizes de armazenamento de aminas biogênicas positivamente carregadas, proteases e outros mediadores e impedem sua acessibilidade ao resto da célula. Os mediadores são liberados dos proteoglicanos em taxas diferentes após a exocitose de grânulos, as aminas biogênicas se dissociando muito mais rapidamente do que a triptase ou a quimase. Desta forma, os proteoglicanos podem controlar a cinética das reações de hipersensibilidade imediata.
Mediadores Lipídicos
Os resultados da ativação dos mastócitos na rápida síntese de novo e na liberação de mediadores provenientes de lipídios que têm uma variedade de efeitos sobre os vasos sanguíneos, músculo liso brônquico e leucócitos. Os mais importantes destes mediadores são derivados do ácido araquidônico, que é gerado pela hidrólise mediada pela PLA2 de fosfolipídios da membrana, conforme discutido anteriormente. O ácido araquidônico é metabolizado pelas vias da ciclooxigenase ou da lipoxigenase para produzir mediadores de reações alérgicas.
O principal mediador derivado do ácido araquidônico produzido pela via da ciclooxigenase nos mastócitos é a prostaglandina D2 (PGD2). A PGD2 liberada se liga aos receptores nas células musculares lisas e atua como um vasodilatador e um broncoconstritor. A PGD2 também promove a quimiotaxia de neutrófilos e o acúmulo em locais de inflamação. A síntese de PGD2 pode ser evitada por inibidores de ciclooxigenase, como a aspirina e outros agentes anti-inflamatórios não esteroides. Estes medicamentos podem exacerbar paradoxalmente a broncoconstrição asmática, porque eles expelem o ácido araquidônico para a produção de leucotrienos, discutidos a seguir.
Os principais mediadores derivados do ácido araquidônico, produzidos pela via da lipoxigenase são os leucotrienos, especialmente os LTC4 e seus produtos de degradação LTD4 e LTE4. O LTC4 é produzido por mastócitos e basófilos de mucosa, mas não por mastócitos do tecido conjuntivo. Os leucotrienos derivados dos mastócitos se ligam a receptores específicos em células musculares lisas, diferentes dos receptores para o PGD2, e provocam broncoconstrição prolongada. Coletivamente, LTC4, LTD4 e LTE4 constituem o que já foi uma vez chamado de substância de reação lenta da anafilaxia (SRS-A) e são tidos como importantes mediadores da broncoconstrição asmática. Quando injetados na pele, estes leucotrienos produzem uma pápula de longa duração característica e uma reação de halo eritematoso. Os inibidores farmacológicos da 5-lipoxigenase também bloqueiam reações anafiláticas em sistemas experimentais.
Um terceiro tipo de mediador lipídico produzido por mastócitos é chamado de fator ativador de plaquetas (PAF) por seu bioensaio original como indutor da agregação plaquetária em coelhos. Nos mastócitos e basófilos, o PAF é sintetizado pela acilação de lisogliceril éter fosforilcolina, um derivado da hidrólise dos fosfolipídios da membrana mediados pelo PLA2. O PAF tem ações broncoconstritoras diretas. Ele também provoca retração das células endoteliais e pode relaxar o músculo liso vascular. No entanto, o PAF é hidrofóbico e é rapidamente destruído por uma enzima plasmática chamada PAF hidrolase, que limita suas ações biológicas. Os inibidores farmacológicos dos receptores de PAF melhoram alguns aspectos da hipersensibilidade imediata no pulmão dos coelhos. Evidências genéticas recentes têm apontado para o PAF como um mediador da asma. A asma se desenvolve na primeira infância em indivíduos com uma deficiência hereditária de PAF hidrolase. O PAF também pode ser importante nas reações de fase tardia, quando os leucócitos inflamatórios podem ser ativados. Nesta situação, a fonte do PAF pode ser os basófilos ou as células endoteliais vasculares (estimuladas por histamina ou leucotrienos), além dos mastócitos.
Citocinas
Os mastócitos (e basófilos) produzem muitas citocinas diferentes que contribuem para a inflamação alérgica (a reação de fase tardia). Estas citocinas incluem TNF, IL-1, IL-4, IL-5, IL-6, IL-13, CCL3, CCL4, e vários fatores estimulantes de colônias, como a IL-3 e o fator estimulante de colônias granulócitos-monócitos (GM-CSF). Conforme mencionado anteriormente, a ativação dos mastócitos induz transcrição e síntese destas citocinas, mas o TNF pré-formado também pode ser armazenado em grânulos e liberado rapidamente em ligações cruzadas de FcεRI. As células TH2 que são recrutadas para os locais de reações alérgicas também produzem algumas destas citocinas. As citocinas que são liberadas após ativação de mastócitos, basófilos e células TH2 são principalmente responsáveis pela inflamação associada à reação de fase tardia. O TNF ativa a expressão endotelial das moléculas de adesão e, juntamente com as quimiocinas, representa a infiltração de neutrófilos e monócitos (Cap. 3). Além da inflamação alérgica, as citocinas dos mastócitos também contribuem aparentemente para as respostas imunes inatas às infecções. Por exemplo, como discutiremos posteriormente, modelos de camundongos indicam que os mastócitos são necessários para uma defesa eficaz contra algumas infecções bacterianas, e esta função efetora é mediada em grande parte pelo TNF.
Propriedades dos Eosinófilos
Os eosinófilos são granulócitos derivados da medula óssea que são abundantes nos infiltrados inflamatórios das reações de fase tardia e estão envolvidos em muitos dos processos patológicos das doenças alérgicas. Os eosinófilos se desenvolvem na medula óssea, e após a maturação eles circulam no sangue. GM-CSF, IL-3 e IL-5 promovem a maturação dos eosinófilos dos precursores mieloides. Os eosinófilos estão presentes normalmente nos tecidos periféricos, especialmente nos revestimentos de mucosa dos tratos respiratório, gastrointestinal e geniturinário, e seus números podem aumentar através do recrutamento no ambiente de inflamação. Os grânulos dos eosinófilos contêm proteínas básicas que ligam corantes ácidos como a eosina (Tabela 19-2 e a Fig. 19-2C).
As citocinas produzidas pelas células TH2 promovem a ativação dos eosinófilos e seu recrutamento para locais inflamatórios da reação de fase tardia. O IL-5 é uma potente citocina de ativação de eosinófilos, que aumenta a capacidade dos eosinófilos de liberar conteúdos de grânulos. O IL-5 também aumenta a maturação dos eosinófilos dos precursores da medula óssea, e na ausência desta citocina (p. ex., nos camundongos knockout para IL-5), há uma deficiência no número e funções de eosinófilos. Os eosinófilos são recrutados para os locais de reação de fase tardia, bem como para os locais de infecção por helmintos, e o seu recrutamento é mediado por uma combinação de interações de moléculas de adesão e quimiocinas. Os eosinófilos se ligam a células endoteliais expressando E-selectina e VCAM-1, o ligante para a integrina VLA-4. A IL-4 produzida pelas células TH2 pode aumentar a expressão das moléculas de adesão para os eosinófilos. O recrutamento de eosinófilos e a infiltração nos tecidos também dependem da quimiocina eotaxina (CCL11), que é produzida pelas células epiteliais nos locais das reações alérgicas e se liga ao receptor de quimiocina CCR3, que é expresso constitutivamente por eosinófilos. Além disso, o produto do complemento C5a e os mediadores lipídicos PAF e LTB4, que são produzidos pelos mastócitos, também funcionam como quimioatrativos para os eosinófilos.
Os eosinófilos liberam proteínas de grânulos que são tóxicas para organismos parasitários e podem lesar o tecido normal. Os eosinófilos expressam receptores Fc para IgG, IgA e IgE, e são, presumivelmente, capazes de responder a estes receptores de ligações cruzadas pelo antígeno ligado aos anticorpos associados aos receptores. O FcεRI nos eosinófilos humanos tem carência de cadeia β, um componente de sinalização do receptor, e não está claro quão eficiente estas células desgranulam em resposta à ligação cruzada da IgE. Os conteúdos dos grânulos dos eosinófilos incluem hidrolases lisossômicas encontradas em outros granulócitos, assim como proteínas específicas de eosinófilos que são especialmente tóxicas para organismos helmintos, incluindo a proteína básica principal e a proteína catiônica eosinofílica. Estes dois polipeptídeos catiônicos não têm nenhuma atividade enzimática conhecida, mas eles são tóxicos para helmintos e bactérias, e também para tecidos normais. Além disso, os grânulos eosinofílicos contêm peroxidase de eosinófilos, que é diferente da mieloperoxidase encontrada nos neutrófilos e catalisa a produção de ácido hipocloroso ou hipobromoso. Estes produtos também são tóxicos para os helmintos, protozoários e células hospedeiras.
Os eosinófilos ativados, como os mastócitos e os basófilos, produzem e liberam mediadores lipídicos, incluindo o PAF, as prostaglandinas e os leucotrienos LTC4 e seus derivados LTD4 e LTE4. Esses mediadores lipídicos derivados dos eosinófilos podem contribuir para os processos patológicos das doenças alérgicas. Os eosinófilos também produzem uma variedade de citocinas que podem promover respostas inflamatórias e reparo do tecido, mas o significado biológico da produção de citocinas pelos eosinófilos não é conhecida.
REAÇÕES DEPENDENTES DE IgE E DE MASTÓCITOS
As células e mediadores que discutimos são responsáveis pelas mudanças vasculares imediatas e respostas inflamatórias tardias que tipificam as reações alérgicas. Nas seções seguintes iremos descrever em detalhes estas reações imediatas e de fase tardia (Fig. 19-7).
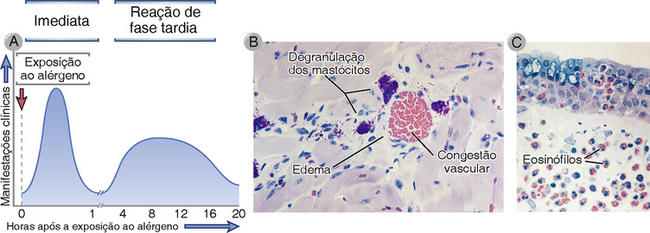
FIGURA 19-7 As reações imediatas e de fase tardia da alergia. A, Cinética. A reação imediata vascular e da musculatura lisa ao alérgeno se desenvolve dentro de minutos após o desafio (exposição de um indivíduo previamente sensibilizado ao alérgeno), e a reação de fase tardia se desenvolve de 2 a 24 horas mais tarde. B, C, Morfologia. A reação imediata (B) é caracterizada pela vasodilatação, congestão, edema e a reação de fase tardia (C) é caracterizada por uma infiltração inflamatória rica em eosinófilos, neutrófilos e células T.
(Cortesia de Dr. Daniel Friend, Department of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.)
A Reação Imediata
As primeiras mudanças vasculares que ocorrem durante as reações de hipersensibilidade imediata são demonstradas pela reação de pápula e de halo eritematoso para a injeção intradérmica de um alérgeno (Fig. 19-8). Quando um indivíduo que já encontrou previamente um alérgeno e produziu anticorpo IgE é desafiado pela injeção intradérmica do mesmo antígeno, o local da injeção se torna vermelho dos vasos sanguíneos localmente dilatados, ingurgitados com células sanguíneas vermelhas. O local então rapidamente incha como resultado do vazamento do plasma das vênulas. Este inchaço suave é chamado de pápula e pode envolver uma área da pele, que pode ter vários centímetros de diâmetro. Posteriormente, os vasos sanguíneos nas margens da pápula se dilatam e se tornam cheios de células sanguíneas vermelhas e produzem uma borda vermelha característica chamada de halo eritematoso. A reação completa de pápula e halo eritematoso pode aparecer dentro de 5 a 10 minutos após a administração do antígeno e geralmente regridem em menos de uma hora.
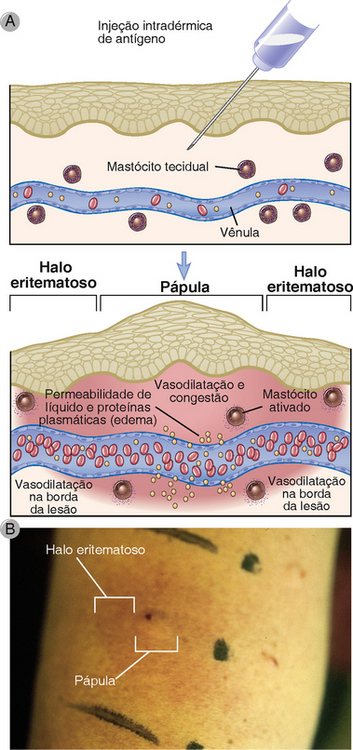
FIGURA 19-8 A reação de pápula e halo eritematoso na pele. A, Em resposta à liberação de mediadores de mastócitos estimulada pelo antígeno, os vasos sanguíneos locais primeiro se dilatam e depois se tornam perfurados para fluidos e macromoléculas, que produz vermelhidão e inchaço local (uma pápula). A dilatação subsequente dos vasos à beira do inchaço produz a aparência de uma borda vermelha (o halo eritematoso). B, Fotografia de uma reação típica de pápula e halo eritematoso na pele em resposta à injeção de um alérgeno.
(Cortesia de Dr. James D. Faix, Department of Pathology, Stanford University School of Medicine, Palo Alto, California.)
A reação de pápula e halo eritematoso é dependente de IgE e mastócitos. O exame histológico mostra que os mastócitos na área da pápula e do halo eritematoso liberaram mediadores pré-formados; isto é, seus grânulos citoplasmáticos foram descarregados. Uma associação causal de IgE e mastócitos com hipersensibilidade imediata foi deduzida pela primeira vez de experimentos envolvendo a transferência passiva de anticorpos IgE de um indivíduo alérgico para um destinatário normal. Por exemplo, as reações de hipersensibilidade imediata contra um alérgeno podem ser provocadas em indivíduos que não respondem se o local da pele é primeiro injetado com IgE de um indivíduo alérgico. Estes experimentos de transferência adotiva foram realizados pela primeira vez com soro de indivíduos imunizados, e o fator do soro responsável pela reação foi originalmente chamado de reagina. Por esta razão, as moléculas de IgE ainda são às vezes chamadas de anticorpos reagínicos. A reação cutânea iniciada pelo antígeno que segue a transferência adotiva do IgE é chamada anafilaxia cutânea passiva.
As reações de pápula e halo eritematoso resultam da sensibilização dos mastócitos dérmicos pela ligação da IgE com o FcεRI, ligação cruzada da IgE pelo antígeno, e ativação dos mastócitos com liberação de mediadores, nomeadamente a histamina. A histamina se liga aos receptores de histamina nas células endoteliais venulares; as células endoteliais sintetizam e liberam PGI2, óxido nítrico e PAF; e estes mediadores provocam vasodilatação e vazamento vascular, conforme descrito anteriormente. Os mastócitos da pele parecem produzir apenas pequenas quantidades de mediadores de longa ação, como os leucotrienos, assim a resposta de pápula e halo eritematoso regride rapidamente. Os alergistas muitas vezes testam pacientes para verificar alergias a antígenos, através do exame da capacidade destes antígenos aplicados em contato com a pele para provocar reações de pápula e eritema.
A Reação de Fase Tardia
A reação imediata de pápula e eritema é seguida 2 a 4 horas mais tarde por uma reação de fase tardia, que consiste no acúmulo de leucócitos inflamatórios, incluindo neutrófilos, eosinófilos, basófilos e células TH2 (Fig. 19-7). A inflamação é máxima por cerca de 24 horas e então ela gradualmente diminui. A capacidade de montar uma reação de fase tardia também pode ser transferida adotivamente com a IgE, e a reação pode ser imitada pelos anticorpos anti-IgE ou pelos agentes de ativação dos mastócitos, como a reação imediata de pápula e eritema. As citocinas produzidas pelos mastócitos, incluindo o TNF, a expressão endotelial de regulagem ascendente das moléculas de adesão dos leucócitos, tais como a E-selectina e a molécula de adesão intercelular 1 (ICAM-1), e as quimiocinas que recrutam os leucócitos do sangue. Assim, a ativação dos mastócitos promove o recrutamento dos leucócitos para os tecidos. Os tipos de leucócitos que são típicos de reações de fase tardia são os eosinófilos e as células TH2; além disso, os neutrófilos estão frequentemente presentes nestas reações. Tanto os eosinófilos como as células TH2 expressam CCR4 e CCR3, e as quimiocinas que se ligam a estes receptores são produzidos por muitos tipos de células nos locais de reações de hipersensibilidade imediata, incluindo as células epiteliais. A reação de fase tardia difere das reações de hipersensibilidade do tipo tardia, em que os macrófagos e as células TH1 são dominantes.
A reação de fase tardia pode ocorrer sem uma reação de hipersensibilidade imediata precedente detectável. A asma brônquica é uma doença na qual pode ocorrer repetidos ataques de inflamação com acúmulo de eosinófilos e células TH2 sem alterações vasculares que são características da resposta imediata. Em tais distúrbios, pode haver pouca ativação de mastócitos, e as citocinas que sustentam a reação de fase tardia podem ser produzidas principalmente pelas células T.
SUSCETIBILIDADE GENÉTICA À HIPERSENSIBILIDADE IMEDIATA
A propensão a desenvolver alergias é influenciada pela herança de vários genes. Níveis anormalmente elevados de síntese de IgE e atopia associada muitas vezes ocorrem nas famílias. Estudos familiares mostraram transmissão autossômica clara de atopia, embora o padrão de herança completo seja multigênico. Dentro da mesma família, o órgão-alvo da doença atópica é variável. Assim, a febre do feno, a asma e o eczema podem estar presentes em vários graus em diferentes membros da mesma parentela. Todos estes indivíduos, no entanto, mostrarão níveis de IgE do plasma mais altos do que a média.
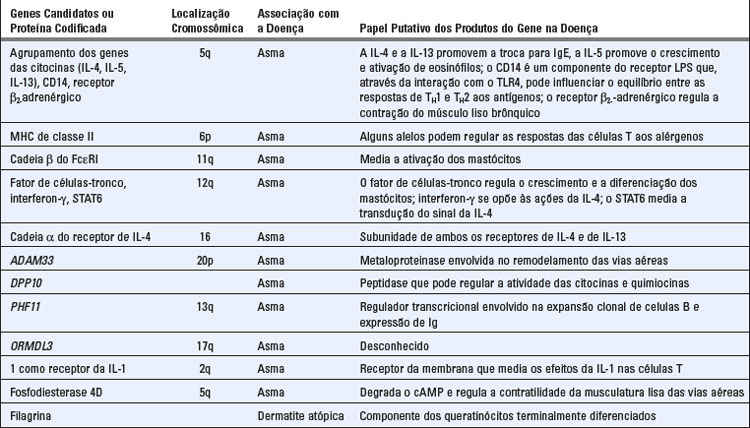
Estudos sobre a genética das doenças alérgicas nas populações incluíram análises das ligações com a gama de genomas e, mas recentemente, estudos da associação da gama de genomas. As análises das ligações para loci de suscetibilidade à atopia/asma identificaram diversas regiões cromossômicas de importância nas doenças alérgicas (Tabela 19-4). Cada um destes loci pode conter diversos genes que podem contribuir para a doença. Alguns dos genes nestes loci podem regular as respostas às TH2 e a produção de IgE. Outros genes podem ter influências específicas do tecido, tais como o remodelamento das vias aéreas no pulmão asmático. Um dos loci de suscetibilidade para a atopia está no cromossomo 5q, próximo ao local do agrupamento do gene que codifica as citocinas IL-3, IL-4, IL-5, IL-9 e IL-13 e o receptor de IL-4. Esta região é de grande interesse devido à conexão entre vários dos genes localizados aqui e os mecanismos de regulação da IgE e o crescimento e diferenciação de mastócitos e eosinófilos. Além disso, a região cromossômica homóloga nos camundongos tem sido associada a uma propensão para células T CD4+, em algumas linhagens endogâmicas de camundongos, diferenciarem-se em células TH2 em resposta aos antígenos da proteína modelo. Entre os genes neste agrupamento, os polimorfismos no gene da IL-13 parecem ter a mais forte associação com a asma. A tendência de produzir anticorpos IgE contra alguns, mas não todos os antígenos, tais como pólen da ambrosia, pode estar ligada a determinados alelos do complexo principal de histocompatibilidade (MHC) de classe II. Esta ligação pode ser um exemplo de efeito de “gene de resposta imune” (gene Ir) em que indivíduos atópicos herdam alelos de MHC de classe II que podem se ligar e apresentar epítopos dominantes de certos alérgenos (Cap. 6). Várias outras regiões cromossômicas mostraram estar associadas a altos níveis séricos de IgE, atopia e asma. Além destes estudos de ligação, os genes individuais associados à asma foram identificados por clonagem posicional. Estes incluem ADAM33, DPP10 e PHF11 (Tabela 19-4). Embora existam associações altamente significativas de polimorfismos destes genes com a asma, a forma pela qual os produtos dos genes contribuem para a doença ainda não é compreendida.
Alguns genes cujos produtos regulam a resposta imune inata às infecções se associaram à alergia e asma. Estes incluem CD14, um componente do receptor de lipopolissacarídeo e TIM-1, uma proteína que acredita-se influenciar a diferenciação das células T auxiliares. Fortes respostas inatas a infecções geralmente favorecem o desenvolvimento das respostas TH1 e inibem as respostas TH2 (Cap. 9). Portanto, os polimorfismos ou mutações nos genes que resultam nas respostas inatas diminuídas a organismos infecciosos comuns podem aumentar o risco de desenvolver atopia.
Os estudos da asma associados a gama de genomas encontraram associações com as variantes dos genes que codificam ORMDL3, uma proteína ubíqua de função desconhecida; 1 como o receptor de IL-1, que pode mediar alguns dos efeitos da IL-1 nas células T; e a fosfodiesterase 4D, que é um regulador da contratilidade da musculatura lisa das vias aéreas (Tabela 19-4).
DOENÇAS ALÉRGICAS EM SERES HUMANOS: PATOGÊNESE E TERAPIA
A desgranulação dos mastócitos é um componente central de todas as doenças alérgicas, e as manifestações clínicas e patológicas das doenças dependem dos tecidos em que os mediadores dos mastócitos têm efeitos, bem como da cronicidade do processo inflamatório resultante. Os indivíduos atópicos podem ter uma ou mais manifestações de doenças alérgicas. As formas mais comuns destas doenças são a rinite alérgica (febre do feno), asma brônquica, dermatite atópica (eczema) e alergias alimentares. As características clínicas e patológicas das reações alérgicas variam de acordo com o local anatômico da reação, por diversas razões. O ponto do contato com o alérgeno determina os órgãos ou tecidos que estão envolvidos. Por exemplo, os antígenos inalados provocam rinite ou asma, antígenos ingeridos geralmente provocam vômito e diarreia, e antígenos injetados provocam efeitos sistêmicos na circulação. A concentração dos mastócitos em vários órgãos-alvo influencia a gravidade das respostas. Os mastócitos são particularmente abundantes na pele e na mucosa do trato respiratório e gastrointestinal, e estes tecidos frequentemente sofrem a maior parte das lesões nas reações de hipersensibilidade imediata. O fenótipo do mastócito local pode influenciar as características da reação de hipersensibilidade imediata. Por exemplo, os mastócitos do tecido conjuntivo produzem histamina abundante e são responsáveis pelas reações de pápula e eritema na pele. Na seção seguinte, discutiremos as principais características das doenças alérgicas manifestas nos diferentes tecidos.
Anafilaxia Sistêmica
A anafilaxia é uma reação de hipersensibilidade imediata sistêmica caracterizada por edema em muitos tecidos e uma queda na pressão arterial, secundária à vasodilatação. Estes efeitos geralmente resultam na presença sistêmica de antígeno introduzido por injeção, picada de inseto, ou absorção através de uma superfície epitelial como a pele ou mucosa do intestino. O alérgeno ativa os mastócitos em muitos tecidos, resultando na liberação de mediadores que têm acesso a leitos vasculares de todo o corpo. A diminuição no tônus vascular e o vazamento de plasma provocado por mediadores liberados podem levar a uma queda na pressão arterial ou choque, chamado choque anafilático, que é muitas vezes fatal. Os efeitos cardiovasculares são acompanhados pela constrição das vias aéreas superiores e inferiores, edema de laringe, hipermotilidade do intestino, derramamento do muco no intestino e trato respiratório, e lesões urticárias (colmeias) na pele. Não se sabe quais mediadores dos mastócitos são os mais importantes no choque anafilático. A base do tratamento é a epinefrina sistêmica, que pode ser um salva-vidas através da inversão dos efeitos broncoconstritores e vasodilatadores dos mediadores dos mastócitos. A epinefrina também melhora o débito cardíaco, ajudando ainda a sobrevivência de uma ameaça de colapso circulatório. Os anti-histamínicos também podem ser benéficos na anafilaxia, sugerindo um papel para a histamina nesta reação. Em alguns modelos animais, os antagonistas aos receptores PAF oferecem proteção parcial.
Asma Brônquica
A asma é uma doença inflamatória provocada por repetidas reações alérgicas de hipersensibilidade de fase imediata e de fase tardia no pulmão, levando a tríade clínicopatológica de obstrução intermitente e reversível das vias aéreas, inflamação brônquica crônica com eosinófilos, e hipertrofia celular do músculo liso brônquico e hiperreatividade para os broncoconstritores (Fig. 19-9). Os pacientes sofrem paroxismos de constrição brônquica e aumento da produção de muco espesso, o que leva à obstrução brônquica e exacerba as dificuldades respiratórias. A asma frequentemente coexiste com a bronquite ou com o enfisema, e a combinação destas doenças pode provocar graves danos ao tecido pulmonar. Os indivíduos afetados podem sofrer considerável morbidade, e a asma pode ser fatal. A asma afeta cerca de 10 milhões de pessoas nos Estados Unidos, e a frequência desta doença aumentou significantemente nos últimos anos. A taxa de prevalência é semelhante à de outros países industrializados, mas pode ser menor em áreas menos desenvolvidas do mundo. Uma possível explicação para o aumento da prevalência da asma e outras doenças em países industrializados é que a frequência de infecções nestes países é geralmente mais baixa. Como discutimos anteriormente, as respostas imunes inatas associadas à maioria das infecções promovem respostas TH1 e suprime respostas TH2, necessárias para o desenvolvimento de atopia. Uma variedade de dados epidemiológicos são consistentes com a ideia de que a redução de infecções leva ao aumento da prevalência de doenças alérgicas. Esta ideia deu o nome atraente à hipótese da higiene.
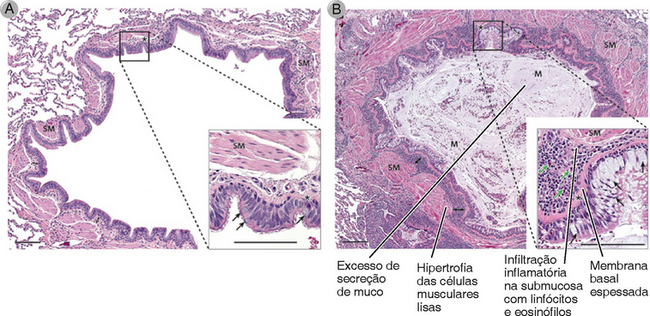
FIGURA 19-9 Características histopatológicas da asma brônquica. A asma brônquica atópica resulta das reações de hipersensibilidade imediata repetidas nos pulmões, com reações de fase tardia crônicas. Um corte transversal de um brônquio normal é mostrado em A; o brônquio de um paciente com asma é mostrado em B. O brônquio doente tem excesso de produção de muco (M), muitas células inflamatórias na submucosa (incluindo os eosinófilos), e hipertrofia do músculo liso (SM), e muito mais células caliciformes do que no brônquio normal (setas pretas nas inserções).
(De Galli SJ, M Tsai, and AM Piliponsky. The development of allergic inflammation. Nature 454:445-454, 2008. Cortesia de G. J. Berry, Stanford University, California.)
Cerca de 70% dos casos de asma estão associados à hipersensibilidade imediata mediada pela IgE. Nos 30% restante dos pacientes, a asma pode não estar associada à atopia e pode ser desencadeada por estímulos não imunes, tais como medicamentos, frio e exercícios físicos. Mesmo entre os asmáticos não atópicos, o processo fisiopatológico da constrição das vias aéreas é semelhante, o que sugere que os mecanismos alternativos da desgranulação dos mastócitos (p. ex., por neurotransmissores produzidos localmente) podem estar por trás da doença.
A sequência fisiopatológica na asma atópica é provavelmente iniciada pela ativação dos mastócitos em resposta à ligação do alérgeno à IgE, assim como pelas células TH2 reagindo aos alérgenos (Fig. 19-10). Os mediadores lipídicos e as citocinas produzidos pelos mastócitos e pelas células T levam ao recrutamento de eosinófilos, basófilos e mais células TH2. A inflamação crônica desta doença pode continuar sem a ativação dos mastócitos. Há evidências experimentais de que outros subgrupos de células, incluindo as células TH1 e TH17, bem como as células T secretoras de IL-9, contribuem para a patologia da doença estabelecida. A hipertrofia das células musculares lisas e a hiperreatividade são tidas como resultados dos mediadores derivados dos leucócitos e das citocinas. Mastócitos, basófilos e eosinófilos produzem mediadores que causam constrição da musculatura lisa das vias respiratórias. Os mediadores broncoconstritores mais importantes são LTC4, os produtos de sua degradação LTD4 e LTE4, e PAF. Em experimentos clínicos, os antagonistas da síntese de LTC4 ou os antagonistas dos receptores dos leucotrienos previnem a constrição das vias aéreas induzida por alérgenos. O aumento da secreção de muco resulta da ação das citocinas, principalmente de IL-13, nas células epiteliais brônquicas.
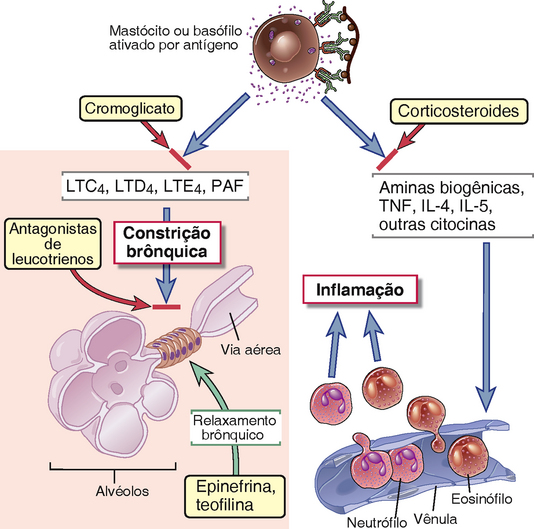
FIGURA 19-10 Mediadores e tratamento da asma. Acredita-se que os leucotrienos e PAF derivados dos mastócitos sejam os principais mediadores da broncoconstrição aguda. A terapia é direcionada tanto na redução da ativação dos mastócitos com inibidores como o cromoglicato, como em ações contra o mediador na musculatura lisa brônquica por broncodilatadores como a epinefrina e a teofilina. Estes medicamentos também inibem a ativação dos mastócitos. Acredita-se que as citocinas derivadas dos mastócitos sejam os principais mediadores da inflamação sustentada das vias aéreas, que é um exemplo de uma reação de fase tardia, e a terapia dos corticosteroides é usada para inibir a síntese de citocinas. As citocinas também são produzidas por células TH2 (não mostradas).
As infecções respiratórias virais e bacterianas são um fator de predisposição no desenvolvimento da asma ou nas exacerbações da asma preexistente. Por exemplo, estima-se que as infecções virais respiratórias precedem até 80% dos ataques de asma nas crianças. Não se sabe se estas infecções aumentam as chances de desenvolvimento de asma ou apenas exacerbam a asma preexistente. A associação da asma com infecções parece inconsistente com a hipótese da higiene já mencionada. Seria esperado que as infecções estimulassem a imunidade inata e, portanto, suprimissem as respostas de TH2. Este aparente paradoxo reflete nossa compreensão incompleta das populações de células T que contribuem para os diferentes estágios da asma.
A terapia atual para a asma tem dois objetivos principais: prevenção e reversão da inflamação e relaxamento da musculatura lista das vias aéreas. Nos últimos anos, o equilíbrio da terapia mudou em direção aos agentes anti-inflamatórios como modo de tratamento primário. Várias classes de medicamentos são de uso corrente no tratamento da asma. Os corticosteroides inalados bloqueiam a produção de citocinas inflamatórias. Os corticosteroides também podem ser dados sistematicamente, especialmente quando um ataque está em curso, para reduzir a inflamação. O relaxamento da célula muscular lisa brônquica tem sido alcançado principalmente através da elevação dos níveis intracelulares de monofosfato cíclico de adenosina (cAMP) nas células musculares lisas, o que inibe a contração. Os principais medicamentos usados são os ativadores da adenilciclase, como a epinefrina e agentes β2-adrenergéticos relacionados, e a teofilina que inibe as enzimas de fosfodiesterase que degradam o cAMP. A teofilina também pode ter efeitos anti-inflamatórios não relacionados a seus efeitos no relaxamento das células musculares lisas que contribuem para sua eficácia. Os inibidores dos leucotrienos bloqueiam a ligação dos leucotrienos broncoconstritores para as células musculares lisas das vias aéreas. O anticorpo anti-IgE monoclonal humanizado é uma terapia aprovada que efetivamente reduz os níveis de IgE sérico nos pacientes. Como a histamina tem um papel pequeno na constrição das vias aéreas, os anti-histamínicos (antagonistas do receptor H1) não são úteis no tratamento da asma. Na verdade, como muitos anti-histamínicos também são anticolinérgicos, estes medicamentos podem piorar a obstrução das vias aéreas, provocando o espessamento das secreções do muco.
Reações de Hipersensibilidade Imediata no Trato Respiratório Superior, Trato Gastrointestinal e Pele
A rinite alérgica, também chamada febre do feno, é talvez a doença alérgica mais comum e é uma consequência das reações de hipersensibilidade imediata aos alérgenos comuns, tais como o pólen da planta ou ácaros da poeira doméstica localizados no trato respiratório superior por inalação. As manifestações patológicas e clínicas incluem o edema da mucosa, a infiltração leucocitária com eosinófilos em abundância, secreção de muco, tosse, espirros e dificuldade em respirar. A conjuntivite alérgica com coceira nos olhos é comumente associada à rinite. As saliências focais da mucosa nasal, chamadas pólipos nasais, cheias de fluido de edema e eosinófilos podem se desenvolver em pacientes que sofrem frequentes episódios repetitivos de rinite alérgica. Os anti-histamínicos são os medicamentos mais comuns utilizados para tratar a rinite alérgica.
As alergias alimentares são reações de hipersensibilidade imediata para alimentos ingeridos que levam à liberação de mediadores dos mastócitos da submucosa e mucosa intestinal. As manifestações clínicas incluem o aumento do peristaltismo, aumento da secreção de fluidos das células de revestimento intestinal, e vômito e diarreia associados. A urticária está frequentemente associada às reações alérgicas aos alimentos, e a anafilaxia sistêmica pode ocasionalmente ocorrer. Reações alérgicas a muitos tipos diferentes de alimentos foram descritas, mas algumas das mais comuns são alergia a amendoins e a frutos do mar. Os indivíduos podem ser tão sensíveis a estes alérgenos que as reações sistêmicas graves podem ocorrer em resposta a contaminantes minúsculos do alérgeno introduzidos acidentalmente durante a preparação dos alimentos.
Algumas reações alérgicas na pele se manifestam como a urticária e o eczema. A urticária, que é essencialmente uma reação aguda de pápula e eritema induzida pelos mediadores dos mastócitos, ocorre em resposta ao contato direto com os alérgenos ou após um alérgeno entrar na circulação através do trato intestinal ou através de injeção. Como a reação que se segue é mediada principalmente pela histamina, os anti-histamínicos (antagonistas do receptor H1) podem bloquear esta resposta quase que completamente. A urticária pode persistir por várias horas, provavelmente porque o antígeno persiste no plasma. O eczema crônico (também chamado de dermatite atópica) é uma doença de pele comum que pode ser provocada por uma reação de fase tardia a um alérgeno na pele. Na reação de fase tardia cutânea, TNF, IL-4, e outras citocinas, provavelmente derivadas das células TH2 e dos mastócitos, agem sobre as células endoteliais venulares para promover a inflamação. Como seria de esperar de uma resposta mediada por citocinas, a reação inflamatória de fase tardia não é inibida por anti-histamínicos. Ela pode ser bloqueada pelo tratamento com corticosteróides, que inibem a síntese das citocinas. A sensibilidade crônica de contato, que é uma reação de DTH mediada por TH1, também é muitas vezes chamada de eczema. Um outro termo usado para distúrbios da pele imunomediados é a dermatite atópica; nem todos os casos são exemplos de atopia.
Imunoterapia para Doenças Alérgicas
Além da terapia que visa as consequências da hipersensibilidade imediata mencionada, os imunologias clínicos muitas vezes tentam limitar o aparecimento de reações alérgicas através de tratamentos destinados a reduzir a quantidade de IgE produzida no paciente. Diversos protocolos empíricos foram desenvolvidos para diminuir a síntese da IgE específica para o alérgeno. Em uma abordagem, chamada de dessensibilização, pequenas quantidades de antígenos são administradas repetidamente por via subcutânea. Como resultado deste tratamento, níveis de IgE específica diminuem e os títulos do IgG geralmente aumentam, talvez inibindo ainda mais a produção de IgE através da neutralização do antígeno e por feedback do anticorpo (Cap. 11). É possível que a dessensibilização possa funcionar através da indução da tolerância de células T específicas ou através da alteração do fenótipo predominante das células T específicas do antígeno de TH2 para TH1; no entanto, não há uma clara evidência para apoiar qualquer destas hipóteses. Os efeitos benéficos da dessensibilização podem ocorrer em questão de horas, muito antes das mudanças dos níveis de IgE. O mecanismo preciso é desconhecido, mas esta abordagem tem sido eficaz na prevenção de respostas anafiláticas agudas a antígenos de proteínas (p. ex., venenos de insetos) ou medicamentos vitais (p. ex., penicilina). Embora muitas pessoas com condições atópicas crônicas mais comuns, tais como a febre do feno e asma, se beneficiam da terapia de dessensibilização, a eficácia global para estes transtornos é mais variável.
Outras abordagens que estão sendo usadas para reduzir os níveis de IgE incluem a administração sistêmica de anticorpos anti-IgE monoclonais humanizados mencionados anteriormente.
OS PAPÉIS DE PROTEÇÃO DAS REAÇÕES IMUNES MEDIADAS POR IgE E MASTÓCITOS
Embora a maior parte de nossa compreensão das respostas mediadas por mastócitos e basófilos venha da análise da hipersensibilidade imediata, é lógico supor que estas respostas tenham evoluído porque elas fornecem funções de proteção. Na verdade, algumas evidências mostram que as respostas mediadas por IgE e mastócitos são importantes para a defesa contra certos tipos de infecção. Grande parte desta evidência vem de estudos em camundongos com deficiência de IgE, citocinas de TH2, ou mastócitos.
Uma das principais funções de proteção das reações imunes iniciadas pela IgE é a erradicação dos parasitas helmintos. A morte de helmintos mediada por eosinófilos é uma defesa eficaz contra estes organismos (Fig. 19-11 e Cap. 10). As atividades de IL-4 e IL-13 na produção de IgE e de IL-5 na ativação de eosinófilos contribuem para uma defesa coordenada contra helmintos. Além disso, a ativação de mastócitos dependente de IgE no trato gastrointestinal promove a expulsão de parasitas através do aumento dos movimentos peristálticos e pelo derramamento de muco. Estudos em camundongos destacaram o papel benéfico da IgE e dos mastócitos. Por exemplo, camundongos tratados com anticorpos anti-IL-4 e camundongos knockout para IL-4 não produzem IgE e parecem ser mais suscetíveis do que animais normais a algumas infecções por helmintos. Os camundongos knockout para IL-5, que são incapazes de ativar os eosinófilos, também mostram aumento de suscetibilidade a alguns helmintos. Além disso, camundongos geneticamente deficientes de mastócitos mostram suscetibilidade elevada à infecção por larvas de carrapato, e pode-se fornecer imunidade a esses camundongos através da transferência adotiva de IgE específica e mastócitos (mas não por um ou outro componente isolado). As larvas são erradicadas pela reação de fase tardia.
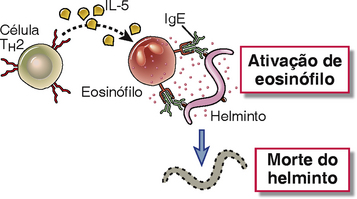
FIGURA 19-11 Ativação de eosinófilos para matar helmintos. A IL-5 secretada pelas células TH2 aumenta a capacidade dos eosinófilos de matar os parasitas. A ligação cruzada dos FcεRI nos eosinófilos pela ligação da IgE com os antígenos dos helmintos também pode induzir a desgranulação dos eosinófilos, liberando enzimas tóxicas para os parasitas.
Os mastócitos desempenham um papel importante de proteção, como parte da resposta imune inata a infecções bacterianas. Estudos em camundongos indicaram que os mastócitos podem ser ativados por mecanismos independentes de IgE no curso de uma infecção bacteriana aguda, e que os mediadores que eles liberam são críticos para a resolução da infecção. Camundongos com deficiência de mastócitos são menos capazes de resolver e são mais propensos a morrer de infecção bacteriana aguda do peritônio do que camundongos normais. O papel protetor dos mastócitos neste ambiente é mediado pelo TNF e depende do influxo de neutrófilos estimulado por TNF para dentro do peritônio, especialmente, a reação de fase tardia. Os mecanismos pelos quais os mastócitos são ativados durante as respostas imunes inatas à infecção bacteriana não são conhecidos, mas podem envolver a ativação do complemento pela via alternativa, levando à liberação de C5a, que desencadeia diretamente a desgranulação dos mastócitos. Também é possível que a via clássica do complemento possa ser ativada por anticorpos naturais que são produzidos por células do tipo B-1 e que reconheçam patógenos microbianos comuns. Os produtos bacterianos também podem ativar os mastócitos ligando-se a receptores semelhantes a Toll expressos pelos mastócitos.
As proteases derivadas dos mastócitos foram mostradas para destruir alguns venenos de cobras e de insetos em camundongos. Esta é uma forma incomum de “imunidade inata” contra um encontro potencialmente letal com organismos não microbianos.
• A hipersensibilidade imediata é uma reação imunológica desencadeada por ligação de antígeno a IgE pré-fixada a mastócitos, que leva à liberação dos mediadores inflamatórios.
• As etapas no desenvolvimento da hipersensibilidade imediata são a exposição a um antígeno (alérgeno) que estimula as respostas de TH2 e a produção de IgE, ligação da IgE aos receptores Fcε nos mastócitos, ligação cruzada da IgE e os receptores Fcε pelo alérgeno, ativação dos mastócitos e liberação dos mediadores.
• Os indivíduos suscetíveis a reações de hipersensibilidade imediata são chamados de atópicos e muitas vezes têm mais IgE no sangue e mais receptores Fc específicos para IgE por mastócito do que os indivíduos não atópicos. A síntese de IgE é induzida pela exposição ao antígeno e às citocinas TH2, especialmente a IL-4.
• Os mastócitos são derivados de precursores da medula óssea que amadurecem nos tecidos. Eles expressam receptores de alta afinidade para IgE (FcεRI) e contêm grânulos citoplasmáticos onde são armazenados vários mediadores inflamatórios. Os subgrupos de mastócitos, incluindo os mastócitos das mucosas e do tecido conjuntivo, podem produzir mediadores diferentes. Os basófilos são um tipo de granulócito circulante que expressa receptores Fcε de alta afinidade e contêm grânulos com conteúdos semelhantes aos mastócitos.
• Os eosinófilos são uma classe especial de granulócitos; eles são recrutados nas reações inflamatórias pelas quimiocinas e IL-4 e são ativados pela IL-5. Os eosinófilos são células efetoras que estão envolvidas no assassinato de parasitas. Nas reações alérgicas, os eosinófilos contribuem para a lesão tecidual.
• Na ligação do antígeno com a IgE na superfície dos mastócitos ou basófilos, os receptores Fcε de alta afinidade se tornam uma ligação cruzada e ativam os segundos mensageiros intracelulares que levam à liberação de grânulos e à nova síntese de mediadores. Os mastócitos e basófilos ativados produzem três importantes classes de mediadores: aminas biogênicas, como a histamina; mediadores lipídicos, como as prostaglandinas, leucotrienos e PAF; e citocinas, como o TNF, IL-4, IL-13 e IL-5.
• As aminas biogênicas e os mediadores lipídicos provocam reações rápidas vasculares musculares lisas da hipersensibilidade imediata, tais como vasodilatação, vazamento vascular e edema, broncoconstrição e hipermotilidade do intestino. As citocinas liberadas pelos mastócitos e pelas células TH2 medeiam a reação de fase tardia, que é uma reação inflamatória envolvendo a infiltração de neutrófilos e eosinófilos.
• Diversos órgãos mostram formas distintas de hipersensibilidade imediata envolvendo diferentes mediadores e tipos de células-alvo. A forma mais grave é uma reação sistêmica chamada choque anafilático. A asma é uma manifestação de hipersensibilidade imediata e de reações de fase tardia no pulmão. A rinite alérgica (febre do feno) é a doença alérgica mais comum do trato respiratório superior. Os alérgenos alimentares podem provocar diarreia e vômito. Na pele, a hipersensibilidade imediata se manifesta como pápula e halo eritematoso e reações de fase tardia e pode levar ao eczema crônico.
• A terapia medicamentosa é destinada à inibição da produção de mediadores de mastócitos e ao bloqueio ou neutralização dos efeitos dos mediadores liberados nos órgãos-alvo. O objetivo da imunoterapia é prevenir ou reduzir as respostas de células TH2 a alérgenos específicos e a produção de IgE.
• As reações de hipersensibilidade imediata fornecem proteção contra infecções helmínticas, promovendo a citotoxicidade mediada por célula dependente de anticorpo mediada por IgE e eosinófilos e o peristaltismo intestinal. Os mastócitos também podem desempenhar um papel nas respostas imunes inatas a infecções bacterianas.
Abraham SN, St John AL. Mast cell–orchestrated immunity to pathogens. Nature Reviews Immunology. 2010;10:440-452.
Gilfillan AM, Tkaczyk C. Integrated signalling pathways for mast-cell activation. Nature Reviews Immunology. 2006;6:218-230.
Kalesnikoff J, Galli SJ. New developments in mast cell biology. Nature Immunology. 2008;9:1215-1223.
Rivera J, Fierro NA, Olivera A, Suzuki R. New insights on mast cell activation via the high affinity receptor for IgE. Advances in Immunology. 2008;98:85-120.
Rothenberg ME, Hogan SP. The eosinophil. Annual Review of Immunology. 2006;24:147-174.
Stone KD, Prussin C, Metcalfe DD. IgE, mast cells, basophils, and eosinophils. Journal of Allergy and Clinical Immunology. 2010;125:S73-S80.
Respostas de TH2 e a Produção de IgE
Barrett NA, Austen KF. Innate cells and T helper 2 cell immunity in airway inflammation. Immunity. 2009;31:425-437.
Blank U, Rivera J. The ins and outs of IgE-dependent mast-cell exocytosis. Trends in Immunology. 2004;25:266-273.
Bufford JD, Gern JE. The hygiene hypothesis revisited. Immunology and Allergy Clinics of North America. 2005;25:247-262. v-vi
Geha RS, Jabara HH, Brodeur SR. The regulation of immunoglobulin E class-switch recombination. Nature Reviews Immunology. 2003;3:721-732.
Cohn L, Elias JA, Chupp GL. Asthma: mechanisms of disease persistence and progression. Annual Review of Immunology. 2004;22:789-815.
Galli SJ, Tsai M, Piliponsky AM. The development of allergic inflammation. Nature. 2008;454:445-454.
Gould HJ, Sutton BJ. IgE in allergy and asthma today. Nature Reviews Immunology. 2008;8:205-217.
Herrick CA, Bottomly K. To respond or not to respond: T cells in allergic asthma. Nature Reviews Immunology. 2003;3:405-412.
Kay AB. Allergy and allergic diseases. New England Journal of Medicine. 2001;344:30-37. 109-113
Kim HY, DeKruyff RH, Umetsu DT. The many paths to asthma: phenotype shaped by innate and adaptive immunity. Nature Immunology. 2010;11:577-584.
Lambrecht BN, Hammad H. Biology of lung dendritic cells at the origin of asthma. Immunity. 2009;31:412-424.
Maddox L, Schwartz DA. The pathophysiology of asthma. Annual Review of Medicine. 2002;53:477-498.
Medoff BD, Thomas SY, Luster AD. T cell trafficking in allergic asthma: the ins and outs. Annual Review of Immunology. 2008;26:205-232.
Nadler MJ, Matthews SA, Turner H, Kinet J-P. Signal transduction by the high affinity immunoglobulin E receptor FcεRI: coupling form to function. Advances in Immunology. 2000;76:325-355.
Vercelli D. Discovering susceptibility genes for asthma and allergy. Nature Reviews Immunology. 2008;8:169-182.
Wills-Karp M, Ewart SL. Time to draw breath: asthma- susceptibility genes are identified. Nature Reviews Genetics. 2004;5:376-387.