CAPÍTULO 15 Imunidade contra Micro-organismos
Nos capítulos anteriores, descrevemos os componentes do sistema imunológico, além da geração e das funções das respostas imunológicas. Ao longo deste livro, temos feito referência à proteção do hospedeiro contra infecções como a principal função fisiológica do sistema imunológico e discutido sobre as respostas imunológicas aos micro-organismos. Neste capítulo, integraremos esta informação e discutiremos as principais características da imunidade contra diferentes tipos de micro-organismos patogênicos, assim como os mecanismos que os micro-organismos utilizam para resistir às defesas do hospedeiro.
O desenvolvimento de uma doença infecciosa em um indivíduo envolve interações complexas entre o micro-organismo e o hospedeiro. Os eventos essenciais durante a infecção incluem a entrada do micro-organismo, invasão e colonização dos tecidos do hospedeiro, evasão da imunidade do hospedeiro e lesão tecidual ou dano funcional. Os micro-organismos produzem doença pela morte de células do hospedeiro ou pela liberação de toxinas que podem causar lesão tecidual e alterações funcionais, mesmo sem a colonização extensa dos tecidos do hospedeiro. Em algumas infecções, a resposta do hospedeiro é a culpada, sendo a principal causa da lesão tecidual e da doença. Muitas características dos micro-organismos determinam sua virulência e muitos mecanismos distintos contribuem para a patogênese das doenças infecciosas. O tópico da patogênese microbiana está além do escopo deste livro e não será discutido aqui. Em vez disso, nossa discussão terá como foco as respostas imunológicas aos micro-organismos patogênicos.
CARACTERÍSTICAS GERAIS DAS RESPOSTAS IMUNOLÓGICAS CONTRA MICRO-ORGANISMOS
Embora as respostas de defesa antimicrobiana do hospedeiro sejam inúmeras e variadas, existem algumas características gerais importantes da imunidade aos micro-organismos.
• A defesa contra micro-organismos é mediada por mecanismos efetores da imunidade inata e adaptativa. O sistema imunológico inato fornece a defesa inicial e o sistema imunológico adaptativo fornece uma resposta mais forte e sustentada. Muitos micro-organismos patogênicos evoluíram para resistir à imunidade inata, e a proteção contra tais infecções depende fundamentalmente das respostas imunológicas adaptativas. As respostas imunológicas adaptativas aos micro-organismos são mais específicas que as respostas imunológicas inatas. Além disso, induzem grandes números de células efetoras que funcionam para eliminar os micro-organismos e também para gerar células de memória que protegem o indivíduo de infecções subsequentes.
• O sistema imunológico responde de modos distintos e especializados a diferentes tipos de micro-organismos para combater com maior eficácia esses agentes infecciosos. Como os micro-organismos diferem imensamente quanto aos padrões de colonização e invasão do hospedeiro, sua eliminação requer sistemas efetores diversos. A especialização da imunidade adquirida permite que o hospedeiro responda otimamente a diferentes tipos de micro-organismos. A geração dos subgrupos TH1, TH2 e TH17 das células T CD4+ efetoras e a produção de diferentes isótipos de anticorpos são excelentes exemplos de especialização da imunidade adquirida. Ambas as respostas foram descritas em capítulos anteriores; a importância delas na defesa contra diferentes tipos de micro-organismos é mencionada nesse capítulo.
• A sobrevivência e a patogenicidade dos micro-organismos no hospedeiro são fundamentalmente influenciadas pela capacidade dos micro-organismos de evadir-se ou resistir aos mecanismos efetores da imunidade. Os micro-organismos infecciosos e o sistema imunológico coevoluíram e estão envolvidos em uma luta constante pela sobrevivência. O equilíbrio entre as respostas imunológicas do hospedeiro e as estratégias microbianas para resistir à imunidade frequentemente determina o prognóstico das infecções. Como veremos a seguir neste capítulo, os micro-organismos desenvolveram uma variedade de mecanismos de sobrevivência em face das poderosas defesas imunológicas.
• Muitos micro-organismos estabelecem infecções latentes ou persistentes, nas quais a resposta imunológica controla mas não elimina o micro-organismo e este sobrevive sem disseminar a infecção. A latência é um aspecto das infecções causadas por vários vírus, particularmente vírus de DNA das famílias herpes-vírus e poxvírus e algumas bactérias intracelulares. Em infecções virais latentes, o DNA viral pode estar integrado ao DNA de células infectadas, mas nenhum vírus infectante é produzido. Em infecções bacterianas persistentes, como a tuberculose, a bactéria pode sobreviver dentro das vesículas endossômicas de células infectadas. Em todas essas situações, se o sistema imunológico do hospedeiro torna-se defeituoso por qualquer motivo (tais como no câncer ou no tratamento para câncer, imunossupressão para tratar rejeição ao transplante ou infecção pelo HIV), o micro-organismo latente pode ser reativado, resultando em uma infecção que causa problemas clínicos significativos.
• Em muitas infecções, a lesão tecidual e a doença podem ser causadas pela resposta do hospedeiro ao micro-organismos e seus produtos, mais do que pelo micro-organismo em si. A imunidade, assim como muitos outros mecanismos de defesa, é necessária para a sobrevivência do hospedeiro, mas também tem o potencial de causar lesão ao hospedeiro.
Este capítulo considera as principais características da imunidade para as cinco principais categorias de micro-organismos patogênicos: bactérias extracelulares, bactérias intracelulares, fungos, vírus, protozoários e parasitos multicelulares (Tabela 15-1). Nossa discussão sobre as respostas imunológicas a esses micro-organismos ilustra a diversidade da imunidade antimicrobiana e o significado fisiológico das funções efetoras dos linfócitos discutidos nos capítulos anteriores.
TABELA 15-1 Exemplos de Micro-organismos Patogênicos
| Micro-organismo | Exemplos de Doenças Humanas | Mecanismos de Patogenicidade |
|---|---|---|
| Bactérias Extracelulares | ||
| Staphylococcus aureus | ||
| Streptococcus pyogenes (grupo A) | Inflamação aguda induzida por várias toxinas (p. ex., estreptolisina O lesiona as membranas celulares) | |
| Streptococcus pyogenes (pneumococo) | Pneumonia, meningite | Inflamação aguda induzida por componentes da parede celular; pneumolisina é similar à estreptolisina O |
| Escherichia coli | Infecções do trato urinário, gastroenterite, choque séptico | As toxinas atuam sobre o epitélio intestinal causando a secreção de cloreto e água; a endotoxina (LPS) estimula a secreção de citocinas por macrófagos |
| Vibrio cholerae | Diarreia (cólera) | Toxina da cólera ADP ribosila a subunidade da proteína G, que leva a aumento de AMP cíclico em células epiteliais intestinais e resulta em secreção de cloreto e perda de água |
| Clostridium tetani | Tétano | A toxina tetânica liga-se à placa motora terminal nas junções neuromusculares e causa contração muscular irreversível |
| Neisseria meningitidis (meningococo) | Meningite | Inflamação aguda e doença sistêmica causada por uma endotoxina potente |
| Corynebacterium diphtheriae | Difteria | A toxina diftérica ADP ribosila o fator de elongação 2 e inibe a síntese proteica |
| Bactérias Intracelulares | ||
| Micobactérias | Tuberculose, hanseníase | Ativação de macrófagos resultando em inflamação granulomatosa e destruição tecidual |
| Listeria monocytogenes | Listeriose | Listeriolisina lesiona as membranas celulares |
| Legionella pneumophila | Doença dos legionários | Citotoxina causa lise nas células, e lesão pulmonar e inflamação |
| Fungos | ||
| Candida albicans | Candidíase | Desconhecido; liga-se a proteínas do complemento |
| Aspergillus fumigatus | Aspergilose | Invasão e trombose dos vasos sanguíneos causando necrose isquêmica e dano celular |
| Histoplasma capsulatum | Histoplasmose | Infecção pulmonar causada por inflamação granulomatosa |
| Vírus | ||
| Pólio | Poliomielite | Inibe a síntese proteica da célula do hospedeiro (tropismo para os neurônios motores no corno anterior da medula espinhal) |
| Influenza | Pneumonia por influenza | Inibe a síntese proteica da célula do hospedeiro (tropismo para os nervos periféricos) |
| Raiva | Encefalite rábica | Inibe a síntese proteica da célula do hospedeiro (tropismo para os nervos periféricos ciliados) |
| Herpes simples | Várias infecções pelo herpes (pele, sistêmica) | Inibe a síntese proteica da célula do hospedeiro; comprometimento funcional das células imunes |
| Hepatite B | Hepatite viral | Resposta de CTL do hospedeiro aos hepatócitos infectados |
| Vírus Epstein-Barr | Mononucleose infecciosa; proliferação de células B, linfomas | |
| Vírus da imunodeficiência humana (HIV) | Síndrome da imunodeficiência adquirida (AIDS) | Múltiplos: morte de células T CD4+, dano funcional das células imunes (Cap. 20) |
Exemplos de micro-organismos patogênicos de diferentes classes estão listados, com breve resumo dos mecanismos conhecidos ou postulados de lesão tecidual e de doença. Exemplos de parasitas estão listados na Tabela 15-4. ADP, difosfato de adenosina; AMP, monofosfato de adenosina; CTL, linfócito T citotóxico; LPS, lipopolissacáride. Esta tabela foi compilada com o auxílio da Dra. Arlene Sharpe, Department of Pathology, Harvard Medical School e Brigham and Women’s Hospital, Boston, Massachusetts.
IMUNIDADE CONTRA BACTÉRIAS EXTRACELULARES
As bactérias extracelulares são capazes de replicar fora das células do hospedeiro, como por exemplo, no sangue, nos tecidos conjuntivos e nos espaços teciduais, tais como o lúmen dos tratos respiratório e gastrointestinal. Muitas espécies diferentes de bactérias extracelulares são patogênicas e a doença é causada por dois principais mecanismos. Primeiro, essas bactérias induzem a inflamação que resulta em destruição tecidual no sítio da infecção. Segundo, muitas dessas bactérias produzem toxinas que apresentam diversos efeitos patológicos. As toxinas podem ser endotoxinas, que são componentes das paredes bacterianas, ou exotoxinas, que são ativamente secretadas pelas bactérias. A endotoxina de bactérias Gram-negativas, também chamada lipopolissacarídeo (LPS), foi mencionada em capítulos anteriores como um potente ativador de macrófagos e de células dendríticas. Muitas exotoxinas são citotóxicas e destroem células por vários mecanismos bioquímicos. Outras exotoxinas interferem nas funções celulares normais sem destruir as células, e ainda outras exotoxinas estimulam a produção de citocinas que causam doença.
Imunidade Inata contra Bactérias Extracelulares
Os principais mecanismos da imunidade inata contra bactérias extracelulares são a ativação do complemento, a fagocitose e a resposta inflamatória.
• Ativação do complemento. O principal componente das paredes celulares de bactérias Gram-positivas, a peptidoglicana, ativa a via alternativa do complemento na ausência do anticorpo (Cap. 12). O LPS nas paredes celulares de bactérias Gram-negativas também ativa o complemento pela via alternativa. As bactérias que expressam manose na sua superfície podem ligar-se à lectina de ligação à manose, que ativa o complemento pela via das lectinas. Consequências da ativação do complemento são a opsonização e o aumento da fagocitose de bactérias. Além disso, o complexo de ataque à membrana causa lise à bactéria, principalmente espécies de Neisseria que são particularmente suscetíveis a lise por causa de suas paredes celulares delgadas, além dos subprodutos do complemento que estimulam as respostas inflamatórias por recrutamento e ativação de leucócitos.
• Ativação de fagócitos e inflamação. Os fagócitos utilizam vários receptores de superfície, inclusive os receptores de manose e os receptores scavenger, para reconhecer bactérias extracelulares, além de receptores Fc e receptores do complemento para reconhecer bactérias opsonizadas com anticorpos e proteínas do complemento, respectivamente. Os receptores semelhantes a Toll (TLR, Toll-like receptors) e vários sensores citoplasmáticos de produtos microbianos participam na ativação de fagócitos como resultado do encontro com os micro-organismos. Alguns desses receptores funcionam principalmente para promover a fagocitose de micro-organismos (p. ex., receptores de manose, receptores scavenger); outros estimulam as atividades microbianas dos fagócitos (principalmente TLR); outros ainda promovem tanto a fagocitose como a ativação de fagócitos (receptores Fc e de complemento) (Cap. 4). Além disso, as células dendríticas e os fagócitos ativados pelos micro-organismos secretam citocinas, que induzem o infiltrado leucocitário nos sítios de infecção (inflamação). Os leucócitos recrutados ingerem e destroem a bactéria.
Imunidade Adaptativa contra Bactérias Extracelulares
A imunidade humoral é uma resposta imunológica protetora contra bactérias extracelulares e funciona para bloquear a infecção, eliminar os micro-organismos e neutralizar suas toxinas (Fig. 15-1A). As respostas de anticorpos contra bactérias extracelulares são dirigidas contra antígenos da parede celular e toxinas secretadas e associadas à célula, que podem ser polissacarídeos ou proteínas. Os polissacarídeos são antígenos independentes do timo prototípicos e a imunidade humoral é o principal mecanismo de defesa contra bactérias encapsuladas ricas em polissacarídeos. Os mecanismos efetores empregados pelos anticorpos para combater essas infecções incluem neutralização, opsonização e fagocitose, além da ativação do complemento pela via clássica (Cap. 12). A neutralização é mediada por isótipos IgG, IgM e IgA de alta afinidade, o último principalmente no lúmen de tecidos das mucosas; a opsonização, por algumas subclasses de IgG; e a ativação do complemento, pela IgM e por subclasses de IgG.
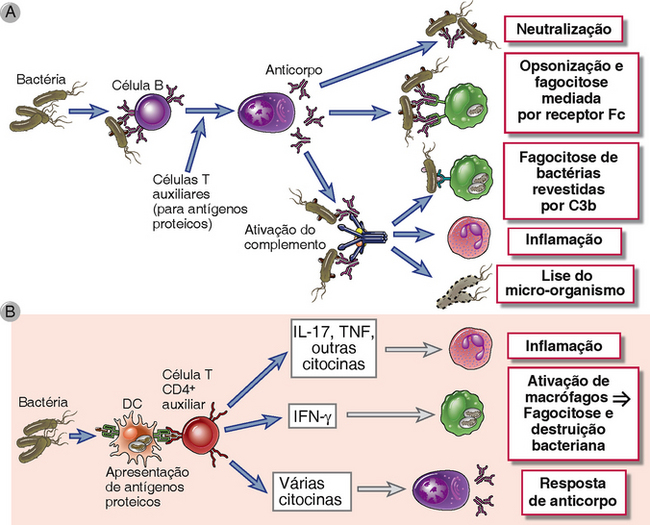
FIGURA 15-1 Respostas imunológicas adaptativas contra micro-organismos extracelulares. As respostas imunológicas adaptativas contra micro-organismos extracelulares, tais como bactérias e suas toxinas, consistem na produção de anticorpo (A) e na ativação de células T CD4+ auxiliares (B). Os anticorpos neutralizam e eliminam os micro-organismos e toxinas por vários mecanismos. As células T auxiliares produzem citocinas que estimulam a inflamação, ativação de macrófagos e respostas de células B. DC, célula dendrítica.
Os antígenos proteicos de bactérias extracelulares também ativam células T CD4+ auxiliares (helper), que produzem citocinas indutoras da inflamação local, aumentando as atividades fagocíticas e microbicidas de macrófagos e neutrófilos e estimulando a produção de anticorpo (Fig. 15-1B). As respostas TH17 induzidas por esses micro-organismos recrutam neutrófilos e monócitos e, portanto, promovem a inflamação local em sítios de infecção bacteriana. Deficiências nas respostas TH17 estão associadas a suscetibilidade aumentada a infecções bacterianas e fúngicas, com formação de vários abscessos cutâneos (infecções localizadas). Uma causa desse distúrbio é uma mutação que afeta o fator de transcrição STAT3, o qual é necessário para o desenvolvimento de células TH17. Esta doença hereditária é chamada síndrome de Jó (porque pacientes desenvolvem abscessos cutâneos que se assemelham à peste que acometeu o personagem bíblico) ou a síndrome de hiper-IgE (pois, por motivos desconhecidos, os pacientes apresentam níveis aumentados de IgE no soro). As bactérias também induzem respostas TH1 e o IFN-γ produzido por células TH1 ativam macrófagos para destruir micro-organismos fagocitados e podem estimular a produção de isótipos de anticorpo opsonizantes e de ligação ao complemento.
Efeitos Lesivos das Respostas Imunológicas
As principais consequências lesivas das respostas do hospedeiro às bactérias extracelulares são inflamação e choque séptico. As mesmas reações de neutrófilos e macrófagos que atuam para erradicar a infecção também causam dano tecidual pela produção local de espécies reativas de oxigênio e enzimas lisossômicas. Essas reações inflamatórias geralmente são autolimitadas e controladas. As citocinas secretadas pelos leucócitos em resposta aos produtos bacterianos também estimulam a produção de proteínas de fase aguda e causam as manifestações sistêmicas da infecção (Cap. 4). O choque séptico é uma consequência patológica grave de infecção disseminada por algumas bactérias Gram-negativas e Gram-positivas. É uma síndrome caracterizada por colapso circulatório e coagulação intravascular disseminada. A fase inicial do choque séptico é causada por citocinas produzidas por macrófagos que são ativados pelos componentes microbianos, inclusive LPS e peptidoglicanas. O fator de necrose tumoral (TNF), a IL-6 e a IL-1 são as principais citocinas mediadoras do choque séptico, mas IFN-γ e interleucina 12 (IL-12) também podem contribuir (Cap. 4). Esta explosão inicial de grandes quantidades de citocinas é algumas vezes chamada “tempestade de citocinas”. Existem algumas evidências de que a progressão do choque séptico está associada a respostas imunológicas defeituosas, talvez relacionadas com a depleção ou supressão das células T, resultando em disseminação microbiana incontrolada.
Certas toxinas bacterianas estimulam todas as células T em um indivíduo que expressam uma determinada família de genes de receptores de células T (TCR) Vβ. Tais toxinas são chamadas superantígenos, pois lembram antígenos que se ligam aos TCR e às moléculas do MHC de classe II (embora não às fendas de ligação ao peptídeo), mas ativam muito mais células T do que os antígenos peptídicos convencionais (Fig. 15-2). Sua importância reside na capacidade que têm de ativar muitas células T, com a produção subsequente de grandes quantidades de citocinas que podem também causar uma síndrome inflamatória sistêmica.
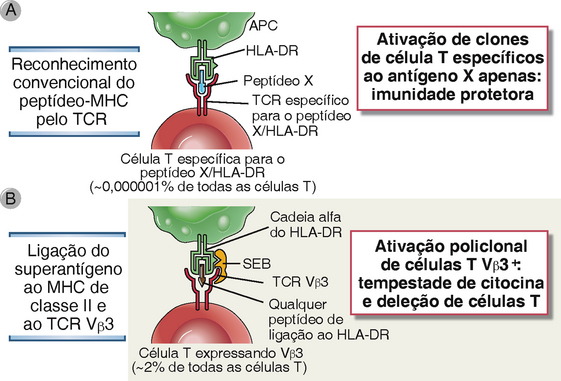
FIGURA 15-2 Ativação policlonal de células T por superantígenos bacterianos. A, Antígenos microbianos convencionais, compostos de um peptídeo ligado à fenda de ligação ao peptídeo de uma molécula de MHC, são reconhecidos por uma pequena fração de células T em qualquer indivíduo, e somente essas células T são ativadas para se tornarem células T efetoras que protegem contra o micro-organismo. B, Por sua vez, um superantígeno se liga a moléculas do MHC de classe II fora da fenda de ligação ao peptídeo e simultaneamente se liga à região variável de qualquer cadeia β do TCR, enquanto pertence a uma família Vβ específica, independentemente da especificidade do TCR ao peptídeo-MHC. Nesta via, os superantígenos ativam as células T para a secreção de citocinas e também induzem apoptose dessas células. Diferentes superantígenos ligam-se aos TCR de diferentes famílias Vβ. Como milhares de clones de células T vão expressar uma cadeia β do TCR de uma família Vβ específica, os superantigenos podem induzir a liberação maciça de citocinas (tempestade de citocinas) e causar a deleção de muitas células T. No exemplo ilustrado, a enterotoxina B de estafilococos (SEB) é o superantígeno, que se liga principalmente ao HLA-DR e aos segmentos Vβ dos TCR pertencentes à família Vβ3. APC, célula apresentadora de antígeno.
Uma complicação tardia da resposta imunológica humoral à infecção bacteriana pode ser a geração de anticorpos produtores de doença. Os exemplos mais bem definidos são duas sequelas raras de infecções estreptocócicas da orofaringe ou da pele que são manifestadas semanas ou até meses após o controle das infecções. A febre reumática é uma sequela da infecção faríngea com alguns tipos sorológicos de estreptococos β-hemolíticos. A infecção leva à produção de anticorpos contra uma proteína da parede celular bacteriana (proteína M). Alguns desses anticorpos reagem cruzadamente com as proteínas miocárdicas e são depositadas no coração e subsequentemente causam inflamação (cardite). A glomerulonefrite pós-estreptocócica é uma sequela da infecção cutânea ou da faringe com outros sorotipos de estreptococos β-hemolíticos. Os anticorpos produzidos contra essas bactérias formam complexos com o antígeno bacteriano, que podem ser depositados nos glomérulos renais e causar nefrite.
Evasão da Resposta Imunológica pelas Bactérias Extracelulares
A virulência de bactérias extracelulares está associada ao número de mecanismos que resistem à imunidade inata (Tabela 15-2), inclusive mecanismos antifagocíticos e a inibição do complemento ou inativação dos produtos do complemento. As bactérias com cápsulas ricas em polissacarídeos resistem à fagocitose e, portanto, são muito mais virulentas do que as cepas homólogas que perdem a cápsula. As cápsulas de muitas bactérias patogênicas Gram-positivas e Gram-negativas contêm resíduos de ácido siálico que inibem a ativação do complemento pela via alternativa.
TABELA 15-2 Mecanismo de Evasão Imunológica pelas Bactérias
| Mecanismos de Evasão da Resposta Imunológica | Exemplos |
|---|---|
| Bactérias Extracelulares | |
| Variação antigênica | Neisseria gonorrhoeae, Escherichia coli, Salmonella typhimurium |
| Inibição da ativação do complemento | Muitas bactérias |
| Resistência à fagocitose | Pneumococos |
| Remoção de espécies reativas de oxigênio | Estafilococos catalase-positivos |
| Bactérias Intracelulares | |
| Inibição da formação do fagolisossomo | Mycobacterium tuberculosis, Legionella pneumophila |
| Inativação de espécies reativas de oxigênio e nitrogênio | Mycobacterium leprae (glicolipídio fenólico) |
| Ruptura da membrana do fagossomo, escape para o citoplasma | Listeria monocytogenes (proteína hemolisina) |
Um mecanismo utilizado pelas bactérias para escapar da imunidade humoral é a variação genética de antígenos de superfície. Alguns antígenos de superfície de bactérias, tais como gonococos e Escherichia coli, estão contidos nos pili, que são as estruturas responsáveis pela adesão bacteriana às células do hospedeiro. O principal antígeno dos pili é uma proteína chamada pilina. Os genes da pilina de gonococos sofrem extensa conversão gênica, razão pela qual a progênie de um micro-organismo pode produzir até 106 moléculas de pilina antigenicamente distintas. Esta capacidade de alterar os antígenos auxilia a bactéria a escapar do ataque pelos anticorpos específicos para pilina, embora seu significado principal para a bactéria possa ser a seleção dos pili que sejam mais aderentes às células do hospedeiro, tornando as bactérias mais virulentas. Em outras bactérias, como a Haemophilus influenzae, mudanças na produção de glicosidases conduzem a alterações químicas no LPS e em outros polissacarídeos de superfície, que permitem a evasão das respostas imunológicas humorais contra esses antígenos.
IMUNIDADE CONTRA BACTÉRIAS INTRACELULARES
Uma característica das bactérias intracelulares facultativas é a sua capacidade de sobreviver e mesmo de se replicar dentro de fagócitos. Como esses micro-organismos são capazes de encontrar um nicho no qual são inacessíveis aos anticorpos circulantes, sua eliminação requer a presença de mecanismos de imunidade mediada por células (Fig. 15-3). Como discutiremos adiante nesta seção, a resposta do hospedeiro em muitas infecções por bactérias intracelulares também causa lesão tecidual.
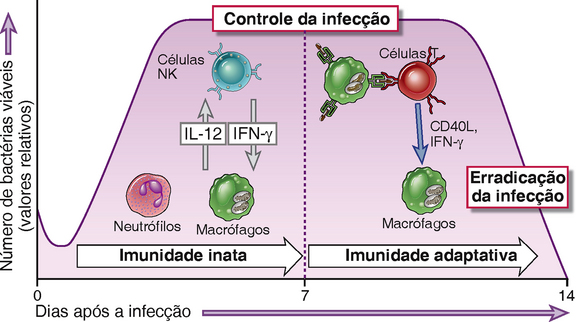
FIGURA 15-3 Imunidade inata e adaptativa contra bactérias intracelulares. A resposta imunológica inata contra bactérias intracelulares consiste nos fagócitos e nas células NK, interações que podem ser mediadas por citocinas (IL-12 e IFN-γ). A resposta imunológica adquirida característica contra esses micro-organismos é a imunidade mediada por células, na qual as células T ativam os fagócitos para eliminar os micro-organismos. A imunidade inata pode controlar o crescimento bacteriano, mas a eliminação da bactéria requer a imunidade adquirida. Estes princípios são baseados principalmente na análise da infecção murina por Listeria monocytogenes; os números de bactérias viáveis apresentados no eixo y são valores relativos das colônias bacterianas que podem ter crescido dos tecidos de camundongos infectados.
(Dados de Unanue ER. Studies in listeriosis show the strong simbiosis between the innate cellular system and the T-cell response. Immunological Reviews 158:11-25, 1997.)
Imunidade Inata contra Bactérias Intracelulares
A resposta imunológica inata contra bactérias intracelulares é mediada principalmente por fagócitos e células assassinas naturais (natural killer — NK). Os fagócitos, inicialmente neutrófilos e depois os macrófagos, ingerem e tentam destruir esses micro-organismos, mas as bactérias patogênicas intracelulares são resistentes à degradação dentro de fagócitos. Os produtos dessas bactérias são reconhecidos por TLR e proteínas citoplasmáticas da família de receptores do tipo NOD (NLR), resultando em ativação dos fagócitos (Cap. 4). As bactérias intracelulares ativam as células NK pela indução da expressão de ligantes ativadores de células NK em células infectadas e pela estimulação de células dendríticas e macrófagos para a produção de IL-12 e IL-15, ambas citocinas ativadoras de células NK. As células NK produzem IFN-γ, que por sua vez ativa os macrófagos e promove a morte de bactérias fagocitadas. Portanto, as células NK fornecem uma defesa inicial contra esses micro-organismos, antes do desenvolvimento da imunidade adquirida. De fato, camundongos com imunodeficiência combinada grave, que apresentam deficiência de células B e T, são capazes de controlar transitoriamente a infecção pela bactéria intracelular Listeria monocytogenes, pela produção de IFN-γ derivada de células NK. Contudo, a imunidade inata geralmente não controla essas infecções, e a erradicação requer a imunidade adaptativa mediada por células.
Imunidade Adaptativa contra Bactérias Intracelulares
A principal resposta imunológica protetora contra bactérias intracelulares é a imunidade mediada por células T. Indivíduos com deficiência na resposta imunológica celular, tais como pacientes com síndrome da imunodeficiência adquirida (AIDS), são extremamente suscetíveis a infecções com bactérias intracelulares (e vírus). Os mecanismos de imunidade mediada por células foram estudados na década de 1950 em camundongos, ao se avaliar a proteção contra a bactéria intracelular L. monocytogenes. Essa forma de imunidade pode ser transferida adotivamente para animais virgens (naïves) com células linfoides, mas não com soro de animais infectados ou imunizados (Cap. 10, Fig. 10-6).
Como foi discutido no Capítulo 10, a imunidade celular consiste em dois tipos de reações: recrutamento e ativação de fagócitos através das ações do ligante de CD40 e IFN-γ derivados de células T CD4+, resultando na morte de micro-organismos fagocitados e lise de células infectadas pela ação de linfócitos T citotóxicos CD8+ (CTL). Tanto as células T CD4+ e como as CD8+ respondem aos antígenos proteicos de micro-organismos fagocitados, os quais são apresentados como peptídeos associados a moléculas do complexo principal de histocompatibilidade de classe II e classe I, respectivamente. As células T CD4+ diferenciam-se em TH1 efetores sob a influência de IL-12, que é produzida por macrófagos e células dendríticas. As células T expressam ligante de CD40 e secretam IFN-γ, e esses dois estímulos ativam os macrófagos, induzindo a produção de várias substâncias microbicidas, inclusive espécies reativas de oxigênio, óxido nítrico e enzimas lisossomais. O IFN-γ também estimula a produção de isótipos de anticorpos (p. ex., IgG2a em camundongos) que ativam o complemento e opsonizam bactérias para a fagocitose, favorecendo desse modo as funções efetoras dos macrófagos. Os estímulos para a produção desses anticorpos em humanos ainda não foram bem definidos. A importância de IL-12 e IFN-γ na imunidade às bactérias intracelulares foi demonstrada em modelos experimentais e em imunodeficiências congênitas. Por exemplo, indivíduos com mutações hereditárias em receptores de IFN-γ ou IL-12 são altamente suscetíveis a infecções por micobactérias atípicas.
As bactérias fagocitadas estimulam as respostas das células T CD8+ se os antígenos bacterianos forem transportados dos fagossomos para o citosol ou se as bactérias escaparem dos fagossomos e entrarem no citoplasma das células infectadas. No citoplasma, os micro-organismos não são mais suscetíveis aos mecanismos microbicidas de fagócitos, e para que ocorra erradicação da infecção as células infectadas precisam ser mortas pelos CTL. Desse modo, os efetores da imunidade mediada por células, ou seja, as células T CD4+ que ativam macrófagos e os CTL CD8+ atuam cooperativamente na defesa contra bactérias intracelulares (Fig. 15-4).
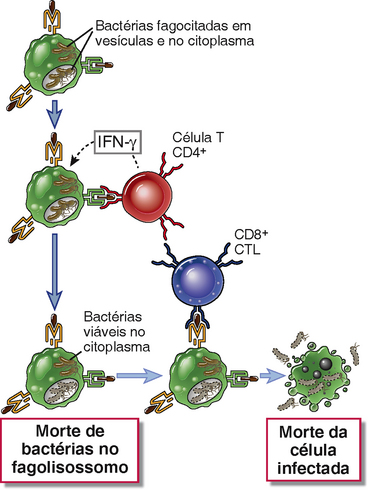
FIGURA 15-4 Cooperação de células T CD4+ e T CD8+ na defesa contra micro-organismos intracelulares. Bactérias intracelulares, tais como Listeria monocytogenes, são fagocitadas por macrófagos e podem sobreviver em fagossomos e escapar para o citoplasma. As células T CD4+ respondem aos antígenos peptídicos associados ao MHC de classe II derivados de bactérias intravesiculares. Essas células T produzem IFN-γ que ativa os macrófagos para destruir os micro-organismos nos fagossomos. Células T CD8+ respondem aos peptídeos associados à classe I derivados de antígenos citosólicos e destroem as células infectadas.
A ativação de macrófagos que ocorre em resposta aos micro-organismos intracelulares é capaz de causar lesão tecidual. Esta lesão pode ser resultado das reações de hipersensibilidade do tipo tardia (DTH, delayed-type hypersensitivity) aos antígenos proteicos microbianos (Cap. 18). Como as bactérias intracelulares evoluíram para resistir à morte dentro de fagócitos, frequentemente persistem por longos períodos e causam estimulação antigênica crônica e ativação de células T e de macrófagos, que podem resultar na formação de granulomas em torno dos micro-organismos (Cap. 18, Fig. 18-8). A característica histológica marcante da infecção por algumas bactérias intracelulares é a inflamação granulomatosa. Este tipo de reação inflamatória pode servir para se localizar e prevenir a disseminação de micro-organismos, mas também está associada ao dano funcional grave causado pela necrose tecidual e fibrose.
A tuberculose é um exemplo de infecção por uma bactéria intracelular na qual a imunidade protetora e a hipersensibilidade patológica coexistem e a resposta do hospedeiro contribui significativamente para a patologia. Em uma infecção primária por M. tuberculosis, os bacilos multiplicam-se lentamente nos pulmões e causam apenas inflamação moderada. A infecção é contida por macrófagos alveolares (e provavelmente por células dendríticas). Mais de 90% dos pacientes infectados permanecem assintomáticos, mas as bactérias sobrevivem nos pulmões, principalmente nos macrófagos. Cerca de 6 a 8 semanas após a infecção, os macrófagos atingem os linfonodos drenantes e as células T CD4+ são ativadas; as células T CD8+ também podem ser ativadas posteriormente. Essas células T produzem IFN-γ, que ativa os macrófagos e aumenta sua capacidade de matar bacilos fagocitados. O TNF produzido por células T e macrófagos também tem um papel na inflamação local e na ativação de macrófagos. A reação de células T é adequada para controlar a disseminação bacteriana. Contudo, M. tuberculosis é capaz de sobreviver no interior dos macrófagos, pois os componentes da parede celular bacteriana inibem a fusão dos vacúolos fagocíticos com os lisossomos. A ativação persistente da célula T leva à formação dos granulomas, os quais tentam bloquear as bactérias e frequentemente estão associados à necrose central, chamada necrose caseosa, causada por produtos de macrófagos, tais como enzimas lisossômicas e espécies reativas de oxigênio. Os granulomas necrosantes e a fibrose (cicatrização) que acompanham a inflamação granulomatosa são as principais causas de lesão tecidual e doença clínica na tuberculose. Indivíduos previamente infectados apresentam as reações de DTH ao desafio cutâneo com preparações antigênicas bacterianas (derivado proteico purificado ou PPD). Os bacilos podem sobreviver por muitos anos e são contidos sem quaisquer consequências patológicas, mas podem ser reativados a qualquer tempo, principalmente se a resposta imunológica se tornar incapaz de controlar a infecção.
As diferenças entre indivíduos em relação aos padrões de respostas de células T aos micro-organismos intracelulares são importantes determinantes da progressão da doença e do prognóstico clínico (Fig. 15-5). Um exemplo dessa relação entre o tipo de resposta de célula T e o prognóstico clínico é a hanseníase, doença causada pelo Mycobacterium leprae. Existem duas formas polares da hanseníase, a forma lepromatosa e a tuberculoide, mas muitos pacientes pertencem a grupos intermediários menos definidos. Na hanseníase lepromatosa, pacientes apresentam altos títulos de anticorpos específicos, mas fracas respostas mediadas por células aos antígenos de M. leprae. As micobactérias proliferam dentro de macrófagos e são detectáveis em grandes números. O crescimento bacteriano e a ativação persistente porém inadequada de macrófagos resultam em lesões destrutivas na pele e no tecido subjacente. Por sua vez, pacientes com hanseníase tuberculoide desenvolvem forte imunidade mediada por células, mas baixos níveis de anticorpos. Este padrão de imunidade é refletido nos granulomas que se formam ao redor dos nervos e produzem defeitos nos nervos sensitivos periféricos e lesões cutâneas traumáticas secundárias, mas com pouca destruição tecidual e escassez de bactérias nas lesões. Uma possível explicação para as diferenças observadas nas duas formas da doença causada pelo mesmo micro-organismo pode ser a existência de diferentes padrões de diferenciação das células T e de produção de citocinas nos indivíduos. Alguns estudos indicam que pacientes com a forma tuberculoide da doença produzem IFN-γ e IL-2 nas lesões (indicativo de ativação de células TH1), enquanto pacientes com hanseníase lepromatosa produzem menos IFN-γ e talvez mais IL-4 e IL-10 (sugestivo de células TH2). Na hanseníase lepromatosa, tanto a deficiência de IFN-γ como os efeitos supressores de IL-10 e possivelmente de IL-4 nos macrófagos podem resultar em fraca resposta imunológica mediada por células e falha no controle da disseminação bacteriana. O papel das citocinas produzidas por células TH1 e TH2 na determinação do prognóstico da infecção foi mais claramente demonstrado na infecção pelo protozoário parasita Leishmania major em diferentes linhagens de camundongos isogênicos (discutido mais adiante neste capítulo).
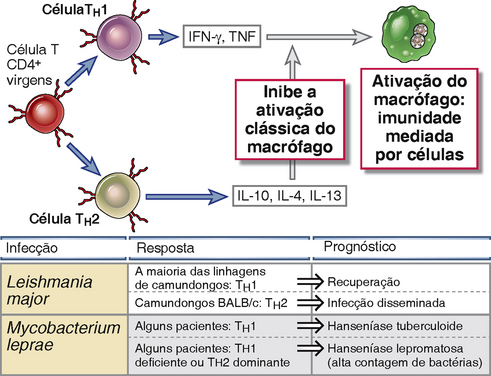
FIGURA 15-5 Papel das células T e das citocinas na determinação do prognóstico das infecções. Linfócitos T CD4+ virgens podem se diferenciar em células TH1, que ativam os fagócitos para destruírem os micro-organismos ingeridos, e em células TH2, que inibem esta via clássica de ativação de macrófagos. O equilíbrio entre esses dois subgrupos pode influir no prognóstico das infecções, como ilustram a infecção de camundongos por Leishmania e a infecção humana por Mycobacterium leprae.
Evasão da Resposta Imunológica pelas Bactérias Intracelulares
Diferentes bactérias intracelulares desenvolveram várias estratégias para resistir à eliminação pelos fagócitos (Tabela 15-2). Estas incluem inibição da fusão do fagolisossomo ou escape para o citosol, assim se escondendo dos mecanismos microbicidas dos lisossomos e diretamente removendo ou inativando as substâncias microbicidas, tais como as espécies reativas de oxigênio. O prognóstico da infecção por esses micro-organismos frequentemente depende do que levará vantagem: os mecanismos antimicrobianos de macrófagos estimulados por células T ou a resistência à morte? A resistência à eliminação mediada por fagócitos também é o motivo pelo qual tais bactérias tendem a causar infecções crônicas que podem durar anos, frequentemente reincidindo após aparente cura, e são difíceis de erradicar.
IMUNIDADE CONTRA FUNGOS
As infecções fúngicas, também chamadas micoses, são causas importantes de morbidade e mortalidade no homem. Algumas infecções fúngicas são endêmicas, e essas infecções geralmente são causadas por fungos que estão presentes no ambiente e cujos esporos são inalados pelo homem. Outras infecções fúngicas são ditas oportunísticas, pois os agentes etiológicos causam doença branda ou nenhuma doença em indivíduos sadios, mas podem infectar e causar doença grave em pessoas imunodeficientes. O imunocomprometimento é o fator predisponente mais importante para as infecções fúngicas de importância clínica. A deficiência de neutrófilos como resultado de supressão ou dano da medula óssea é frequentemente associada a tais infecções. Um recente aumento foi observado em relação às infecções fúngicas oportunistas, secundárias a um aumento nas imunodeficiências causadas principalmente pelo HIV e por tratamento para câncer disseminado e rejeição ao transplante. Uma infecção fúngica oportunista grave associada à AIDS é a pneumonia causada por Pneumocystis jiroveci, mas muitas outras contribuem para a morbidade e mortalidade causadas pelas imunodeficiências.
Diferentes fungos infectam o homem e podem viver em tecidos extracelulares e dentro de fagócitos. Portanto, as respostas imunológicas a esses micro-organismos são frequentemente combinações de respostas a bactérias extracelulares e intracelulares. Contudo, pouco se sabe sobre a imunidade antifúngica quando comparada à imunidade contra bactérias e vírus. Esta falta de conhecimento deve-se em parte, à escassez de modelos animais para micoses e, ao mesmo tempo, ao fato de que essas infecções normalmente ocorrem em indivíduos que são incapazes de montar respostas imunológicas efetivas.
Imunidade Inata e Adaptativa contra Fungos
Os principais mediadores da imunidade inata contra fungos são os neutrófilos e os macrófagos. Pacientes com neutropenia são extremamente suscetíveis às infecções fúngicas oportunistas. Os fagócitos e as células dendríticas reconhecem os fungos através dos TLR e dos receptores do tipo lectina chamados dectinas (Cap. 4). Os neutrófilos presumivelmente liberam substâncias fungicidas, tais como espécies reativas de oxigênio e enzimas lisossômicas, e fagocitam os fungos para a morte intracelular. As cepas virulentas de Cryptococcus neoformans inibem a produção de citocinas, tais como TNF e IL-12, por macrófagos e estimulam a produção de IL-10, assim inibindo a ativação de macrófagos.
A imunidade mediada por células é o principal mecanismo de imunidade adquirida contra infecções fúngicas. Histoplasma capsulatum, um parasita intracelular facultativo que vive nos macrófagos, é eliminado pelos mesmos mecanismos celulares que são efetivos contra bactérias intracelulares. As células T CD4+ e CD8+ cooperam para eliminar as leveduras de C. neoformans, que tendem a colonizar os pulmões e o cérebro em hospedeiros imunodeficientes. Muitos fungos extracelulares induzem fortes respostas TH17, que são conduzidas em parte pela ativação de células dendríticas através da ligação de glucanas fúngicas à dectina 1, um receptor para este polissacarídeo fúngico, resultando na produção de citocinas indutoras de resposta TH17 (IL-6, IL-23) em células dendríticas (Cap. 9). As células TH17 estimulam a inflamação e os neutrófilos e monócitos recrutados destroem os fungos. As infecções por Candida frequentemente começam nas superfícies mucosas e acredita-se que a imunidade celular previna a propagação dos fungos para os tecidos. As respostas TH1 são protetoras nas infecções por fungos intracelulares, como a histoplasmose, mas essas respostas podem induzir inflamação granulomatosa, que é uma causa importante da lesão tecidual do hospedeiro nessas infecções (Cap. 18). Os fungos também induzem respostas específicas de anticorpos consideradas protetoras.
IMUNIDADE CONTRA VÍRUS
Os vírus são micro-organismos intracelulares obrigatórios que vivem no interior das células, usando componentes do ácido nucleico e o mecanismo de síntese proteica do hospedeiro para replicar e disseminar-se. Os vírus tipicamente infectam vários tipos celulares utilizando moléculas de superfície celular normais como receptores para entrar nas células. Após entrarem nas células, os vírus podem causar lesão tecidual e doença por inúmeros mecanismos. A replicação viral interfere na síntese e na função proteicas da célula normal e leva a lesão e, por fim, morte da célula infectada. Isto é um tipo de efeito citopático dos vírus, e diz-se que a infecção é lítica quando ocorre lise da célula infectada. Os vírus também podem causar infecções latentes, discutidas posteriormente.
As respostas imunológicas inata e adaptativa aos vírus têm como objetivos bloquear a infecção e eliminar as células infectadas (Fig. 15-6). A infecção é prevenida por interferons do tipo I como parte da imunidade inata e por anticorpos neutralizantes que contribuem para o desenvolvimento da imunidade adaptativa. Uma vez que a infecção esteja estabelecida, as células infectadas são eliminadas pelas células NK na resposta imunológica inata, e os CTL, na resposta adaptativa.
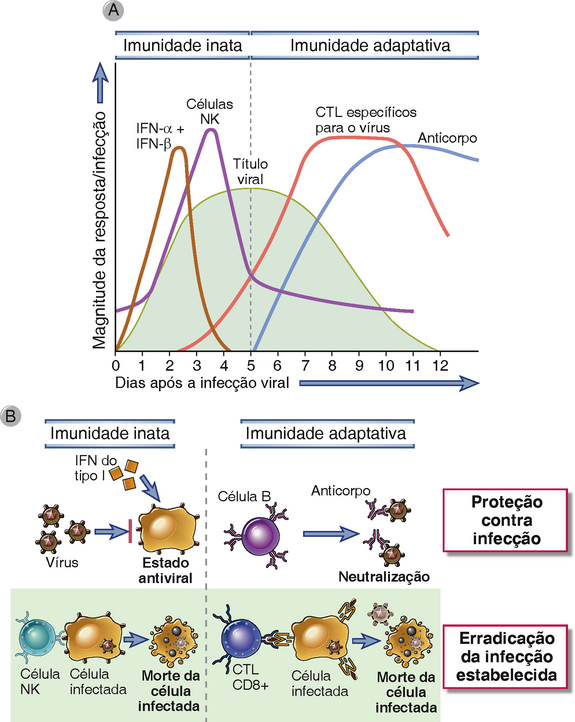
FIGURA 15-6 Respostas imunológicas inata e adaptativa contra vírus. A, Cinética das respostas imunológicas inata e adaptativa à infecção viral. B, Mecanismos pelos quais as imunidades inata e adaptativa previnem e erradicam as infecções virais. A imunidade inata é mediada por interferons do tipo I, que previnem a infecção, e células NK, que eliminam as células infectadas. A imunidade adaptativa é mediada por anticorpos e CTL, que também bloqueiam e destroem as células infectadas, respectivamente.
Imunidade Inata contra Vírus
Os principais mecanismos da imunidade inata contra vírus são inibição da infecção por interferons do tipo I e morte de células infectadas mediada pelas células NK. A infecção por muitos vírus está associada à produção de interferons do tipo I por células infectadas, principalmente células dendríticas do tipo plasmocitoide (Cap. 4). Diversas vias bioquímicas desencadeiam a produção de interferon (Fig. 15-7). Essas vias incluem reconhecimento de RNA e DNA virais por TLR endossômicos e ativação de receptores tipo RIG citoplasmáticos pelo RNA viral. Estas vias convergem para a ativação de proteínas cinases, que por sua vez ativam os fatores de transcrição IRF que estimulam a transcrição do gene de interferon. Os interferons do tipo I atuam na inibição da replicação viral em células infectadas e não infectadas pela indução de um “estado antiviral”. Os mecanismos pelos quais os interferons bloqueiam a replicação viral foram discutidos no Capítulo 4 (Fig. 4-15).
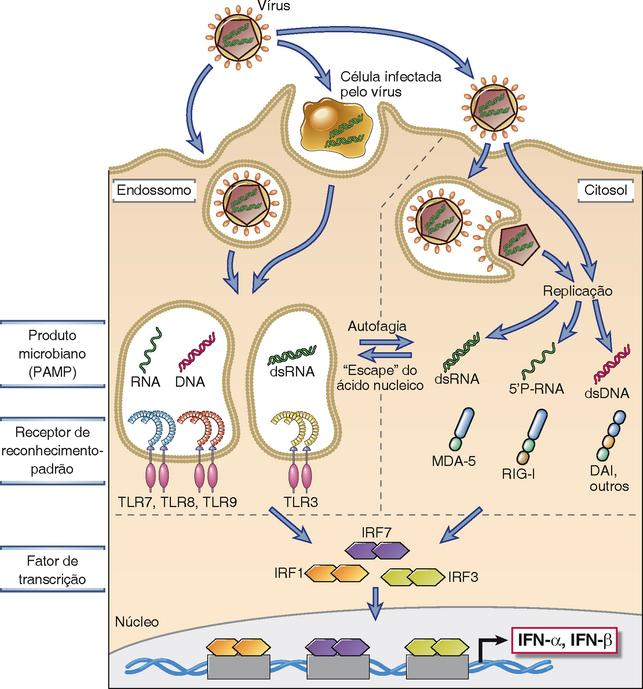
FIGURA 15-7 Mecanismos de indução de interferons do tipo I pelos vírus. Os ácidos nucleicos e proteínas virais são reconhecidos por várias famílias de receptores celulares (TLR e a família de receptores do tipo RIG citosólicos ou RLR, que incluem MDA-5, RIG-I, DAI e outros), os quais ativam fatores de transcrição (as proteínas IRF) que estimulam a produção de interferons do tipo I, IFN-α e IFN-β. Esse processo e as ações dos interferons estão descritos em mais detalhes no Capítulo 4.
As células NK destroem as células infectadas por uma variedade de vírus e constituem um importante mecanismo de imunidade antiviral no início do curso da infecção, antes do desenvolvimento da imunidade adquirida. As células NK também reconhecem as células infectadas nas quais o vírus causa o bloqueio da expressão do MHC de classe I como um mecanismo de escape dos CTL, pois a ausência da molécula de classe I libera as células NK de um estado normal de inibição (Fig. 4-6, Cap. 4).
Imunidade Adaptativa contra Vírus
A imunidade adaptativa contra infecções virais é mediada por anticorpos, que bloqueiam a ligação do vírus e a entrada nas células do hospedeiro, e também por CTL, que eliminam a infecção destruindo as células infectadas (Fig. 15-6). Os anticorpos mais eficazes são os de alta afinidade produzidos nas reações que ocorrem nos centros germinativos dependentes de células T (Cap. 11). Os anticorpos são eficazes contra os vírus apenas durante o estágio extracelular da vida desses micro-organismos. Os vírus podem ser extracelulares no início do curso da infecção, antes que infectem as células do hospedeiro, ou quando são liberados das células infectadas pelo brotamento do vírus ou se as células tiverem sido destruídas. Os anticorpos antivirais ligam-se ao envoltório viral ou aos antígenos do capsídeo e desempenham funções principalmente como anticorpos neutralizantes para prevenir a ligação do vírus e a entrada nas células do hospedeiro. Portanto, os anticorpos previnem tanto a infecção inicial como a disseminação de célula para célula. Os anticorpos secretados do isótipo IgA são importantes para neutralizar os vírus dentro dos tratos respiratório e intestinal. A imunização oral contra a poliomielite funciona através da imunidade das mucosas. Além da neutralização, os anticorpos podem opsonizar partículas virais e promover a eliminação do patógeno por meio dos fagócitos. A ativação do complemento também pode participar na imunidade viral mediada por anticorpos, principalmente pela promoção da fagocitose e possivelmente pela lise direta dos vírus com envoltórios lipídicos.
A importância da imunidade humoral na defesa contra as infecções virais é sustentada pela observação de que a resistência a um determinado vírus, induzida por infecção ou vacinação, é frequentemente específica para o tipo sorológico (definido pelo anticorpo) do vírus. Um exemplo é o vírus da influenza, no qual a exposição a um tipo sorológico não confere resistência a outros sorotipos do vírus. Os anticorpos neutralizantes bloqueiam a infecção viral das células e a propagação dos vírus de célula para célula, mas, uma vez que os vírus entram nas células e iniciam a replicação intracelular, tornam-se inacessíveis aos anticorpos. Por conseguinte, a imunidade humoral induzida por infecção ou vacinação prévia é capaz de proteger os indivíduos da infecção viral, mas não pode por si só erradicar uma infecção estabelecida.
A eliminação dos vírus que residem dentro das células é mediada por CTL, os quais destroem as células infectadas. Como foi mencionado nos capítulos anteriores, o principal papel fisiológico dos CTL é a vigilância contra infecção viral. A maioria dos CTL específicos para vírus é constituída por células T CD8+ que reconhecem peptídeos virais, citosólicos, geralmente sintetizados endogenamente e que são apresentados no contexto das moléculas do MHC de classe I. Se a célula infectada for uma célula tecidual e não uma célula apresentadora de antígeno (APC), tal como a célula dendrítica, a célula infectada pode ser fagocitada pela célula dendrítica, que processa e apresenta os antígenos virais às células T CD8+ virgens. Este processo de apresentação cruzada ou preparação cruzada foi descrito no Capítulo 6 (Fig. 6-20). A diferenciação completa dos CTL CD8+ frequentemente requer a produção de citocinas pelas células T CD4+ auxiliares ou coestimuladores expressos em células infectadas (Cap. 9). Como foi discutido no Capítulo 9, as células T CD8+ sofrem proliferação maciça durante a infecção viral e a maioria das células em proliferação é específica para poucos peptídeos virais. Algumas das células T ativadas diferenciam-se em CTL efetoras, que podem destruir qualquer célula nucleada infectada. Os efeitos antivirais dos CTL são principalmente devidos à morte de células infectadas, mas outros mecanismos incluem a ativação de nucleases em células infectadas que degradam os genomas virais e a secreção de citocinas, como IFN-γ, que ativa os fagócitos e pode apresentar alguma atividade antiviral.
A importância dos CTL na defesa contra a infecção viral é demonstrada pela suscetibilidade aumentada a tais infecções que é se observar em pacientes e animais deficientes em linfócitos T e pela observação experimental de que os camundongos podem ser protegidos contra algumas infecções virais por meio da transferência adotiva de CTL específicos de determinado vírus, restritos à classe I. Além disso, muitos vírus são capazes de alterar seus antígenos de superfície, tais como as glicoproteínas do envoltório, e, assim, escapar ao ataque pelos anticorpos. No entanto, as células infectadas podem produzir algumas proteínas virais que são invariantes, de forma que a defesa mediada por CTL permanece eficaz contra esses vírus.
Em infecções latentes, o DNA viral persiste nas células do hospedeiro, mas o vírus não replica nem destrói as células infectadas. A latência frequentemente é um estado de equilíbrio entre a infecção e a resposta imunológica. Os CTL são gerados em resposta ao vírus que pode controlar a infecção, mas não erradicá-la. Como resultado, o vírus persiste nas células infectadas, algumas vezes por toda a vida do indivíduo. Qualquer deficiência na resposta do hospedeiro pode resultar em reativação da infecção latente, com a expressão de genes virais que são responsáveis pelos efeitos citopáticos e pela propagação viral. Os efeitos citopáticos podem incluir a lise de células infectadas ou a proliferação descontrolada das células. Essas infecções latentes ocorrem comumente com o vírus Epstein-Barr e vários outros vírus de DNA da família do herpes-vírus.
Em algumas infecções virais, a lesão tecidual pode ser causada por CTL. Um modelo experimental de uma doença na qual a patologia é decorrente da resposta imunológica do hospedeiro é a infecção pelo vírus da coriomeningite linfocítica (LCMV) em camundongos, que induz inflamação das meninges da medula espinhal. O LCMV infecta as células da meninge, mas não é citopático e não causa lesão direta das células infectadas. O vírus estimula o desenvolvimento dos CTL específicas de determinado vírus que destroem as células da meninge durante uma tentativa fisiológica de erradicar a infecção. Portanto, a meningite desenvolve-se em camundongos normais com sistema imunológico intacto, mas os camundongos com deficiência de células T não desenvolvem a doença e tornam-se portadores do vírus. Esta observação surge para contradizer a situação comum na qual indivíduos imunodeficientes são mais suscetíveis a doenças infecciosas do que indivíduos normais. A infecção humana pelo vírus da hepatite B apresenta algumas similaridades em relação ao LCMV murino pelo fato de que indivíduos imunodeficientes que se tornam infectados não desenvolvem a doença, mas tornam-se portadores que podem transmitir a infecção para pessoas saudáveis. O fígado de pacientes com hepatite ativa aguda e crônica contém grandes números de células T CD8+, e os CTL específicos para o vírus da hepatite e restritos ao MHC de classe I podem ser isolados de espécimes de biópsia hepática e disseminados in vitro.
As respostas imunológicas às infecções virais podem estar envolvidas no desenvolvimento da doença por outras vias. Uma consequência da infecção persistente por alguns vírus, tais como o da hepatite B, é a formação de complexos imunológicos circulantes compostos de antígenos virais e anticorpos específicos (Cap. 18). Esses complexos são depositados nos vasos sanguíneos e levam a vasculite sistêmica. Algumas proteínas virais contêm sequências de aminoácidos que também estão presentes em alguns antígenos próprios. Foi postulado que, devido a esse “mimetismo molecular”, a imunidade antiviral pode conduzir a respostas imunológicas contra antígenos próprios.
Evasão da Resposta Imunológica pelos Vírus
Os vírus desenvolveram numerosos mecanismos para escapar da imunidade do hospedeiro (Tabela 15-3).
TABELA 15-3 Mecanismo de Evasão Imunológica pelos Vírus
| Mecanismos de Evasão Imunológica | Exemplos |
|---|---|
| Variação antigênica | Influenza, rinovírus, HIV |
| Inibição do processamento antigênico | |
| Bloqueio do transportador TAP | Herpes simples |
| Remoção das moléculas de classe I do RE | Citomegalovírus |
| Produção de homólogos do receptor de citocinas | Vacínia, poxvírus (IL-1, IFN-γ) |
| Citomegalovírus (quimiocina) | |
| Produção de citocinas imunossupressoras | Epstein-Barr (IL-10) |
| Infecção e morte ou dano funcional das células imunes | HIV |
Estão listados exemplos representativos de diferentes mecanismos utilizados pelos vírus para resistir à imunidade do hospedeiro. RE, retículo endoplasmático; HIV, vírus da imunodeficiência humana; TAP, transportador associado ao processamento antigênico.
• Os vírus podem alterar seus antígenos e não ser mais os alvos das respostas imunológicas. Os antígenos afetados são mais comumente glicoproteínas de superfície que são reconhecidas pelos anticorpos, mas os epítopos de células T também podem sofrer variação. Os principais mecanismos de variação antigênica são as mutações pontuais e os rearranjos dos genomas de RNA (nos vírus de RNA), levando, respectivamente, à mutação antigênica menor (antigenic drift) e à mutação antigênica maior (antigenic shift). Esses processos têm grande importância na disseminação do vírus influenza. Os dois principais antígenos do vírus são a hemaglutinina viral trimérica (a proteína viral da “espícula”) e a neuraminidase. Os genomas virais sofrem mutações nos genes que codificam essas proteínas de superfície, e a variação decorrente resulta em mutação antigênica menor. Os vírus influenza que normalmente habitam diferentes espécies de hospedeiro podem recombinar-se nas células do hospedeiro e esses vírus rearranjados podem diferir drasticamente das cepas prevalentes (Fig. 15-8). Os processos de rearranjo resultam em mudanças maiores na estrutura antigênica chamada “mutação antigênica maior” que criam vírus distintos, tais como o vírus da gripe aviária ou o vírus da gripe suína. Como resultado da variação antigênica, um vírus pode tornar-se resistente à imunidade gerada na população por infecções prévias. As pandemias de influenza que ocorreram em 1918, 1957 e 1968 foram ocasionadas por diferentes cepas do vírus, e a pandemia de H1N1 ocorrida em 2009 foi causada por uma cepa na qual as fitas do genoma de RNA foram rearranjadas entre as cepas endêmicas em suínos, aves e humanos. Variantes sutis surgem com maior frequência. Existem tantos sorotipos de rinovírus que a imunização específica contra o resfriado comum pode não ser uma estratégia preventiva viável. O vírus da imunodeficiência humana 1 (HIV-1), o vírus que causa a AIDS, também é capaz de sofrer grandes variações antigênicas (Cap. 20). Nessas situações, a vacinação profilática deverá ser dirigida contra proteínas virais invariantes.
• Alguns vírus inibem a apresentação de antígenos proteicos citosólicos associados ao MHC de classe I. Os vírus produzem uma variedade de proteínas que bloqueiam diferentes etapas do processamento, transporte e apresentação antigênicos (Fig. 15-9). A inibição da apresentação antigênica bloqueia a montagem e a expressão de moléculas do MHC de classe I e a exposição dos peptídeos virais. Como consequência, as células infectadas por esses vírus não podem ser reconhecidas nem destruídas por CTL CD8+. Contudo, é difícil provar que os genes virais codificadores de proteínas que inibem a apresentação do antígeno são na verdade genes de virulência, necessários para a infectividade ou patogenicidade desses vírus. As células NK podem ter evoluído como uma forma de adaptação a essa estratégia de evasão viral, pois são ativadas pelas células infectadas, particularmente na ausência de moléculas do MHC de classe I. Há evidências emergentes de que alguns vírus podem produzir proteínas que atuam como ligantes para os receptores inibidores de células NK e, assim, inibir a ativação dessa população de células. Estes são ótimos exemplos da constante luta evolutiva entre os micro-organismos e a imunidade do hospedeiro.
• Alguns vírus produzem moléculas que inibem a resposta imunológica. Os poxvírus codificam moléculas que são secretadas por células infectadas e se ligam a várias citocinas, incluindo IFN-γ, TNF, IL-1, IL-18 e quimiocinas. As proteínas de ligação às citocinas secretadas podem atuar como antagonistas competitivos das citocinas. O vírus Epstein-Barr produz uma proteína que é homóloga à citocina IL-10, que inibe a ativação de macrófagos e de células dendríticas, podendo dessa forma suprimir a imunidade mediada por células. Esses exemplos provavelmente representam uma pequena fração das moléculas virais imunossupressoras. A identificação dessas moléculas levanta a possibilidade intrigante de que os vírus tenham adquirido genes que codificam inibidores endógenos das respostas imunológicas durante sua passagem em hospedeiros humanos e, portanto, teriam evoluído para infectar e colonizar o homem.
• Algumas infecções virais crônicas estão associadas à falha das respostas dos CTL, que permite a persistência viral. Estudos de infecção crônica com a coriomeningite linfocítica em camundongos mostraram que esse tipo de imunodeficiência pode resultar da ativação das vias inibitórias de células T, inclusive a via PD-1, que normalmente atua para manter a tolerância das células T aos antígenos próprios (Cap. 14). As respostas reduzidas das células T resultantes da infecção pelo HIV também podem dever-se, em parte, à falta de responsividade das células T mediada por PD-1. Portanto, os vírus podem ter evoluído para explorar os mecanismos normais da regulação imunológica e para ativar essas vias em células T. Este fenômeno é chamado exaustão, o que implica que as respostas imunológicas contra vírus são iniciadas, mas interrompidas prematuramente.
• Os vírus podem infectar e destruir ou inativar as células imunocompetentes. Um exemplo evidente é o HIV, que sobrevive ao infectar e eliminar as células T CD4+, as indutoras-chave das respostas imunológicas para os antígenos proteicos.
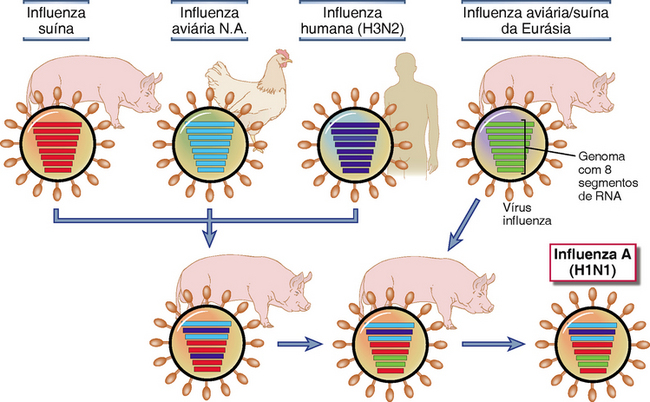
FIGURA 15-8 Geração de novas cepas do vírus influenza por recombinação genética (variação antigênica). O genoma do vírus influenza é composto de oito fitas de RNA separadas, que permitem a recombinação genética por rearranjos dos segmentos em vários hospedeiros, tais como suínos, aves ou humanos, que são simultaneamente infectados por duas cepas diferentes. Estes rearranjos genéticos criam novos vírus que são antigenicamente distintos dos seus precursores e, portanto, são capazes de escapar da detecção pelo sistema imunológico em um grande número de novos hospedeiros infectados. No exemplo mostrado, o vírus influenza H1N1 responsável pela pandemia de 2009 foi gerado pelo rearranjo dos vírus de suínos, aves e humanos em suínos e depois repassados ao homem.
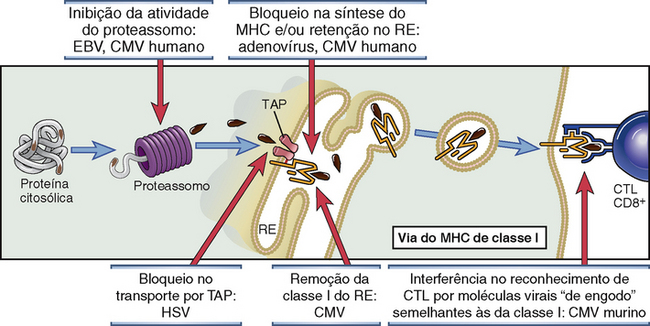
FIGURA 15-9 Mecanismos pelos quais os vírus inibem o processamento e a apresentação do antígeno. A via de apresentação do antígeno associada ao MHC de classe I é aqui ilustrada, com exemplos dos vírus que bloqueiam diferentes etapas dessa via. CMV, citomegalovírus; EBV, vírus Epstein-Barr; RE, retículo endoplasmático; HSV, vírus herpes simples; TAP, transportador associado ao processamento do antígeno.
IMUNIDADE CONTRA PARASITAS
Na terminologia das doenças infecciosas, a infecção parasitária refere-se à infecção por parasitas animais, como protozoários, helmintos e ectoparasitos (p. ex., carrapatos e ácaros). Atualmente, tais parasitas são responsáveis por maiores taxas de morbidade e mortalidade do que qualquer outra classe de organismos infecciosos, particularmente em países em desenvolvimento. Estima-se que cerca de 30% da população mundial sofram de infecções parasitárias. Somente a malária acomete mais de 100 milhões de pessoas em todo o mundo e é responsável por cerca de 1 a 2 milhões de mortes anualmente. A magnitude deste problema de saúde pública é o principal motivo do grande interesse pela imunidade antiparasitária e pelo desenvolvimento da imunoparasitologia como um ramo distinto da imunologia.
A maioria dos parasitas passa por ciclos de vida complexos, parte dos quais ocorre no homem (ou em outros vertebrados) e a outra parte ocorre em hospedeiros intermediários, tais como moscas, carrapatos e caramujos. O homem geralmente é infectado por picadas de hospedeiros intermediários infectados ou pelo compartilhamento de um habitat com o hospedeiro intermediário. Por exemplo, a malária e a tripanossomíase são transmitidas por picadas de insetos, enquanto a esquistossomose é transmitida pela exposição à água na qual residem caramujos infectados. A maioria das infecções parasitárias é crônica por causa da fraca imunidade inata e da capacidade dos parasitas de escaparem ou resistirem à eliminação pelas respostas imunológicas adaptativas. Além disso, muitos fármacos antiparasitários não são eficazes em destruir os micro-organismos. Indivíduos que vivem em áreas endêmicas necessitam de quimioterapia repetida por causa da exposição contínua, e esse tratamento frequentemente não é possível devido ao custo e a problemas logísticos. Portanto, o desenvolvimento de vacinas profiláticas contra parasitas é considerado um importante objetivo para os países em desenvolvimento.
Imunidade Inata contra Parasitas
Embora se tenha demonstrado que diferentes agentes parasitários, como os protozoários e os helmintos, ativam distintos mecanismos de imunidade inata, esses organismos frequentemente são capazes de sobreviver e replicar dentro dos seus hospedeiros, pois são bem adaptados para resistir frente às defesas do hospedeiro. A principal resposta imunológica inata aos protozoários é a fagocitose, mas muitos desses parasitas são resistentes à morte fagocítica e podem replicar dentro de macrófagos. Alguns protozoários expressam moléculas de superfície que são reconhecidas por TLR e ativam os fagócitos. As espécies de Plasmodium (o protozoário responsável pela malária), o Toxoplasma gondii (o agente que causa toxoplasmose) e espécies de Cryptosporidium (o principal parasito que causa diarreia em pacientes infectados pelo HIV), expressam lipídios glicosil fosfatidilinositol que podem ativar TLR2 e TLR4. Os fagócitos também podem atacar os parasitas helmínticos e secretar substâncias microbicidas para matar organismos que são grandes demais para serem fagocitados. Entretanto, muitos helmintos possuem tegumentos espessos que podem torná-los resistentes aos mecanismos citocidas de neutrófilos e macrófagos, e são parasitas grandes demais para serem ingeridos por fagócitos. Alguns helmintos podem ativar a via alternativa do complemento, embora, como será discutido adiante, os parasitas recuperados de hospedeiros infectados pareçam ter desenvolvido resistência à lise mediada pelo complemento.
Imunidade Adaptativa contra Parasitas
Diferentes protozoários e helmintos variam enormemente quanto a suas propriedades estruturais e bioquímicas, ciclos de vida e mecanismos patogênicos. Não surpeende, portanto, que os diferentes parasitas induzam distintas respostas imunológicas adaptativas (Tabela 15-4). Alguns protozoários patogênicos evoluíram para sobreviver dentro de células do hospedeiro, de modo que a imunidade protetora contra esses organismos é mediada por mecanismos similares àqueles que eliminam as bactérias intracelulares e os vírus. Por sua vez, metazoários, tais como os helmintos, sobrevivem nos tecidos extracelulares, e sua eliminação frequentemente depende de tipos especiais de respostas de anticorpos.
TABELA 15-4 Respostas Imunológicas contra Parasitas Causadores de Doenças
| Parasita | Doenças | Principais Mecanismos de Imunidade Protetora |
|---|---|---|
| Protozoários | ||
| Plasmodium spp. | Malária | Anticorpos e CTL CD8+ |
| Leishmania donovani | Leishmaniose (mucocutânea disseminada) | Células TH1 CD4+ ativam macrófagos para destruir parasitas fagocitados |
| Trypanosoma brucei | Tripanossomíase africana | Anticorpos |
| Entamoeba histolytica | Amebíase | Anticorpos, fagocitose |
| Metazoários | ||
| Schistosoma spp. | Esquistossomose | Morte mediada por eosinófilos, macrófagos |
| Filárias, como | Filariose | Imunidade mediada por células; papel dos anticorpos? |
| Wuchereria bancrofti |
Exemplos selecionados de parasitas e as respostas imunológicas induzidas estão listados nesta tabela.
O principal mecanismo de defesa contra protozoários que sobrevivem dentro de macrófagos é a resposta imunológica mediada por células, particularmente a ativação dos macrófagos por citocinas derivadas de células TH1. A infecção de camundongos por Leishmania major, um protozoário que sobrevive dentro dos endossomos de macrófagos, é o exemplo mais bem documentado de como a predominância das respostas TH1 ou TH2 determina a resistência ou suscetibilidade à doença (Fig. 15-5). A resistência à infecção está associada à ativação de células T CD4+ TH1 específicas para Leishmania, que produzem IFN-γ e, portanto, ativam macrófagos para destruírem parasitos intracelulares. Em contraste, a ativação de células TH2 pelos protozoários resulta em aumento da sobrevivência do parasito e exacerbação das lesões devido às ações supressoras de citocinas TH2 sobre macrófagos, especialmente IL-4. Um bom exemplo dessa diferença é observado em infecções de diferentes linhagens de camundongos isogênicos por Leishmania. A maioria das linhagens isogênicas de camundongos é resistente à infecção por L. major, mas camundongos BALB/c isogênicos e algumas linhagens relacionadas são altamente suscetíveis e morrem se forem infectados por um grande número de parasitas. Após a infecção, as linhagens resistentes produzem grandes quantidades de IFN-γ em resposta aos antígenos de Leishmania, enquanto as linhagens que são suscetíveis à leishmaniose fatal produzem mais IL-4 em resposta ao parasito. A promoção da resposta TH1 ou a inibição da resposta TH2 em linhagens suscetíveis aumenta a resistência à infecção. Múltiplos genes parecem controlar o balanço entre as respostas imunológicas protetoras e prejudiciais aos parasitos intracelulares em camundongos isogênicos, e é provável que isso ocorra também no homem. Tentativas de identificar esses genes estão em andamento em muitos laboratórios.
Protozoários que replicam no interior de várias células do hospedeiro e causam lise a essas células estimulam a produção de anticorpos específicos e as respostas dos CTL de modo similar ao dos vírus citopáticos. Um exemplo de organismo é o parasita da malária, que durante seu ciclo de vida reside principalmente em células sanguíneas e em hepatócitos. Durante muitos anos acreditou-se que os anticorpos fossem o principal mecanismo efetor contra a malária, e as primeiras tentativas de vacinação contra essa infecção focalizaram na geração de anticorpos. Hoje, é evidente que a resposta dos CTL contra parasitas que infectam hepatócitos é uma importante defesa contra a disseminação desse protozoário intracelular. A citocina IFN-γ é considerada protetora em muitas infecções por protozoários, inclusive malária, toxoplasmose e criptosporidiose.
A defesa contra muitas infecções por helmintos é mediada pela ativação de células TH2, resultando em produção de anticorpos IgE e ativação de eosinófilos. Os helmintos estimulam a diferenciação de células T CD4+ auxiliares virgens para a subgrupo TH2 das células efetoras, que secretam as citocinas IL-4 e IL-5. A IL-4 estimula a produção de IgE, a qual se liga ao receptor Fcε de eosinófilos e mastócitos, enquanto a IL-5 estimula o desenvolvimento e a ativação dos eosinófilos. Os mecanismos efetores mediados por IgE, mastócitos e eosinófilos são descritos no Capítulo 19. As ações combinadas de mastócitos e eosinófilos ambém contribuem para a expulsão dos parasitos do intestino, a chamada imunidade das barreiras (Cap. 10, Fig. 10-9). A expulsão de alguns nematódeos do intestino pode ser decorrente de mecanismos dependentes de IL-4 que não necessitam de IgE, como a peristalse aumentada.
As respostas imunológicas adaptativas aos parasitas também podem contribuir para a lesão tecidual. Alguns parasitos e seus produtos induzem respostas granulomatosas com desenvolvimento concomitante de fibrose. Os ovos de Schistosoma mansoni depositados no fígado estimulam as células T CD4+, que por sua vez ativam os macrófagos e induzem reações de DTH. Essas reações resultam na formação dos granulomas ao redor dos ovos; um aspecto incomum dessa resposta inflamatória, principalmente em camundongos, é a associação a respostas TH2. (Granulomas geralmente são induzidos por respostas TH1 contra antígenos persistentes; Cap. 18.) Esses granulomas induzidos por TH2 podem resultar do processo de “ativação alternativa de macrófagos” que é induzida por IL-4 e IL-13 (Cap. 10). Os granulomas servem para conter os ovos dos esquistossomos, mas a fibrose grave associada a essa resposta imunológica crônica mediada por células leva a cirrose, interrupção do fluxo sanguíneo venoso no fígado e hipertensão porta. Na filariose linfática, o alojamento dos parasitas nos vasos linfáticos leva a reações imunológicas celulares crônicas e, por fim, a fibrose. A fibrose resulta em obstrução linfática e linfedema grave. As infestações parasitárias crônicas e persistentes estão frequentemente associadas à formação de complexos de antígenos parasitários e anticorpos específicos. Os complexos podem ser depositados nos vasos sanguíneos e nos glomérulos renais e produzem vasculite e nefrite, respectivamente (Cap. 18). Doença do complexo imunológico é uma complicação da esquistossomose e da malária.
Evasão da Resposta Imunológica pelos Parasitas
Os parasitas escapam da imunidade protetora ao reduzirem a imunogenicidade e inibirem as respostas imunológicas do hospedeiro. Diferentes parasitas desenvolveram mecanismos notavelmente eficazes de resistir à imunidade (Tabela 15-5).
TABELA 15-5 Mecanismo de Evasão Imunológica pelos Parasitas
| Mecanismos da Resposta Imunológica | Exemplos |
|---|---|
| Variação antigênica | Tripanossomos, Plasmodium |
| Resistência adquirida ao complemento, CTL | Esquistossomos |
| Inibição das respostas imunológicas do hospedeiro | Filária (secundária à obstrução linfática), tripanossomas |
| Expulsão do antígeno | Entamoeba |
CTL, linfócitos T citotóxicos.
• Os parasitas mudam seus antígenos de superfície durante o ciclo de vida nos hospedeiros vertebrados. Duas formas de variação antigênica são bem definidas. A primeira é uma alteração específica de determinado estágio na expressão antigênica, de tal forma que os estágios teciduais maduros dos parasitos produzem antígenos diferentes daqueles dos estágios infectantes. Por exemplo, os esporozoítos do parasita da malária pertencentes ao estágio infectante são antigenicamente distintos dos merozoítos que residem no hospedeiro e são responsávei pela infecção crônica. Com o desenvolvimento da resposta do sistema imunológico frente à infecção por esporozoítos, ocorre a diferenciação do parasito e a expressão de novos antígenos, não sendo mais alvo da eliminação pelo sistema imunológico. O segundo e mais notável exemplo de variação antigênica em parasitas é a contínua variação nos principais antígenos de superfície observados em tripanossomos africanos, tais como Trypanosoma brucei e Trypanosoma rhodesiense. A contínua variação antigênica nos tripanossomos deve-se principalmente à variação programada na expressão dos genes codificadores do principal antígeno de superfície. Pacientes infectados mostram flutuações na parasitemia sanguínea, e cada flutuação consiste em parasitas expressando um antígeno de superfície que é diferente daquele da flutuação anterior. Portanto, no momento em que o hospedeiro produz anticorpos contra o parasita, um micro-organismo antigenicamente diferente já se desenvolveu. Mais de uma centena dessas flutuações de parasitemia podem ocorrer em uma infecção. Uma consequência da variação antigênica nos parasitas é a dificuldade de vacinar de forma eficaz os indivíduos contra essas infecções.
• Os parasitas tornam-se resistentes aos mecanismos imunológicos efetores durante a sua permanência em hospedeiros vertebrados. Talvez os melhores exemplos sejam as larvas de esquistossomos que migram para os pulmões de animais infectados e durante essa etapa desenvolvem um tegumento que é resistente a dano pelo complemento e pelos CTL. A base bioquímica dessa alteração é desconhecida.
• Os protozoários parasitos podem se esconder do sistema imunológico vivendo dentro das células do hospedeiro ou desenvolvendo cistos que são resistentes aos efetores imunológicos. Alguns parasitas helmínticos vivem no lúmen intestinal e são protegidos dos mecanismos imunológicos efetores mediados por células. Os parasitas podem também expelir suas coberturas antigênicas, de modo espontâneo ou após ligação aos anticorpos específicos. A expulsão de antígenos torna os parasitas resistentes ao ataque subsequente mediado por anticorpos. A Entamoeba histolytica é um parasita do grupo dos protozoários que expele antígenos e pode também se converter para uma forma cística no lúmen do intestino grosso.
• Os parasitas inibem as respostas imunológicas por múltiplos mecanismos. A anergia das células T aos antígenos parasitários foi observada na forma grave da esquistossomose envolvendo o fígado e o baço e nas infecções por filária. Os mecanismos da ausência de resposta imunológica nessas infecções não são bem compreendidos. Na filariose linfática, a infecção dos linfonodos com a destruição subsequente da arquitetura tecidual pode contribuir para a resposta imunológica deficiente. Alguns parasitos, tais como Leishmania, estimulam o desenvolvimento de células T reguladoras, que suprimem a resposta imunológica o suficiente para permitir a persistência dos parasitas. A imunossupressão mais inespecífica e generalizada é observada na malária e na tripanossomíase africana. Esta imunodeficiência é atribuída à produção de citocinas imunossupressoras por macrófagos ativados e células T e defeitos na ativação das células T.
As consequências das infestações parasitárias para a saúde e o desenvolvimento econômico são devastadoras. Tentativas de desenvolver vacinas eficazes contra essas infecções têm sido feitas ativamente há muitos anos. Embora o progresso seja mais lento do que se poderia esperar, a elucidação dos mecanismos fundamentais das respostas imunológicas aos parasitas e da evasão imunológica por parasitas representa uma promessa para o futuro.
ESTRATÉGIAS PARA O DESENVOLVIMENTO DE VACINAS
O nascimento da imunologia como ciência data da vacinação bem-sucedida realizada por Edward Jenner contra a varíola em 1796. A importância da imunização profilática contra as doenças infecciosas é mais bem ilustrada pelo fato de que os programas de vacinação mundiais levaram a uma erradicação completa ou quase completa de muitas dessas doenças nos países desenvolvidos (Cap. 1, Tabela 1-1). O princípio fundamental da vacinação é administrar uma forma morta ou atenuada de um agente infeccioso ou um componente de um micro-organismo que não causa doença, mas induz uma resposta imunológica que fornece proteção contra a infecção pelo micro-organismo patogênico vivo.
O bom êxito da vacinação na erradicação da doença infecciosa depende de várias propriedades dos micro-organismos. As vacinas são eficazes se o agente infeccioso não estabelecer latência, se não sofrer muita ou qualquer variação antigênica e se não interferir na resposta imunológica do hospedeiro. É difícil vacinar de modo eficaz contra micro-organismos, tais como o HIV, o qual estabelece infecção latente, é altamente variável e incapacita os componentes-chave do sistema imunológico. As vacinas são mais eficazes contra infecções que são limitadas aos hospedeiros humanos e não apresentam reservatórios animais.
Atualmente, a maioria das vacinas em uso induz a imunidade humoral. Os anticorpos constituem o único mecanismo imunológico que previne infecções através da neutralização e eliminação dos micro-organismos antes que consigam se estabelecer no hospedeiro. As melhores vacinas são aquelas que estimulam o desenvolvimento de plasmócitos de vida longa, produtores de anticorpos de alta afinidade, assim como de células B de memória. Estas características das respostas imunológicas humorais são mais bem induzidas pela reação no centro germinativo (Cap. 11) que requer o auxílio proporcionado pelas células T CD4+ específicas para antígenos proteicos.
Na próxima seção, resumiremos as abordagens para vacinação que estão sendo desenvolvidas (Tabela 15-6) e suas principais vantagens e limitações.
TABELA 15-6 Estratégias de Vacinação
| Tipo de Vacina | Exemplos |
|---|---|
| Bactéria viva atenuada ou morta | Bacilo de Calmette-Guérin, cólera |
| Vírus vivos atenuados | Pólio, raiva |
| Vacinas de subunidades (antígeno) | Toxoide tetânico, toxoide diftérico |
| Vacinas conjugadas | Haemophilus influenzae, pneumococo |
| Vacinas sintéticas | Hepatite (proteínas recombinantes) |
| Vetores virais | Ensaios clínicos de antígenos do HIV em vetor canarypox |
| Vacinas de DNA | Ensaios clínicos em andamento para várias infecções |
Vacinas Bacterianas e Virais Atenuadas e Inativadas
As vacinas compostas de micro-organismos não patogênicos intactos são produzidas pelo tratamento do micro-organismo de modo que não possa causar doença (p. ex., atenuação da virulência) ou pela morte dos micro-organismos, mas mantendo-se a sua imunogenicidade. A grande vantagem das vacinas microbianas atenuadas é que induzem todas as respostas imunológicas inatas e adaptativas (tanto humorais como mediadas por células) que o micro-organismo desencadearia e são, portanto, a maneira ideal de induzir imunidade protetora. Louis Pasteur foi o primeiro cientista a demonstrar que bactérias vivas atenuadas poderiam conferir imunidade específica. Atualmente, as vacinas bacterianas atenuadas ou mortas em uso geralmente induzem proteção limitada e são eficazes apenas por curtos períodos. As vacinas virais vivas atenuadas geralmente são mais eficazes; pólio, sarampo e febre amarela são três bons exemplos. A abordagem mais empregada para a produção de tais vírus atenuados é a passagem repetida em cultura de células. Mais recentemente, a geração de mutantes sensíveis à temperatura e por deleção chegou ao mesmo objetivo. Vacinas virais frequentemente induzem imunidade específica de longa duração, de modo que a imunização de crianças seja suficiente para proteção por toda a vida. Algumas vacinas virais atenuadas (p. ex., contra pólio) podem causar doença em hospedeiros imunocomprometidos, e por esse motivo as vacinas de poliovírus inativados são agora as mais comumente utilizadas. A principal preocupação com as vacinas virais ou bacterianas atenuadas é a segurança.
Uma vacina inativada amplamente usada e de considerável importância na saúde pública é a vacina do vírus influenza. O crescimento desse vírus em ovos de galinha é utilizado em dois tipos de vacinas. A mais comum é a forma trivalente inativada (morta) que é usada na vacina contra a gripe e é aplicada intramuscularmente. Três das cepas de influenza mais frequentemente encontradas são selecionadas todo ano e incorporadas a essa vacina. Um segundo tipo de vacina da influenza envolve as mesmas três cepas, mas a vacina é feita de vírus vivos atenuados e é usada como spray nasal.
Vacinas de Antígeno Purificado (Subunidade)
As vacinas de subunidades são compostas de antígenos purificados de micro-organismos ou toxinas inativadas e geralmente são administradas com um adjuvante. Um emprego eficaz dos antígenos purificados como vacinas é feito para prevenção contra doenças causadas por toxinas bacterianas. As toxinas podem se tornar inócuas sem perder a imunogenicidade, e esses “toxoides” induzem fortes respostas de anticorpos. A difteria e o tétano são duas infecções cujas consequências prejudiciais foram em grande parte controladas devido à imunização de crianças com preparações de toxoides. As vacinas compostas de antígenos polissacarídicos bacterianos são usadas contra pneumococos e H. influenza. Como os polissacárides são antígenos independentes de células T, tendem a estimular respostas de anticorpos de baixa afinidade e podem ser fracamente imunogênicos em lactentes (que não montam fortes respostas de anticorpos independentes de células T). Os anticorpos de alta afinidade podem ser gerados contra antígenos polissacarídicos mesmo em crianças, acoplando os polissacárides às proteínas para formar vacinas conjugadas. Essas vacinas funcionam como conjugados carreadores de hapteno e são uma aplicação prática do princípio da cooperação de células T-B (Cap. 11). As vacinas contra H. influenza, pneumococos e meningococos atualmente utilizadas são vacinas conjugadas. As vacinas de proteínas purificadas estimulam as células T auxiliares e as respostas de anticorpos, mas não geram potentes CTL. A explicação para o fraco desenvolvimento dos CTL é que, ao contrário das vacinas microbianas atenuadas, as proteínas exógenas (e peptídeos) são ineficientes ao entrarem na via de processamento e ativação associada ao MHC de classe I e não podem deslocar prontamente os peptídeos das moléculas de classe I de superfície. Como consequência, as vacinas proteicas não são reconhecidas de forma eficaz pelas células T CD8+ restritas ao MHC de classe I.
Vacinas de Antígenos Sintéticos
O objetivo da pesquisa com vacinas é identificar os antígenos ou epítopos microbianos mais imunogênicos para sintetizá-los em laboratório, e utilizar os antígenos sintéticos como vacinas. É possível deduzir as sequências proteicas de antígenos microbianos dos dados de sequências nucleotídicas e preparar grandes quantidades de proteínas pela tecnologia do DNA recombinante. As vacinas feitas de antígenos derivados do DNA recombinante estão atualmente em uso para o vírus da hepatite, vírus herpes simples, vírus da febre aftosa (o principal patógeno do gado), papilomavírus humano e rotavírus. No caso da maioria das vacinas amplamente usadas contra o papilomavírus humano, as proteínas virais recombinantes de quatro cepas do vírus (HPV 6, 11, 16 e 18) são produzidas em leveduras e combinadas com um adjuvante. Os HPV 6 e 11 são causas comuns de verrugas e os HPV 16 e 18 são as cepas mais comuns relacionadas ao câncer cervical. Desse modo, esta vacina antiviral é também uma vacina preventiva contra o câncer.
Vacinas de Vírus Vivos Envolvendo Vírus Recombinantes
Outra abordagem para o desenvolvimento de vacinas é introduzir genes que codificam antígenos microbianos em vírus não citopáticos e infectar indivíduos com esse vírus. Portanto, o vírus serve como uma fonte de antígeno em um indivíduo inoculado. A grande vantagem dos vetores virais é que, como outros vírus vivos, induzem o complemento integral das respostas imunológicas, incluindo fortes respostas dos CTL. Esta técnica é usada mais comumente com os vetores do vírus da vacínia. A inoculação desses vírus recombinantes em muitas espécies de animais induz tanto a imunidade humoral quanto a mediada por células contra o antígeno produzido pelo gene estranho (e, é claro, também contra os antígenos do vírus da vacínia). Um problema potencial com os vírus recombinante é que podem infectar as células do hospedeiro e, embora não sejam patogênicos, podem produzir antígenos que estimulam as respostas de CTLs que destroem as células infectadas do hospedeiro. Essas e outras preocupações quanto à segurança limitaram o uso generalizado de vetores virais para a produção de vacinas.
Vacinas de DNA
Um método interessante de vacinação foi desenvolvido com base em uma observação inesperada. A inoculação de um plasmídeo contendo DNA complementar (cDNA) que codifica um antígeno proteico leva a respostas imunológicas celulares e humorais fortes e duradouras contra o antígeno. É provável que as APC, como as células dendríticas, sejam transfectadas pelo plasmídeo e que o cDNA seja transcrito e traduzido em proteína imunogênica que induz respostas específicas. Um aspecto peculiar das vacinas de DNA é que elas proporcionam a única abordagem, além dos vírus vivos, para o desencadeamento de fortes respostas de CTL, pois as proteínas codificadas pelo DNA são sintetizadas no citosol de células transfectadas. Além disso, os plasmídeos bacterianos são ricos em nucleotídeos CpG não metilados e são reconhecidos pelo TLR (TLR9) em células dendríticas e outras células, desse modo induzindo uma resposta imunológica inata que aumenta a imunidade adaptativa (Cap. 4). Portanto, as vacinas com DNA plasmidiótico podem ser eficazes mesmo quando administradas sem adjuvantes. A facilidade de manipulação dos cDNAs para expressão muitos diferentes antígenos, a capacidade de estocar DNA sem refrigeração para uso no campo e a capacidade de coexpressar outras proteínas que podem aumentar as respostas imunológicas (tais como citocinas e coestimuladores) tornam essa técnica promissora. Entretanto, as vacinas de DNA não foram efetivas como se esperava nos ensaios clínicos, e os fatores que determinam a eficácia dessas vacinas, especialmente no homem, ainda não estão totalmente definidos.
Adjuvantes e Imunomoduladores
O início das respostas imunológicas dependentes de células T contra antígenos proteicos requer que os antígenos sejam administrados com adjuvantes. A maioria dos adjuvantes induz respostas imunológicas inatas, com expressão aumentada de coestimuladores e a produção de citocinas, como IL-12, que estimula o crescimento e a diferenciação de células T. Bactérias mortas pelo calor são poderosos adjuvantes que são comumente utilizados em animais experimentais. Contudo, a grave inflamação local que esses adjuvantes desencadeiam desaconselha seu uso em humanos. Muito esforço tem sido dedicado ao desenvolvimento de adjuvantes seguros e eficazes para uso no homem. Alguns estão na prática clínica, inclusive o hidróxido de alumínio em gel (que parece promover as respostas de células B) e as formulações lipídicas que são ingeridas pelos fagócitos. Uma alternativa para os adjuvantes é administrar substâncias naturais que estimulam as respostas de células T junto com os antígenos. Por exemplo, IL-12 incorporada às vacinas promove uma intensa imunidade celular. Como foi mencionado, o DNA plasmidiótico tem atividades intrínsecas semelhantes às do adjuvante e é possível incorporar coestimuladores (p. ex., moléculas B7) ou citocinas às vacinas de DNA plasmidiótico. No entanto, essas ideias ainda permanecem experimentais.
Imunização Passiva
A imunidade protetora também pode ser conferida pela imunização passiva, como pela transferência de anticorpos. Na condição clínica, a imunização passiva é mais comumente empregada para tratamento rápido de doenças potencialmente fatais causadas por toxinas, tais como o tétano, e para proteção contra a raiva e a hepatite. Os anticorpos contra o veneno de serpente podem ser salvadores quando administrados após a picada de serpentes peçonhentas. A imunidade passiva tem vida curta porque o hospedeiro não responde à imunização, e a proteção dura apenas o tempo em que os anticorpos injetados persistem. Além disso, a imunização passiva não induz memória, de modo que um indivíduo imunizado não é protegido contra a exposição subsequente à toxina ou ao micro-organismo.
• A interação do sistema imunológico com os organismos infecciosos é evento dinâmico dos mecanismos do hospedeiro com o objetivo de eliminar as infecções e as estratégias microbianas desenvolvidas para permitir a sobrevivência em face dos poderosos mecanismos de defesa. Diferentes tipos de agentes infecciosos estimulam distintos tipos de respostas imunológicas e desenvolveram mecanismos peculiares para escapar da imunidade. Em algumas infecções, a resposta imunológica é a causa da lesão tecidual e da doença.
• A imunidade inata contra bactérias extracelulares é mediada pelos fagócitos e pelo sistema complemento (a via alternativa e a via da lectina).
• A principal resposta imunológica adquirida contra bactérias extracelulares consiste em anticorpos específicos que opsonizam a bactéria para a fagocitose e ativam o sistema complemento. As toxinas produzidas por essas bactérias são neutralizadas por anticorpos específicos. Algumas toxinas bacterianas são poderosos indutores da produção de citocinas e estas respondem por grande parte da doença sistêmica associada às infecções graves e disseminadas causadas por esses micro-organismos.
• A imunidade inata contra bactérias intracelulares é mediada principalmente por macrófagos. Entretanto, as bactérias intracelulares são capazes de sobreviver e replicar dentro das células do hospedeiro, inclusive fagócitos, pois desenvolveram mecanismos para resistir à degradação no interior dessas células.
• A imunidade adaptativa contra bactérias intracelulares é principalmente mediada por células e consiste na ativação de macrófagos por células T CD4+ (como na DTH), assim como na morte de células infectadas por CTL CD8+. A resposta patológica característica na infecção por bactérias intracelulares é a inflamação granulomatosa.
• As respostas protetoras contra os fungos consistem na imunidade inata, mediada por neutrófilos e macrófagos, e a imunidade adquirida humoral e mediada por células. Os fungos são, em geral, rapidamente eliminados por fagócitos e por um sistema imunológico competente, razão pela qual as infecções fúngicas disseminadas são observadas principalmente em indivíduos imunodeficientes.
• A imunidade inata contra os vírus é mediada pelos interferons do tipo I e pelas células NK. Os anticorpos neutralizantes impedem que o vírus entre nas células no início do curso da infecção e mais tarde, se os vírus forem liberados das células infectadas mortas. O principal mecanismo de defesa contra a infecção estabelecida é a lise de células infectadas mediada por CTL. Os CTL podem contribuir para lesão tecidual mesmo quando o vírus infeccioso não é prejudicial por si só. Os vírus escapam das respostas imunológicas por meio de variação antigênica, inibição da apresentação antigênica e produção de moléculas imunossupressoras.
• Os parasitas, tais como protozoários e helmintos, dão origem a infecções crônicas e persistentes, porque a imunidade inata presente é fraca e os parasitas desenvolveram múltiplos mecanismos para evasão e resistência à imunidade específica. A diversidade estrutural e antigênica dos parasitas patogênicos é refletida na heterogeneidade das respostas imunológicas adaptativas que são induzidas. Os protozoários que vivem dentro das células do hospedeiro são destruídos pela imunidade mediada por células, enquanto os helmintos são eliminados por anticorpos IgE e por destruição mediada por eosinófilos, assim como por outros leucócitos. Os parasitas escapam do sistema imunológico pela variação antigênica durante a permanência em hospedeiros vertebrados, pela aquisição de resistência aos mecanismos efetores imunonógicos e pelo mascaramento e liberação dos seus antígenos de superfície.
• A vacinação é uma estratégia poderosa para prevenir infecções. As vacinas mais eficazes são aquelas que estimulam a produção de anticorpos de alta afinidade e as células de memória. Muitas abordagens para vacinação fazem parte da prática clínica e estão sendo testadas para várias infecções.
Alcais A, Abel L, Casanova J-L. Human genetics of infectious diseases: between proof of principle and paradigm. Journal of Clinical Investigation. 2009;119:2506-2514.
Dorhol A, Kaufmann SH. Fine-tuning T cell responses during infection. Current Opinion in Immunology. 2009;21:367-377.
Finlay BB, McFadden G. Anti-immunology: evasion of the host immune system by bacterial and viral pathogens. Cell. 2006;124:767-782.
Imunidade contra Bactérias Extracelulares e Intracelulares
Brodsky IE, Medzhitov R. Targeting of immune signaling networks by bacterial pathogens. Nature Cell Biology. 2009;11:521-526.
Cooper AM. Cell-mediated immune responses in tuberculosis. Annual Review of Immunology. 2009;27:393-422.
Curtis MM, Way SS. Interleukin-17 in host defence against bacterial, mycobacterial and fungal pathogens. Immunology. 2009;126:177-185.
Kaufmann SHE. Tuberculosis: back on the immunologists’ agenda. Immunity. 2006;24:351-357.
Antoniou AN, Powis SJ. Pathogen evasion strategies for the major histocompatibility complex class I assembly pathway. Immunology. 2008;124:1-12.
Klenerman P, Hill A. T cells and viral persistence: lessons from diverse infections. Nature Immunology. 2005;6:873-879.
Perry AK, Chen G, Zheng D, Tang H, Cheng G. The host type I interferon response to viral and bacterial infections. Cell Research. 2005;15:407-422.
Rouse BT, Seherwat S. Immunity and immunopathology to viruses: what decides the outcome? Nature Reviews Immunology. 2010;10:514-526.
Virgin HW, Wherry EJ, Ahmed R. Redefining chronic viral infection. Cell. 2009;138:30-50.
Good MF, Xu H, Wykes M, Engwerda CR. Development and regulation of cell-mediated immune responses to the blood stages of malaria: implications for vaccine research. Annual Review of Immunology. 2005;23:69-99.
Langhorne J, Ndungu FM, Sponaas A-M, Marsh K. Immunity to malaria: more questions than answers. Nature Immunology. 2008;9:725-732.
Maizels RM, Pearce EJ, Artis D, Yazdanbaksh M, Wynn TA. Regulation of pathogenesis and immunity in helminth infections. Journal of Experimental Medicine. 2009;201:2059-2066.
McCulloch R. Antigenic variation in African trypanosomes: monitoring progress. Trends in Parasitology. 2004;20:117-121.
Brunner R, Jensen-Jarolim E, Pali-Scholl I. The ABC of clinical and experimental adjuvants—a brief overview. Immunology Letters. 2010;128:29-35.
Donnelly JJ, Wahren B, Liu MA. DNA vaccines: progress and challenges. Journal of Immunology. 2005;175:633-639.
Harris J, Sharp FA, Lavelle EC. The role of inflammasomes in the immunostimulatory effects of particulate vaccine adjuvants. European Journal of Immunology. 2010;40:634-638.