CAPÍTULO 16 Imunologia do Transplante
Transplantes são um método de tratamento usado amplamente para a substituição de órgãos e tecidos que não funcionam por órgãos e tecidos saudáveis. Tecnicamente, um transplante é o processo de retirada de células, tecidos ou órgãos, chamados de enxerto, de um indivíduo e a sua inserção em um indivíduo (geralmente) diferente. O indivíduo que oferece o enxerto é chamado de doador, e o indivíduo que recebe o enxerto é chamado de receptor (recebedor) ou hospedeiro. Se o enxerto é inserido em sua localização anatômica habitual, o procedimento é chamado de transplante ortotópico; se é inserido em um local diferente, o procedimento é chamado de transplante heterotópico. A transfusão é o transplante de células sanguíneas circulantes ou de plasma de um indivíduo para outro. Os transplantes clínicos para o tratamento de doenças humanas têm aumentado sistematicamente nos últimos 45 anos, e o transplante de rim, coração, pulmão, fígado, pâncreas e medula óssea é amplamente utilizado hoje (Fig. 16-1). Mais de 30.000 transplantes de rim, coração, pulmão, fígado e pâncreas são realizados atualmente por ano nos Estados Unidos. Além disso, estão sendo realizados transplantes de muitos outros órgãos ou células, inclusive de células-tronco.
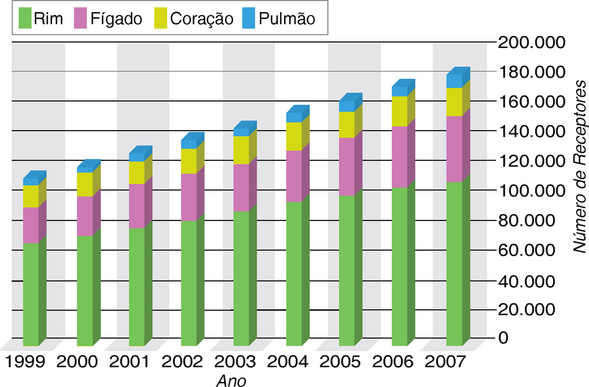
FIGURA 16-1 Pessoas que vivem com enxertos funcionais de órgãos nos Estados Unidos, 1999-2007.
(Dados de OPTN/SRTR Annual Report 2009. Disponível em: http://www.ustransplant.org/csr/current/fastfacts.aspx. Acessado em abril de 2010.)
O transplante de células ou tecidos de um indivíduo para um indivíduo não geneticamente idêntico invariavelmente leva à rejeição do transplante devido a uma resposta imunológica adaptativa. A rejeição tem sido a principal barreira para o sucesso dos transplantes de tecidos. Este problema foi inicialmente observado quando tentativas de repor pele lesionada ou queimada de doadores não familiares fracassaram constantemente. Em um período de 1 a 2 semanas, a pele transplantada sofria necrose e se desprendia. O insucesso dos enxertos levou Peter Medawar e muitos outros pesquisadores a estudar o transplante de pele em modelos animais. Esses experimentos estabeleceram que o insucesso do enxerto cutâneo era causado por uma reação inflamatória chamada rejeição. A conclusão que a rejeição do enxerto é o resultado de uma resposta imunológica adaptativa veio de experimentos que demonstravam que o processo tinha características de memória e especificidade e era mediado por linfócitos (Fig. 16-2). Por exemplo, a rejeição ocorre entre 7 e 14 dias após o primeiro transplante de um doador para um recebedor (chamada de rejeição de primeiro conjunto) e mais rapidamente depois do segundo transplante do mesmo doador para este recebedor (chamada de rejeição de segundo conjunto), sugerindo que o recebedor tenha desenvolvido uma memória para o tecido enxertado. Indivíduos que rejeitaram um enxerto de um doador demonstram rejeição acelerada de outro enxerto do mesmo doador, mas não de um doador diferente, demonstrando que o processo de rejeição é imunologicamente específico. Estes resultados experimentais foram retomados em transplantes clínicos. Talvez a evidência mais irrefutável demonstrando que a rejeição do aloenxerto é uma resposta imunológica adaptativa tenha sido a descoberta que a habilidade de rejeitar rapidamente um transplante pode ser transferida com linfócitos de um hospedeiro sensibilizado para um virgem.
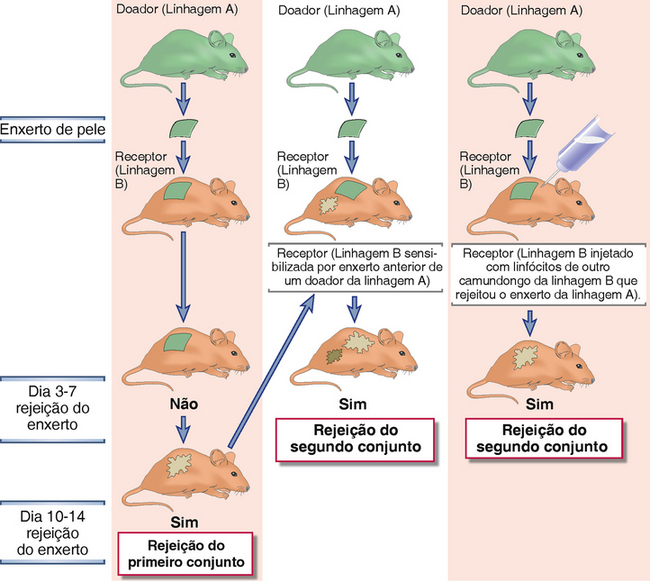
FIGURA 16-2 Rejeição de primeiro e segundo conjunto de aloenxerto. Resultados dos experimentos mostrados indicam que a rejeição do enxerto exibe as características das respostas imunológicas adaptativas, ou seja, a memória e a mediação por linfócitos. Um camundongo de linhagem B pura rejeitará um enxerto de um camundongo de linhagem A pura com cinética de primeiro conjunto (painel esquerdo). Um camundongo de linhagem B pura sensibilizado por um enxerto prévio de um camundongo de linhagem pura A rejeitará um segundo enxerto de um camundongo de linhagem pura A com cinética de segundo conjunto (painel do meio), demonstrando memória. Um camundongo de linhagem B pura injetado com linfócitos de outra linhagem de camundongo B que rejeitou um enxerto de um camundongo de linhagem A rejeitará um enxerto de um camundongo de linhagem A com cinética de segundo conjunto (painel direito), demonstrando o papel dos linfócitos na mediação da rejeição e da memória. Um camundongo de linhagem B pura sensibilizado por um enxerto anterior de um camundongo de linhagem A rejeitará um enxerto de uma terceira linhagem não relacionada com cinética de primeiro conjunto, demonstrando assim outra característica da imunidade adaptativa, a especificidade (não mostrado). Enxertos singênicos nunca são rejeitados (não mostrado).
Os imunologistas de transplantes desenvolveram um vocabulário especial para descrever os tipos de células e tecidos encontrados no ambiente do transplante. Um enxerto transplantado de um indivíduo para si mesmo é chamado de enxerto autólogo. Um enxerto transplantado entre dois indivíduos geneticamente idênticos ou singênicos é chamado de enxerto singênico. Um enxerto transplantado entre dois indivíduos geneticamente diferentes da mesma espécie é chamado de enxerto alogênico (ou aloenxerto). Um enxerto transplantado entre indivíduos de espécies diferentes é chamado de enxerto xenogênico (ou xenoenxerto). As moléculas que são reconhecidas como estranhas nos aloenxertos são chamadas de aloantígenos, e aquelas nos xenoenxertos são chamadas xenoantígenos. Os linfócitos e anticorpos que reagem com aloantígenos ou xenoantígenos são descritos como alorreativos ou xenorreativos, respectivamente.
A imunologia do transplante é importante por diversos motivos. Primeiro, a rejeição imunológica ainda é um dos principais problemas no transplante clínico. Segundo, embora o transplante de tecidos não seja um fenômeno normal, a resposta imunológica a moléculas alogênicas tem sido um modelo útil para o estudo dos mecanismos de ativação de linfócitos. Terceiro, muitas terapias imunossupressoras que demonstraram ser úteis para uma variedade de doenças imunológicas e inflamatórias foram primeiro testadas e comprovadas como eficazes para o tratamento da rejeição do enxerto, que é uma reação imunológica clinicamente importante que pode ser medida rápida e precisamente. A maior parte deste capítulo enfoca o transplante alogênico porque este é praticado com muito mais frequência e é mais bem entendido que o transplante xenogênico, que é discutido sucintamente no final do capítulo. Consideramos tanto a imunologia básica quanto alguns aspectos da prática clínica dos transplantes. Concluímos o capítulo com uma discussão sobre o transplante hematopoiético de células-tronco, que levanta questões especiais geralmente não encontradas nos transplantes de órgãos sólidos.
RESPOSTAS IMUNES AOS ALOENXERTOS
Os aloantígenos desencadeiam respostas imunes celulares e humorais. Nesta seção do capítulo, discutimos os mecanismos moleculares e celulares do alorreconhecimento, com ênfase na natureza dos antígenos do enxerto que estimulam respostas alogênicas e as propriedades dos linfócitos que a eles respondem.
Reconhecimento de Aloantígenos
O reconhecimento de células transplantadas como próprias ou estranhas é determinado por genes polimórficos, chamado de genes de histocompatibilidade, que diferem entre os diferentes membros de uma espécie. Esta conclusão é baseada nos resultados de transplantes experimentais entre linhagens consanguíneas de camundongos, e em alguns casos, os resultados foram confirmados em transplantes humanos. Lembre que todos os animais de uma linhagem consanguínea são geneticamente idênticos, que são homozigóticos para todos os genes (exceto os cromossomos sexuais nos machos). As regras básicas da imunologia dos transplantes, que são derivadas de tais experimentos animais, são as seguintes (Fig. 16-3).
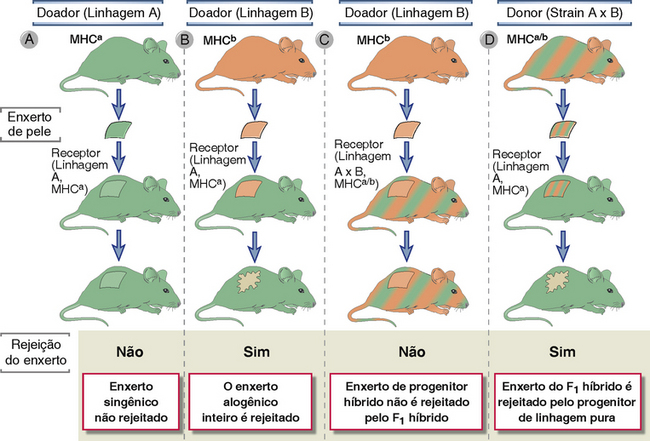
FIGURA 16-3 A genética da rejeição do enxerto. Na ilustração, as duas cores diferentes de camundongo representam linhagens puras com haplótipos MHC diferentes. Alelos MHC herdados de ambos os progenitores são codominantemente expressos na pele do descendente A × B, e, portanto estes camundongos são representados pelas suas cores. Enxertos singênicos não são rejeitados (A). Aloenxertos sempre são rejeitados (B). Enxertos de um progenitor A ou B não será rejeitado por um descendente (A × B)F1 (C), mas enxertos dos descendentes serão rejeitados por qualquer um dos progenitores (D). Estes fenômenos devem-se ao fato que os produtos do gene do MHC são responsáveis pela rejeição do enxerto; enxertos são rejeitados somente se expressarem um tipo de MHC (representado por verde ou laranja) que não é expresso pelo camundongo receptor.
• Células ou órgãos transplantados entre indivíduos geneticamente idênticos (gêmeos idênticos ou membros da mesma linhagem pura de animais) nunca são rejeitados.
• Células ou órgãos transplantados entre indivíduos geneticamente diferentes ou membros de duas linhagens puras diferentes de uma espécie são quase sempre rejeitados.
• A prole de um cruzamento entre duas diferentes linhagens puras tipicamente não rejeita enxertos de qualquer dos progenitores, ou seja, um animal (A × B)F1 não rejeitará enxertos de um animal de linhagem A ou B. (Esta regra é violada no transplante de medula óssea, que discutiremos mais adiante neste capítulo.)
• Um enxerto derivado da prole de um cruzamento entre duas linhagens puras diferentes é quase sempre rejeitado por qualquer um dos progenitores. Em outras palavras, um enxerto de um animal (A × B)F1 será rejeitado por animais de linhagem A ou B.
Tais resultados experimentais sugeriram que as moléculas nos enxertos, responsáveis pelo desencadeamento da rejeição, devem ser polimórficas e sua expressão é codominante. Polimórfico se refere ao fato de estes antígenos de enxerto diferirem entre os indivíduos de uma espécie (além de gêmeos idênticos) ou entre diferentes linhagens puras de animais. A expressão codominante significa que cada indivíduo herda genes codificando estas moléculas de ambos os progenitores e os dois alelos parentais são expressos. Portanto, animais (A × B)F1 expressam tanto os alelos A e B como consideram os tecidos A e B próprios, enquanto animais puros A ou B expressam apenas um alelo e consideram tecidos (A × B)F1 como parcialmente estranhos. É por isso que um animal (A × B)F1 não rejeita enxertos de linhagem A ou B e tanto os recipientes de linhagem A e B rejeitam um enxerto (A × B)F1.
As moléculas responsáveis por quase todas as reações de rejeição forte (rápida) são chamadas de moléculas do complexo principal de histocompatibilidade (MHC). George Snell e seus colegas usaram pares de linhagens congênitas de camundongos puros, que foram criados para serem geneticamente idênticos um ao outro exceto pelos genes necessários para a rejeição do enxerto, para identificar os genes polimórficos que codificam os alvos moleculares da rejeição do aloenxerto. Essa abordagem levou à identificação de genes MHC como a base genética subjacente à rejeição do enxerto. Transplantes de grande parte dos tecidos entre qualquer par de indivíduos, exceto gêmeos idênticos, serão rejeitados porque as moléculas MHC, os principais alvos polimórficos da rejeição do enxerto, são expressos em quase todos os tecidos. Conforme discutido no Capítulo 6, a função normal de moléculas MHC é apresentar peptídeos derivados de antígenos proteicos em uma forma que pode ser reconhecida por células T. O papel das moléculas MHC como os antígenos que causam a rejeição do enxerto é uma consequência da natureza do reconhecimento de antígenos da célula T, como veremos mais adiante. Lembre que moléculas do MHC humanas são chamadas de antígenos leucocitários humanos (HLA), e no contexto do transplante humano, os termos MHC e HLA são usados alternadamente.
Moléculas alogênicas do MHC de um enxerto podem ser apresentadas para o reconhecimento pelas células T do receptor por duas vias fundamentalmente diferentes, chamadas direta e indireta (Fig. 16-4). Estudos iniciais mostraram que as células T do receptor de um enxerto reconhecem moléculas do MHC intactas e não processadas no enxerto, e isto é chamado de apresentação direta de aloantígenos. Estudos subsequentes mostraram que às vezes as células T receptoras reconhecem as moléculas do MHC do enxerto somente no contexto das moléculas do MHC do receptor, sugerindo que as moléculas do MHC do receptor devem estar apresentando proteínas alogênicas do MHC do enxerto para as células T receptoras. Este processo é chamado de apresentação indireta, e é essencialmente igual à apresentação de qualquer antígeno proteico estranho (p. ex., microbiano). Em um enxerto, não apenas as moléculas do MHC como também outros aloantígenos que são diferentes entre o doador e o receptor podem ser apresentados a células T hospedeiras pela via indireta. Discutiremos os mecanismos da apresentação direta e indireta separadamente.
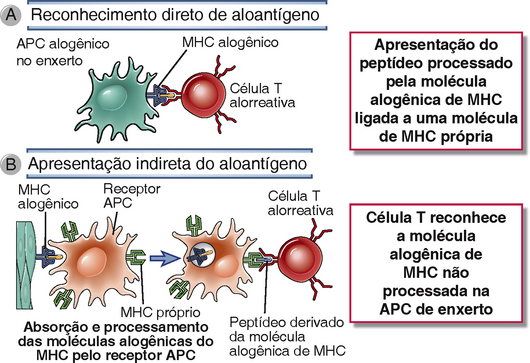
FIGURA 16-4 Reconhecimento direto e indireto de aloantígeno. A, Reconhecimento direto de aloantígeno ocorre quando as células T se ligam diretamente a uma molécula alogênica do MHC intacta em uma célula apresentadora de antígeno (APC) no enxerto (doador). B, O reconhecimento indireto de aloantígenos ocorre quando moléculas do MHC alogênicas das células do enxerto são capturadas e processadas por APC receptores e fragmentos de peptídeos das moléculas do MHC alogênicas contendo resíduos polimórficos de aminoácidos são ligados e apresentados por moléculas receptoras do MHC (próprias).
Apresentação Direta de Aloantígenos MHC
Na apresentação direta, uma molécula do MHC intacta é exposta por células apresentadoras de antígeno (APC) no enxerto e reconhecida por células T receptoras sem a necessidade de APC hospedeiros. Pode parecer intrigante que células T que são normalmente selecionadas durante sua maturação para serem restritas ao MHC próprio sejam capazes de reconhecer moléculas do MHC estranhas (alogênicas ou xenogênicas). Na realidade, conforme discutiremos mais detalhadamente mais adiante, a frequência de células T em um indivíduo normal que reconhecem uma única molécula alogênica do MHC é de 1% a 2% de todas as células T, o que é de 100 a 1.000 vezes maior do que a frequência de células T específicas para qualquer peptídeo microbiano exibido por moléculas do MHC próprias. Existem várias explicações prováveis para este reconhecimento surpreendentemente forte de moléculas do MHC estranhas.
• A estrutura de todos os receptores de célula T (TCR) é inerentemente tendenciosa para reconhecer moléculas do MHC, mesmo antes da seleção no timo. Em outras palavras, os genes do TCR evoluíram para codificar uma estrutura de proteína que tem alguma afinidade intrínseca, provavelmente baixa, pelas moléculas do MHC. Durante o desenvolvimento das células T no timo, a seleção positiva resulta na sobrevivência das células T com fraca reatividade ao MHC próprio, e entre estas células, pode haver muitas com forte reatividade a moléculas alogênicas do MHC. A seleção negativa no timo também elimina eficientemente as células T com alta afinidade pelo MHC próprio (Caps. 8 e 14), mas não elimina necessariamente as células T que se ligam fortemente a moléculas alogênicas do MHC, pelo simples fato de estas moléculas não estarem presentes no timo. O resultado é que o repertório maduro tem fraca afinidade intrínseca pelas moléculas do MHC próprias e inclui muitas células T que ligam moléculas do MHC alogênicas com alta afinidade.
• A estrutura de uma molécula do MHC alogênica é bastante similar ao MHC próprio para que muitas células T restritas ao MHC próprio reconheçam a molécula do MHC estranha. Em outras palavras, uma molécula do MHC alogênica com um peptídeo ligado pode imitar o determinante formado por uma molécula do MHC própria mais um peptídeo estranho específico (Fig. 16-5). O alorreconhecimento direto é um exemplo de uma reação imunológica cruzada na qual uma célula T que foi selecionada para ser restrita ao MHC próprio consegue reconhecer moléculas do MHC alogênicas estruturalmente similares. Uma única molécula alogênica do MHC pode ser semelhante a muitas combinações de MHC próprio mais peptídeos diferentes ligados devido às diferenças nos aminoácidos entre as moléculas do MHC alogênicas e próprias. Neste caso, células T múltiplas específicas para os vários complexos MHC próprio-peptídeo podem ter reações cruzadas com uma única molécula alogênica do MHC.
• Muitos peptídeos podem combinar com uma única molécula do MHC e expandir ainda mais o número de células T que podem reconhecer estas combinações. Moléculas do MHC que são expressas na superfície celular normalmente contêm peptídeos ligados, e os peptídeos formam parte da estrutura reconhecida pelas células T alorreativas, exatamente como a função dos peptídeos no reconhecimento normal de antígenos estranhos por células T próprias restritas do MHC (Fig. 16-5C). É provável que a maior parte destes peptídeos seja peptídeos próprios que são iguais no doador e no receptor, mas os peptídeos do doador são expostos por moléculas alogênicas do MHC e portanto parecem diferentes dos complexos peptídeo próprio-MHC próprio.
• Todas as moléculas MHC em um APC doador serão estranhas e serão reconhecidas por células T alorreativas; em contrapartida, no caso de uma infecção, menos de 1% (e talvez tão pouco quanto 0,1%) das moléculas do MHC em uma APC normalmente apresentam peptídeos microbianos em qualquer momento e são reconhecidas pelas células T.
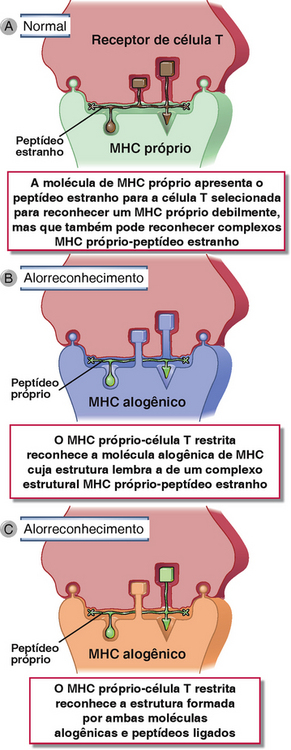
FIGURA 16-5 Base molecular do reconhecimento direto de moléculas alogênicas do MHC. O reconhecimento direto de moléculas alogênicas do MHC pode ser considerado como uma reação cruzada na qual uma célula T específica para um complexo molecular do MHC própria–peptídeo estranho (A) também reconhece uma molécula alogênica do MHC (B, C). Peptídeos doadores não polimórficos, rotulados “peptídeo próprio”, podem contribuir para o alorreconhecimento (C) ou não (B).
O alorreconhecimento direto pode gerar células T CD4+ e CD8+ que reconhecem antígenos do enxerto e contribuem para a rejeição. Este aspecto da resposta da célula T alorreativa é descrito mais adiante.
Apresentação Indireta de Aloantígenos
Nesta via indireta, moléculas do MHC do doador (alogênicas) são capturadas e processadas por APC receptoras que entram nos enxertos, e peptídeos derivados das moléculas alogênicas do MHC são apresentados em associação com moléculas do MHC próprias (Fig. 16-4). Assim, peptídeos das moléculas alogênicas do MHC são expostos por APCs dos hospedeiros e reconhecidos por células T como antígenos proteicos estranhos convencionais. Como as moléculas alogênicas do MHC têm sequências de aminoácidos diferentes daquelas do hospedeiro, elas podem gerar peptídeos estranhos associados a moléculas do MHC próprias na superfície das APC dos hospedeiros. Na verdade, as moléculas do MHC são as proteínas mais polimórficas do genoma; portanto, cada molécula do MHC alogênica pode gerar múltiplos peptídeos estranhos, cada um sendo reconhecido por células T diferentes. A apresentação indireta pode resultar no alorreconhecimento por células T CD4+ porque o aloantígeno é adquirido pelas APC do hospedeiro principalmente pela via endossômica vesicular (ou seja, em consequência da fagocitose) e é, portanto, apresentado por moléculas do MHC de classe II. Alguns antígenos de células de enxerto fagocitadas parecem entrar na rota de apresentação de antígenos MHC classe I e são indiretamente reconhecidos por células T CD8+. Este fenômeno é um exemplo de apresentação cruzada ou cross-priming (Cap. 6, Fig. 6-20), onde células dendríticas ingerem antígenos de outra célula, do enxerto, e apresentam estes antígenos em moléculas MHC de classe I para ativar ou “gerar” linfócitos T CD8+.
Evidências de que a apresentação indireta de moléculas do MHC alogênicas desempenha função significante na rejeição de enxertos foram obtidas de estudos com camundongos knockout que não possuíam expressão do MHC de classe II. Por exemplo, enxertos de pele de camundongos doadores sem MHC de classe II são capazes de induzir respostas de célula T CD4+ (i. e., restritas à classe II) aos aloantígenos do doador, incluindo peptídeos derivados de moléculas MHC de classe I do doador. Nestes experimentos, as moléculas MHC de classe I do doador são processadas e apresentadas por moléculas classe II nas APC do receptor e estimulam as células T auxiliares (helper) do receptor. Foram obtidas evidências de que a apresentação indireta de antígenos pode contribuir para a rejeição tardia de aloenxertos. Por exemplo, células T CD4+ de receptores de aloenxertos de coração e fígado reconhecem e são ativadas por peptídeos derivados do MHC do doador quando apresentadas por APCs do próprio paciente.
No ambiente de qualquer transplante entre doador e receptor geneticamente não idênticos, haverá antígenos polimórficos além das moléculas MHC contra as quais o receptor pode criar uma resposta imunológica. Esses antígenos induzem reações de rejeição fracas ou mais lentas (mais graduais) do que as moléculas do MHC e são chamados de antígenos de histocompatibilidade secundários. A maioria dos antígenos de histocompatibilidade secundários é proteínas processadas e apresentadas a células T do hospedeiro em associação com moléculas do MHC próprias nas APC do hospedeiro (ou seja, pela via indireta). A relevância dos antígenos de histocompatibilidade secundários em transplantes clínicos de órgãos sólidos é incerta, principalmente pelo pouco sucesso na identificação dos antígenos relevantes. O antígeno masculino H-Y parece ser um alvo do reconhecimento imunológico por fêmeas receptoras de órgãos de doadores masculinos, e isso se correlaciona com um aumentou muito pequeno no risco de rejeição comparado a transplantes do mesmo sexo. Anticorpos específicos para alelos doadores MIC-A da molécula MHC de classe I são detectáveis em alguns receptores de aloenxertos renais, e a presença dos anticorpos está correlacionada com a sobrevivência reduzida do enxerto. Isso levou à especulação de que estas proteínas também são antígenos de histocompatibilidade secundários relevantes para a rejeição do enxerto. Antígenos de histocompatibilidade secundários têm uma função mais significativa na estimulação de respostas enxerto versus hospedeiro depois de transplante de células tronco hematopoiéticas, discutidos mias adiante, mas a natureza dos antígenos relevantes neste cenário também não foi definida.
Ativação de Linfócitos Alorreativos
Aloenxertos estimulam respostas de células T e B que são semelhantes às respostas imunes a antígenos proteicos convencionais, porém também têm algumas características especiais. Discutimos aqui aspectos comuns e singulares das respostas imunes aos aloantígenos.
Reconhecimento de Aloantígenos por Células T
A resposta da célula T a um enxerto de órgão pode ser iniciada nos linfonodos que drenam o enxerto (Fig. 16-6). A maior parte dos órgãos contém APC residentes, tais como células dendríticas. O transplante desses órgãos para um receptor alogênico fornece APCs que expressam moléculas do MHC do doador, assim como coestimuladores. Acredita-se que estas APC doadoras migram para linfonodos regionais e apresentam, em sua superfície, moléculas alogênicas do MHC não processadas para as células T do receptor (a via direta do alorreconhecimento). Células dendríticas hospedeiras do receptor também podem migrar para dentro do enxerto, coletando aloantígenos do enxerto, e transportando-os de volta para os linfonodos de drenagem, onde eles são expostos (a via indireta). Linfócitos virgens (naïve) que normalmente trafegam através do linfonodo encontram esses aloantígenos e são induzidos a proliferar e a se diferenciar em células efetoras. Esse processo é às vezes chamado de sensibilização a aloantígenos. Células T efetoras migram de volta para dentro do enxerto e mediam a rejeição.
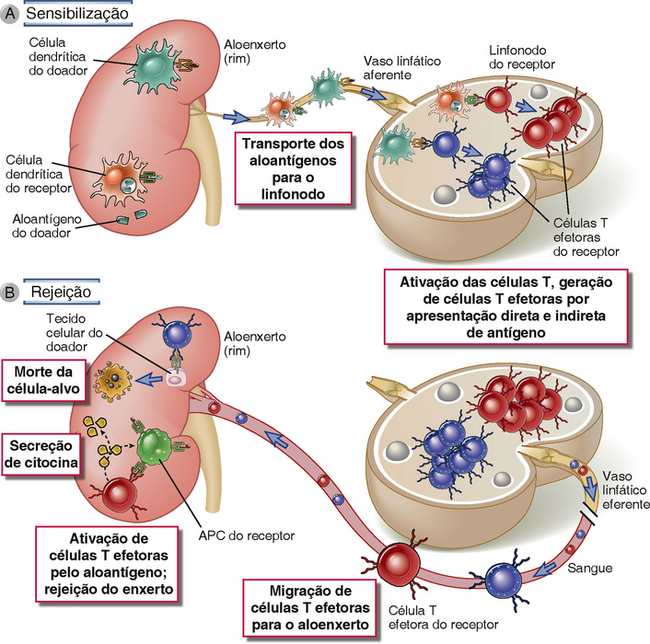
FIGURA 16-6 Ativação de células T alorreativas. A, No caso do alorreconhecimento direto, células dendríticas doadoras no aloenxerto migram para os tecidos linfoides secundários, onde apresentam moléculas alogênicas de MHC a células T hospedeiras. B, No caso do alorreconhecimento direto, células dendríticas receptoras que entraram no aloenxerto transportam proteínas MHC do doador para tecidos linfoides secundários e apresentam peptídeos derivados destas proteínas MHC para células T hospedeiras alorreativas. Nos dois casos, as células T ficam ativadas e se diferenciam como células efetoras. As células T efetoras alorreativas migram para dentro do aloenxerto, tornam-se reativadas pelo aloantígeno, e mediam os danos. A drenagem linfática de órgãos enxertados não é bem descrita, e portanto a localização dos linfonodos relevantes é incerta.
Até 1% a 2% das células T de um indivíduo são capazes de reconhecer e responder a uma única molécula do MHC estranha, e esta alta frequência de células T reativas com moléculas alogênicas do MHC é uma razão para os aloenxertos desencadearem fortes respostas imunológicas. Lembre que a frequência de células T reativa com qualquer antígeno estranho (p. ex., microbiano) é de apenas 1 em 105 ou 106. Os motivos prováveis para que cada molécula alogênica do MHC seja diretamente reconhecida por tantas TCR diferentes foram discutidos anteriormente.
Muitas das células T que respondem a uma molécula alogênica do MHC, mesmo na primeira exposição, são células T de memória. É provável que estas células de memória tenham sido geradas durante uma exposição anterior a outros antígenos estranhos (p. ex., microbiano) e tenham reação cruzada com moléculas alogênicas do MHC. Estas células de memória não são apenas populações expandidas de células antígeno-específicas, mas também de respondedores mais rápidos e potentes do que os linfócitos virgens, e contribuem desta maneira para a força da resposta das células T alorreativas. Acredita-se também que células de memória são mais resistentes à imunossupressão do que os linfócitos virgens, e a presença de grandes números de células de memória pode levar a resultados ruins em transplantes.
Função da Coestimulação em Respostas de Células T a Aloantígenos
Além do reconhecimento de aloantígenos, a coestimulação de células T primariamente por moléculas B7 nas APC é importante para a ativação de células T alorreativas. A rejeição de aloenxertos e a estimulação de células T alorreativas em uma cultura mista de linfócitos (descrita mais tarde) pode ser inibida por agentes que bloqueiam as moléculas B7. Os aloenxertos sobrevivem por períodos mais longos quando são transplantados em camundongos geneticamente deficientes que não possuem B7-1 (CD80) e B7-2 (CD86), em comparação com transplantes para receptores normais. Como discutiremos mais adiante, o bloqueio da coestimulação de B7 é um a estratégia terapêutica para inibir a rejeição do enxerto também em humanos. Há evidências experimentais, em grande parte de roedores, que diversas outras rotas coestimulatórias de célula T, incluindo o ligante ICOS/ICOS e o ligante Ox40/Ox40, que contribuem para a rejeição aguda de aloenxertos, mas a relevância destas rotas para transplantes humanos ainda não foi examinada.
A necessidade de coestimulação leva à seguinte questão interessante: por que estes coestimuladores são expressos por APC de enxerto na ausência de infecção, que já discutimos anteriormente como o estímulo fisiológico para a expressão de coestimuladores (Cap. 9). Uma possibilidade é que o processo de transplante de órgão é associado ao dano isquêmico e à morte de algumas células no enxerto, durante o tempo em que o órgão é removido do doador e antes que seja cirurgicamente conectado ao sistema circulatório do receptor. Várias moléculas expressas por ou liberadas de células isquemicamente danificadas (chamadas de padrões moleculares associados a danos) estimulam respostas imunológicas naturais que resultam na expressão aumentada de coestimuladores nas APC (Cap. 4). De fato, a experiência clínica é que o tempo de isquemia de um órgão é um determinador da frequência e gravidade da rejeição aguda, e uma razão para isso pode ser que a morte isquêmica das células do enxerto estimule subsequentes respostas imunológicas ao enxerto.
A Cultura Mista de Linfócitos (MLR)
A resposta de células T alorreativas a moléculas do MHC estranhas pode ser analisada em uma reação in vitro chamada de cultura mista de linfócitos (MLR). O MLR é usado como um teste preditivo de rejeição do enxerto mediado por célula T. Estudos do MLR estavam entre os primeiros a estabelecer o papel de moléculas MHC de classe I e classe II na ativação de diferentes populações de células T (CD8+ e CD4+, respectivamente).
A MLR é induzida pelo cultivo de leucócitos mononucleares (que incluem células T, células B, células NK, fagócitos mononucleares e células dendríticas) de um indivíduo com leucócitos mononucleares derivados de outro indivíduo. Na prática clínica, essas células são tipicamente isoladas do sangue periférico; em experimentos com camundongos ou ratos, leucócitos mononucleares são geralmente purificados do baço ou dos linfonodos. Se os dois indivíduos apresentam diferenças nos alelos dos genes do MHC, uma grande proporção das células mononucleares irá proliferar durante um período de 4 a 7 dias. Esta resposta proliferativa é chamada de MLR alogênica (Fig. 16-7). Se células de dois indivíduos com MHC díspares são misturadas, cada uma pode reagir contra a outra e ambas vão proliferar, resultando em um MLR de duas vias. Para simplificar a análise, uma das duas populações de leucócitos pode tornar-se incapaz de proliferar antes da cultura, seja por irradiação γ ou por tratamento com o fármaco antimitótico mitomicina C. Nesta MLR de mão única, as células tratadas servem exclusivamente como estimuladoras, e as células não tratadas, ainda capazes de proliferar, servem como células de resposta. Entre as células T que respondem em uma MLR, as células CD4+ são específicas para moléculas MHC alogênicas de classe II e as células CD8+ para moléculas de classe I.
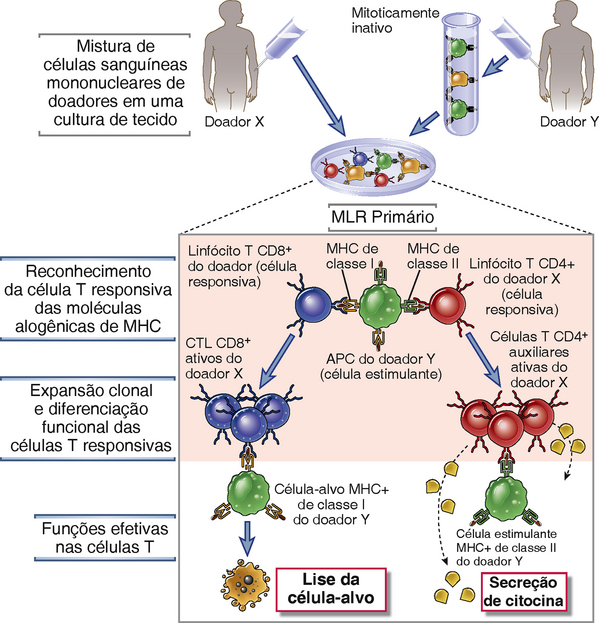
FIGURA 16-7 A cultura mista de linfócitos (MLR). Em uma MLR primária de uma via, células estimuladoras (do doador Y) ativam e causam a expansão de dois tipos de células T respondedoras (do doador X). Células T CD4+ do doador X reagem com as moléculas classe II do doador Y, e linfócitos T CD8+ do doador X reagem com as moléculas do MHC classe I do doador Y. As células T CD4+ se diferenciam em células T auxiliares secretoras de citocina, e as células T CD8+ se diferenciam em CTL. APC, célula apresentadora de antígenos.
Devido à alta frequência de células T alorreativas, as respostas primárias contra aloantígenos são as únicas respostas de células T virgens que podem ser rapidamente detectadas in vitro. As respostas das células T a um antígeno proteico in vitro podem ser detectadas somente se as células T forem de um indivíduo que tivesse sido previamente exposto àquele antígeno (p. ex., por vacinação), porque há pouquíssimas células T virgens antígeno-específicas para gerar uma resposta detectável. Em contrapartida, células T virgens vão proliferar vigorosamente quando cultivadas com células mononucleares de outro indivíduo em uma MLR.
Funções Efetoras de Células T Alorreativas
Células T alorreativas CD4+ e CD8+ que são ativadas por aloantígenos de enxerto causam rejeição por mecanismos distintos. As células T auxiliares CD4+ se diferenciam em células efetoras produtoras de citocina que danificam enxertos por meio de inflamação mediada por citocina, semelhante à reação de hipersensibilidade do tipo tardia (DTH) (Caps. 10 e 18). Células T CD8+ alorreativas se diferenciam em linfócitos T citotóxicos (CTL), que matam células nucleadas no enxerto, que expressam as moléculas MHC alogênicas de classe I As CTL também secretam citocinas inflamatórias, que podem contribuir para danificar o enxerto.
Somente CTL que são geradas por reconhecimento direto de MHC alogênico podem matar células de enxerto, enquanto as CTL ou células T auxiliares geradas por reconhecimento alogênico direto ou indireto podem causar danos mediados por citocina aos enxertos. CDL CD8+ que são geradas por alorreconhecimento direto reconhecem aloantígenos de enxerto e podem, então, matar células de enxerto que expressam estes mesmos aloantígenos. Em contrapartida, quaisquer CTL CD8+ que são geradas pela via indireta são restritas a MHC próprios, e não serão capazes de matar as células de enxerto estranhas porque estas células não expressam alelos MHC próprios mostrando peptídeos alogênicos. Portanto, quando células T autorreativas são estimuladas pela via indireta, o principal mecanismo de rejeição não é a morte de células de enxerto mediada por CTL, mas por inflamação causada pelas citocinas produzidas por células T CD8+ ou CD4+ efetoras. Presumivelmente, estas células efetoras se infiltram no enxerto e reconhecem os aloantígenos do enxerto sendo expostos pelas APC hospedeiras que também entraram no enxerto. A importância relativa das vias direta e indireta na rejeição do enxerto ainda não foi estabelecida em definitivo. Pode ser que as CTL CD8+ induzidos pelo reconhecimento direto de aloantígenos sejam mais importantes na rejeição celular aguda dos aloenxertos, onde as células do enxerto são um componente proeminente, enquanto células T CD4+ efetoras estimuladas pela via indireta desempenham um papel mais importante na rejeição crônica. Essas diferenças podem ter significância clínica porque a terapia imunossupressora convencional para rejeição do enxerto parece suprimir preferencialmente respostas CTL CD8+ induzidas por alorreconhecimento direto e é menos eficaz contra células T CD4+ ativadas pela via indireta.
Ativação de Células B Alorreativas e Produção de Aloanticorpos
A maioria dos aloanticorpos de alta afinidade é produzida por ativação de célula T auxiliar dependente de células B alorreativas, como anticorpos contra outros antígenos proteicos (Cap. 11). Os antígenos reconhecidos mais frequentemente pelos aloanticorpos na rejeição do enxerto são moléculas HLA doadoras, incluindo proteínas MHC de classe I e classe II. A sequência provável de eventos levando à geração destas células produtoras de aloanticorpos é que os linfócitos B virgens reconhecem moléculas do MHC estranhas, internalizam e processam estas proteínas, e apresentam peptídeos delas derivados às células T auxiliares que foram previamente ativadas pelos mesmos peptídeos apresentados por células dendríticas Assim, a ativação de células B alorreativas é um exemplo de apresentação indireta de aloantígenos. Anticorpos anti-HLA contribuem significantemente para a rejeição do aloenxerto, como discutiremos a seguir.
PADRÕES E MECANISMOS DE REJEIÇÃO DE ALOENXERTO
Até agora, descrevemos as bases moleculares do reconhecimento de antígenos e as células envolvidas no reconhecimento e respostas a aloenxertos. Consideraremos agora os mecanismos efetores responsáveis pela rejeição de aloenxertos pelo sistema imunológico. Em diferentes modelos experimentais e no transplante clínico, demonstrou-se que células T CD4+ e CD8+ alorreativas e aloanticorpos são capazes de mediar a rejeição de aloenxertos. Estes efetores imunológicos diferentes causam rejeição ao enxerto por diferentes mecanismos (Fig. 16-8), e todos os três efetores podem contribuir simultaneamente para a rejeição.
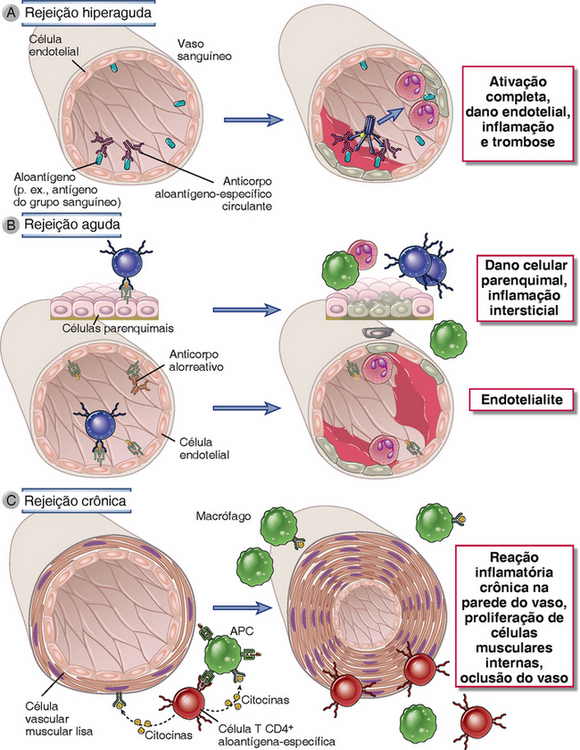
FIGURA 16-8 Mecanismos imunológicos de rejeição do enxerto. A, Na rejeição hiperaguda, anticorpos pré-formados reativos com endotélio vascular ativam o complemento e desencadeiam trombose intravascular rápida e necrose da parede do vaso. B, Na rejeição aguda, linfócitos T CD8+ reativos com aloantígenos em células endoteliais e células parênquimas mediam os danos a estes tipos de células. Anticorpos alorreativos formados depois do enxerto também podem contribuir para lesões vasculares. C, Na rejeição crônica com arteriosclerose do enxerto, lesões à parede do vaso levam à proliferação de células musculares lisas e oclusão luminal. Essa lesão pode ser causada por uma reação crônica de DTH aos aloantígenos na parede do vaso.
Por razões históricas, a rejeição de enxertos é classificada com base nas características histopatológicas ou no curso temporal da rejeição após o transplante, e não nos mecanismos imunológicos efetores. Com base na experiência com transplantes renais, os padrões histopatológicos são chamados de hiperagudos, agudos ou crônicos (Fig. 16-8). Esses padrões são associados a diferentes mecanismos imunológicos efetores dominantes.
Rejeição Hiperaguda
A rejeição hiperaguda se caracteriza pela oclusão trombótica da vasculatura do enxerto que se inicia minutos ou horas após a anastomose entre os vasos sanguíneos do hospedeiro e do enxerto, e é mediada por anticorpos preexistentes na circulação do hospedeiro que se ligam aos antígenos endoteliais do doador (Fig. 16-8A). A ligação de anticorpos ao endotélio ativa o complemento, e anticorpos e produtos do complemento juntos induzem diversas alterações no endotélio do enxerto que promovem a trombose intravascular. A ativação do complemento leva à lesão celular endotelial e à exposição de proteínas da membrana basal subendotelial que ativam as plaquetas. As células endoteliais são estimuladas a secretar formas de alto peso molecular do fator de von Willebrand que causam a adesão e a agregação plaquetárias. Tanto as células endoteliais quanto as plaquetas sofrem vesiculação da membrana, levando à secreção de partículas lipídicas que promovem a coagulação. As células endoteliais perdem os proteoglicanos de sulfato de heparana da superfície celular que normalmente interagem com a antitrombina III para inibir a coagulação. Esses processos contribuem para trombose e oclusão vascular (Fig. 16-9A), e o órgão enxertado sofre lesão isquêmica irreversível.
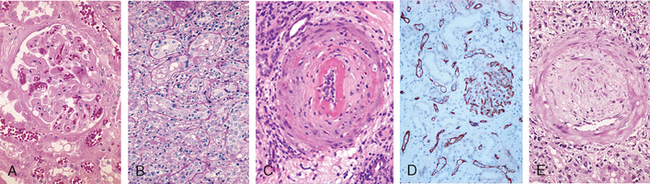
FIGURA 16-9 Histopatologia de diferentes formas de rejeição do enxerto. A, Rejeição hiperaguda de um aloenxerto renal com dano endotelial, dano a plaquetas, trombose de trombina, e infiltração inicial em um glomérulo. B, Rejeição aguda de um rim com células inflamatórias no tecido conectivo ao redor dos túbulos e entre células epiteliais dos túbulos. C, Rejeição aguda mediada por anticorpos de um aloenxerto renal com reação inflamatória destrutiva destruindo a camada endotelial de uma artéria. D, Deposição de complemento C4d em vasos na rejeição aguda mediada por anticorpos. E, Rejeição crônica em um aloenxerto renal com arteriosclerose do enxerto. O lúmen vascular é substituído por um acúmulo de células musculares lisas e tecido conectivo na íntima do vaso.
(Cortesia de Dr. Helmut Rennke, Department of Pathology, Brigham and Women’s Hospital and Harvard Medical School, Boston, Massachusetts.)
Nos primeiros dias após o transplante, a rejeição hiperaguda é frequentemente mediada por aloanticorpos IgM preexistentes, que estão presentes em altas titulações antes do transplante. Acredita-se que tais “anticorpos naturais” surjam em resposta a antígenos de carboidratos expressos por bactérias que normalmente colonizam o intestino. Os melhores exemplos conhecidos de tais aloanticorpos são aqueles dirigidos contra os antígenos dos grupos sanguíneos ABO expressos pelas hemácias, discutidos mais adiante. Antígenos ABO também são expressos em células endoteliais vasculares. Atualmente, a rejeição hiperaguda por anticorpos anti-ABO é muito rara porque todos os doadores e receptores são selecionados para que tenham o mesmo tipo ABO. Conforme discutiremos mais adiante neste capítulo, a rejeição hiperaguda causada por anticorpos naturais é a maior barreira ao xenotransplante e limita o uso de órgãos animais para o transplante humano.
Atualmente, a rejeição hiperaguda de aloenxertos, quando ocorre, é em geral mediada por anticorpos IgG dirigidos contra aloantígenos proteicos, tais como moléculas do MHC do doador, ou contra aloantígenos menos bem definidos, expressos nas células endoteliais vasculares. Tais anticorpos geralmente surgem como resultado de uma exposição prévia a aloantígenos mediante transfusão sanguínea, transplante prévio ou gestações múltiplas. Se a titulação desses anticorpos alorreativos for baixa, a rejeição hiperaguda pode se desenvolver lentamente, durante vários dias. Neste caso, a rejeição é às vezes chamada de rejeição acelerada do aloenxerto, porque o início é ainda mais precoce do que o normal para a rejeição aguda. Conforme discutiremos mais adiante no capítulo, pacientes que necessitam de aloenxertos são rotineiramente avaliados antes do enxerto em busca da presença de anticorpos que se liguem a células de um potencial doador de órgão para evitar a rejeição hiperaguda.
Em casos raros, nos quais os enxertos têm de ser feitos em receptores com ABO incompatível, a sobrevida pode ser melhorada pelo esgotamento rigoroso de anticorpos e células B. Às vezes, se o enxerto não for rejeitado rapidamente, ele sobrevive mesmo na presença de um anticorpo antienxerto. Um mecanismo possível desta resistência à rejeição hiperaguda é a expressão aumentada de proteínas regulatórias complementares nas células endoteliais do enxerto, uma adaptação benéfica do tecido que é chamada de acomodação.
Rejeição Aguda
A rejeição aguda é um processo de lesão do parênquima do enxerto e dos vasos sanguíneos mediada por células T alorreativas e anticorpos. Antes da imunossupressão moderna, a rejeição aguda frequentemente começava de vários dias a algumas semanas após o transplante. O tempo retardado do início da rejeição aguda é porque células T efetoras alorreativas e anticorpos levam tempo para ser gerados a partir de células T virgens ou de memória em repouso em resposta ao enxerto. Na prática clínica atual, episódios de rejeição aguda podem ocorrer muito mais tarde, até mesmo anos após o transplante, se a imunossupressão for reduzida por qualquer razão. Embora os padrões de rejeição aguda sejam divididos em celular, mediados por células T, e humoral, mediados por anticorpos, ambos geralmente coexistem em um órgão que rejeita agudamente.
Rejeição Celular Aguda
O principal mecanismo da rejeição celular aguda é a morte de células do enxerto mediada por CTL (Fig. 16-8B). Em um exame histológico, este tipo de rejeição é caracterizado por infiltrados de linfócitos, que invadem e destroem componentes do enxerto (Fig. 16-9B). Há muitas linhas de evidência que suportam o papel das CTL na rejeição celular aguda. Os infiltrados celulares presentes em enxertos que passam por este tipo de rejeição são marcadamente ricos em CTL CD8+ específicas para aloantígenos do enxerto. Na verdade, a presença de mRNA codificando genes CTL-específicos (p. ex., perforina e granzima B) é às vezes usada como um indicador específico e sensível de rejeição clínica aguda. Experimentalmente, CTL CD8+ alorreativas podem ser usadas para transferir a rejeição celular aguda do enxerto adotivamente. A destruição de células alogênicas em um enxerto é altamente específica, uma marca característica da destruição por CTL. As melhores evidências dessa especificidade vieram de experimentos de enxertos cutâneos em camundongos que usaram enxertos quiméricos contendo duas populações celulares distintas, uma singênica ao hospedeiro e outra alogênica. Quando esses enxertos cutâneos são transplantados, as células alogênicas são destruídas sem lesão para as células singênicas vizinhas.
Além da morte direta das células do enxerto por CTL, células T CD4+ auxiliares ativadas e CTL produzem citocinas que recrutam e ativam células inflamatórias, que também lesam o enxerto.
Em enxertos vascularizados, tais como os renais, as células endoteliais são os principais alvos da rejeição aguda. A endotelite endovascular é um achado precoce frequente em enxertos passando por episódios de rejeição aguda. A endotelite ou arterite da íntima em artérias de médio calibre também ocorre em um estágio precoce da rejeição aguda e indica rejeição grave, que, se não tratada, provavelmente resultará em falência aguda do enxerto. Tanto as células T CD8+ como as CD4+ podem contribuir para lesão endotelial.
Rejeição Aguda Mediada por Anticorpos
Aloanticorpos causam rejeição aguda ao se ligar a aloantígenos, principalmente moléculas HLA, em células endoteliais vasculares, causando lesão endotelial e trombose intravascular que resulta na destruição do enxerto (Fig. 16-8B). A ligação dos aloanticorpos à superfície da célula endotelial dispara a ativação do complemento local, que leva à lise das células, recrutamento e ativação de neutrófilos, e formação de trombos. Além disso, a ligação de aloanticorpos à superfície epitelial pode alterar diretamente a função endotelial pela indução de sinais intracelulares que aumentam a expressão de moléculas pró-inflamatórias e pró-coagulantes na superfície.
O padrão histológico dessa forma de rejeição aguda é uma necrose transmural da parede dos vasos do enxerto com inflamação aguda (Fig. 16-9C), que é diferente da oclusão trombótica sem necrose da parede dos vasos vista na rejeição hiperaguda. A identificação imuno-histoquímica do fragmento C4d do complemento nos capilares dos aloenxertos renais é usada clinicamente como um indicador da ativação da via clássica do complemento e rejeição humoral (Fig. 16-9D). Em uma fração significante de casos de rejeição mediada por anticorpos, não há deposição detectável de C4d, sugerindo que o dano é causado pelos efeitos independentes do complemento da ligação dos aloanticorpos às células endoteliais, mencionado anteriormente.
Vasculopatia de Enxerto e Rejeição Crônica
Como a terapia para a rejeição aguda melhorou, a principal causa de falha dos aloenxertos de órgãos vascularizados tem sido a rejeição crônica. Desde 1990, a sobrevida de aloenxertos renais de 1 ano tem sido maior que 90%, mas a sobrevida de 10 anos permanece em aproximadamente 60% apesar dos avanços na terapia imunossupressora. A rejeição crônica se desenvolve insidiosamente durante meses ou anos e pode ou não ser precedida por episódios de rejeição aguda. A rejeição crônica de diferentes órgãos transplantados está associada a alterações patológicas distintas. No rim e no coração, a rejeição crônica resulta na oclusão vascular e na fibrose intersticial. Transplantes de pulmão que passam por rejeição crônica apresentam vias aéreas pequenas espessadas (bronquiolite obliterante), e transplantes de fígado exibem dutos biliares fibróticos e não funcionais (chamada síndrome do desaparecimento dos dutos biliares).
Uma lesão dominante da rejeição crônica em enxertos vascularizados é a oclusão arterial como consequência da proliferação de células musculares lisas da íntima, e os enxertos falham no fim, principalmente devido ao dano isquêmico resultante (Fig. 16-8C). As alterações arteriais são chamadas vasculopatia de enxerto ou arteriosclerose acelerada de enxerto (Fig. 16-9E). A vasculopatia de enxerto é vista frequentemente em aloenxertos cardíacos e renais fracassados e pode se desenvolver em qualquer transplante de órgão vascularizado dentro de 6 meses a 1 ano depois do transplante. A patogênese das lesões ainda é pouco compreendida, mas é provável que envolva uma combinação de processos imunológicos e não imunológicos. Os mecanismos subjacentes prováveis das lesões vasculares oclusivas são: ativação de células T alorreativas e secreção de citocinas que estimula a proliferação de células vasculares endoteliais e células musculares lisas; reparo com fibrose depois de ataques repetidos de rejeição aguda celular ou mediada por anticorpos; e consequência de isquemia perioperativa, efeitos tóxicos de fármacos imunossupressores, e até mesmo infecções virais crônicas. À medida que as lesões arteriais de arteriosclerose do enxerto progridem, o fluxo sanguíneo para o parênquima renal é comprometido, e o parênquima é lentamente substituído por tecido fibroso não funcional. Esse processo leva à falência cardíaca congestiva ou a arritmias em pacientes de transplante cardíaco ou à perda de função nos glomérulos e falência isquêmica renal em pacientes de transplante renal.
PREVENÇÃO E TRATAMENTO DA REJEIÇÃO DE ALOENXERTOS
Se o receptor de um aloenxerto apresenta um sistema imunológico plenamente funcionante, o transplante resulta, quase invariavelmente, em alguma forma de rejeição. As estratégias usadas na prática clínica e em modelos experimentais para evitar ou retardar a rejeição são a imunossupressão geral e a minimização da força da reação alogênica específica. Um objetivo importante na pesquisa do transplante é encontrar maneiras de induzir a tolerância específica para o doador, que permitiria que os enxertos sobrevivessem sem a imunossupressão inespecífica.
Imunossupressão para Prevenir ou Tratar a Rejeição de Aloenxertos
Fármacos imunossupressores que inibem ou destroem os linfócitos T são os principais agentes para tratar ou prevenir a rejeição de enxertos. Diversos métodos de imunossupressão são comumente usados (Fig. 16-10).
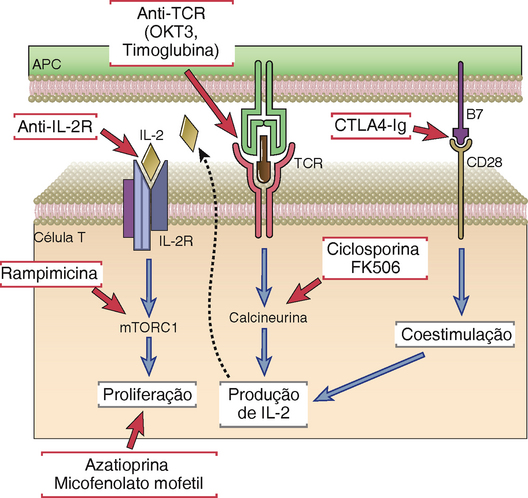
FIGURA 16-10 Mecanismos de ação de fármacos imunossupressores. Cada categoria principal de fármacos usados para prevenir ou tratar a rejeição do aloenxerto é mostrada juntamente com os alvos moleculares dos fármacos.
Inibidores de Vias Sinalizadoras de Células T
Os inibidores de calcineurina ciclosporina e FK506 (tacrolimus) inibem a transcrição de certos genes em células T, em especial aquelas que codificam citocinas como a IL-2. A ciclosporina é um peptídeo fúngico que se liga com alta afinidade a uma proteína celular ubíqua chamada ciclofilina. O complexo de ciclosporina e ciclofilina se liga e inibe a atividade enzimática da fosfatase calcineurina serina/treonina ativada por cálcio/calmodulina (Cap. 7). Como a calcineurina é necessária para ativar a transcrição do fator NFAT (fator nuclear de células T ativadas), a ciclosporina inibe a ativação do NFAT e a transcrição de IL-2 e outros genes de citocinas. O resultado final é que a ciclosporina bloqueia a proliferação e diferenciação de células T dependente de IL-2. FK506 é um macrólido lactona feito por uma bactéria que funciona como a ciclosporina. O FK-506 e sua proteína ligante (chamada de FKBP) compartilham com o complexo ciclosporina-ciclofilina a habilidade de ligar a calcineurina e inibir sua atividade.
A introdução da ciclosporina na prática clínica introduziu a era moderna dos transplantes. Antes do uso da ciclosporina, a maioria dos corações e fígados transplantados era rejeitada. Agora, em consequência do uso da ciclosporina, do FK506, e de outros fármacos introduzidos mais recentemente, a maioria destes aloenxertos tem sobrevida de mais de 5 anos (Fig. 16-11). Apesar disto, estes fármacos têm limitações. Por exemplo, em doses necessárias para a imunossupressão ideal a ciclosporina causa lesões renais, e alguns episódios de rejeição são refratários ao tratamento com ciclosporina. O FK506 foi inicialmente usado para receptores de transplantes de fígado, mas agora é usado amplamente para a imunossupressão de receptores de enxertos de fígado, inclusive aqueles que não são adequadamente controlados pela ciclosporina. O FK506 também é usado topicamente para algumas doenças inflamatórias da pele.
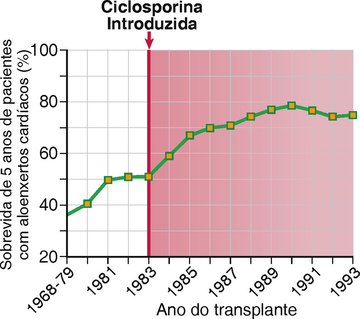
FIGURA 16-11 Influência da ciclosporina na sobrevida do enxerto. Taxas de sobrevida de 5 anos para pacientes recebendo aloenxertos cardíacos aumentaram significativamente, começando quando a ciclosporina foi introduzida em 1983.
(Dados de Transplant Patient DataSource, United Network for Organ Sharing, Richmond, Virginia. Disponível em: http://207.239.150.13/tpd/. Acessado em 16 de fevereiro de 2000.)
O fármaco imunossupressor rapamicina (sirolimus) inibe a proliferação de células T mediada pelo fator de crescimento. Como o FK506, a rapamicina se liga ao FKBP, mas o complexo rapamicina-FKBP não inibe a calcineurina. Em vez disso, este complexo se liga a e inibe uma enzima celular chamada de alvo mamífero do complexo rapamicina 1 (mTORC1), que é uma proteína cinase serina/treonina necessária para a translação de proteínas que promovem a sobrevivência e proliferação das células. O mTORC1 é regulado negativamente por um complexo proteico chamado complexo esclerose tuberosa 1 (TSC1)-complexo TSC2. A sinalização de fosfotidinositol 3-cinase (PI3K)–Akt resulta na fosforilação de TSC2 e na liberação de regulação de mTOR. Várias vias de sinalização de receptores do fator de crescimento, incluindo a rota receptora de IL-2 em células T, ativam mTOR através de PI3K-Akt, levando à translação de proteínas necessárias para a progressão do ciclo celular. Assim, pela inibição da função mTORC1, a rapamicina bloqueia a proliferação de célula T conduzida por IL-2. Combinações de ciclosporina (que bloqueia a síntese de IL-2) e rapamicina (que bloqueia a proliferação conduzida por IL-2) são inibidores potentes de respostas de célula T. Curiosamente, a rapamicina inibe a geração de células T efetoras, mas não prejudica tanto a sobrevivência e funções de células T reguladoras, o que pode promover a imunossupressão da rejeição de enxertos. O mTORC1 está envolvido em funções da célula dendrítica, e portanto a rapamicina pode suprimir respostas da célula T interferindo também na função de células dendríticas. O mTORC1 também está envolvido na proliferação de células B e nas respostas de anticorpos, e por conseguinte a rapamicina também pode ser eficaz na prevenção ou no tratamento de rejeição mediada por anticorpos. Além da rapamicina, outros inibidores mTOR foram desenvolvidos para a imunossupressão de receptores de aloenxertos e para a terapia do câncer.
Outras moléculas envolvidas na sinalização de citocina e de receptores de célula T também são alvos de fármacos imunossupressores que estão passando por testes iniciais para o tratamento ou prevenção de rejeição de aloenxertos. Estas moléculas alvo incluem a JAK3, um cinase ligada à sinalização de vários receptores de citocina, incluindo IL-2, e proteína cinase C, uma cinase essencial na sinalização de receptor de célula T.
Antimetabólitos
Toxinas metabólicas que destroem as células T em proliferação são usadas em combinação com outros fármacos para tratar a rejeição de enxertos. Estes agentes inibem a proliferação de linfócitos de precursores durante sua maturação e também podem matar células T maduras que foram estimuladas por aloantígenos. O primeiro desses fármacos a ser desenvolvido para a prevenção e o tratamento da rejeição foi a azatioprina. O fármaco ainda é utilizado, mas é tóxico para os precursores de leucócitos na medula óssea e nos enterócitos no intestino. O fármaco mais novo e mais amplamente usado nesta classe é o micofenolato mofetil (MMF). O MMF é metabolizado em ácido micofenólico, que bloqueia uma isoforma específica para linfócitos da inosinamonofosfato desidroxigenase, uma enzima necessária para a síntese de novo de nucleotídeos de guanina. Como a seletividade do MMF inibe a isoforma específica para linfócitos desta enzima, ela apresenta relativamente poucos efeitos tóxicos em outras células. O MMF é agora utilizado rotineiramente em combinação com a ciclosporina ou com o FK506, para prevenir a rejeição aguda de aloenxertos.
Bloqueio de Função ou Esgotamento de Anticorpos Antilinfocíticos
Anticorpos que reagem com estruturas de superfície das células T e esgotam ou inibem as células T são usados para tratar episódios de rejeição aguda. Um anticorpo amplamente utilizado é um anticorpo monoclonal de camundongo chamado OKT3, que é específico para o CD3 humano. Anticorpos policlonais de coelho ou de cavalo, específicos para uma mistura de proteínas da superfície da célula T de humanos, chamado de globulina antitimócito, também tem sido usado clinicamente por muitos anos para o tratamento de rejeições agudas de aloenxertos. Estes anticorpos anticélula T esgotam as células T em circulação pela ativação do sistema complementar para eliminar células T ou pela ou por sua opsonização para fagocitose. As células T que escapam da eliminação por OKT3 provavelmente o fazem realizando a endocitose (“modulação”) do CD3, retirando-o de sua superfície, mas tais células podem se tornar não funcionais.
No momento, há anticorpos monoclonais em uso que são específicos para CD25, a subunidade α do receptor IL-2. É provável que estes reagentes evitem a ativação de células T pelo bloqueio da ligação de IL-2 a células T ativadas e da sinalização de IL-2.
Outro anticorpo monoclonal sendo usado em transplantes clínicos é um IgM de rato específico para CD52, uma proteína da superfície celular amplamente expressa na maioria das células B e T maduras cuja função não é compreendida. O anti-CD52 foi originalmente desenvolvido para tratar neoplasias malignas da célula B, e descobriu-se que ele esgotava profundamente a maioria das células B e T periféricas por muitas semanas depois de ser injetado em pacientes. Em experimentos atuais, ele foi administrado imediatamente antes e logo após o transplante, na esperança de que pudesse induzir um estado prolongado de tolerância ao enxerto conforme novos linfócitos se desenvolvem na presença do aloenxerto.
A maior limitação ao uso de anticorpos monoclonais ou policlonais de outras espécies é que humanos que recebem estes agentes produzem anticorpos anti-imunoglobulina (Ig) que eliminam a Ig estranha injetada. Por essa razão, foram desenvolvidos anticorpos quiméricos humano-camundongo (“humanizados”), como contra CD3 e CD25, que são menos imunogênicos.
Bloqueio Coestimulatório
Fármacos que bloqueiam as rotas coestimuladoras das células T reduzem a rejeição aguda de aloenxerto. A fundamentação para o uso destes tipos de fármacos é evitar a apresentação de sinais coestimuladores necessários para ativação das células T (Cap. 9). Uma forma solúvel de CTLA-4 de alta afinidade fundida a um domínio Fc de IgG se liga a moléculas B7 em APC e evita que elas interajam com CD28 das células T (Cap. 9, Fig. 9-7) e está próxima de obter a aprovação para uso em receptores de aloenxertos. Estudos clínicos mostraram que a Ig-CTLA-4 pode ser tão eficaz quanto a ciclosporina na prevenção de rejeição aguda. Um anticorpo que se liga a um ligante da célula T CD40 e previne suas interações com CD40 nas APCs (Cap. 9) também mostrou ser benéfica para prevenir a rejeição do enxerto em animais experimentais. Em alguns protocolos experimentais, o bloqueio simultâneo de B7 e CD40 parece ser mais efetivo que o de qualquer outro isoladamente na promoção da sobrevivência do enxerto. Entretanto, o anticorpo anti-CD40L tem um efeito colateral grave, de complicações trombóticas, aparentemente relacionadas à expressão do CD40L nas plaquetas.
Fármacos que Focam Aloanticorpos e Células B Alorreativas
Como já aprendemos mais sobre a importância de aloanticorpos na mediação da rejeição aguda e talvez até da rejeição crônica, terapias que almejam anticorpos e células B que foram desenvolvidos para outras doenças estão agora sendo usadas em pacientes de transplantes. Por exemplo, a plasmaférese é usada às vezes para tratar rejeição aguda mediada por anticorpos. Nesse procedimento, o sangue de um paciente é bombeado através de uma máquina que remove o plasma, mas devolve as hemácias para a circulação. Desta maneira, anticorpos circulantes, inclusive anticorpos patogênicos alorreativos, podem ser removidos. A terapia intravenosa de imunoglobulina (IVIG), usada para tratar várias doenças inflamatórias, frequentemente mediadas por anticorpos, também está sendo aplicada no estabelecimento da rejeição aguda mediada por anticorpos. Na terapia IVIG, IgG coletada de doadores normais é injetada intravenosamente em um paciente. Os mecanismos de ação não são totalmente compreendidos, mas é provável que envolvam a ligação da IgG injetada aos receptores Fc do paciente em diversos tipos de célula, reduzindo assim a produção de aloanticorpos e bloqueando as funções efetoras dos anticorpos do próprio paciente. A IVIG também melhora a degradação dos anticorpos do paciente inibindo competitivamente sua ligação ao receptor Fc neonatal (Cap. 12). Um anticorpo monoclonal específico para a proteína de superfície da célula B, CD20, esgota muito eficientemente as células B maduras da circulação e dos órgãos linfoides secundários. O anti-CD20 já foi usado para tratamento de linfomas da célula B e para doenças autoimunes e agora é usado em experimentos clínicos para o tratamento de rejeição de aloenxerto mediada por anticorpos. Estas terapias de anticorpo e focadas em células B foram usadas em combinação para tratar a rejeição mediada por anticorpos eficazmente.
Fármacos Anti-inflamatórios
Agentes anti-inflamatórios, especificamente os corticosteroides, são frequentemente usados para reduzir a reação inflamatória a aloenxertos de órgãos. O mecanismo de ação proposto para esses hormônios naturais e seus análogos sintéticos é o bloqueio da síntese e secreção de citocinas, incluindo o fator de necrose tumoral (TNF) e a IL-1, e outros mediadores inflamatórios, como as prostaglandinas, espécies de oxigênio reativo, e óxido nítrico, produzidos pelos macrófagos e outras células inflamatórias. O resultado final desta terapia é o recrutamento reduzido de leucócitos, inflamação, e danos ao enxerto. Doses muito altas de corticosteroides podem inibir a secreção de citocinas pelas células T ou mesmo destruir algumas células T, mas é improvável que os níveis de corticosteroides alcançados in vivo atuem desta maneira. Agentes anti-inflamatórios mais novos estão passando por experimentos clínicos, incluindo receptores solúveis de citocina e anticorpos anticitocinas.
Inibidores da Migração de Leucócitos
Um novo agente terapêutico, chamado fingolimod (FTY720), opera ligando-se a e bloqueando os receptores de esfingosina 1-fosfato (S1P) nos linfócitos. O S1P é necessário para a saída dos linfócitos dos órgãos linfoides (Cap. 3), e o bloqueio da sua ação leva ao sequestro dos linfócitos nos linfonodos. O fingolimod inibe a rejeição de aloenxerto em modelos animais. Este fármaco ainda não é usado para transplantes clínicos, mas foi aprovado para o tratamento de esclerose múltipla, uma doença autoimune do sistema nervoso central.
Anticorpos de anti-integrina mostraram ser tratamentos eficazes para algumas doenças autoimunes porque eles bloqueiam o recrutamento de leucócitos da circulação para dentro dos tecidos inflamados (Cap. 3). Há estudos animais inicias testando se estes fármacos funcionam para bloquear a rejeição ao aloenxerto, mas até o momento há poucos dados para prever se esta abordagem será útil.
Os protocolos imunossupressores atuais melhoraram muito a sobrevida de enxertos. Antes do uso dos inibidores de calcineurina, a sobrevida em 1 ano de enxertos cadavéricos de rins não familiares estava entre 50% e 60%, com uma taxa de 90% para enxertos de doadores familiares vivos (que são mais compatíveis com os receptores). Desde a introdução da ciclosporina, do FK506, da rapamicina e do MMF, a taxa de sobrevida de enxertos renais cadavéricos aumentou para aproximadamente 90% em 1 ano. O transplante cardíaco, para o qual a compatibilidade de HLA não é prática, melhorou significativamente com o uso de ciclosporina e agora também apresenta uma taxa de sobrevida em 1 ano de quase 90% (Fig. 16-11). A experiência com outros órgãos é mais limitada, mas as taxas de sobrevida também melhoraram com a terapia imunossupressora moderna, com taxas de sobrevida de 10 anos de pacientes de aproximadamente 60% e 75% para receptores de pâncreas e fígado, respectivamente, e taxas de sobrevida de 3 anos de paciente de 70% a 80% para receptores de pulmão.
Uma forte imunossupressão é geralmente iniciada em receptores de aloenxerto no momento do transplante com uma combinação de fármacos, e após alguns dias, os fármacos são mudados para a manutenção da imunossupressão a longo prazo. Por exemplo, no caso de um transplante de rim adulto, um paciente pode ser inicialmente induzido com um anticorpo destruidor anti-IL-2R ou anticélula T e uma alta dose de corticosteroide, e depois mantido em um inibidor de calcineurina, um antimetabólito, e talvez esteroides de baixa dose. A rejeição aguda, quando ocorre, é tratada com a intensificação rápida da terapia imunossupressora. Nos transplantes modernos, a rejeição crônica tornou-se uma causa mais comum de falha do aloenxerto, especialmente no transplante cardíaco. A rejeição crônica é mais insidiosa que a aguda, e muito menos reversível pela imunossupressão.
A terapia imunossupressora leva a uma maior suscetibilidade a vários tipos de infecções intracelulares e tumores associados a vírus. O maior objetivo da imunossupressão para tratar a rejeição de enxertos é reduzir a geração e função de células T auxiliares e CTL, que medeiam a rejeição celular aguda. Portanto, não é surpreendente que as defesas contra vírus e outros patógenos intracelulares, a função fisiológica das células T, seja também comprometida em receptores de transplantes imunossuprimidos. A reativação de vírus latente do herpes é um problema frequente em pacientes imunossuprimidos, incluindo os citomegalovírus, o vírus herpes simplex, o vírus varicela-zoster e o vírus Epstein-Barr. Por esta razão, os receptores de transplantes atualmente recebem terapia antiviral profilática contra infecções pelo vírus do herpes. Receptores de aloenxerto imunossuprimidos também correm maior risco de uma variedade de infecções chamadas oportunistas, que normalmente não ocorrem em pessoas imunocompetentes, incluindo infecções fúngicas (pneumonia por Pneumocystis jiroveci, histoplasmoses, coccidioidomicoses), infecções protozoárias (toxoplasmose) e infecções gastrointestinais parasitárias (Cryptosporidium e Microsporidium). Receptores de aloenxerto imunossuprimidos correm maior risco de desenvolver neoplasias quando comparados à população em geral, inclusive várias formas de câncer de pele. Sabe-se que alguns dos tumores que são encontrados mais frequentemente em receptores de aloenxertos são causados por vírus, e, portanto eles podem surgir devido à imunidade antiviral diminuída. Estes incluem o carcinoma cérvico-uterino, relacionado à infecção pelo vírus papiloma humano, e linfomas causados pela infecção do vírus Epstein-Barr. Os linfomas encontrados em receptores de aloenxerto são chamados, como grupo, de distúrbios linfoproliferativos pós-transplante, e a maioria deriva de linfócitos B.
Apesar dos riscos de infecções e neoplasias associados ao uso de fármacos imunossupressores, a principal limitação das doses toleradas da maioria destes fármacos, incluindo os inibidores de calcineurina, inibidores mTOR, antimetabólitos e esteroides, é a toxicidade direta para células não relacionadas com a imunossupressão. Em alguns casos, as toxicidades afetam as mesmas células que a rejeição afeta, como a toxicidade à ciclosporina em células epiteliais tubulares renais, o que pode complicar a interpretação da perda de função renal em receptores de aloenxerto de rim.
Métodos para Reduzir a Imunogenicidade de Aloenxertos
No transplante humano, a principal estratégia para reduzir a imunogenicidade de enxertos tem sido minimizar as diferenças aloantigênicas entre o doador e o receptor. Diversos testes laboratoriais clínicos são realizados rotineiramente para reduzir o risco de rejeição imunológica de aloenxertos. Estes incluem a tipagem sanguínea ABO; a determinação de alelos de HLA expressos nas células do doador e do receptor, chamada de tipagem de tecidos; a detecção de anticorpos pré-formados no receptor que reconhecem a HLA e outros antígenos representativos da população do doador; e a detecção de anticorpos pré-formados no receptor que se ligam a antígenos dos leucócitos de um doador identificado, chamada de compatibilidade cruzada. Nem todos esses testes são realizados em todos os tipos de transplantes. Vamos resumir agora cada um destes testes e discutir seu significado.
Para evitar a rejeição hiperaguda, os antígenos dos grupos sanguíneos ABO do doador do enxerto são selecionados para serem compatíveis aos do receptor. Este teste é uniformemente usado em transplantes renais porque enxerto renais não sobreviverão se houver incompatibilidades ABO entre o doador e o receptor. Anticorpos IgM naturais específicos contra antígenos dos grupos sanguíneos ABO (discutidos anteriormente) causarão rejeição hiperaguda. A tipagem sanguínea é realizada pela mistura das hemácias de um paciente com soros padronizados contendo anticorpos anti-A ou anti-B. Se o paciente expressar o antígeno de um dos grupos sanguíneos, o soro específico para aquele antígeno aglutinará as células vermelhas. A biologia do sistema do grupo sanguíneo ABO é discutida mais adiante neste capítulo no contexto da transfusão sanguínea.
No transplante renal, quanto maior o número de alelos do MHC compatíveis entre o doador e o receptor, melhor será a sobrevida do enxerto (Fig. 16-12). A compatibilidade HLA teve influência mais profunda na sobrevida do enxerto antes do uso rotineiro de fármacos imunossupressores, mas dados atuais ainda mostram maior sobrevida de enxertos quando o doador e o receptor têm menos incompatibilidade de alelos HLA. A experiência clínica passada com métodos de tipagem mais antigos demonstrou que, de todos os loci classes I e II, a compatibilidade de HLA-A, HLA-B e HLA-DR são as mais importantes para a previsão da sobrevida dos aloenxertos renais. (O HLA-C não é tão polimórfico quanto o HLA-A ou o HLA-B, e o HLA-DR e o HLA-DQ estão em forte desequilíbrio de linhagem, de modo que a compatibilidade no lócus DR frequentemente também é compatível no lócus DQ.) Apesar dos protocolos atuais de tipagem em muitos centros incluírem HLA-C, loci DQ e DP, a maior parte dos dados disponíveis na previsão do resultado do enxerto se refere somente à incompatibilidades de HLA-A, HLA-B e HLA-DR. Como dois alelos expressos codominantemente são herdados por cada um desses genes HLA, é possível haver entre zero e seis incompatibilidades de HLA destes três loci entre o doador e o receptor. Nenhuma incompatibilidade de antígenos prediz a melhor sobrevida de enxerto de doador vivo, e enxertos com uma incompatibilidade de antígenos é ligeiramente pior. As sobrevidas de enxertos com duas a seis incompatibilidades de HLA são todas significativamente piores do que as de enxerto com nenhuma ou uma incompatibilidade de antígenos. A compatibilidade de HLA tem um impacto ainda maior sobre aloenxertos renais de doador não vivo (não familiar). Portanto, são feitas tentativas para reduzir o número de diferenças nos alelos da HLA expressos nas células do doador e do receptor, que terão um efeito modesto na redução das chances de rejeição.
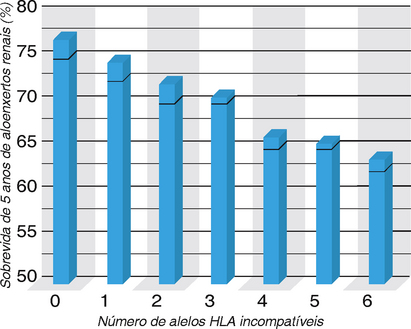
FIGURA 16-12 Influência da compatibilidade de MHC na sobrevida do enxerto. A compatibilidade de alelos MHC entre o doador e o receptor melhora significativamente a sobrevida de aloenxertos renais. Os dados mostrados são de enxertos de doadores falecidos (cadáveres). A compatibilidade de HLA tem menor impacto na sobrevida de aloenxertos renais de doadores vivos, e alguns alelos MHC são mais importantes do que outros na determinação do resultado.
(Dados de Organ Procurement and Transplantation Network/Scientific Registry annual report, 2010.)
Nos transplantes renais, a compatibilidade de HLA é possível porque os rins dos doadores podem ser estocados por até 72 horas antes do transplante até que possa ser identificado um doador bem compatível e porque pacientes que necessitam de um aloenxerto de rim podem ser mantidos com diálise até que um órgão bem compatível se encontre disponível. Nos casos dos transplantes de coração e fígado, a preservação do órgão é mais difícil e os receptores em potencial muitas vezes se encontram em situação crítica. Por esses motivos, a tipagem de HLA não é considerada no pareamento de doadores e receptores potenciais, e a escolha dos doadores e receptores é baseada somente na tipagem sanguínea ABO e na compatibilidade anatômica. No transplante cardíaco, a insuficiência de doadores, a necessidade emergente do transplante e o sucesso da imunossupressão superam a possível vantagem de reduzir as incompatibilidades de HLA entre doador e receptor. Como discutiremos mais adiante, no transplante de medula óssea, a compatibilidade de HLA é essencial para reduzir o risco de doença enxerto versus hospedeiro.
A maioria das determinações haplotípicas HLA agora é realizada por reação em cadeia da polimerase (PCR), substituindo métodos serológicos mais antigos. Os genes do MHC podem ser amplificados por métodos de PCR usando-se primers que se ligam a sequências conservadas nas extremidades 5′ e 3′ desses éxons, que codificam as regiões polimórficas das moléculas do MHC de classes I e II. O segmento amplificado de DNA pode, então, ser facilmente sequenciado. Assim, a verdadeira sequência de nucleotídeos e, portanto, a sequência de aminoácidos prevista pode ser diretamente determinada para os alelos MHC de qualquer célula, fornecendo uma tipagem tecidual molecular precisa. Com base nestes esforços de sequenciamento do DNA, a nomenclatura dos alelos HLA foi mudada para refletir a identificação de muitos alelos não distinguidos pelos métodos sorológicos precedentes. Cada alelo definido por sequência tem pelo menos um número com quatro algarismos, mas alguns alelos exigem seis ou oito dígitos para definição precisa. Os primeiros dois dígitos normalmente correspondem ao alotipo definido serologicamente mais antigo, e o terceiro e o quarto dígitos indicam os subtipos. Os alelos com diferenças nos primeiros quatro algarismos codificam proteínas com aminoácidos diferentes. Por exemplo, HLA-DRB1*1301 é o 01 alelo definido por sequência da família de 13 alelos do gene codificando a proteína HLA-DR β1.
Pacientes que necessitam de aloenxertos também são testados contra a presença de anticorpos pré-formados contra moléculas MHC do doador ou outros antígenos da superfície celular. Dois tipos de testes são feitos para detectar estes anticorpos. No teste do painel de anticorpos reativos, os pacientes que esperam transplantes de órgãos são avaliados em busca da presença de anticorpos pré-formados reativos contra moléculas HLA alogênicas prevalentes na população. Esses anticorpos, que podem ser produzidos como resultado de gestações, transfusões ou transplantes anteriores, podem identificar o risco de reação hiperaguda ou vascular aguda. Pequenas quantidades do soro do paciente são misturadas com múltiplos grânulos fluorescentes rotulados com moléculas MHC definidas, representativas dos alelos MHC que podem estar presentes em uma população de doadores de órgão. Cada alelo MHC é ligado a um grânulo com um rótulo fluorescente de cor diferente. A ligação dos anticorpos do paciente aos grânulos é determinada por citometria de fluxo. Os resultados são relatados como PRA (percentagem de anticorpos reativos), que é a percentagem do reservatório de alelos MHC com a qual o soro do paciente reage. A PRA é determinada em múltiplas ocasiões enquanto um paciente espera pelo aloenxerto de um órgão. Isso ocorre porque a PRA pode variar, conforme cada painel é escolhido aleatoriamente, e as titulações de anticorpos do soro do paciente podem se alterar ao longo do tempo.
Se um doador potencial é identificado, o teste de compatibilidade cruzada determinará se o paciente tem anticorpos que reagem especificamente com as células do doador. O teste é realizado misturando o soro do receptor com os linfócitos sanguíneos do doador. Testes de citotoxicidade mediados por complementos ou avaliações por citometria de fluxo podem então ser usadas para determinar se anticorpos no soro do receptor se ligaram às células do doador. Por exemplo, um complemento é acrescentado à mistura de células e soro, e se anticorpos pré-formados, normalmente contra as moléculas MHC do doador, estiverem presentes no soro do receptor, as células do doador são lisadas. Este seria um cruzamento positivo, que indica que o doador não é adequado para aquele receptor.
Métodos para Induzir a Tolerância Específica ao Doador
A rejeição de aloenxertos pode ser prevenida, tornando-se o hospedeiro tolerante aos aloantígenos do enxerto. Tolerância, neste contexto, significa que o hospedeiro não lesa o enxerto apesar da ausência ou retirada dos agentes anti-inflamatórios ou imunossupressores. Presume-se que a tolerância a um aloenxerto inclua os mesmos mecanismos envolvidos na tolerância a antígenos próprios (Cap. 14), ou seja, anergia, deleção ou supressão ativa de células T alorreativas. A tolerância é desejável nos transplantes porque é específica contra aloantígenos e, portanto, evita os principais problemas associados à imunossupressão inespecífica, que são deficiência imunológica que leva à suscetibilidade aumentada a infecções e ao desenvolvimento de tumores induzidos e toxicidade dos fármacos. Além disso, atingir a tolerância ao enxerto pode reduzir a rejeição crônica que, até agora, não foi afetada pelos agentes imunossupressores comumente usados, que previnem e revertem episódios de rejeição aguda.
Diversas abordagens experimentais e observações clínicas têm mostrado que deveria ser possível atingir a tolerância a aloenxertos. Em experimentos com camundongos, Medawar e colaboradores descobriram que se camundongos neonatos de uma linhagem (a receptora) recebem células do baço de outra linhagem (a doadora), os receptores subsequentemente aceitarão enxertos do doador. Tal tolerância é específica contra aloantígenos, porque os receptores rejeitarão enxertos de linhagens de camundongos que expressem alelos do MHC diferentes daqueles do doador. Pacientes de transplantes renais que receberam transfusões sanguíneas contendo leucócitos alogênicos apresentam uma menor incidência de episódios de rejeição aguda do que aqueles que não foram transfundidos. A explicação postulada para esse efeito é que a introdução de leucócitos alogênicos por meio da transfusão produz tolerância a aloantígenos. Um mecanismo subjacente para a indução da tolerância pode ser que as células transfundidas contêm células dendríticas imaturas, que induzem a irresponsividade a aloantígenos do doador. De fato, o pré-tratamento de potenciais receptores com transfusões sanguíneas é hoje usado como terapia profilática para reduzir a rejeição. Alguns receptores de aloenxertos de fígado são capazes de reter enxertos saudáveis mesmo após a retirada da imunossupressão. O mecanismo subjacente a essa tolerância aparentemente “espontânea” não é conhecido, e parece ser exclusivo para enxertos hepáticos.
Diversas estratégias estão sendo testadas para induzir tolerância doador-específico em receptores de aloenxerto.
• Bloqueio coestimulatório. Foi postulado que o reconhecimento de aloantígenos na ausência de coestimulação levaria à tolerância da célula T, e há alguma evidência experimental em animais para apoiar isso. No entanto, a experiência clínica com agentes que bloqueiam a coestimulação é que eles inibem respostas imunológicas ao aloenxerto, mas não induzem tolerância duradoura, e pacientes têm de ser mantidos em terapia.
• Quimerismo hematopoiético. Mencionamos anteriormente que a transfusão de células sanguíneas do doador para o receptor do enxerto inibe a rejeição. Se as células transfundidas do doador ou a progênie das células sobreviver por longos períodos no receptor, o receptor torna-se uma quimera. O quimerismo hematopoiético com tolerância a longo prazo ao aloenxerto também foi alcançada em um pequeno número de pacientes de aloenxerto renal por meio de um transplante de células da medula óssea do doador ao mesmo tempo que foi feito o aloenxerto do órgão, mas os riscos do transplante de medula óssea e a disponibilidade de doadores apropriados podem limitar a aplicabilidade desta abordagem.
• Transferência ou indução de células T reguladoras. Tentativas de gerar células T reguladoras específicas ao doador e de transferi-las para receptores de enxerto estão em curso. Algum sucesso foi relatado em receptores de transplantes de células-tronco hematopoiéticas, em quem infusões de células T reguladoras reduzem a doença enxerto versus hospedeiro. Uma abordagem alternativa é a ativação de células T reguladoras in vivo, e isto está sendo tentado pela administração de anticorpos anti-CD3 fracamente estimulantes em receptores de transplantes de ilhotas pancreáticas.
• Outras abordagens. Outras estratégias que já foram tentadas em modelos experimentais incluem a administração de proteínas MHC ou peptídeos solúveis sob condições previstas para induzir a tolerância. Parece improvável que tal abordagem seja amplamente aplicável em situações clínicas devido ao grande polimorfismo das moléculas HLA.
TRANSPLANTE XENOGÊNICO
O uso de transplantes de órgãos sólidos como uma terapia clínica é muito limitado pela pouca disponibilidade de doadores de órgãos. Por essa razão, a possibilidade de transplante de órgãos de outros mamíferos, tais como porcos, em receptores humanos tem atraído grande interesse.
Uma grande barreira imunológica para o transplante xenogênico é a presença de anticorpos naturais que causam rejeição hiperaguda. Mais de 95% dos primatas apresentam anticorpos IgM naturais que reagem com os determinantes de carboidratos expressos pelas células de espécies que são evolutivamente distantes, tais como o porco. A maioria dos anticorpos humanos naturais antiporco é direcionada contra um determinante de carboidrato específico formado pela ação de uma enzima porcina α-galactosiltransferase. Esta enzima coloca uma fração de galactose α-ligada no mesmo substrato que, em células humanas e de outros primatas, é fucosilado para formar o antígeno H de grupo sanguíneo. Combinações de espécies que geram anticorpos naturais uma contra a outra são chamadas de discordantes. Anticorpos naturais raramente são produzidos contra determinantes de carboidratos de espécies concordantes, proximamente relacionadas, tais como o ser humano e o chimpanzé. Assim, órgãos de chimpanzés ou outros primatas mais evoluídos podem ser, teoricamente, aceitos em humanos. Entretanto, preocupações éticas e logísticas têm limitado tais procedimentos. Por razões de compatibilidade anatômica, os porcos são a espécie xenogênica preferida para a doação de órgãos para humanos.
Anticorpos naturais contra xenoenxertos induzem a rejeição hiperaguda pelos mesmos mecanismos vistos na rejeição hiperaguda de aloenxertos. Estes mecanismos incluem a geração de pró-coagulantes de células endoteliais e substâncias de agregação plaquetária, associados à perda de mecanismos anticoagulantes endoteliais. Entretanto, as consequências da ativação de complemento humano em células de porco são tipicamente mais graves que as da ativação de complemento por anticorpos naturais em células alogênicas humanas, possivelmente porque algumas das proteínas reguladoras do complemento feitas pelas células de porco, tais como o fator de aceleração de declínio, não são capazes de interagir com proteínas do complemento humano e, portanto, não podem limitar a extensão da lesão induzida pelo complemento (Cap. 12). Uma estratégia para reduzir a rejeição hiperaguda no xenotransplante é a criação de porcos transgênicos que não possam expressar enzimas que sintetizam antígenos de porco ou expressem proteínas humanas que inibem a ativação do complemento humano. Por exemplo, porcos com knockout de α-galactosiltransferase e porcos transgênicos que expressam proteínas reguladoras complementares humanas foram gerados, e transplantes de órgãos destes animais para primatas são resistente à rejeição hiperaguda.
Mesmo quando se previne a rejeição hiperaguda, os xenoenxertos são frequentemente lesados por uma forma de rejeição vascular aguda que ocorre entre 2 e 3 dias após o transplante. Essa forma de rejeição tem sido chamada de rejeição retardada do xenoenxerto, rejeição aguda acelerada ou rejeição vascular aguda, e se caracteriza por trombose intravascular e necrose da parede dos vasos. Os mecanismos da rejeição retardada do xenoenxerto não são completamente compreendidos; descobertas recentes indicam que pode haver incompatibilidades entre as plaquetas dos primatas e as células endoteliais porcinas que promovem a trombose independentemente de danos mediados por anticorpos.
Os xenoenxertos também podem ser rejeitados por respostas imunológicas contra xenoantígenos mediadas por células T. Acredita-se que os mecanismos da rejeição celular de xenoenxertos sejam semelhantes aos descritos para a rejeição de aloenxertos, e as respostas de células T a xenoantígenos podem ser tão fortes quanto, ou ainda mais fortes do que as respostas contra aloantígenos.
TRANSFUSÃO DE SANGUE E OS GRUPOS DE ANTÍGENOS DE SANGUE ABO E RH
A transfusão de sangue é uma forma de transplante na qual o sangue total ou células sanguíneas de um ou mais indivíduos são transferidos por via endovenosa para a circulação de um hospedeiro. As transfusões sanguíneas são realizadas mais frequentemente para substituir o sangue perdido por hemorragia ou para corrigir defeitos causados pela produção inadequada de células sanguíneas, que podem ocorrer em diversas doenças. A principal barreira ao sucesso das transfusões sanguíneas é a resposta imunológica contra moléculas da superfície celular que diferem entre indivíduos. O sistema de aloantígenos mais importante na transfusão sanguínea é o sistema ABO, que discutiremos em detalhes logo abaixo. Antígenos ABO são expressos em todas as células, incluindo as hemácias. Indivíduos que não têm um antígeno específico de um grupo sanguíneo produzem anticorpos IgM naturais contra aquele antígeno. Se tais indivíduos receberem células sanguíneas que expressem o antígeno ausente, os anticorpos preexistentes se ligam às células transfundidas, ativam o complemento e provocam reações de transfusão, que podem causar perigo de vida A transfusão através de uma barreira ABO pode desencadear uma reação hemolítica imediata, resultando em lise intravascular das hemácias, provavelmente mediada pelo sistema de complemento, e fagocitose extensiva dos eritrócitos revestidos por anticorpos e complemento, pelos macrófagos do fígado e baço. A hemoglobina é liberada das hemácias que sofrem lise em quantidades que podem ser tóxicas para as células renais, causando necrose aguda de células tubulares renais e insuficiência renal. Podem ocorrer febre alta, choque e coagulação intravascular disseminada, sugestivos de liberação maciça de citocinas (p. ex., de TNF ou IL-1). A coagulação intravascular disseminada consome os fatores de coagulação mais rapidamente do que podem ser sintetizados, e o paciente pode, paradoxalmente, morrer por hemorragia na presença de coagulação disseminada. Mais reações hemolíticas retardadas podem resultar de incompatibilidades de antígenos de grupos sanguíneos menores. Estas resultam em perda progressiva das células transfundidas, levando a anemia e icterícia, em consequência de um fígado sobrecarregado com pigmentos derivados da hemoglobina.
Discutiremos a seguir os antígenos dos grupos sanguíneos ABO e outros antígenos de grupos sanguíneos de relevância clínica.
Antígenos do Grupos Sanguíneo ABO
Os antígenos ABO são carboidratos ligados a proteínas e lipídios da superfície celular e que são sintetizados por enzimas glicosiltransferase polimórficas, cuja atividade varia de acordo com o alelo herdado (Fig. 16-13). Os antígenos ABO foram o primeiro sistema aloantígeno a ser definido em mamíferos. Todos os indivíduos normais sintetizam uma glicana central, chamada de antígeno O, que é ligada principalmente a proteínas da membrana plasmática. A maioria dos indivíduos possui uma fucosiltransferase que adiciona uma fração de fucose a um resíduo não terminal de açúcar do antígeno O, e o glicano fucosilado é chamado de antígeno H. Um único gene no cromossomo 9 codifica uma enzima glicosiltransferase, que modifica ainda mais o antígeno H. Existem três variantes alélicas deste gene. O produto do alelo O do gene não apresenta atividade enzimática. A enzima codificada pelo alelo A transfere uma fração terminal N-acetilgalactosamina, e o produto do alelo B do gene transfere uma fração terminal galactose. Indivíduos que são homozigóticos para o alelo O não conseguem prender açúcares terminais ao antígeno H e expressam somente o antígeno H. Em contrapartida, indivíduos que possuem um alelo A (AA homozigotos, AO heterozigotos, ou AB heterozigotos) formam o antígeno A adicionando N-acetilgalactosamina terminal a alguns de seus antígenos H. Da mesma forma, indivíduos que expressam um alelo B (BB homozigotos, BO heterozigotos, ou AB heterozigotos) formam o antígeno B adicionando galactose terminal a alguns de seus antígenos H. Heterozigotos AB formam antígenos A e B de alguns de seus antígenos H. A terminologia foi simplificada de modo que se diz que indivíduos OO têm tipo sanguíneo O; indivíduos AA e AO têm tipo sanguíneo A; indivíduos BB e BO têm tipo sanguíneo B; e indivíduos AB têm tipo sanguíneo AB. Mutações no gene que codifica a fucosiltransferase, que produz o antígeno H, são raras; diz-se que pessoas homozigóticas para tal mutação têm o tipo sanguíneo Bombaim e não podem produzir antígenos H, A ou B. Estes indivíduos fabricam anticorpos contra antígenos H, A e B e não podem receber sangue tipo O, A, B ou AB.
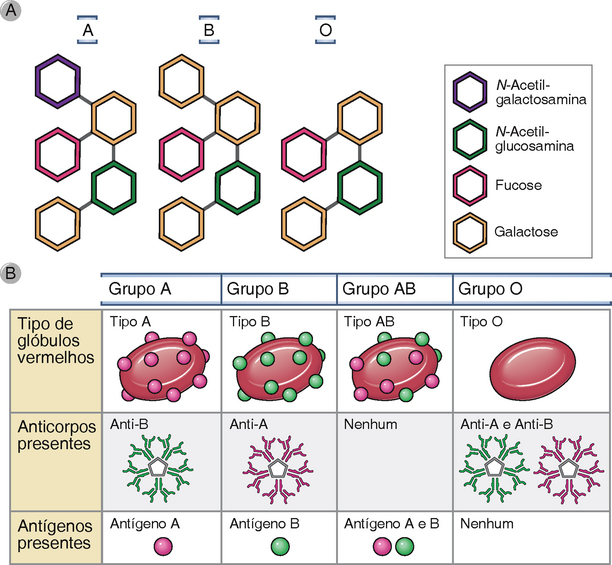
FIGURA 16-13 Antígenos de grupo sanguíneo ABO. A, Antígenos de grupos sanguíneos são estruturas de carboidrato adicionadas a proteínas da superfície celular pela ação de glicosiltransferases. A maioria das pessoas herda um gene que codifica L-fucosiltransferase, que produz o antígeno H. A herança de um gene para N-acetil-D-galactosaminil transferase, que gera o antígeno A, e do gene que codifica d-galactosiltransferase, que gera o antígeno B, varia entre as pessoas. Uma pessoa que não herda genes para nenhuma destas enzimas será tipo O; uma pessoa que herda apenas uma destes genes glicosal transferase será tipo A ou B; e uma pessoa que herda genes para as duas enzimas será tipo AB.
Indivíduos que expressam um antígeno ABO específico são tolerantes àquele antígeno, mas indivíduos que não expressam aquele antígeno produzem anticorpos naturais que reconhecem o antígeno. Praticamente todos os indivíduos expressam o antígeno H, e, portanto são tolerantes a este antígeno e não produzem anticorpos anti-H. Indivíduos que expressam antígenos A ou B são tolerantes a estas moléculas e não produzem anticorpos anti-A ou anti-B, respectivamente. Contudo, indivíduos com tipo sanguíneo O e A produzem anticorpos anti-B IgM, e indivíduos com tipo sanguíneo O e B produzem anticorpos anti-A IgM. Visto assim, parece paradoxal que indivíduos que não expressam um antígeno de um grupo sanguíneo produzam anticorpos contra ele. A explicação provável é que os anticorpos são produzidos contra glicolipídios de bactérias intestinais que têm reações cruzadas com os antígenos ABO, a menos que o indivíduo seja tolerante a um ou mais destes.
Na transfusão clínica, a escolha de doadores de sangue para um receptor específico é baseada na expressão dos antígenos do grupo sanguíneo e nas respostas dos anticorpos a eles. Se um paciente recebe uma transfusão de hemácias de um doador que expressa o antígeno não expresso em hemácias próprias, pode haver uma reação de transfusão (descrita anteriormente). Segue-se que indivíduos AB podem tolerar transfusões de todos os doadores potenciais e são, portanto, chamados de receptores universais; da mesma forma, indivíduos O toleram transfusões somente de doadores O, mas podem fornecer sangue para todos os receptores, sendo chamados de doadores universais. Em geral, diferenças em grupos sanguíneos menores só levam à lise de hemácias depois que transfusões repetidas tenham produzido uma resposta de anticorpos secundária.
Antígenos ABO são expressos em muitos outros tipos celulares além das células sanguíneas, incluindo células endoteliais. Por essa razão, a tipagem ABO é crítica para se evitar a rejeição hiperaguda de enxertos de órgãos sólidos, conforme já discutido neste capítulo. A incompatibilidade ABO entre mãe e feto geralmente não causa problemas para o feto porque a maior parte doa anticorpos anticarboidrato são IgM e não cruzam a placenta.
Antígenos de Outros Grupos Sanguíneos
Antígeno Lewis
As mesmas glicoproteínas que transportam os determinantes ABO podem ser modificadas por outras glicosiltransferases para gerar antígenos de grupos sanguíneos menores. Por exemplo, a adição de frações de fucose em outras posições não terminais pode ser catalisada por diferentes fucosiltransferases e resulta em epítopos do sistema de antígenos de Lewis. Os antígenos de Lewis têm recebido atualmente muita atenção por parte de imunologistas, porque estes grupos de carboidratos servem como ligantes para E-selectina e P-selectina.
Antígeno Rhesus (Rh)
Os antígenos Rhesus (Rh), assim denominados devido à espécie de macaco na qual foram originalmente identificados, são outro antígeno de grupo sanguíneo clinicamente importante. Antígenos Rh são proteínas de superfície celular hidrofóbicas, não glicosiladas, encontradas em membranas de hemácias e estruturalmente relacionadas a outras glicoproteínas de membrana de hemácias com funções de transporte. Proteínas Rh são codificadas por dois genes altamente homólogos estritamente ligados, mas apenas um deles, chamado de RhD, é em geral considerado na tipagem sanguínea clínica. Isso ocorre porque até 15% da população apresenta uma deleção ou outra alteração do alelo RhD. Essas pessoas, chamadas de Rh negativas, não toleram o antígeno Rh e produzirão anticorpos contra o antígeno se forem expostas a células sanguíneas Rh positivas.
A principal significância clínica dos anticorpos anti-Rh está relacionada às reações hemolíticas associadas à gestação que são similares às reações de transfusão. Mães Rh negativas que estejam gestando um feto Rh positivo podem ser sensibilizadas por hemácias fetais que penetram na circulação materna, geralmente durante o parto. Como o antígeno Rh é uma a proteína, ao contrário dos antígenos ABO de carboidratos, anticorpos IgG com classes alteradas são gerados nas mães Rh negativas. Gestações subsequentes nas quais o feto seja Rh-positivo estão sob risco porque os anticorpos anti-Rh maternos podem cruzar a placenta e mediar a destruição das hemácias fetais. Isso causa a eritroblastose fetal (doença hemolítica do recém-nascido) e pode ser letal para o feto. Essa doença pode ser prevenida pela administração de anticorpos anti-RhD para a mãe em até 72 horas após o nascimento do primeiro bebê Rh positivo. Esse tratamento evita que as hemácias Rh positivas do bebê que penetraram na circulação da mãe induzam a produção de anticorpos anti-Rh na mãe. Os mecanismos de ação exatos dos anticorpos administrados não estão claros, mas podem incluir a remoção fagocítica ou lise mediada por complemento dos eritrócitos do bebê, ou inibição por feedback, dependente do receptor a Fc das células B RhD-específicas da mãe (Cap. 11).
TRANSPLANTE HEMATOPOIÉTICO DE CÉLULAS-TRONCO
O transplante de células-tronco alogênicas hematopoiéticas pluripotentes é comumente realizado usando um inóculo de células da medula óssea coletadas por aspiração, e o procedimento é frequentemente chamado de transplante de medula óssea. Células-tronco hematopoiéticas também podem ser purificadas do sangue de doadores, após o tratamento com fatores estimuladores de colônias, que mobilizam células-tronco da medula óssea. O receptor é tratado antes do transplante para exaurir células de medula óssea e liberar locais para as células-tronco transferidas. Após o transplante, as células-tronco repovoam a medula óssea do receptor e se diferenciam em todas as linhagens hematopoiéticas. Consideramos o transplante de medula óssea separadamente porque muitas características únicas deste tipo de enxerto não são encontradas no transplante de órgãos sólidos.
O transplante medula óssea é usado clinicamente com mais frequência no tratamento de leucemias. Em algumas formas de leucemia, as células enxertadas são eficazes na destruição das células residuais de leucemia. Além disso, os agentes quimioterápicos necessários para destruir as células cancerígenas destroem também os elementos medulares normais, e o transplante de medula óssea é usado para “resgatar” o paciente dos efeitos colaterais da quimioterapia. O transplante de células-tronco hematopoiéticas também é usado clinicamente para tratar doenças causadas por mutações herdadas em genes afetando somente células derivadas de células-tronco hematopoiéticas, como linfócitos ou hemácias. Exemplos de doenças que podem ser curadas pela transferência de células-tronco hematopoieticas são deficiência de adenosina deaminase (ADA), imunodeficiência grave ligada ao X e mutações de hemoglobina como beta-talassemia major e anemia falciforme.
Células-tronco alogênicas hematopoieticas são rejeitadas mesmo por um hospedeiro minimamente imunocompetente e, portanto, o receptor e o doador devem ter sua compatibilidade cuidadosamente testada para todos os loci polimórficos do MHC. Os mecanismos de rejeição das células da medula óssea não são completamente compreendidos, mas, além dos mecanismos imunológicos adaptativos, células-tronco do sistema hematopoiético também podem ser rejeitadas por células NK. O papel das células NK na rejeição da medula óssea tem sido estudado em animais experimentais. Camundongos híbridos F1 irradiados rejeitam a medula óssea doada por qualquer dos progenitores isogênicos. Este fenômeno, chamado de resistência híbrida, parece violar as leis clássicas do transplante de tecidos sólidos (Fig. 16-2). A resistência híbrida é observada em camundongos deficientes de células T, e a depleção das células NK do receptor com anticorpos anticélula NK previne a rejeição de medula óssea dos progenitores. A resistência híbrida é provavelmente devida a células NK que reagem contra precursores da medula óssea que não apresentam moléculas do MHC de classe I expressas pelo hospedeiro. Lembre que, normalmente, o reconhecimento de MHC próprio de classe I inibe a ativação de células NK, e se estas moléculas MHC próprios estão faltando, as células NK são liberadas da inibição (Cap. 4, Fig. 4-6). A alorreatividade da célula NK doador versus receptor tem sido usada para reduzir relapsos de leucemia depois do transplante de células-tronco hematopoiéticas com haplótipo HLA não correspondente.
Mesmo após o enxerto bem-sucedido, dois problemas adicionais são frequentemente associados ao transplante de medula óssea; são eles a doença do enxerto versus hospedeiro e a imunodeficiência.
Doença do Enxerto versus Hospedeiro
A doença do enxerto versus hospedeiro (GVHD) é causada pela reação de células T maduras enxertadas no inóculo da medula com aloantígenos do hospedeiro. Ela ocorre quando o hospedeiro é imunocomprometido e, portanto, incapaz de rejeitar as células alogênicas no enxerto. Na maioria dos casos, a reação é dirigida contra antígenos de histocompatibilidade menores do hospedeiro porque o transplante de medula óssea geralmente não é realizado quando o doador e o receptor têm diferenças em suas moléculas do MHC. A GVHD também pode se desenvolver quando órgãos sólidos que contêm números significativos de células T são transplantados, tais como intestino delgado, pulmão ou fígado.
A GVHD é a principal limitação contra o êxito do transplante de medula óssea. Como no transplante de órgãos sólidos, a GVHD pode ser classificada, com base em padrões histopatológicos, em formas aguda e crônica.
A GVHD aguda é caracterizada por morte de células epiteliais na pele, no fígado (sobretudo o epitélio biliar) e no trato gastrointestinal (Fig. 16-14). A GVHD aguda se manifesta clinicamente por exantema, icterícia, diarreia e hemorragia gastrointestinal. Quando a morte de células epiteliais é extensa, a pele ou a mucosa intestinal podem simplesmente se desprender. Nessas circunstâncias, a GVHD pode ser fatal.
FIGURA 16-14 Histopatologia de GVHD agudo na pele. Um infiltrado linfocítico escasso pode ser visto na junção dérmica-epidérmica, e dano à camada epitelial é indicado por espaços na junção dérmica-epidérmica (vacuolização), células com manchas anormais de queratina (disqueratose), queratinócitos apoptóticos, e desorganização da maturação de queratinócitos da camada basal para a superfície.
(Cortesia de Dr. Scott Grantor, Department of Pathology, Brigham and Women’s Hospital and Harvard Medical School, Boston, Massachusetts.)
A GVHD crônica é caracterizada por fibrose e atrofia de um ou mais dos mesmos órgãos, sem evidências de morte celular aguda. A GVHD crônica pode também envolver os pulmões, produzindo obstrução das pequenas vias aéreas. Quando grave, a GVHD crônica induz a uma completa disfunção do órgão afetado.
Em modelos animais, a GVHD é iniciada pelas células T maduras presentes no inóculo da medula óssea, e a eliminação das células T maduras do doador do enxerto poderá evitar o seu desenvolvimento. No transplante clínico de células-tronco hematopoiéticas, os esforços para eliminar as células T do inóculo da medula reduziram a incidência de GVHD, mas também diminuíram o efeito enxerto versus leucemia que é bastante crítico no tratamento de leucemias com esse tipo de transplante. A medula esgotada de células T também tende a enxertar fracamente, talvez porque as células T maduras produzam fatores estimuladores de colônia que auxiliam no repovoamento das células-tronco. Uma abordagem que foi tentada é a combinação da remoção das células T com tratamento suplementar do fator estimulador de colônias para promover a aceitação do enxerto.
Embora a GVHD seja iniciada por células T enxertadas que reconhecem aloantígenos do hospedeiro, as células efetoras que causam a lesão celular epitelial estão menos bem definidas. No exame histológico, as células NK se encontram frequentemente ligadas às células epiteliais moribundas, sugerindo que as células NK são importantes células efetoras da GVHD aguda. CTL CD8+ e citocinas também parecem estar envolvidos na lesão tecidual da GVHD aguda.
A relação entre GVHD aguda e crônica não é conhecida, e levanta questões semelhantes às da relação entre a rejeição aguda e crônica de aloenxertos. Por exemplo, a GVHD crônica pode representar a fibrose da reparação de lesões secundária à perda de células epiteliais. Entretanto, a GVHD crônica pode surgir sem evidências de GVHD aguda prévia. Uma explicação alternativa é que a GVHD crônica representa uma resposta à isquemia causada pela lesão vascular.
Tanto a GVHD aguda quanto a crônica são geralmente tratadas com imunossupressão intensa. Não está bem estabelecido se qualquer uma dessas condições responde muito bem ao tratamento. Uma possível explicação para este fracasso terapêutico é que a imunossupressão convencional tem como alvo os linfócitos T, que podem ser apenas um dos vários mediadores da GVHD. A ciclosporina e a toxina metabólica metotrexato também são usadas na profilaxia contra GVHD. Diversas terapias novas estão sendo estudadas em experimentos clínicos, incluindo a rapamicina, anticorpos anti-TNF, e transferência de célula T reguladora.
Imunodeficiência após o Transplante de Medula Óssea
O transplante de medula óssea é frequentemente acompanhado de imunodeficiência clínica. Diversos fatores podem contribuir para as respostas imunológicas defeituosas nos receptores. Os receptores de transplante de medula óssea podem ser incapazes de regenerar um repertório novo e completo de linfócitos. A radioterapia e a quimioterapia usadas para preparar os receptores para o transplante tendem a esgotar as células de memória e as células plasmáticas de vida longa do paciente, e pode ser necessário um longo tempo para regenerar estas populações.
A consequência da imunodeficiência é que os receptores de transplante de medula óssea se tornam suscetíveis a infecções virais, especialmente por citomegalovírus, e a muitas infecções bacterianas e fúngicas. Também ficam suscetíveis a linfomas de células B provocados pelo vírus Epstein-Barr. As imunodeficiências dos receptores de transplante de medula óssea podem ser mais graves do que as de pacientes imunossuprimidos convencionais. Portanto, os receptores de transplantes de medula óssea geralmente recebem antibióticos profiláticos e terapia anticitomegalovírus e, com frequência, são ativamente imunizados contra bactérias encapsuladas, tais como o pneumococo, antes do transplante.
Há um grande interesse no uso de células-tronco pluripotentes para reparar tecidos com pouca capacidade natural de regeneração, como o músculo cardíaco, o cérebro e a medula espinhal. Uma abordagem é usar células-tronco embriônicas, que são células-tronco pluripotentes derivadas do estágio blastocístico de embriões humanos. Embora células-tronco embriônicas ainda não tenham sido usadas clinicamente, é muito provável que uma grande barreira para sua utilidade será sua aloantigenicidade e rejeição pelo sistema imunológico do receptor. Uma possível solução para isso pode ser o uso de células-tronco pluripotentes induzidas (iPS), que podem ser obtidas de tecidos somáticos adultos pela transdução de certos genes. A vantagem imunológica da abordagem da célula iPS é que estas células podem ser obtidas de células somáticas colhidas do paciente, que serão portanto singênicas com o paciente.
• O transplante de tecidos de um indivíduo para um receptor não idêntico geneticamente leva a uma resposta imunológica específica chamada de rejeição, que pode destruir o enxerto. Os principais alvos moleculares na rejeição do aloenxerto são as moléculas do MHC alogênicas de classes I e II.
• Moléculas do MHC alogênicas podem ser apresentadas por APC do doador para as células T do receptor (a via direta), ou os aloantígenos podem ser coletados por APC do hospedeiro que penetram no enxerto ou residem em órgãos linfoides de drenagem e ser processados e apresentados às células T na forma de peptídeos associados a moléculas do MHC próprias (a via indireta).
• A frequência de células T capazes de reconhecer moléculas do MHC alogênicas é muito alta, o que explica porque a resposta aos aloantígenos é muito mais forte do que a resposta aos antígenos estranhos convencionais. Os motivos para esta alta frequência são uma tendência inerente das células T de reconhecer moléculas MHC e porque muitos clones diferentes de célula T específicos para peptídeos estranhos diferentes, além das moléculas MHC próprias, podem ter reações cruzadas com uma molécula alogênica individual do MHC.
• A rejeição do enxerto é mediada por células T, incluindo CTL que destroem as células do enxerto e células T auxiliares que causam inflamação mediada por citocina parecida com as reações DTH, e por anticorpos.
• Diversos mecanismos efetores causam rejeição de enxertos de órgãos sólidos, e cada mecanismo pode levar a uma reação histologicamente característica. Anticorpos preexistentes causam rejeição hiperaguda caracterizada por trombose de vasos enxertados. Células T alorreativas e anticorpos produzidos em resposta ao enxerto causam lesão da parede dos vasos sanguíneos e morte de células parenquimatosas, chamada de rejeição aguda. A rejeição crônica é caracterizada por fibrose e anomalias vasculares (vasculopatia do enxerto), que podem representar danos aos vasos sanguíneos e lesões ao parênquima devido a uma reação inflamatória mediada por célula T e citocina nas paredes das artérias.
• A rejeição do enxerto pode ser prevenida ou tratada por imunossupressão do hospedeiro e pela minimização da imunogenicidade do enxerto (pela limitação das diferenças alélicas do MHC). Grande parte da imunossupressão é direcionada às respostas da célula T e envolve o uso de fármacos citotóxicos, agentes imunossupressores específicos, ou anticorpos anticélula T. Um agente imunossupressor amplamente usado é a ciclosporina, que bloqueia a sinalização do receptor antígeno da célula T ligado à síntese de citocina. A imunossupressão é frequentemente combinada com fármacos anti-inflamatórios como corticosteroides que inibem a síntese de citocina por macrófagos e outras células.
• Pacientes que recebem transplantes de órgãos sólidos podem se tornar imunodeficientes devido à sua terapia e são suscetíveis a infecções virais e tumores malignos.
• O transplante xenogênico de órgãos sólidos é limitado pela presença de anticorpos naturais contra antígenos de carboidratos nas células de espécies discordantes que causam rejeição hiperaguda, rejeição vascular mediada por anticorpos e uma forte resposta imunológica mediada por células T contra moléculas do MHC xenogênicas, e efeitos pró-trombóticos do endotélio xenogênico em plaquetas e proteínas da coagulação humana.
• Os antígenos do grupo sanguíneo ABO são um conjunto de estruturas polimórficas de carboidratos presentes nas células sanguíneas e no endotélio que limitam transfusões e alguns transplantes de órgãos sólidos entre indivíduos. Anticorpos naturais anti-A ou anti-B IgM preexistentes estão presentes em indivíduos que não expressam antígenos A ou B em suas células, respectivamente, estes anticorpos podem causar reações de transfusão e rejeição hiperaguda de aloenxerto.
• Os transplantes de células-tronco hematopoiéticas são suscetíveis à rejeição, e os receptores necessitam de uma intensa imunossupressão preparatória. Além disso, linfócitos T no enxerto de medula óssea podem responder a aloantígenos do hospedeiro e causar GVHD. A GVHD aguda se caracteriza por morte celular epitelial na pele, no trato intestinal e no fígado e pode ser fatal. A GVHD crônica é caracterizada por fibrose e atrofia de um ou mais dos mesmos órgãos-alvo, como os pulmões, e pode também ser fatal. Receptores de transplantes de medula óssea também desenvolvem uma imunodeficiência grave, tornando-os suscetíveis a infecções.
Reconhecimento e Rejeição de Transplantes Alogênicos
Baldwin WM, Valujskikh A, Fairchild RL. Antibody-mediated rejection: emergence of animal models to answer clinical questions. American Journal of Transplantation. 2010;10:1135-1142.
Colvin RB, Smith RN. Antibody-mediated organ-allograft rejection. Nature Review Immunology. 2005;5:807-817.
Heeger PS. T-cell allorecognition and transplant rejection: a summary and update. American Journal of Transplantation. 2003;3:525-533.
LaRosa DF, Rahman AH, Turka LA. The innate immune system in allograft rejection and tolerance. Journal of Immunology. 2007;178:7503-7509.
Li XC, Rothstein DM, Sayegh MH. Costimulatory pathways in transplantation: challenges and new developments. Immunological Reviews. 2009;229:271-293.
Chinen J, Buckley RH. Transplantation immunology: solid organ and bone marrow. Journal of Allergy and Clinical Immunology. 2010;125:S324-S335.
Lechler RI, Sykes M, Thomson AW, Turka LA. Organ transplantation—how much of the promise has been realized? Nature Medicine. 2005;11:605-613.
Ricordi C, Strom TB. Clinical islet transplantation: advances and immunological challenges. Nature Reviews Immunology. 2004;4:259-268.
Rogers NJ, Lechler RI. Allorecognition. American Journal of Transplantation. 2001;1:97-102.
Imunossupressão e Indução de Tolerância aos Aloenxertos
Chidgey AP, Layton D, Trounson A, Boyd RL. Tolerance strategies for stem-cell-based therapies. Nature. 2008;453:330-377.
Gibbons C, Sykes M. Manipulating the immune system for anti-tumor responses and transplant tolerance via mixed hematopoietic chimerism. Immunological Reviews. 2008;223:334-360.
Halloran PF. Immunosuppressive drugs for kidney transplantation. New England Journal of Medicine. 2004;351:2715-2729.
Newell KA, Larsen CP, Kirk AD. Transplant tolerance: converging on a moving target. Transplantation. 2006;81:1-6.
Safinia N, Sagoo P, Lechler R, Lombardi G. Adoptive regulatory T cell therapy: challenges in clinical transplantation. Current Opinions in Organ Transplantation. 2010;15:427-434.
Turka LA, Lechler RI. Towards the identification of biomarkers of transplantation tolerance. Nature Reviews Immunology. 2009;9:521-526.