CAPÍTULO 3 Migração dos Leucócitos para os Tecidos
MOLÉCULAS DE ADESÃO DOS LEUCÓCITOS E DAS CÉLULAS ENDOTELIAIS ENVOLVIDAS NO RECRUTAMENTO DOS LEUCÓCITOS,
QUIMIOCINAS E RECEPTORES DE QUIMIOCINAS,
INTERAÇÕES DE LEUCÓCITOS COM AS CÉLULAS ENDOTELIAIS E EXTRAVASAMENTO DOS LEUCÓCITOS,
MIGRAÇÃO DOS NEUTRÓFILOS E DOS MONÓCITOS PARA OS LOCAIS DE INFECÇÃO OU DE LESÃO TECIDUAL,
Uma propriedade singular do tecido imunológico que o distingue dos outros sistemas de tecidos do corpo é o movimento constante e altamente regulado de seus principais componentes celulares pelo sangue, nos tecidos e, com frequência, de volta ao sangue. Esse movimento desempenha três funções principais (Fig. 3-1):
• Transporte dos leucócitos de linhagem mieloide (principalmente neutrófilos e monócitos) de seu local de maturação na medula óssea até os locais teciduais de infecção ou de lesão, onde essas células executam suas funções protetoras de eliminação dos agentes infecciosos, remoção dos tecidos mortos e reparo da lesão.
• Transporte dos linfócitos de seus locais de maturação (medula óssea ou timo) para os órgãos linfoides secundários, onde entram em contato com antígenos e sofrem diferenciação em linfócitos efetores.
• Transporte dos linfócitos efetores dos órgãos linfoides secundários em que foram produzidos até locais de infecção em qualquer tecido no qual desempenham suas funções protetoras.
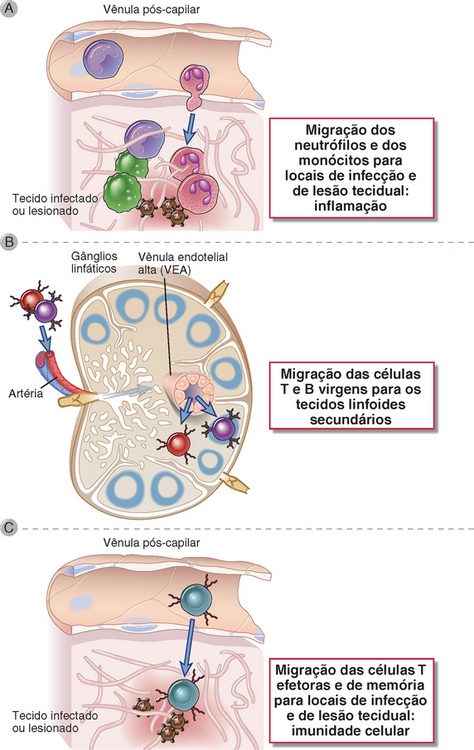
FIGURA 3-1 As principais funções da migração dos leucócitos do sangue para os tecidos. A, Os neutrófilos e os monócitos que se originam na medula óssea são recrutados para os locais teciduais de infecção ou de lesão, onde eliminam patógenos e procedem à remoção dos tecidos mortos e reparo da lesão. B, Os linfócitos virgens que se desenvolvem na medula óssea ou no timo estabelecem residência nos órgãos linfoides secundários, como os gânglios linfáticos (ou o baço, não mostrado nesta figura), onde são ativados por antígenos e se diferenciam em linfócitos efetores. C, Os linfócitos efetores que surgem nos órgãos linfoides secundários migram para os locais teciduais de infecção, onde participam na defesa microbiana.
A migração de um tipo específico de leucócito para um tipo restrito de tecido, ou para um tecido com infecção em processo de evolução ou que tenha sofrido lesão, é frequentemente denominada endereçamento dos leucócitos (homing), e o processo geral de movimento dessas células do sangue para os tecidos é conhecido como recrutamento. A migração dos leucócitos até os tecidos obedece a vários princípios gerais.
• Os leucócitos que não foram ativados por estímulos externos (i. e., considerados como estando em estado de repouso) estão normalmente localizados na circulação e nos órgãos linfoides. Somente após a ocorrência de ativação é que essas células são rapidamente recrutadas para locais em que são necessárias. Tipicamente, os estímulos ativadores consistem em produtos de micro-organismos e células mortas (durante as respostas imunes inatas) e antígenos (durante as respostas imunes adaptativas).
• As células endoteliais nos locais de infecção e de lesão tecidual também são ativadas, principalmente em resposta a citocinas secretadas por macrófagos e por outras células teciduais nesses locais. A ativação endotelial resulta em aumento da adesão das células endoteliais aos leucócitos circulantes. A base molecular dessa adesão será descrita posteriormente.
• O recrutamento dos leucócitos e das proteínas plasmáticas do sangue para os locais de infecção e de lesão tecidual é denominado inflamação. A inflamação é desencadeada pelo reconhecimento de micro-organismos e tecidos mortos nas respostas imunes inatas e é intensificada e prolongada durante as respostas imunes adaptativas. Esse processo permite que as células e moléculas de defesa do hospedeiro cheguem aos locais em que os agentes agressores devem ser combatidos. O mesmo processo é responsável pela lesão tecidual e encontra-se na base de muitas doenças importantes. Voltaremos a discutir o processo de inflamação no contexto da imunidade inata, no Capítulo 4, bem como na descrição das doenças inflamatórias, no Capítulo 18.
O recrutamento dos leucócitos do sangue para os tecidos depende, em primeiro lugar, da adesão dos leucócitos ao revestimento endotelial das vênulas pós-capilares e, em seguida, do movimento através do endotélio e da membrana basal subjacente para dentro do tecido extravascular. Trata-se de um processo em múltiplas etapas, em que cada etapa é coordenada por diferentes tipos de moléculas, incluindo quimiocinas e moléculas de adesão. O mesmo processo básico ocorre com diferentes tipos de leucócitos (neutrófilos, monócitos e linfócitos virgens e efetores) guiados para diferentes tipos de tecidos (órgãos linfoides secundários, tecidos infectados), embora sejam observadas variações nas quimiocinas e moléculas de adesão específicas, resultando em diferentes propriedades de migração para cada tipo celular. Antes de descrever o processo, discutiremos as propriedades e as funções das moléculas de adesão e das quimiocinas que estão envolvidas no recrutamento dos leucócitos.
MOLÉCULAS DE ADESÃO DOS LEUCÓCITOS E DAS CÉLULAS ENDOTELIAIS ENVOLVIDAS NO RECRUTAMENTO DOS LEUCÓCITOS
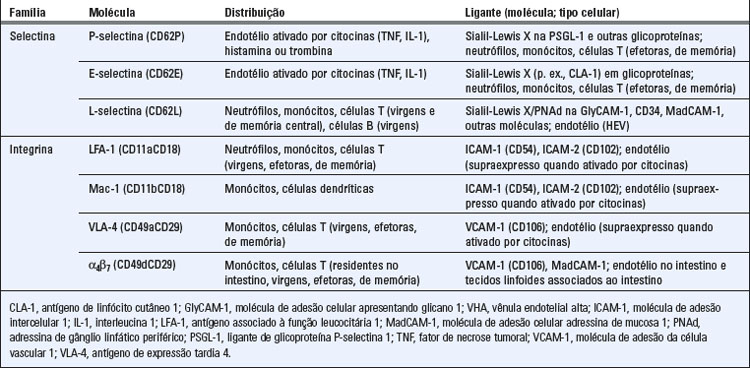
A migração dos leucócitos do sangue para os tecidos envolve um processo de adesão entre os leucócitos circulantes e as células endoteliais vasculares como um evento preliminar ao movimento dos leucócitos dos vasos para dentro dos tecidos. Essa adesão é mediada por duas classes de moléculas, denominadas selectinas e integrinas, e seus ligantes. A expressão dessas moléculas varia entre diferentes tipos de leucócitos e nos vasos sanguíneos em diferentes locais. A seguir, descrevemos as principais selectinas e integrinas e seus ligantes, bem como seus papéis no recrutamento dos leucócitos para os tecidos.
Selectinas e Ligantes de Selectinas
As selectinas são moléculas de adesão que se ligam a carboidratos da membrana plasmática medeiando assim a etapa inicial na adesão de baixa afinidade dos leucócitos circulantes com as células endoteliais que revestem as vênulas pós-capilares (Tabela 3-1). Os domínios extracelulares das selectinas assemelham-se às lectinas do tipo C, assim denominadas devido à sua ligação a carboidratos (a definição das lectinas) por um processo dependente de cálcio. As selectinas e seus ligantes são expressos nos leucócitos e nas células endoteliais.
As células endoteliais expressam dois tipos de selectinas, denominadas P-selectina (CD62P) e E-selectina (CD62E). A P-selectina, assim designada por ter sido encontrada pela primeira vez nas plaquetas, é armazenada em grânulos citoplasmáticos das células endoteliais e é rapidamente redistribuída para a superfície da célula, em resposta a produtos microbianos, citocinas, histamina dos mastócitos e trombina gerada durante a coagulação sanguínea. A E-selectina é sintetizada e expressa na superfície da célula endotelial dentro de 1 a 2 horas, em resposta às citocinas interleucina 1 (IL-1) e fator de necrose tumoral (TNF), bem como a produtos microbianos, como o lipopolissacarídio (LPS). A IL-1, o TNF e o LPS serão discutidos na seção em que descrevemos a inflamação, no Capítulo 4.
Os ligantes nos leucócitos que se ligam à E-selectina e P-selectina das células endoteliais consistem em grupos de carboidratos complexos que contêm sialil, relacionados com a família Lewis X ou Lewis A, presentes em várias glicoproteínas de superfície dos granulócitos e monócitos e algumas células T de memória e efetoras previamente ativadas. Entre eles, o mais bem definido é o tetrassacarídio denominado sialil-Lewis X (sLeX). Uma glicoproteína de membrana dos leucócitos, denominada ligante de glicoproteína da P-selectina 1 (PSGL-1), é modificada após tradução para exibir os ligantes de carboidrato para a P-selectina. Várias moléculas diferentes podem exibir os ligantes de carboidrato para a E-selectina, inclusive as glicoproteínas PSGL-1, e ligante da E-selectina 1 e alguns glicolipídios.
Uma terceira selectina, denominada L-selectina (CD62L), é expressa nos leucócitos, mas não nas células endoteliais. Os ligantes da L-selectina são sialomucinas encontradas nas vênulas endoteliais altas, denominadas, em conjunto, adressina de gânglios linfáticos periféricos (PNAd). O determinante de reconhecimento principal ao qual se liga a L-selectina nessas sialomucinas é sialil 6-sulfo-Lewis X. A expressão desses ligantes é aumentada com a ativação das células endoteliais pelas citocinas. A L-selectina nos neutrófilos serve para a ligação dessas células às células endoteliais que são ativadas pela IL-1, pelo TNF e por outras citocinas produzidas em locais de inflamação. Na imunidade adaptativa, a L-selectina é importante para guiar os linfócitos T virgens (naïve) até os gânglios linfáticos, através das vênulas endoteliais altas. Os leucócitos expressam L-selectina e os ligantes de carboidratos da P-selectina e da E-selectina na região apical de suas microvilosidades, facilitando as interações com moléculas na superfície da célula endotelial.
Integrinas e Ligantes de Integrinas
As integrinas são proteínas heterodiméricas de superfície celular, compostas de duas cadeias polipeptídicas ligadas de modo não covalente, que medeiam a adesão das células a outras células ou à matriz extracelular, através de interações de ligação específicas com diversos ligantes. Existem mais de 30 integrinas diferentes, e todas apresentam a mesma estrutura básica, contendo um dos mais de 15 tipos de cadeias α e um dos sete tipos de cadeias β. As cabeças globulares extracelulares de ambas as cadeias contribuem não apenas para a ligação entre cadeias como também para a ligação de ligantes dependente de cátions divalentes. Os domínios citoplasmáticos das integrinas interagem com componentes do citoesqueleto (incluindo vinculina, talina, actina, α-actina e tropomiosina). O nome dessa família de proteínas provém da ideia de que elas coordenam (i.e., integram) sinais gerados quando se ligam a ligantes extracelulares com motilidade dependente do citoesqueleto, alteração da forma e respostas fagocíticas.
No sistema imune, as integrinas mais importantes são duas integrinas expressas nos leucócitos, denominadas LFA-1 (antígeno associado à função leucocitária 1, mais precisamente denominado β2αL ou CD11aCD18) e VLA-4 (antígeno de expressão tardia 4, ou β1α4, ou CD49dCD29) (Tabela 3-1). Um importante ligante para o LFA-1 é a molécula de adesão intercelular 1 (ICAM-1, CD54), uma glicoproteína de membrana expressa nas células endoteliais ativadas por citocinas e em uma variedade de outros tipos de células, inclusive linfócitos, células dendríticas, macrófagos, fibroblastos e ceratinócitos. A porção extracelular da ICAM-1 é composta de domínios globulares que compartilham alguma homologia de sequência e características estruturais terciárias de domínios encontrados em moléculas de imunoglobulina (Ig), sendo assim denominados domínios Ig. (Muitas proteínas do sistema imunológico contêm domínios de Ig e pertencem à superfamília das Ig, que é discutida de modo mais detalhado no Cap. 5.) A ligação do LFA-1 à ICAM-1 é importante para as interações entre leucócitos e células endoteliais (discutidas posteriormente) e as interações das células T com células apresentadoras de antígenos (Cap. 6). Dois outros ligantes da superfamília das Ig para o LFA-1 são a ICAM-2, que é expressa nas células endoteliais, e a ICAM-3, expressa nos linfócitos. O VLA-4 liga-se à molécula de adesão da célula vascular 1 (VCAM-1, CD106), uma proteína da superfamília das Ig expressa nas células endoteliais ativadas por citocinas de alguns tecidos, e essa interação é importante para o recrutamento dos leucócitos nos locais de inflamação. Outras integrinas também desempenham papéis nas respostas imunes tanto inata quanto adaptativa. Por exemplo, o Mac-1 (β2αm, CD11bCD18) nos monócitos circulantes liga-se à ICAM-1 e medeia a adesão ao endotélio. O Mac-1 também atua como receptor do complemento, ligando partículas opsonizadas por fragmentos C3b inativado (iC3b) que resultam da ativação do complemento, intensificando, dessa maneira, a fagocitose dos micro-organismos.
Uma importante característica das integrinas é a sua capacidade de responder a sinais intracelulares através de um rápido aumento de sua afinidade com seus ligantes (Fig. 3-2). Esse processo é designado como ativação e ocorre em resposta a sinais gerados da ligação de quimiocinas a receptores de quimiocinas e, nos linfócitos, por sinais intracelulares gerados quando o antígeno liga-se a receptores de antígeno. O processo de alterações na afinidade de ligação do domínio extracelular das integrinas induzido por sinais intracelulares é denominado sinalização de dentro para fora. A sinalização de dentro para fora induzida por receptores de quimiocinas e de antígenos envolve proteínas de ligação de GTP (descritas de modo mais detalhado posteriormente), levando finalmente à associação de moléculas da família RAP e de proteínas de interação ao citoesqueleto às caudas citoplasmáticas das proteínas de integrina. Portanto, as mudanças resultantes de afinidade são uma consequência das alterações na conformação dos domínios extracelulares. No estado de baixa afinidade, os pedículos dos domínios extracelulares de cada subunidade das integrinas aparecem inclinados, e as cabeças globulares de ligação aos ligantes estão mais próximas da membrana. Em resposta a alterações na cauda citoplasmática, os pedículos estendem-se à maneira de um canivete de mola, afastando as cabeças globulares da membrana até uma posição onde elas interagem mais efetivamente com seus ligantes (Fig. 3-2).
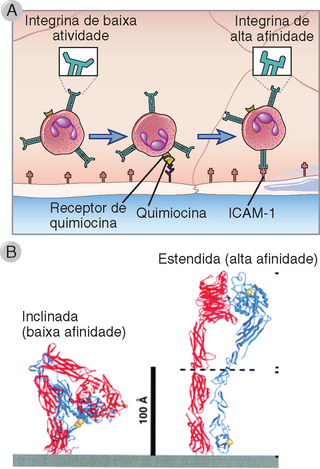
FIGURA 3-2 Ativação das integrinas. A, As integrinas nos leucócitos do sangue circulante estão normalmente em um estado de baixa afinidade. Quando um leucócito se aproxima das células endoteliais, como durante o processo de rolamento dos leucócitos dependente de selectinas, as quimiocinas presentes na superfície endotelial podem ligar-se a receptores de quimiocinas do leucócito. Em seguida, ocorre sinalização dos receptores de quimiocinas, o que ativa as integrinas dos leucócitos, aumentando a sua afinidade pelos seus ligantes nas células endoteliais. B, Diagramas das conformações em fita inclinada e estendida de uma integrina de leucócito, correspondendo aos estados de baixa e de alta afinidade, respectivamente.
(B, De Takagi J, and TA Springer. Integrin activation and structural rearrangement. Immunological Reviews 186:141-163, 2002.)
As quimiocinas também induzem o agrupamento das integrinas de membrana. Isso resulta em aumento da avidez de interações das integrinas com ligantes nas células endoteliais e, portanto, em ligação mais firme dos leucócitos ao endotélio.
QUIMIOCINAS E RECEPTORES DE QUIMIOCINAS
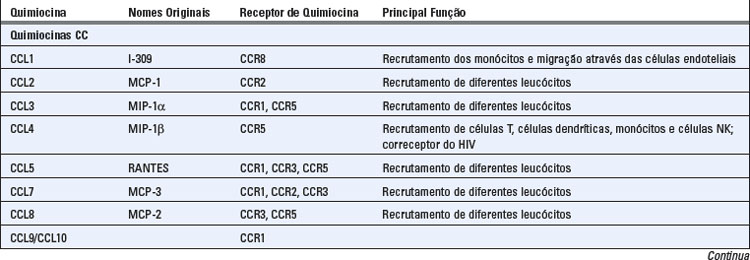
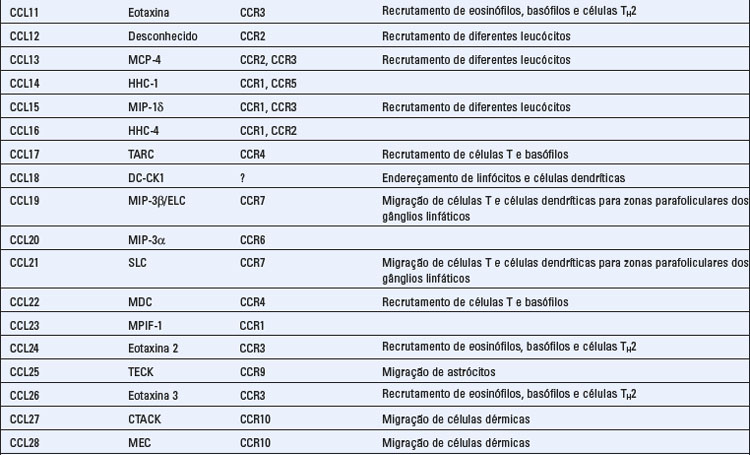
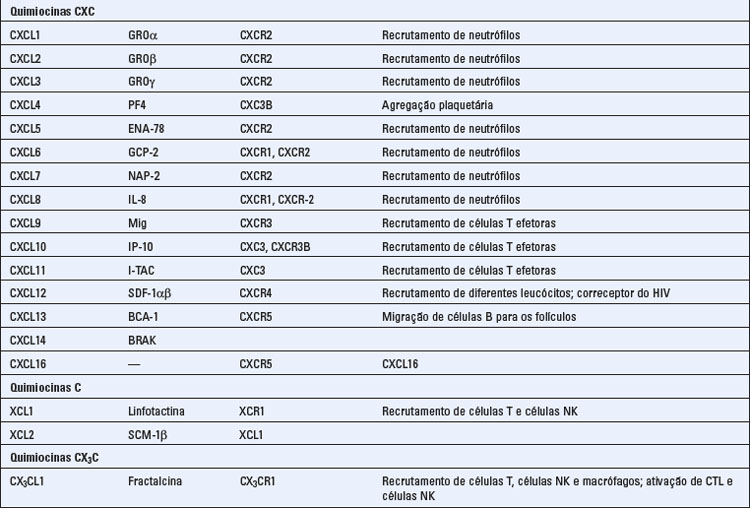
As quimiocinas formam uma grande família de citocinas estruturalmente homólogas, que estimulam o movimento dos leucócitos e regulam a sua migração do sangue para os tecidos. O termo quimiocina é uma contração de “citocina quimiotática”. Mencionamos anteriormente o papel das quimiocinas na organização do tecido linfoide, e agora iremos descrever as propriedades gerais dessa família de citocinas e resumir suas múltiplas funções na imunidade tanto inata quanto adaptativa. A Tabela 3-2 fornece um resumo das principais características das quimiocinas e seus receptores.
Estrutura, Produção e Receptores de Quimiocinas
Existem cerca de 50 quimiocinas humanas, e todas consistem em polipeptídios de 8 a 12 kD, que contêm duas alças de dissulfeto internas. As quimiocinas são classificadas em quatro famílias, com base no número e na localização dos resíduos de cisteína N-terminais. As duas principais famílias são as quimiocinas CC (também denominadas β), em que os resíduos de cisteína são adjacentes, e a família CXC (ou α), cujos resíduos estão separados por um aminoácido. Essas diferenças correlacionam-se com a organização das subfamílias em grupos de genes separados. Um pequeno número de quimiocinas apresenta uma única cisteína (família C) ou duas cisteínas separadas por três aminoácidos (CX3C). De início, as quimiocinas foram designadas com base no modo de sua identificação e no tipo de resposta deflagrado. Mais recentemente, está sendo utilizada uma nomenclatura padronizada, baseada, em parte, nos receptores aos quais as quimiocinas se ligam (Tabela 3-2). Embora existam exceções, as quimiocinas CC, em sua maior parte, e seus receptores medeiam o recrutamento dos neutrófilos e dos linfócitos, enquanto a maior parte das quimiocinas CXC e seus receptores recrutam os monócitos e os linfócitos.
As quimiocinas das subfamílias CC e CXC são produzidas pelos leucócitos e por vários tipos de células teciduais, como as células endoteliais, as células epiteliais e os fibroblastos. Em muitas dessas células, a secreção de quimiocinas é induzida pelo reconhecimento de micro-organismos através de vários receptores celulares do sistema imune inato, que é discutido no Capítulo 4. Além disso, as citocinas inflamatórias, principalmente o TNF e a IL-1, induzem a produção de quimiocinas. Várias quimiocinas CC também são produzidas por células T estimuladas por antígenos, proporcionando uma ligação entre a imunidade adaptativa e o recrutamento dos leucócitos inflamatórios.
Os receptores de quimiocinas pertencem à superfamília de receptores transmembrana acoplados à proteína (G) que se liga à guanina trifosfato (GTP) (GPCR), que atravessa sete vezes a membrana. Esses receptores iniciam respostas intracelulares através de proteínas G triméricas associadas. Em uma célula em repouso, as proteínas G associadas ao receptor formam um complexo inativo estável que contém guanosina difosfato (GDP) ligado às subunidades Gα. A ocupação do receptor pelo ligante resulta em uma troca do GDP pelo GTP. A forma da proteína G ligada ao GTP ativa numerosas enzimas celulares, inclusive uma isoforma da fosfolipase C específica de fosfatidilinositol, que atua para aumentar o cálcio intracelular e ativar a proteinocinase C. As proteínas G estimulam alterações no citoesqueleto, bem como a polimerização dos filamentos de actina e miosina, resultando em aumento da motilidade celular. Esses sinais também modificam a conformação das integrinas de superfície celular e aumentam a afinidade das integrinas com seus ligantes. Os receptores de quimiocina podem sofrer rápida regulação negativa (redução em sua expressão) seguindo a exposição à própria quimiocina, constituindo provavelmente um mecanismo para a interrupção das respostas.
Diferentes combinações de mais de 17 receptores de quimiocinas distintos são expressas em diferentes tipos de leucócitos, resultando em padrões distintos de migração dos leucócitos. Existem 10 receptores distintos para as quimiocinas CC (denominados CCR1 a CCR10), seis receptores para as quimiocinas CXC (denominados CXCR1 a CXCR6) e um receptor para CX3CL1 (denominado CX3CR1) (Tabela 3-2). Os receptores de quimiocinas são expressos em todos os leucócitos, dentre os quais, as células T exibem o maior número e a maior diversidade. Os receptores apresentam uma sobreposição de especificidade para as quimiocinas dentro de cada família, e o padrão de expressão celular dos receptores determina que tipos de células irão responder a quimiocinas específicas. Certos receptores de quimiocinas, notavelmente o CCR5 e o CXCR4, atuam como co-receptores para o vírus da imunodeficiência humana (HIV) (Cap. 20). Alguns linfócitos T ativados secretam quimiocinas que se ligam ao CCR5 e que bloqueiam a infecção pelo HIV através de sua competição com o vírus.
Ações Biológicas das Quimiocinas
Algumas quimiocinas são produzidas pelos leucócitos e por outras células em resposta a estímulos externos e estão envolvidas em reações inflamatórias, enquanto outras quimiocinas são produzidas de modo constitutivo nos tecidos e desempenham um papel na organização do tecido. As quimiocinas foram descobertas em virtude de sua atividade como quimioatraentes dos leucócitos, e esta ação constitui a principal base de seus papéis funcionais.
• As quimiocinas são essenciais para o recrutamento dos leucócitos circulantes dos vasos sanguíneos para dentro dos locais extravasculares. O recrutamento dos leucócitos, inclusive dos leucócitos virgens que entram nos gânglios linfáticos através das vênulas endoteliais altas e linfócitos efetores, monócitos e neutrófilos que penetram nos locais de infecção nos tecidos, é regulado pelas ações de várias quimiocinas. As quimiocinas produzidas nos tecidos ligam-se ao sulfato de heparina dos proteoglicanos sobre as células endoteliais que revestem as vênulas pós-capilares e são apresentadas dessa maneira aos leucócitos circulantes que se ligam às superfícies endoteliais através de interações com moléculas de adesão. A deposição dessas quimiocinas sobre a membrana endotelial proporciona uma alta concentração local destes quimioatraentes que são capazes de se ligar aos receptores de quimiocinas nos leucócitos. Os sinais deflagrados dos receptores de quimiocinas levam a um aumento da afinidade das integrinas, resultando em adesão firme do leucócito — uma etapa crucial para a migração dos leucócitos dos vasos sanguíneos para dentro do tecido extravascular. Diferentes quimiocinas atuam em células distintas e, portanto, em coordenação com os tipos de moléculas de adesão expressas, controlam a natureza do infiltrado inflamatório.
• As quimiocinas extravasculares estimulam o movimento orientado dos leucócitos porque seguem um gradiente de concentração da proteína secretada, processo denominado quimiocinese. Dessa maneira, os leucócitos podem ser direcionados para as células infectadas nos tecidos ou para determinadas regiões dentro dos órgãos linfoides.
• As quimiocinas estão envolvidas no desenvolvimento dos órgãos linfoides, e regulam o trânsito dos linfócitos e de outros leucócitos através dos tecidos linfoides periféricos. A função das quimiocinas na organização anatômica dos tecidos linfoides foi discutida no Capítulo 2.
• As quimiocinas são necessárias para a migração das células dendríticas dos locais de infecção para os gânglios linfáticos regionais (drenantes). As células dendríticas desempenham um papel-chave ao estabelecer uma ligação entre a imunidade inata e a adaptativa. Elas utilizam vários receptores para reconhecer os micro-organismos nos tecidos periféricos e responder a eles; em seguida, migram até os gânglios linfáticos, onde informam os linfócitos T sobre a presença de infecção (discutida no Cap. 6). A migração depende do aumento na expressão do CCR7 na célula dendrítica, em resposta ao reconhecimento aos micro-organismos. O CCR7 permite à célula dendrítica responder à CCL19 e à CCL21, duas quimiocinas que são produzidas nos gânglios linfáticos. Convém lembrar que o CCR7 também é o receptor de quimiocinas nas células T virgens, o que explica como as células dendríticas e as células T virgens estão localizadas na mesma região nos gânglios linfáticos, possibilitando a apresentação do antígeno pelas células dendríticas às células T.
INTERAÇÕES DE LEUCÓCITOS COM AS CÉLULAS ENDOTELIAIS E EXTRAVASAMENTO DOS LEUCÓCITOS
As selectinas, as integrinas e as quimiocinas atuam em conjunto para reger as interações entre leucócitos e células endoteliais que são necessárias para a migração dos leucócitos nos tecidos (Fig. 3-3). Estudos dessas interações em condições de fluxo in vitro, e pelo uso de técnicas microscópicas intravitais in vivo estabeleceram uma sequência de eventos comuns na migração da maioria dos leucócitos para a maior parte dos tecidos. Esses eventos incluem:
• Rolamento dos leucócitos mediado por selectinas sobre o endotélio. Em resposta aos micro-organismos e às citocinas produzidas por células (p. ex., macrófagos) que entram em contato com agentes infecciosos, as células endoteliais que revestem as vênulas pós-capilares no local da infecção aumentam rapidamente a expressão de selectinas em sua superfície. Os leucócitos circulam próximo às paredes das vênulas revestidas por endotélio nos locais de resposta imune inata, em consequência da vasodilatação e lentificação do fluxo sanguíneo, e os ligantes de selectinas sobre as microvilosidades dos leucócitos ligam-se às selectinas na superfície das células endoteliais. Como as interações de selectina e ligante de selectina são de baixa afinidade (Kd ∼100 μM), com rápida taxa de desligamento, elas são facilmente rompidas pela força de cisalhamento do fluxo sanguíneo. Em consequência, os leucócitos desprendem-se repetidamente e ligam-se novamente e, dessa maneira, rolam ao longo da superfície endotelial. Essa lentificação dos leucócitos sobre o endotélio permite a atuação do conjunto de estímulos seguinte sobre os leucócitos, no processo em múltiplas etapas.
• Aumento da afinidade das integrinas mediado por quimiocinas. Conforme foi discutido anteriormente, as quimiocinas são produzidas no local de infecção por vários tipos de células, em resposta a uma variedade de patógenos ou estímulos endógenos. Uma vez secretadas, são transportadas até a superfície luminal das células endoteliais das vênulas pós-capilares, onde se ligam aos glicosaminoglicanos que contenham o domínio de sulfato de heparina e são expressos em altas concentrações. Nesse local, as quimiocinas ligam-se aos receptores específicos de quimiocinas sobre as superfícies dos leucócitos em rolamento. As integrinas leucocitárias encontram-se em um estado de baixa afinidade nas células não ativadas e não são efetivas na mediação de interações de adesão. Duas consequências da sinalização via receptor de quimiocina incluem o aumento de afinidade das integrinas leucocitárias com seus ligantes e o agrupamento das integrinas na membrana, resultando em aumento de avidez de ligação das integrinas leucocitárias a seus ligantes sobre a superfície endotelial.
• Adesão estável dos leucócitos ao endotélio mediada por integrinas. Paralelamente à ativação das integrinas e a sua conversão para um estado de alta afinidade, as citocinas (TNF e IL-1) também aumentam a expressão endotelial de ligantes de integrina, principalmente a VCAM-1, o ligante da integrina VLA-4, e a ICAM-1, o ligante das interinas LFA-1 e Mac-1. O resultado final dessas alterações consiste na fixação firme dos leucócitos ao endotélio, reorganização do citoesqueleto e adesão a uma área maior da superfície endotelial, passo fundamental para que ocorra a transmigração.
• Transmigração dos leucócitos através do endotélio. Com maior frequência, os leucócitos transmigram entre as bordas das células endoteliais, processo conhecido como transmigração paracelular, para alcançar os tecidos extravasculares. A transmigração paracelular depende das integrinas dos leucócitos e de seus ligantes sobre as células endoteliais, bem como de outras proteínas, notavelmente CD31, que é expressa nos leucócitos e nas células endoteliais. Esse processo exige uma ruptura transitória e reversível das proteínas envolvidas nas junções de adesão, que mantém as células endoteliais pós-capilares unidas entre si, principalmente o complexo VE-caderina. Acredita-se que o mecanismo responsável pela ruptura do complexo VE-caderina envolva a ativação de cinases, quando as integrinas leucocitárias ligam-se à ICAM-1 ou à VCAM-1. As cinases fosforilam a cauda citoplasmática da VE-caderina, levando à ruptura reversível do complexo de adesão. Com menor frequência, foi observado que os leucócitos movem-se através das células endoteliais, e não entre elas, através de um processo menos elucidado, denominado migração transcelular.
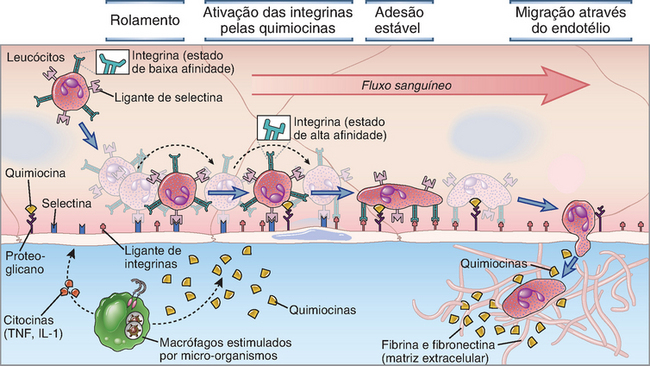
FIGURA 3-3 Interações dos leucócitos às células endoteliais por múltiplas etapas, que medeiam o recrutamento dos leucócitos para os tecidos. Nos locais de infecção, os macrófagos que entraram em contato com micro-organismos produzem citocinas (como o TNF e a IL-1), que ativam as células endoteliais de vênulas adjacentes a produzir selectinas, ligantes de integrinas e quimiocinas. As selectinas medeiam a fixação fraca e o rolamento dos leucócitos do sangue circulante sobre o endotélio, e a força de cisalhamento do fluxo sanguíneo faz com que os leucócitos rolem ao longo da superfície endotelial. As quimiocinas produzidas nos tecidos infectados adjacentes ou pelas células endoteliais são apresentadas na superfície endotelial e ligam-se aos receptores presentes nos leucócitos em processo de rolamento, resultando em ativação das integrinas leucocitárias a um estado de ligação de alta afinidade. As integrinas ativadas ligam-se a seus ligantes pertencentes à superfamília das Ig que são expressos na células endoteliais, mediando a adesão firme dos leucócitos. Em seguida, os leucócitos rastejam pelas junções entre as células endoteliais e migram através da parede venular. Os neutrófilos, os monócitos e os linfócitos T utilizam essencialmente os mesmos mecanismos para migrar do sangue.
Existe uma especificidade nesse processo de migração dos leucócitos, com base na expressão de combinações distintas de moléculas de adesão e receptores de quimiocinas nos neutrófilos, monócitos e em diferentes subgrupos de linfócitos, conforme será discutido de modo mais detalhado adiante.
As evidências do papel essencial das selectinas, integrinas e quimiocinas na migração dos leucócitos derivam de experimentos conduzidos em camundongos nocauteados (knockouts) para genes, assim como de observações em doenças humanas raras causadas por mutações gênicas. Por exemplo, os camundongos que carecem de fucosiltransferases, que são enzimas necessárias para a síntese dos ligantes de carboidratos que se ligam às selectinas, apresentam um acentuado defeito na migração dos leucócitos e nas respostas imunológicas. Os seres humanos que carecem de uma das enzimas necessárias para expressar os ligantes de carboidratos para a E-selectina e a P-selectina nos neutrófilos possuem problemas similares, resultando em uma síndrome, denominada deficiência de adesão leucocitária tipo 2 (LAD-2) (Cap. 20). De modo semelhante, uma deficiência do gene CD18, de herança autossômica recessiva, que codifica a subunidade β do LFA-1 e Mac-1, constitui a causa de uma doença por imunodeficiência denominada deficiência de adesão leucocitária tipo 1 (LAD-1). Esses distúrbios caracterizam-se por infecções bacterianas e fúngicas recorrentes, ausência de acúmulo de neutrófilos nos locais de infecção e defeitos nas funções dos linfócitos dependentes da aderência. Mutações humanas raras nas vias de sinalização que ligam os receptores de quimiocinas à ativação de integrinas também resultam em comprometimento da adesão e do recrutamento dos leucócitos nos tecidos e, portanto, em defesa leucocitária ineficaz contra infecções.
MIGRAÇÃO DOS NEUTRÓFILOS E DOS MONÓCITOS PARA OS LOCAIS DE INFECÇÃO OU DE LESÃO TECIDUAL
Após passar pelo processo de maturação na medula óssea, os neutrófilos e os monócitos entram no sangue e circulam por todo o corpo. Embora essas células possam desempenhar algumas funções fagocíticas no sangue circulante, suas principais funções, inclusive a fagocitose dos micro-organismos e das células teciduais mortas, ocorrem nos locais extravasculares de infecção, praticamente em qualquer parte do corpo.
Os neutrófilos e os monócitos do sangue circulante são recrutados até locais de infecção e lesão dos tecidos por um processo em múltiplas etapas, dependente de selectinas, integrinas e quimiocinas, que segue a sequência básica comum à migração de todos os leucócitos até os tecidos, conforme foi discutido anteriormente. As citocinas (TNF e IL-1), secretadas durante a resposta imune inata aos micro-organismos, induzem a expressão de moléculas de adesão (selectinas e ligantes de integrina) sobre as células endoteliais, bem como a produção local de quimiocinas. Os neutrófilos e os monócitos na circulação ligam-se a essas moléculas de adesão e respondem às quimiocinas, resultando no recrutamento dos leucócitos para os tecidos.
Os neutrófilos e os monócitos expressam conjuntos distintos de moléculas de adesão e receptores de quimiocinas e, portanto, migram para diferentes locais de inflamação ou para o mesmo local de inflamação em momentos distintos. Conforme se discute detalhadamente no Capítulo 4, os neutrófilos constituem o primeiro tipo de leucócito a ser recrutado do sangue para um local de infecção ou de lesão tecidual. Segue-se o recrutamento dos monócitos dentro de algumas horas, que continua, talvez por vários dias, após cessar o recrutamento dos neutrófilos. Além disso, em alguns locais de inflamação, os neutrófilos não são recrutados, mas sim os monócitos. Esses diferentes comportamentos de migração refletem variações na expressão das moléculas de adesão e dos receptores de quimiocinas nos neutrófilos e nos monócitos, bem como o fato de que diferentes quimiocinas são expressas em locais diferentes ou em momentos distintos no mesmo local. Tanto os monócitos quanto os neutrófilos expressam ligantes de L-selectina e P- e E-selectina e utilizam todas as três selectinas para mediar as interações iniciais de rolamento com as células endoteliais ativadas por citocinas. Os neutrófilos expressam as integrinas LFA-1 e Mac-1, que, ao serem ativadas, ligam-se à ICAM-1 endotelial e medeiam a parada estável das células na parede vascular. Os monócitos expressam as integrinas LFA-1 e VLA-4, que se ligam, respectivamente, à ICAM-1 e à VCAM-1 endoteliais, causando uma parada estável desses leucócitos.
Os receptores de quimiocinas expressos nos neutrófilos e nos monócitos também são diferentes, o que provavelmente constitui o principal determinante do comportamento migratório divergente de cada tipo de célula. Os neutrófilos expressam o CXCR1 e o CXCR2, que se ligam às quimiocinas da família GRO, inclusive CXCL8 (IL-8), a principal quimiocina que sustenta a migração dos neutrófilos para os tecidos (Tabela 3-2). Por conseguinte, o recrutamento inicial de neutrófilos reflete a produção precoce e abundante de CXCL8 pelos macrófagos residentes teciduais, em resposta à infecção. Existem pelo menos duas populações de monócitos no sangue, e tanto nos seres humanos quanto nos camundongos as populações são definidas, em parte, pela expressão dos receptores de quimiocina. Os monócitos inflamatórios, que constituem o principal tipo recrutado para os locais de inflamação, expressam o CCR2 tanto em camundongos quanto nos seres humanos. Esse receptor liga-se a várias quimiocinas; entretanto, a mais importante para o recrutamento dos monócitos é a CCL2 (MCP-1). Por conseguinte, o recrutamento dos monócitos ocorre quando as células teciduais residentes expressam e secretam a CCL2 em resposta à infecção. A outra população de monócitos, algumas vezes denominada não clássica, carece do CCR2, porém expressa o CX3CR1. O ligante desse receptor, a CX3CL1, é expresso tanto na forma solúvel quanto na forma de molécula ligada à membrana, que pode sustentar a adesão dos monócitos ao endotélio.
Quando penetram nos locais de inflamação, os neutrófilos desempenham várias funções efetoras, que serão descritas no Capítulo 4, e morrem dentro de poucas horas. Os monócitos transformam-se em macrófagos nos tecidos e executam suas funções efetoras durante um período de dias a semanas. Alguns macrófagos podem migrar para os gânglios linfáticos através dos vasos linfáticos de drenagem.
MIGRAÇÃO E RECIRCULAÇÃO DOS LINFÓCITOS T
Os linfócitos estão em contínuo movimento através da corrente sanguínea, dos vasos linfáticos, tecidos linfoides secundários e tecidos não linfoides periféricos, e as populações funcionalmente distintas de linfócitos exibem diferentes padrões de trânsito por esses locais (Fig. 3-4). Quando uma célula T virgem emerge do timo e entra no sangue circulante, estabelece residência nos gânglios linfáticos, no baço ou nos tecidos linfoides de mucosa migrando para as zonas de células T desses tecidos linfoides secundários. Se não reconhecer um antígeno nesses locais, a célula T permanece virgem e deixa os gânglios linfáticos ou o tecido linfoide associado à mucosa através dos vasos linfáticos, drenando finalmente essas células de volta à corrente sanguínea. As células T virgens deixam o baço diretamente através da circulação. De volta ao sangue, a célula T virgem repete o processo de estabelecer residência em outros gânglios linfáticos secundários. Esse padrão de trânsito dos linfócitos virgens, denominado recirculação dos linfócitos, maximiza a probabilidade de que o número limitado de linfócitos virgens que emergem do timo e que são específicos para determinado antígeno estranho irá encontrar o antígeno se este estiver presente em qualquer parte do corpo. Os linfócitos que reconheceram e tornaram-se ativados pelo antígeno proliferam e se diferenciam, produzindo milhares de células efetoras e de memória dentro dos tecidos linfoides secundários. Os linfócitos efetores e de memória podem retornar à corrente sanguínea e, em seguida, migrar para locais de infecção ou de inflamação nos tecidos periféricos (não linfoides). Alguns subtipos de linfócitos efetores migram preferencialmente para determinado tecido, como a pele ou o intestino. O processo pelo qual determinadas populações de linfócitos entram seletivamente em gânglios linfáticos ou em determinados tecidos, mas não em outros, é denominado endereçamento (homing) dos linfócitos. A existência de diferentes padrões de endereçamento assegura o aporte de diferentes subtipos de linfócitos aos microambientes teciduais em que se fazem necessários para combater diferentes tipos de micro-organismos, e não de modo aleatório para locais em que não teriam qualquer finalidade. Na próxima seção, iremos descrever os mecanismos e as vias de recirculação e endereçamento dos linfócitos. Nossa discussão enfatiza as células T, visto que existe muito mais conhecimento sobre os seus movimentos através dos tecidos do que sobre a recirculação das células B.
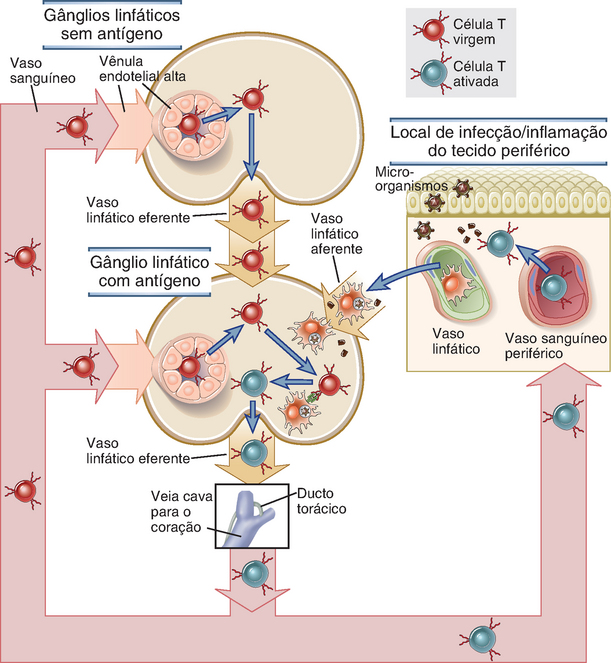
FIGURA 3-4 Vias de recirculação dos linfócitos. As células T virgens deixam preferencialmente o sangue e entram nos gânglios linfáticos através das vênulas endoteliais altas. As células dendríticas que transportam antígenos penetram nos gânglios linfáticos através dos vasos linfáticos. Quando reconhecem um antígeno, as células T são ativadas e retornam à circulação através dos vasos linfáticos eferentes e do ducto torácico, que desemboca na veia cava superior; em seguida, passam para o coração e, por fim, para a circulação arterial. As células T efetoras e de memória deixam preferencialmente o sangue e penetram nos tecidos periféricos através das vênulas nos locais de inflamação. A figura não mostra a recirculação por órgãos linfoides periféricos, a não ser os gânglios linfáticos.
Recirculação dos Linfócitos T Virgens entre o Sangue e os Órgãos Linfoides Secundários
A recirculação dos linfócitos T depende de mecanismos que controlam a entrada das células T virgens do sangue para dentro dos gânglios linfáticos, bem como de sinais moleculares que controlam o momento em que essas células deixam esses órgãos linfoides secundários. Esses dois mecanismos serão discutidos separadamente.
Migração das Células T Virgens para Dentro dos Gânglios Linfáticos
Os mecanismos de endereçamento que transportam as células T virgens até os gânglios linfáticos são muito eficientes, resultando em um fluxo efetivo de linfócitos através dos gânglios linfáticos de até 25 × 109 células por dia. Cada linfócito passa, em média, por um gânglio linfático uma vez por dia. A inflamação do tecido periférico, que geralmente acompanha as infecções, provoca um aumento significativo do fluxo sanguíneo para os gânglios linfáticos e, consequentemente, um aumento do influxo de células T para os gânglios linfáticos que drenam o local de inflamação. Ao mesmo tempo, a saída das células T dos vasos linfáticos eferentes é transitoriamente reduzida por mecanismos que serão discutidos adiante, de modo que as células T permanecem por mais tempo nos gânglios linfáticos que drenam locais de inflamação do que em outros gânglios linfáticos. Os antígenos estão concentrados nos órgãos linfoides secundários, inclusive gânglios linfáticos, tecidos linfoides associados à mucosa e no baço, onde são apresentados por células dendríticas maduras, o tipo de célula apresentadora de antígeno com maior capacidade de iniciar respostas das células virgens (Cap. 6). Por conseguinte, o movimento e a retenção transitória das células T virgens nos órgãos linfoides secundários maximizam a probabilidade de encontro com um antígeno específico e a iniciação de uma resposta imunológica adaptativa.
O endereçamento (homing) das células T virgens para dentro dos gânglios linfáticos e tecidos linfoides associados à mucosa ocorre através de vênulas pós-capilares especializadas, denominadas vênulas endoteliais altas (HEV) localizadas nas zonas de células T. Os linfócitos T virgens chegam aos tecidos linfoides secundários através do fluxo sanguíneo arterial e deixam a circulação, migrando no estroma dos gânglios linfáticos através das HEV. Esses vasos são revestidos por células endoteliais arredondadas, e não pelas células endoteliais planas que são típicas de outras vênulas (Fig. 3-5). As HEV são também encontradas em tecidos linfoides associados à mucosa, como as placas de Peyer no intestino, mas não no baço. As células endoteliais das HEV são especializadas em exibir determinadas moléculas de adesão e quimiocinas sobre a sua superfície, discutidas mais adiante, que sustentam o endereçamento seletivo de apenas determinadas populações de linfócitos. São necessárias certas citocinas, como a linfotoxina, para o desenvolvimento das HEV. Com efeito, as HEV podem desenvolver-se em locais extralinfoides de inflamação crônica, onde essas citocinas são produzidas durante intervalos prolongados de tempo.
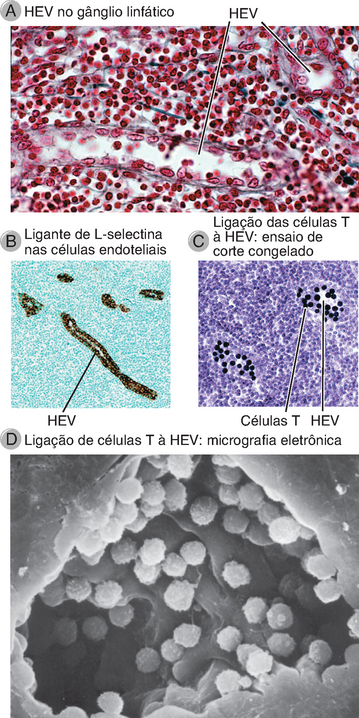
FIGURA 3-5 Vênulas endoteliais altas. A, Micrografia óptica de uma HEV em um gânglio linfático, ilustrando as células endoteliais altas. B, Expressão do ligante de L-selectina nas HEV, corado com um anticorpo específico pela técnica de imunoperoxidase. (A localização do anticorpo é revelada por um produto de reação da peroxidase, de cor marrom, que está acoplado ao anticorpo; ver Apêndice IV para mais detalhes.) As HEV são abundantes na zona de células T do gânglio linfático. C, Ensaio de ligação em que são incubados linfócitos com cortes congelados de um gânglio linfático. Os linfócitos (corados de azul intenso) ligam-se seletivamente às HEV. D, Micrografia eletrônica de varredura de uma HEV com linfócitos fixados à superfície luminal das células endoteliais.
A, (Cortesia de Dr. Steve Rosen, Department of Anatomy, University of California, San Francisco.) B, (Cortesia de Drs. Steve Rosen e Akio Kikuta, Department of Anatomy, University of California, San Francisco.) C, (Cortesia de Dr. Steve Rosen, Department of Anatomy, University of California, San Francisco.) D, (Cortesia de J. Emerson and T. Yednock, University of California, San Francisco, School of Medicine. De Rosen SD and LM Stoolman. Potential role of cell surface lectin in lymphocyte recirculation. In Olden K and J Parent [eds]. Vertebrate Lectins. Van Nostrand Reinhold, New York, 1987.)
A migração das células T virgens do sangue, através das HEV, para dentro do parênquima dos gânglios linfáticos constitui um processo em múltiplas etapas, que consiste em rolamento das células mediado por selectinas, ativação das integrinas induzida por quimiocinas, adesão firme mediada por integrinas e transmigração através da parede vascular (Fig. 3-6). Esse processo assemelha-se à migração de outros leucócitos, descrita anteriormente. As moléculas de adesão expressas nos linfócitos são frequentemente denominadas receptores de endereçamento (homing), e as moléculas de adesão que se ligam a esses receptores nas células endoteliais são denominadas adressinas. Os eventos sequenciais envolvidos no endereçamento das células T virgens para os gânglios linfáticos e as moléculas envolvidas são os seguintes:
• O rolamento das células T virgens nas HEV de órgãos linfoides periféricos é mediado pela ligação da L-selectina dos linfócitos a seu ligante de carboidrato nas HEV, denominado adressina de gânglios linfáticos periféricos (PNAd). Os grupos de carboidratos da PNAd que se ligam à L-selectina podem fixar-se a diferentes sialomucinas nas HEV de tecidos diferentes. Por exemplo, nas HEV dos gânglios linfáticos, a PNAd é exibida por duas sialomucinas, denominadas GlyCAM-1 (molécula de adesão celular com glicano 1) e CD34. Nas placas de Peyer na parede intestinal, o ligante da L-selectina é uma molécula denominada MadCAM-1 (molécula de adesão celular de adressina da mucosa 1).
• A adesão firme subsequente das células T às HEV é mediada por integrinas, principalmente pelo LFA-1. A afinidade dessas integrinas nas células T virgens é rapidamente aumentada pela CCL19 e pela CCL21, que foram apresentadas no Capítulo 2 como quimiocinas necessárias para a manutenção das zonas de células T nos gânglios linfáticos. A CCL19 é produzida de modo constitutivo pelas HEV e liga-se a glicosaminoglicanos na superfície celular dos linfócitos em processo de rolamento. A CCL21 é produzida por outros tipos de células no gânglio linfático e é exibida pelas HEV da mesma maneira que a CCL19. Convém lembrar que ambas as quimiocinas ligam-se ao receptor de quimiocinas denominado CCR7, que é altamente expresso nos linfócitos virgens. Essa interação das quimiocinas com o CCR7 assegura a capacidade das células T virgens de aumentar a avidez das integrinas e aderir firmemente às HEV.
• As células T firmemente aderidas não estão mais sujeitas a seu deslocamento pelo fluxo sanguíneo, porém são capazes de rastejar pela superfície endotelial em direção às junções intercelulares. Nessas junções, as células T movem-se através da parede do vaso para dentro do tecido extravascular. Esse processo é provavelmente dependente de outras moléculas de adesão na célula T que se liga a moléculas de adesão da HEV, cuja expressão é restrita às junções intercelulares.
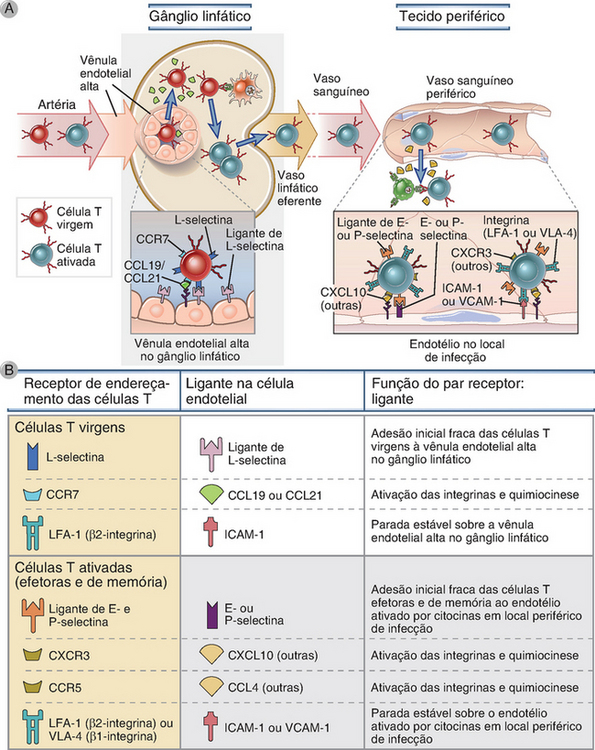
FIGURA 3-6 Migração dos linfócitos T virgens e efetores. A, Os linfócitos T virgens são guiados até os gânglios linfáticos em consequência da ligação da L-selectina a seu ligante nas vênulas endoteliais altas, que são encontradas apenas nos gânglios linfáticos, e como resultado das quimiocinas de ligação (CCL19 e CCL21) presentes na superfície da vênula endotelial alta. Os linfócitos T ativados, inclusive as células efetoras, são endereçados até os locais de infecção nos tecidos periféricos, e essa migração é mediada pela E-selectina e pela P-selectina, por integrinas e por quimiocinas que são produzidas nos locais de infecção. Outras quimiocinas e receptores de quimiocinas, além daqueles ilustrados, estão envolvidos na migração das células T efetoras/de memória. B, São descritas as moléculas de adesão, as quimiocinas e os receptores de quimiocinas envolvidos na migração das células T efetoras/de memória.
Muitas observações experimentais diferentes sustentam o importante papel da L-selectina e das quimiocinas no processo de endereçamento das células T virgens para os tecidos linfoides secundários. Os linfócitos de camundongos knockout para L-selectina não se ligam às HEV dos gânglios linfáticos periféricos, e esses animais apresentam uma acentuada redução no número de linfócitos nos gânglios linfáticos periféricos. Existem poucas células T virgens nos gânglios linfáticos de camundongos com deficiências genéticas em CCL19 e CCL21 ou CCR7, porém o conteúdo de células T desses gânglios linfáticos é relativamente normal.
Saída das Células T Virgens dos Gânglios Linfáticos
As células T virgens que foram guiadas até os gânglios linfáticos mas que não reconhecem nenhum antígeno e que se tornam ativadas irão finalmente retornar à corrente sanguínea. Esse retorno ao sangue circulante completa uma alça de recirculação e proporciona às células T virgens outra chance de encontrar tecidos linfoides secundários e procurar os antígenos que elas podem reconhecer. A principal via de reentrada no sangue circulante é feita através dos linfáticos eferentes, talvez através de outros gânglios linfáticos na mesma cadeia e, em seguida, pela vascularização linfática até o ducto torácico ou vaso linfático direito e, por fim, na veia cava superior ou na veia subclávia direita.
A saída das células T virgens dos gânglios linfáticos depende de um lipídico quimioatraente, denominado esfingosina 1-fosfato (S1P), que se liga a um receptor de sinalização nas células T, denominado receptor 1 de esfingosina 1 fosfato (S1PR1) (Fig. 3-7). A S1P está presente em concentrações relativamente altas no sangue e na linfa, quando comparação com os tecidos. Esse gradiente de concentração é mantido devido à presença ubíqua de uma enzima de degradação da S1P, a S1P liase, nos tecidos, de modo que a concentração tecidual do lipídio é menor do que na linfa e no sangue. O S1PR1 é um receptor acoplado à proteína G. Os sinais gerados pela ligação da S1P ao S1PR1 estimulam o movimento direcionado das células T virgens ao longo do gradiente de concentração da S1P para fora do parênquima do gânglio linfático. As células T virgens circulantes têm uma quantidade muito pequena de S1P1R de superfície, visto que a elevada concentração sanguínea de S1P causa a internalização do receptor. Após a entrada de uma célula T virgem em um gânglio linfático, onde as concentrações de S1P estão baixas, podem ser necessárias várias horas para a reexpressão do S1P1R de superfície. Isso proporciona tempo suficiente para a interação da célula T virgem com células apresentadoras de antígeno antes de ser direcionada ao longo do gradiente de concentração da S1P para o vaso linfático eferente. A S1P e o S1P1R também são necessários para a saída das células T virgens maduras do timo, para a migração das células T ativadas fora dos gânglios linfáticos e para a migração das células B secretoras de anticorpos dos órgãos linfoides secundários.
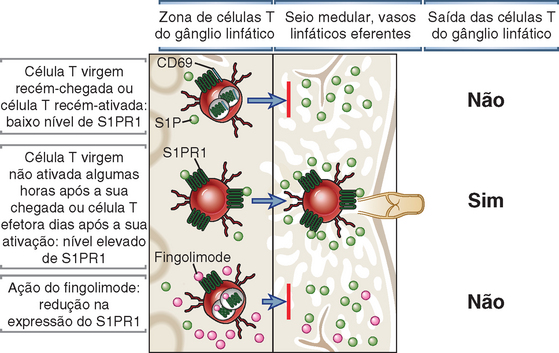
FIGURA 3-7 Mecanismo de saída dos linfócitos dos órgãos linfoides. A saída das células T do timo e dos gânglios linfáticos exige a expressão de um receptor de sinalização, denominado S1PR1, que se liga ao lipídio quimioatraente, a esfingosina 1-fosfato (S1P). As concentrações de S1P no sangue e na linfa são muito mais altas do que nos tecidos linfoides, devido à ação da enzima de degradação da S1P, a S1P liase, nos tecidos. As células T virgens circulantes apresentam baixos níveis de S1PR1, visto que o receptor é internalizado após a sua ligação à S1P no sangue. Por conseguinte, as células T virgens que recentemente entraram em um gânglio linfático não conseguem perceber o gradiente de concentração de S1P entre a zona de células T do gânglio linfático e a linfa no região medular e nos vasos linfáticos eferentes, e essas células T são incapazes de deixar o gânglio linfático. Após a ativação de uma célula T virgem por um antígeno, o S1PR1 não é reexpresso por vários dias, e as células ativadas tampouco irão deixar o gânglio linfático. Depois de algumas horas para as células T virgens, ou dias para as células T efetoras ativadas e diferenciadas, ocorre reexpressão do S1PR1, e essas células podem então ser sensível ao gradiente de S1P e sair do gânglio linfático. O fármaco imunossupressor, o fingolimode, é um agonista do S1PR1 se ligando a esse receptor e provocando uma redução na sua expressão nas superfície dos linfócitos, não sendo degradado pela S1P liase. Por conseguinte, esse fármaco interfere na percepção do gradiente de concentração de S1P e bloqueia a saída das células virgens e efetoras do gânglio linfático e a sua reentrada na circulação.
Nossa compreensão do papel da S1P e do S1PR1 no trânsito das células T baseia-se, em grande parte, em estudos dos efeitos de um fármaco denominado fingolimode (FTY720), que se liga ao S1P1R e causa a sua redução na expressão de S1P1R de superfície celular. O fingolimode bloqueia a saída das células T dos órgãos linfoides e, portanto, atua como fármaco imunossupressor. Hoje, este fármaco está aprovado para tratamento da esclerose múltipla, uma doença autoimune do sistema nervoso central, e há grande interesse pelo uso de fingolimode e outros fármacos com mecanismo semelhante de ação para tratamento várias outras doenças autoimunes ou para a rejeição de enxerto. Outras evidências experimentais do papel central da S1P no trânsito das células T virgens provêm de estudos de camundongos geneticamente knockout para S1PR1. Nesses camundongos, as células T são incapazes de deixar o timo e residir nos órgãos linfoides secundários. Se células T virgens de camundongos knockout de S1PR1 forem injetadas na circulação de outros camundongos, as células penetram nos gânglios linfáticos, porém são incapazes de sair deles.
Recirculação das Células T através de Outros Tecidos Linfoides
O endereçamento de células T virgens para os tecidos linfoides associados ao intestino, incluindo as placas de Peyer e os gânglios linfáticos mesentéricos, é fundamentalmente semelhante ao processo de endereçamento para outros gânglios linfáticos e depende das interações das células T com as HEV, que são mediadas por selectinas, integrinas e quimiocinas. Um aspecto específico do endereçamento das células T virgens para os gânglios linfáticos mesentéricos e as placas de Peyer é a contribuição de uma molécula da superfamília das Ig, denominada MadCAM-1 (molécula de adesão celular de adressina da mucosa 1), que é expressa nas HEV nesses locais, porém não em outras partes do corpo. As células T virgens expressam dois ligantes que se ligam à MadCAM-1, a L-selectina e uma integrina denominada α4β7, e ambas contribuem para a etapa de rolamento do processo de endereçamento das células T virgens para os tecidos linfoides associados ao intestino.
A migração das células T virgens para o baço não é tão primorosamente regulada quanto o endereçamento para os gânglios linfáticos. O baço não contém HEV, e parece que as células T virgens são levadas até a zona marginal e os seios da polpa vermelha por mecanismos passivos que não envolvem as selectinas, as integrinas ou as quimiocinas. Entretanto, as quimiocinas que se ligam ao CCR7 participam efetivamente no direcionamento das células T virgens para a polpa branca. Embora o endereçamento das células T virgens para o baço pareça ser menos rigorosamente regulado do que aquele para os gânglios linfáticos, a taxa de passagem dos linfócitos através do baço é muito alta, com cerca de metade da população total de linfócitos circulantes a cada 24 horas.
Migração dos Linfócitos T Efetores para Locais de Infecção
As células T efetoras que foram geradas pela ativação das células T virgens induzida por antígeno deixam os tecidos linfoides secundários através da drenagem linfática e retornam ao sangue circulante. Muitas das funções antimicrobianas protetoras das células T efetoras precisam ser executadas localmente, nas áreas de infecção, razão pela qual essas células devem ser capazes de deixar os tecidos linfoides. Durante a diferenciação das células T virgens em células efetoras, que ocorre nos órgãos linfoides periféricos, as células sofrem uma mudança na expressão dos receptores de quimiocina, S1PR1 e moléculas de adesão, que determinam o comportamento migratório dessas células. A expressão do S1PR1 fica suprimida por vários dias após a ativação das células T virgens mediada pelo antígeno, e, em consequência, a capacidade dessas células de deixar o tecido linfoide em resposta a um gradiente de S1P fica comprometida. Essa supressão do S1PR1 é controlada, em parte, por citocinas, denominadas interferons do tipo I, que são expressas durante a resposta imune inata às infecções, conforme será discutido adiante. Juntas, a estimulação antigênica e os interferons aumentam a expressão de uma proteína de membrana da célula T, denominada CD69, que se liga ao S1PR1 e bloqueia a sua expressão na superfície celular. Por conseguinte, a célula T ativada torna-se transitoriamente insensível ao gradiente de S1P. Em consequência, as células T ativadas pelo antígeno podem permanecer no órgão linfoide e sofrer expansão clonal e diferenciação em células T efetoras, processo que leva vários dias. Quando a diferenciação em células efetoras está completa, as células reexpressam o S1PR1 e, portanto, tornam-se responsivas ao gradiente de concentração de S1P, que está baixo no tecido linfoide e alto na linfa dos vasos linfáticos drenantes. A expressão do CCR7 também está acentuadamente reduzida nas células T efetoras, e, portanto, essas células não são obrigadas a permanecer nas zonas das células T, onde são produzidos os ligantes do CCR7, o CCL19 e CCL20. Essas mudanças na expressão do S1RP1 e do CCR7 favorecem a saída das células T efetoras do tecido linfoide para os vasos linfáticos eferentes, com retorno subsequente ao sangue circulante. A expressão da L-selectina, que é necessária para a entrada das células T virgens nos tecidos linfoides secundários, também está reduzida nas células T efetoras recentemente diferenciadas. Por conseguinte, duas moléculas essenciais, necessárias para a reentrada das células T nos órgãos linfoides secundários através das HEV (CCR7 e L-selectina), estão faltando nas células T efetoras, impedindo a reentrada dessas células nos tecidos linfoides e mantendo-as disponíveis para migração em direção aos tecidos infectados.
As células T efetoras circulantes são guiadas preferencialmente para os locais de infecção nos tecidos periféricos por um processo em múltiplas etapas dependente de selectinas, integrinas e quimiocinas (Fig. 3-6). À semelhança dos neutrófilos e dos monócitos, o recrutamento seletivo das células T efetoras para locais de infecção, mas não para os tecidos sadios, depende inicialmente da resposta imune inata aos micro-organismos, resultando na expressão de ligantes de E-selectina, P-selectina e integrina nas células endoteliais das vênulas pós-capilares, e na produção local de várias quimiocinas, que são apresentadas no revestimento endotelial das vênulas pós-capilares. As células T efetoras na circulação expressam ligantes de selectina, integrinas e receptores de quimiocinas, que se ligam aos tipos de selectinas, ligantes de integrinas e quimiocinas, respectivamente, que são induzidos por respostas imune inatas. O resultado final consiste no aumento da adesão das células T ao endotélio e transmigração através da parede das vênulas. Como as células T virgens não expressam ligantes para a E-selectina e a P-selectina, nem receptores de quimiocinas que se ligam às quimiocinas inflamatórias, elas não são recrutadas eficientemente para esses locais de infecção (Fig. 3-6). A ativação das células T efetoras induzida por antígenos nos tecidos inflamados e a presença contínua de quimiocinas mantém as integrinas dessas células em estado de alta afinidade, o que favorece a retenção das células T efetoras nesses locais. As células efetoras que chegam a um local de infecção acabam morrendo, em sua maioria, nesses locais após desempenharem suas funções efetoras.
Existem diferentes subtipos de células T efetoras, cada qual com funções distintas, e esses subtipos têm padrões de migração diferentes, embora frequentemente superpostos. As células T efetoras incluem as células T CD8+ citotóxicas e as células T CD4+ auxiliares. As células T auxiliares (helper) incluem os subtipos TH1, TH2 e TH17, cada um dos quais expressa diferentes tipos de citocinas e protege contra diferentes tipos de patógenos. As características e as funções desses subtipos são discutidas de modo detalhado nos Capítulos 9 e 10. Por enquanto, é importante saber que a migração de cada subtipo é diferente. Isso se deve ao fato de que o conjunto de receptores de quimiocinas e moléculas de adesão expresso por cada subgrupo difere, resultando no recrutamento preferencial de cada subtipo em locais inflamatórios, induzido por diferentes tipos de infecções.
Algumas células efetoras têm propensão a migrar para tipos específicos de tecidos. Essa capacidade de migração seletiva é adquirida durante a diferenciação das células T efetoras de precursores virgens nos tecidos linfoides secundários. Ao capacitar a migração de grupos distintos de células T efetoras para diferentes locais, o sistema imunológico adaptativo direciona as células com funções efetoras especializadas para os locais em que são mais apropriadas para combater tipos específicos de infecções. Os exemplos mais claros de populações de células T efetoras que são especificamente guiadas para diferentes tecidos são as células T endereçadas para a pele e para o intestino. As células T efetoras guiadas para a pele expressam um ligante de carboidrato para a E-selectina, denominado CLA-1 (antígeno de linfócito cutâneo 1) e os receptores de quimiocinas CCR4 e CCR10, que se ligam às CCL17 e CCL27, isto é, quimiocinas que são comumente expressas na pele inflamada. As células T efetoras endereçadas para o intestino expressam a integrina α4β7 que se liga à MadCAM-1 na superfície das células endoteliais do intestino, e o CCR9, que se liga à CCL25, uma quimiocina expressa no intestino inflamado. Extraordinariamente, esses fenótipos migratórios distintos de células T efetoras guiadas para a pele e para o intestino podem ser induzidos por sinais distintos fornecidos às células T virgens por ocasião da apresentação do antígeno pelas células dendríticas nos gânglios linfáticos subcutâneos ou nos tecidos linfoides associados ao intestino, respectivamente. Embora não se conheça a base molecular para a determinação (imprinting) desse fenótipo migratório, há evidências de que as células dendríticas nas placas de Peyer produzem ácido retinoico, que promove a expressão de α4β7 e do CCR9 pelas células T responsivas. De modo semelhante, as células dendríticas nos gânglios linfáticos drenantes (regionais) da pele produzem vitamina D, que instrui as células T a expressar CLA-1, CCR4 e CCR10. Outras células T expressam uma integrina, denominada CD103 (αEβ7), que pode ligar-se às moléculas de caderina-E nas células epiteliais, permitindo a manutenção das células T como linfócitos intraepiteliais tanto na pele quanto no intestino. No Capítulo 13, iremos discutir com mais detalhes o endereçamento dos linfócitos específicos de tecidos.
Migração das Células T de Memória
As células T de memória são heterogêneas nos seus padrões de expressão de moléculas de adesão e receptores de quimiocinas, bem como na sua propensão a migrar para diferentes tecidos. Como as maneiras de identificar as células T de memória ainda não são perfeitas (Cap. 2), a distinção entre células T efetoras e células T de memória em estudos experimentais e em seres humanos frequentemente não é precisa. Dois subtipos de células T de memória, isto é, as células T de memória central e de memória efetora, foram inicialmente identificados, com base em diferenças na expressão do CCR7 e da L-selectina. As células T de memória central em humanos, no sangue circulante, foram definidas como células T CD45RO+, que expressam altos níveis de CCR7 e de L-selectina, enquanto as células T de memória efetoras foram definidas como células T CD45RO+, que expressam baixos níveis de CCR7 e de L-selectina, mas que expressam outros receptores de quimiocinas que se ligam às quimiocinas inflamatórias. Esses fenótipos sugerem que as células T de memória central são endereçadas para os órgãos linfoides secundários, enquanto as células T de memória efetoras são guiadas para os tecidos periféricos. Embora populações de células T de memória tanto centrais quanto efetoras também possam ser detectadas em camundongos, estudos experimentais de endereçamento (homing) indicaram que a expressão do CCR7 não constitui um marcador definitivo para distinguir subtipos de células T de memória central e efetora. Entretanto, é evidente que algumas células T de memória permanecem nos órgãos linfoides secundários ou tendem a ser levadas para eles, enquanto outras migram para tecidos periféricos, particularmente para tecidos da mucosa. Em geral, as células T de memória efetoras com endereçamento para os tecidos periféricos respondem à estimulação antigênica através da rápida produção de citocinas efetoras, enquanto as células de memória central guiadas para tecidos linfoides tendem a proliferar mais (proporcionando um reservatório de células para respostas de reforço) e desempenham funções auxiliares para as células B.
MIGRAÇÃO DOS LINFÓCITOS B
As células B virgens utilizam os mesmos mecanismos básicos das células T virgens para endereçamento até os tecidos linfoides secundários através da corrente sanguínea, o que aumenta a sua probabilidade de responder a antígenos microbianos em diferentes locais. As células B imaturas deixam a medula óssea através da corrente sanguínea e entram na polpa vermelha do baço, migram para a periferia da polpa branca e, em seguida, amadurecem, penetram na polpa branca em resposta a uma quimiocina, denominada CXCL13, que se liga ao receptor de quimiocina CXCR5 expresso pela célula B. Uma vez completado o processo de maturação dentro da polpa branca, as células B foliculares virgens retornam à circulação e são endereçadas para os gânglios linfáticos e os tecidos linfoides da mucosa. O endereçamento das células B virgens do sangue para dentro do sangue circulante envolve interações de rolamento nas HEV, ativação de integrinas por quimiocinas e parada estável, conforme foi descrito anteriormente para as células T auxiliares. Quando entram no estroma dos órgãos linfoides secundários, as células B migram para dentro dos folículos — o local em que podem encontrar um antígeno e tornar-se ativadas. Essa migração das células B virgens para dentro dos folículos é mediada pela CXCL13, que é produzida nos folículos e que se liga ao receptor CXCR5 nas células B virgens. O endereçamento das células B virgens para as placas de Peyer envolve o CXCR5 e a integrina α4β7, que se liga à MadCAM-1. Durante as respostas das células B a antígenos proteicos, as células B e as células T auxiliares precisam interagir diretamente, e essa interação torna possível a ocorrência de movimentos altamente regulados de ambos os tipos de células dentro dos órgãos linfoides secundários. Esses eventos locais de migração e as quimiocinas que os coordenam serão discutidos de modo detalhado no Capítulo 11.
A saída das células B dos órgãos linfoides secundários depende da S1P1. Isso foi mais claramente demonstrado para as células B diferenciadas secretoras de anticorpos, que deixam os órgãos linfoides secundários, nos quais foram geradas das células B virgens através de ativação pelo antígeno, e são guiadas para a medula óssea ou tecidos periféricos. As células secretoras de anticorpos com deficiência de S1PR1 apresentam uma redução da capacidade de endereçamento do baço para a medula óssea ou de formar tecidos linfoides associados ao intestino. Presumivelmente, as células B virgens que entraram nos tecidos linfoides secundários, mas que não foram ativadas pelo antígeno, retornam à circulação, como o fazem as células T virgens, porém não se sabe ao certo como esse processo é controlado.
Os subtipos de células B comprometidas a produzir determinados tipos de anticorpos migram dos órgãos linfoides secundários para tecidos específicos. Conforme será descrito em capítulos posteriores, diferentes populações de células B ativadas podem secretar diferentes tipos de anticorpos, denominados isótipos, que desempenham um conjunto distinto de funções efetoras. Muitos plasmócitos produtores de anticorpos migram para a medula óssea, onde secretam anticorpos por longos períodos. Os plasmócitos endereçados para a medula óssea produzem, em sua maioria, anticorpos da classe IgG, que são então distribuídos por todo o corpo através da corrente sanguínea. As células B dentro dos tecidos linfoides associados à mucosa tornam-se geralmente condicionadas a expressar o isótipo de anticorpo IgA, e essas células podem ser guiadas especificamente para o epitélio dos tecidos da mucosa. Esse padrão de endereçamento, associado à diferenciação local das células B em plasmócitos secretores de IgA na mucosa, serve para otimizar as respostas da IgA às infecções na mucosa. Como iremos descrever de modo mais detalhado no Capítulo 13, a IgA é excretada eficientemente no lúmen dos tecidos revestidos por epitélio mucoso, como o intestino e o trato respiratório. De modo não surpreendente, os mecanismos pelos quais as diferentes populações de células B migram para diferentes tecidos são similares aos que foram descritos para a migração de células T efetoras para tecidos específicos e dependem da expressão de combinações distintas de moléculas de adesão e receptores de quimiocinas em cada subgrupo de células B. Por exemplo, os plasmócitos secretores de IgG guiados para a medula óssea expressam VLA-4 e CXCR4, que se ligam, respectivamente, à VCAM-1 e à CXCL12 expressas nas células endoteliais sinusoidais da medula óssea. Em contrapartida, os plasmócitos secretores de IgA endereçados para a mucosa expressam α4β7, CCR9 e CCR10, que se ligam, respectivamente, à MacCAM-1, à CCL25 e à CCL28 expressas nas células endoteliais da mucosa. As células B secretores de IgG também são recrutadas para locais de inflamação crônica em vários tecidos, e esse padrão de endereçamento pode ser atribuído ao CXCR3 e ao VLA-4 dessas células B que se ligam à CXCL9 e à CXCL10 e à VCAM-1, que são frequentemente encontradas na superfície endotelial em locais de inflamação crônica.
• A migração dos leucócitos do sangue circulante para os tecidos ocorre através das vênulas pós-capilares e depende de moléculas de adesão expressas nos leucócitos e nas células endoteliais vasculares, bem como das quimiocinas.
• As selectinas são moléculas de adesão que se ligam aos carboidratos que medeiam interações de baixa afinidade entre os leucócitos e as células endoteliais, como primeira etapa na migração dos leucócitos do sangue para os tecidos. A E-selectina e a P-selectina são expressas nas células endoteliais ativadas e ligam-se a ligantes de selectina sobre os leucócitos, enquanto a L-selectina é expressa nos leucócitos e liga-se a ligantes das células endoteliais.
• As integrinas compreendem uma grande família de moléculas de adesão, algumas das quais medeiam a adesão firme dos leucócitos ao endotélio ativado, como etapa crucial da migração dos leucócitos do sangue para os tecidos. As integrinas leucocitárias importantes incluem o LFA-1 e o VLA-4, que se ligam à ICAM-1 e à VCAM-1, respectivamente, nas células endoteliais.
• A migração dos leucócitos do sangue para os tecidos envolve uma série de etapas sequenciais de interações com as células endoteliais, começando com a ligação de baixa afinidade dos leucócitos e seu rolamento ao longo da superfície endotelial (mediados por selectinas e ligantes de selectina). Em seguida, os leucócitos ligam-se firmemente ao endotélio, através de interações das integrinas leucocitárias, que se ligam a ligantes que pertencentes à superfamília das Ig sobre o endotélio. A ligação das integrinas é amplificada pelas quimiocinas, produzidas no local de infecção, que se ligam a receptores presentes nos leucócitos.
• A recirculação dos linfócitos é o processo pelo qual os linfócitos virgens migram continuamente do sangue para dentro dos órgãos linfoides secundários através das HEV, de volta ao sangue pelos vasos linfáticos e para dentro de outros órgãos linfoides. Esse processo maximiza a probabilidade do encontro da célula T virgem com o antígeno e é crucial para a iniciação das respostas imunes.
• As células T e as células B virgens migram preferencialmente para os gânglios linfáticos; esse processo é mediado pela ligação da L-selectina nos linfócitos à adressina dos gânglios linfáticos periféricos presente nas HEV desses órgãos linfoides secundários, bem como pelo receptor CCR7 nos linfócitos, que se liga às quimiocinas CCL19 e CCL21, que são produzidas nos gânglios linfáticos.
• Os linfócitos efetores e de memória que são gerados pela estimulação das células virgens pelo antígeno deixam o gânglio linfático por um processo que depende do receptor de esfingosina-1 fosfato nos linfócitos e de um gradiente de esfingosina-1 fosfato. As células T efetoras apresentam uma expressão diminuída de L-selectina e do CCR7 mas uma expressão aumentada de integrinas e de ligantes de E-selectina e P-selectina, e essas moléculas medeiam a ligação da célula ao endotélio nos locais periféricos de inflamação. Os linfócitos efetores e de memória também expressam receptores para as quimiocinas que são produzidas em tecidos periféricos infectados.
Kinashi T. Intracellular signalling controlling integrin activation in lymphocytes. Nature Reviews Immunology. 2005;5:546-559.
Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews Immunology. 2007;7:678-689.
Bromley SK, Mempel TR, Luster AD. Orchestrating the orchestrators: chemokines in control of T cell traffic. Nature Immunology. 2008;9:970-980.
Sallusto F, Baggiolini M. Chemokines and leukocyte traffic. Nature Immunology. 2008;9:949-952.
Migração dos Linfócitos através dos Tecidos Linfoides
Bajénoff M, Egen JG, Qi H, Huang AY, Castellino F, Germain RN. Highways, byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends in Immunology. 2007;28:346-352.
Cyster JG. Chemokines, sphingosine-1-phosphate, and cell migration in secondary lymphoid organs. Annual Review of Immunology. 2005;23:127-159.
Rot A, von Andrian UH. Chemokines in innate and adaptive host defense: basic chemokinese grammar for immune cells. Annual Review of Immunology. 2004;22:891-928.
Sigmundsdottir H, Butcher EC. Environmental cues, dendritic cells and the programming of tissue-selective lymphocyte trafficking. Nature Immunology. 2008;9:981-987.
von Andrian UH, Mackay CR. T-cell function and migration: two sides of the same coin. New England Journal of Medicine. 2000;343:1020-1034.