CAPÍTULO 7 Receptores Imunológicos e Transdução de Sinais
O conceito de que as células podem ter receptores de superfície específicos capazes de serem ativados por ligantes externos foi proposto por um dos fundadores da imunologia moderna. Em seu artigo “Teoria da Cadeia Lateral” publicado em 1897, Paul Ehrlich concebia a existência de anticorpos na superfície das células imunes que poderiam reconhecer antígenos e estimular essas células a secretar quantidades maiores do mesmo anticorpo. Os receptores de superfície celular para os hormônios foram descobertos muitas décadas depois, na segunda metade do século XX, mas bem antes da identificação dos receptores de antígenos dos linfócitos, no início da década de 1980.
Os receptores de superfície celular desempenham duas funções principais – ativar a sinalização intracelular e estimular a adesão de uma célula a outra ou à matriz extracelular. Em sentido amplo, a expressão transdução de sinais refere-se às respostas bioquímicas intracelulares que ocorrem nas células depois do acoplamento dos ligantes aos seus receptores específicos. Quase todos os receptores sinalizadores estão localizados na membrana plasmática. Em geral, a sinalização iniciada por esses receptores inclui uma fase citosólica inicial, durante a qual o receptor ou as proteínas que interagem com ele podem passar por modificações pós-translacionais. Isso geralmente resulta na ativação ou na translocação nuclear dos fatores de transcrição que se encontram inativos nas células em repouso; em seguida, há uma fase nuclear, durante a qual os fatores de transcrição coordenam as alterações da expressão dos genes (Fig. 7-1). Algumas vias de transdução de sinais estimulam a motilidade celular ou ativam a exocitose de grânulos citoplasmáticos, independentemente de uma fase nuclear. A transdução de sinais pode trazer algumas consequências diversas na mesma célula, inclusive aquisição de novas funções, indução da diferenciação, comprometimento com uma linhagem específica, proteção contra a morte celular, iniciação das respostas de proliferação e crescimento e indução do bloqueio do ciclo celular ou da morte por apoptose. Os receptores de antígenos dos linfócitos B e T estão entre os mecanismos de sinalização mais sofisticados que se conhecem e ocuparão grande parte do texto deste capítulo.
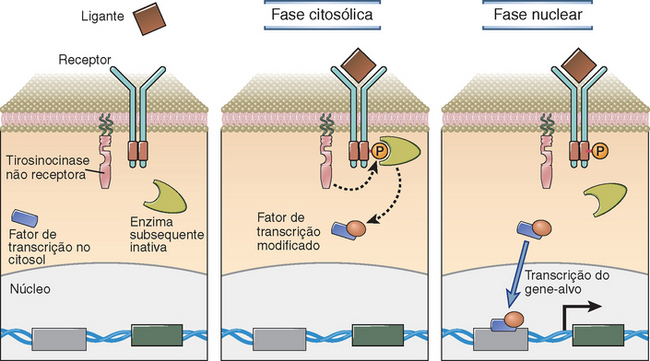
FIGURA 7-1 A sinalização originada da superfície celular consiste nas fases citosólica e nuclear. A figura ilustra um receptor genérico que ativa uma tirosinocinase não receptora depois do seu acoplamento ao ligante. Na fase de sinalização citosólica, a cinase não receptora fosforila um resíduo fundamental de tirosina presente na extremidade citoplasmática do receptor e, consequentemente, a extremidade contendo fosfotirosina consegue recrutar uma enzima subsequente que é ativada em seguida. Na fase citosólica, essa enzima subsequente ativada acarreta uma modificação pós-translacional de um fator de transcrição específico localizado no citoplasma. Na fase nuclear, esse fator de transcrição modificado entra no núcleo e induz a expressão dos genes-alvo, entre os quais todos têm sítios de ligação no promotor ou em alguma outra região reguladora que possa ligar-se a esse fator de transcrição modificado e facilitar a transcrição.
Inicialmente, faremos uma revisão ampla da transdução de sinais e, em seguida, apresentaremos descrições da sinalização mediada por receptores de antígenos distribuídos entre os clones de linfócitos e por receptores imunológicos estruturalmente relacionados, que estão presentes principalmente nas células do sistema imune inato. Ao longo da descrição dos receptores de antígenos das células B e T, estudaremos o papel dos coreceptores da ativação linfocitária, analisaremos a sinalização por receptores coestimuladores de cada linhagem linfocítica e discutiremos o papel dos receptores inibitórios das células T, B e NK. Também estudaremos as diferentes classes de receptores das citocinas e os mecanismos de transdução de sinais desencadeados por esses receptores; por fim, examinaremos a principal via que resulta na ativação do NF-κB, um fator de transcrição importante para as imunidades inata e adaptativa.
VISÃO GERAL DA TRANSDUÇÃO DE SINAIS
Em geral, os receptores que iniciam as respostas de sinalização são proteínas estruturais presentes na membrana plasmática, na qual seus domínios extracelulares reconhecem ligantes solúveis secretados ou estruturas ligadas à membrana plasmática de uma ou mais células adjacentes. Um grupo especial de receptores – os receptores nucleares – consiste, na verdade, em fatores de transcrição que são ativados funcionalmente por ligantes lipossolúveis que conseguem atravessar facilmente a membrana plasmática.
A iniciação da sinalização por um receptor da superfície celular pode depender do agrupamento dos receptores induzido pelo ligante (conhecido como ligação cruzada dos receptores), ou pode envolver uma alteração de conformação do receptor que é induzida por seu acoplamento ao ligante. Em geral, esses dois mecanismos de iniciação dos sinais resultam na aquisição de uma nova configuração geométrica da parte citosólica do receptor, que facilita as interações com outras moléculas de sinalização. Em alguns casos, essa alteração da geometria do receptor pode ser causada pelo acréscimo enzimático de uma molécula de fosfato à cadeia lateral fundamental de tirosina, serina ou treonina presentes na parte citosólica de um componente do receptor, ou de uma proteína adaptadora diferente. As enzimas que acrescentam grupos de fosfato às cadeias laterais dos aminoácidos são conhecidas como proteinocinases. Muitas etapas que iniciam a sinalização linfocitária dependem das proteinocinases que fosforilam moléculas essenciais de tirosina, e por esta razão essas enzimas são conhecidas como tirosinocinases proteicas. Outras proteinocinases envolvidas em outros sistemas de sinalização são a serinocinase e a treoninocinase, enzimas que fosforilam substratos proteicos nos resíduos de serina ou treonina. Outras enzimas ativadas via sinalização pelos receptores fosforilam substratos lipídicos e, por esta razão, são conhecidas como lipidocinases. Há uma fosfatase específica para cada tipo de reação de fosforilação, ou seja, uma enzima que pode remover uma molécula de fosfato e, desse modo, modular a sinalização. Essas fosfatases desempenham funções importantes (geralmente inibitórias) na transdução dos sinais. A fosforilação das proteínas não é a única modificação pós-translacional que desencadeia a transdução de sinais. Muitas outras modificações facilitam os processos de sinalização. Por exemplo, alguns fatores de transcrição e as histonas podem ser regulados por acetilação e por metilação. Um tipo de modificação que descreveremos nas seções subsequentes deste capítulo é a ubiquitinação proteica, ou seja, o acréscimo de moléculas de ubiquitina que marcam como alvos as proteínas a serem decompostas ou desencadeiam a transdução de sinais em muitas células, inclusive linfócitos. Muitas moléculas de sinalização importante são modificadas pelo acréscimo de lipídios, que podem ajudar a localizar a proteína na membrana plasmática ou, em alguns casos, em uma região especializada da membrana plasmática com quantidades abundantes de moléculas sinalizadoras.
Os receptores celulares são classificados em vários grupos baseados nos mecanismos de sinalização que utilizam e nos processos bioquímicos intracelulares que ativam (Fig. 7-2):
• Receptores que utilizam tirosinocinases não receptoras. Nesse grupo de receptores de membrana, as cadeias de acoplamento aos ligantes não possuem atividade catalítica intrínseca, mas uma tirosinocinase intracelular diferente (conhecida como tirosinocinase não receptora) participa da ativação do receptor por fosforilação de alguns componentes específicos do receptor ou de outras proteínas associadas (Fig. 7-1). Todos os componentes da família de receptores conhecidos como receptores imunológicos, dentre os quais alguns reconhecem antígenos e outros reconhecem as frações Fc dos anticorpos, utilizam tirosinocinases não receptoras para iniciar a sinalização. Além da família de receptores imunológicos, alguns receptores de citocinas (descritos nas seções subsequentes deste capítulo) também utilizam tirosinocinases não receptoras. As integrinas – receptores de adesão essenciais ao sistema imunológico – também sinalizam por ativação de tirosinocinases não receptoras.
• As tirosinocinases receptoras (RTK) são proteínas estruturais da membrana, que ativam um ou mais domínios intrínsecos de tirosinocinase localizados nas suas extremidades citoplasmáticas, quando formam ligações cruzadas com ligantes extracelulares polivalentes (Fig. 7-2). Um exemplo de RTK importante para a formação das células sanguíneas é a proteína c-Kit. Essa PTK possui domínios extracelulares de Ig, que se acoplam a um ligante conhecido como fator da célula-tronco. A interação com esse fator resulta na dimerização da c-Kit e na ativação dos domínios citosólicos da cinase do receptor dimerizado. A sinalização por meio da c-Kit contribui para a iniciação da hematopoiese e da linfopoiese. Outros exemplos de PTK são o receptor de insulina, o receptor do fator de crescimento epidérmico e o receptor do fator de crescimento derivado das plaquetas.
• Receptores nucleares. O acoplamento de um ligante lipossolúvel ao seu receptor nuclear (Fig. 7-2) resulta na possibilidade desse receptor induzir a transcrição ou reprimir a expressão dos genes. Os receptores hormonais nucleares, inclusive o receptor de vitamina D e o receptor de glicocorticoides, podem influenciar nos processos como o desenvolvimento do sistema imunológico e a modulação da expressão dos genes das citocinas.
• Os receptores transmembrana de sete alças são polipeptídios que atravessam a membrana plasmática sete vezes, razão pela qual também são conhecidos como receptores serpentinos (Fig. 7-2). Como atuam ativando proteínas associadas de ligação ao GTP (proteínas G), esses receptores também são comumente conhecidos como receptores acoplados às proteínas G (GPCR). Uma alteração de conformação induzida pelo acoplamento do ligante a esse tipo de receptor permite a ativação de uma proteína G heterotrimérica associada, que inicia os processos de sinalização subsequentes. Exemplos desse grupo de receptores relevantes à imunidade e à inflamação são os receptores dos leucotrienos, das prostaglandinas, da histamina, dos fragmentos C3a e C5a do complemento, do peptídio bacteriano f-met-leu-phe e de todas as citocinas (Cap. 3). Os diferentes tipos de proteínas G ligadas aos diversos GPCR podem ativar ou inibir vários efetores subsequentes. As duas enzimas principais que os GPCR ativam são a adenilatociclase (que converte o ATP na molécula efetora cAMP – capaz de ativar muitas respostas celulares) e a fosfolipase C (que também desencadeia vários sinais), conforme está descrito adiante.
• Outros grupos de receptores. Outros grupos de receptores são conhecidos há muito tempo por sua importância no desenvolvimento embrionário e em alguns tecidos plenamente desenvolvidos, e mais recentemente suas funções no sistema imune começaram a ser desvendadas. As proteínas receptoras da família Notch (Fig. 7-2) participam do desenvolvimento de muitas espécies. A combinação de ligantes específicos com os receptores dessa família resulta na clivagem proteolítica do receptor e na translocação nuclear do domínio citoplasmático clivado (Notch intracelular), que funciona como um dos componentes do complexo de transcrição. As proteínas Notch contribuem para a determinação do destino das células durante o desenvolvimento linfocitário (Cap. 8) e também podem influenciar a ativação dos linfócitos desenvolvidos. Um grupo de ligantes, conhecidos como proteínas Wnt, pode afetar a linfopoese. A sinalização por meio dos receptores transmembrana dessas proteínas pode regular os níveis da β-catenina, que facilita a atividade transcricional das proteínas que contribuem para o desenvolvimento das células B e T, conforme está descrito no Capítulo 8. Várias outras vias de sinalização e receptores identificados inicialmente nas populações de células não imunológicas começam agora a ser estudados no contexto da biologia linfocitária. Neste capítulo, não tentaremos descrever detalhadamente todas essas vias de sinalização.
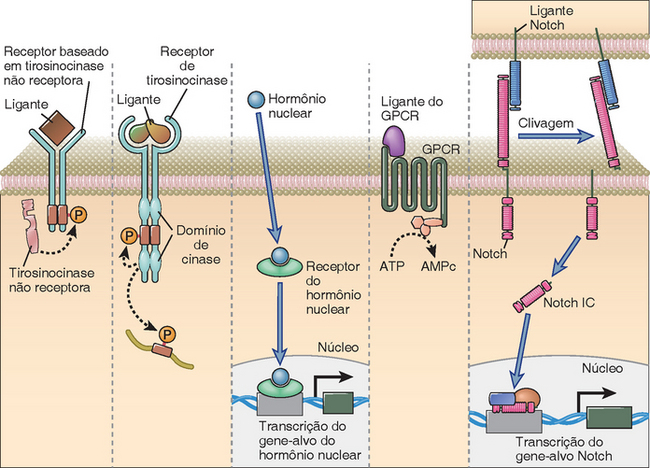
FIGURA 7-2 Principais tipos de receptores de sinalização do sistema imunológico. A figura ilustra um receptor que utiliza uma tirosinocinase não receptora, uma tirosinocinase receptora, um receptor nuclear que se liga ao seu ligante e depois pode induzir a transcrição, um receptor transmembrana de sete alças ligado às proteínas G heterotriméricas e a cinase Notch, que reconhece seu ligante em uma célula diferente e é clivada, resultando na liberação de um fragmento intracelular (IC Notch) que pode entrar no núcleo e afetar a transcrição dos genes-alvo específicos.
Proteínas e Adaptadores Modulares da Sinalização
As moléculas de sinalização geralmente são formadas por diferentes módulos, cada qual com função específica de ligação ou catálise. A descoberta da fosforilação da tirosina representou um avanço significativo no estudo das vias de sinalização celular. Em seguida, pesquisadores descobriram que a sequência relativa às moléculas específicas de tirosina fosforilada contribuía para a interação das proteínas tirosinofosforiladas com outras moléculas de sinalização. O estudo das tirosinocinases não receptoras levou ao reconhecimento de que as moléculas de sinalização contêm módulos ou domínios com funções bem definidas. O homólogo celular da proteína transformadora do vírus do sarcoma de Rous, conhecida como c-Src, é o protótipo de uma família imunologicamente importante de tirosinocinases não receptoras que são conhecidas como cinases da família Src. A c-Src possui domínios singulares, inclusive os domínios de homologia 2 Src (SH2) e de homologia 3 Src (SH3) descritos adiante. Essa proteína também tem um domínio catalítico de tirosinocinase e um domínio de acréscimo lipídico N-terminal, que facilita a adição covalente de uma molécula de ácido mirístico à proteína. O miristato ajuda a direcionar as cinases da família Src para a membrana plasmática. A Figura 7-3 ilustra as estruturas modulares de três famílias de tirosinocinases importantes para o sistema imunológico.
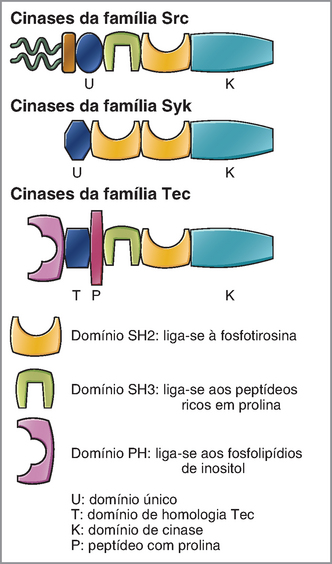
FIGURA 7-3 Estrutura modular das tirosinocinases que atuam na ativação dos linfócitos. Os módulos incluem domínios SH2 que se ligam aos polipeptídios específicos contendo fosfotirosinas, domínios SH3 que reconhecem fragmentos polipeptídicos ricos em prolina, domínios PH que reconhecem o PIP3 ou outros lipídios derivados do fosfatidilinositol e domínios de homologia Tec encontrados nas tirosinocinases da família Tec. As famílias de tirosinocinases ilustradas nesta figura são as cinases da família Src (inclusive c-Src, Lyn, Fyn e Lck); da família Syk (inclusive Syk e ZAP-70); e da família Tec (inclusive Tec, Btk e Itk).
Os domínios SH2 são formados por cerca de 100 aminoácidos enovelados em uma conformação especial e reconhecem peptídeos que contêm fosfotirosina. Na sinalização dos receptores de antígeno, as cinases da família Src fosforilam as moléculas de tirosina presentes nas extremidades citoplasmáticas de determinados componentes proteicos que fazem parte do complexo receptor (descrito adiante). Em seguida, essas moléculas de fosfotirosina do complexo dos receptores de antígenos são reconhecidas pelos domínios SH2 presentes nas tirosinocinases da família Syk, inclusive Syk e ZAP-70 (Fig. 7-3). O recrutamento de uma cinase da família Syk para o receptor de antígenos por meio de uma interação específica entre o domínio SH2 e a fosfotirosina é uma etapa essencial na ativação dos receptores de antígenos.
Os domínios SH3 também possuem cerca de 100 aminoácidos e ajudam a mediar as interações entre proteínas por sua ligação aos fragmentos ricos em prolina de certas proteínas. Outro tipo de domínio modular, conhecido como homologia de plecstrina (PH), consegue reconhecer fosfolipídios específicos. Os domínios PH de algumas moléculas de sinalização, inclusive a tirosinocinase Btk da família TEC, reconhecem o fosfatidilinositol trifosfato (PIP3), que é uma molécula lipídica presente na superfície interna da membrana plasmática.
As proteínas adaptadoras funcionam como encaixes moleculares que interligam fisicamente diferentes enzimas e estimulam complexos de moléculas sinalizadoras. As proteínas adaptadoras podem ser proteínas estruturais de membrana, inclusive LAT (acoplador de ativação das células T) (Fig. 7-4), ou podem ser proteínas citosólicas como a BLNK (acoplador de células B), a SLP-76 (proteína acopladora de 76 kD com um domínio SH2) e a GADS (proteína adaptadora subsequente à Shc relacionada com a Grb-2). Um adaptador típico pode ter domínios específicos que medeiam as interações entre duas proteínas, inclusive domínios SH2 e SH3, entre outros (existem muitos outros tipos de domínios modulares que não foram mencionados aqui). Os adaptadores também podem conter alguns fragmentos ricos em prolina (que podem ligar-se a outras proteínas que possuem domínios SH3) e geralmente também contêm resíduos essenciais de tirosina, que podem ser fosforilados pelas tirosinocinases. Os resíduos de aminoácidos situados nas proximidades de uma tirosina fosforilada determinam quais domínios SH2 específicos podem ligar-se àquele sítio. Por exemplo, um adaptador com a composição YxxM (na qual Y representa tirosina, M é metionina e x é qualquer aminoácido) liga-se a um domínio SH2 da cinase 3 do lipídio fosfatidilinositol (PI3-cinase). A mesma proteína adaptadora pode recrutar uma tirosinocinase com domínio SH3 específico para um fragmento rico em prolina e, desse modo, a fosforilação da tirosina do adaptador pode levar à sobreposição de uma tirosinocinase e da PI3-cinase próximas uma da outra, resultando na fosforilação e na ativação da PI3-cinase. Por essa razão, a transdução de sinais pode ser entendida como um tipo de rede social. Um sinal inicial (p. ex., fosforilação da tirosina) resulta na aproximação das proteínas em determinados encaixes (adaptadores) e isto desencadeia a ativação de enzimas específicas que, por fim, influem na localização nuclear ou na atividade de determinados fatores de transcrição subsequentes ou induzem outros processos celulares (p. ex., polimerização da actina).
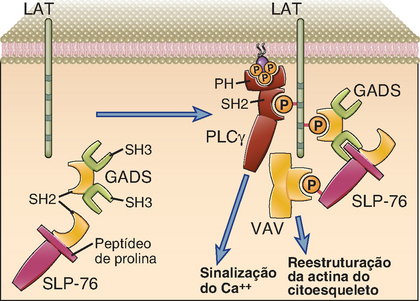
FIGURA 7-4 Algumas proteínas adaptadas que participam da ativação dos linfócitos. À esquerda, a figura ilustra o LAT (uma proteína estrutural da membrana que funciona como adaptador) e dois adaptadores citosólicos (GADS e SLP-76) de uma célula T não ativada. À direita, depois da ativação da célula T, o LAT tem suas tirosinas fosforiladas e recruta a PLCγ e o adaptador GADS, ambos contendo domínios SH2. Um motivo rico em aminoácidos prolina da SLP-76 combina-se com um domínio SH3 do GADS e a SLP-76 com tirosinas fosforiladas recruta a Vav.
A FAMÍLIA DOS RECEPTORES IMUNOLÓGICOS
Os receptores imunológicos constituem uma família singular de complexos receptores geralmente formados por proteínas estruturais de membrana pertencente à superfamília das imunoglobulinas (Ig) envolvidas no reconhecimento dos ligantes, que estão associados a outras proteínas de sinalização transmembrana que possuem moléculas singulares contendo tirosina em suas extremidades citoplasmáticas. Embora os componentes da sinalização geralmente sejam proteínas diferentes daquelas que participam do reconhecimento dos ligantes, em alguns componentes dessa família o receptor consiste em uma única cadeia, na qual os domínios extracelulares participam do reconhecimento dos ligantes e a extremidade citoplasmática contém resíduos de tirosina que contribuem para a sinalização. As proteínas de sinalização da família dos receptores imunológicos geralmente ficam posicionadas nas proximidades das tirosinocinases não receptoras da família Src. Essas últimas enzimas também possuem âncoras lipídicas N-terminais, que as fixam à superfície interna da membrana plasmática. Em geral, os segmentos citoplasmáticos das proteínas de sinalização da família dos receptores imunológicos que contêm tirosina podem ser de dois tipos. Os ITAM (sequências de ativação baseadas na tirosina do imunoreceptor) estão presentes nos receptores que participam da ativação celular e têm a sequência YxxL/I(x)6-8YxxL/I, na qual Y representa uma molécula de tirosina, L é leucina, I é isoleucina e x é qualquer aminoácido. Quando os receptores imunológicos são ativados, as sequências de ITAM podem ser fosforilados nas duas moléculas de tirosina presentes pelas cinases da família Src. Os ITAM com tirosina fosforilada recrutam uma tirosinocinase diferente da família Syk/ZAP-70, que contém domínios SH2 paralelos que se ligam a uma das duas sequências YxxL/I fosforiladas do ITAM. A ligação da Syk (ou da ZAP-70) a um ITAM fosforilado provoca uma alteração de conformação desta cinase e em sua ativação. Em seguida, a cinase Syk ou ZAP-70 ativada estimula a ativação das células imunes. Alguns receptores imunológicos inibem respostas celulares, e as cadeias de sinalização desses receptores podem conter uma molécula de tirosinocinase ligeiramente diferente, que é conhecida como ITIM (sequência inibidora baseada na tirosina do imunorreceptor) e possui a sequência correspondente de V/L/IxYxxL, na qual V é representada pela valina. As ITIM fosforiladas recrutam fosfatases de tirosina ou inositol, enzimas que removem as moléculas de fosfato da fosfotirosina ou de determinados fosfatos lipídicos e, desse modo, impedem a ativação do receptor imunológico pelo ITAM.
Os componentes da família dos receptores imunes incluem os receptores de antígenos das células B e T, o receptor de IgE nos mastócitos e os receptores de Fc ativadores e inibidores das células da imunidade inata e dos linfócitos B (Fig. 7-5). Os ITAM estão localizados nas extremidades citoplasmáticas de vários complexos de receptores imunes envolvidos na transdução de sinais, inclusive a cadeia ζ e as proteínas CD3 do complexo receptor das células T (TCR), as proteínas Igα e Igβ associadas às moléculas de Ig da membrana (receptores de antígenos) das cédulas B e os componentes de vários receptores de Fc do receptor ativador NKG2D das células assassinas naturais (natural killer − NK) (Cap. 4). Os receptores inibitórios que contêm ITIM incluem os receptores CD22, FcγRIIB e vários receptores das células NK.
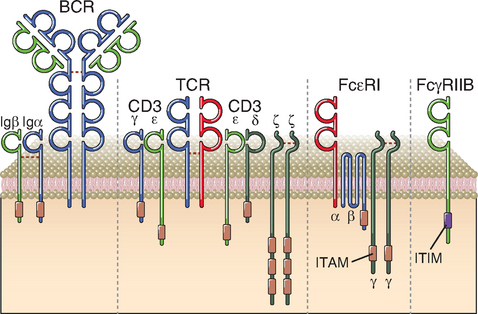
FIGURA 7-5 Alguns componentes da família dos receptores imunológicos. A figura ilustra quatro componentes selecionados da família dos receptores imunológicos. Em geral, os receptores imunológicos que ativam as células do sistema imune têm cadeias independentes para o reconhecimento e cadeias associadas que contém ITAM citosólicos. Os exemplos ilustrados nesta figura são o receptor de células B (BCR), o receptor de células T (TCR) e o receptor de alta afinidade para IgE (FcεR). Os receptores inibitórios do sistema imune geralmente têm motivos de ITIM na parte citosólica da mesma cadeia que utiliza seu domínio extracelular para reconhecimento do ligante. O receptor inibitório ilustrado – FcγRIIB – está presente nos linfócitos B e nas células mieloides.
Aspectos Gerais da Sinalização dos Receptores de Antígenos
A sinalização subsequente dos receptores de antígenos das células B e T caracteriza-se por uma sequência semelhante de eventos, que é a seguinte:
• O acoplamento do receptor geralmente depende do seu agrupamento por ligantes polivalentes, resultando na ativação de uma cinase associada da família Src. O acoplamento do receptor também pode resultar na mudança conformacional da extremidade citoplasmática de uma cadeia polipeptídica que faz parte do receptor. O processo de alteração da conformação pode permitir que moléculas de tirosina até então escondidas no fragmento citosólico do ITAM fiquem disponíveis para a fosforilação por uma cinase da família Src.
• Cinase da família Src ativada fosforila as tirosinas disponíveis nos ITAM das proteínas de sinalização, que fazem parte do complexo receptor.
• As duas tirosinas fosforiladas de um único ITAM são reconhecidas por uma tirosinocinase da família Syk, que possui dois domínios SH2 paralelos, cada qual capaz de reconhecer uma fosfotirosina do ITAM.
• O recrutamento da cinase da família Syk para o ITAM fosforilado resulta na ativação desta tirosinocinase e na fosforilação subsequente da tirosina das proteínas adaptadoras e das enzimas que ativam diferentes vias de sinalização subsequentes do receptor imunológico.
Essa sequência de eventos está descrita em mais detalhes em uma seção subsequente deste capítulo, em que se descreve a sinalização pelos receptores das células B e T.
As alterações na intensidade da sinalização pelo TCR e pelo receptor de células B (BCR) afetam o destino final dos linfócitos durante seu desenvolvimento e sua ativação. Em outras palavras, a presença de quantidades variadas de moléculas de sinalização ativadas e induzidas pelos receptores acoplados aos antígenos é interpretada diferentemente pelos linfócitos. Por exemplo, durante a maturação das células T no timo, os sinais fracos emitidos pelos receptores de antígenos são necessários para a seleção positiva – o processo que preserva as células úteis que são capazes de se ligar às moléculas do MHC próprias – e a intensidade dos sinais pode determinar a seleção positiva das células T em desenvolvimento na linhagem CD4 ou CD8 (Cap. 8). Por sua vez, fortes sinais emitidos aos receptores de antígenos durante a maturação podem contribuir para a morte dos linfócitos por apoptose. A intensidade da sinalização pelo TCR e pelo BCR também pode afetar diferentemente o tipo de resposta imune desencadeada por determinado antígeno.
A sinalização dos receptores de antígenos é rigorosamente controlada e modulada por três mecanismos singulares a esse grupo de receptores.
• Utilização progressiva dos ITAM. Um dos mecanismos pelos quais diferentes intensidades de sinalização poderiam ser produzidas pelos receptores de antígenos é o grau de fosforilação das tirosinas dos ITAM, depois do acoplamento do receptor. O complexo do TCR tem seis cadeias de sinalização e 10 ITAM, e a extensão da fosforilação nos ITAM é diretamente proporcional à afinidade dos diferentes ligantes pelo TCR. Por essa razão, a quantidade de ITAM fosforilados pode mediar a interpretação citosólica da afinidade do antígeno que se liga ao TCR; desse modo, a afinidade pelo antígeno pode influenciar o tipo de resposta celular nos diferentes estágios da diferenciação e da ativação. O BCR possui apenas dois ITAM, mas como este número aumenta quando o receptor forma ligações cruzadas com antígenos polivalentes, o grau de ligação cruzada pelos antígenos pode determinar a quantidade de ITAM que poderiam ser usados e, desse modo, desencadear diferentes respostas aos antígenos com afinidade e valência diversas.
• Aumento da ativação celular por correceptores. Correceptor é uma proteína de sinalização transmembrana presente nos linfócitos, que pode facilitar a ativação dos receptores de antígenos porque se liga simultaneamente ao mesmo complexo antigênico reconhecido pelo receptor. O correceptor traz consigo enzimas de sinalização acopladas à sua extremidade citoplasmática e, deste modo, pode facilitar a fosforilação dos ITAM e a ativação do receptor de antígenos quando este último é atraído para as proximidades do receptor. Os correceptores das células T são as proteínas CD4 e CD8, que definem os dois subtipos funcionalmente diversos. O receptor de complemento do tipo 2 (CR2/CD21) é o correceptor das células B.
• Modulação da sinalização por receptores inibitórios. Os receptores inibitórios essenciais presentes nas células T incluem o CTLA-4 e o PD-1, enquanto os sinais inibitórios importantes para as células B são liberados por receptores como CD22 e FcγRIIB, entre outros. As funções desses inibidores estão descritas nas seções subsequentes deste capítulo.
Além disso, os sinais dos receptores de antígenos podem, em algumas situações, cooperar com os sinais emitidos pelos outros receptores (conhecidos como receptores coestimuladores), que acrescentam um nível adicional de controle do processo de ativação dos linfócitos. Os receptores coestimuladores fornecem “sinais secundários” aos linfócitos (o reconhecimento do antígeno é o primeiro sinal) e asseguram que as respostas imunes sejam desencadeadas em condições ideais pelos agentes infecciosos patogênicos e pelas substâncias que simulam a ação dos micro-organismos. Ao contrário dos correceptores, os receptores coestimuladores não fazem parte do complexo de reconhecimento dos antígenos:MHC; a sinalização subsequente aos receptores coestimuladores é incorporada aos sinais emitidos pelo receptor de antígenos e esses sinais colaboram para a ativação plena dos linfócitos. O protótipo de receptor coestimulador das células T é o CD28, que é ativado pelas moléculas coestimuladoras B7-1 e B7-2 (CD80 e CD86), moléculas induzidas nas células apresentadoras de antígenos (APC, para antigen presentign cells) em consequência de sua exposição aos micro-organismos (Cap. 9).
O Complexo Receptor e a Sinalização das Células T
O TCR foi descoberto no início da década de 1980, praticamente na mesma época em que foram definidas as estruturas das moléculas do complexo de histocompatibilidade principal (MHC) associadas aos peptídeos (ligantes das células T) (Cap. 6). Algumas abordagens diferentes foram utilizadas para definir a estrutura molecular do TCR. Uma delas dependia da identificação dos genes expressos especificamente nas células T e que também poderiam passar por um fenômeno de recombinação especificamente nessas células (um aspecto característico dos genes dos receptores de antígenos, conforme está descrito no Cap. 8). Desse modo, o primeiro gene identificado era homólogo aos genes das Ig e foi definido como uma cadeia de TCR heterodimérico γδ. Com outra abordagem, foram geradas populações clonais de células T e foram produzidos os anticorpos monoclonais contra diferentes clones dessas células. Desse modo, foi possível identificar os anticorpos monoclonais que reconheciam apenas um clone específico de células T. Esses anticorpos específicos de clones identificavam uma cadeia do TCR. Em outro estudo diferente, uma cadeia do TCR foi identificada por acaso, quando o sequenciamento de uma coleção de cDNAs específicos das células T revelou inesperadamente um novo gene semelhante ao das imunoglobulinas. Hoje sabemos que o TCR é semelhante aos anticorpos, mas existem diferenças importantes entre estes dois tipos de receptores de antígenos (Tabela 7-1).
TABELA 7-1 Propriedades dos Receptores de Antígenos dos Linfócitos: o Receptor de Células T e as Imunoglobulinas
| Receptor da Célula T (TCR) | Imunoglobulina (Ig) | |
|---|---|---|
| Componentes | Cadeias α e β | Cadeias pesadas e leves |
| Número de domínios de Ig | Um domínio V e um domínio C em cada cadeia | |
| Número de CDR | Três em cada cadeia para ligação do antígeno | Três em cada cadeia |
| Moléculas de sinalizadoras associadas | CD3 e ζ | Igα e Igβ |
| Afinidade pelo antígeno (Kd) | 10−5-10−7 M | 10−7 a 10−11 M (Ig secretória) |
| Alterações após ativação celular | ||
| Produção da forma secretória | Não | Sim |
| Mudança de isotope | Não | Sim |
| Mutações somáticas | Não | Sim |
A Estrutura do Receptor de Antígeno das Células T
Os receptores de antígenos das células T CD4+ auxiliares (helper) e das células T citotóxicas CD8+ (CTL) MHC-restritas consistem em heterodímeros formados por duas cadeias polipeptídicas transmembranas (designadas TCR α e β) ligadas covalentemente entre si através de ponte dissulfeto através dos resíduos de cisteínas presentes nas porções extracelulares das cadeias do TCR (Fig. 7-6). Essas células T são conhecidas como linfócitos T αβ. Um tipo menos comum de TCR encontrado nas células γδ é formado por cadeias γ e δ do TCR. Cada cadeia α e β do TCR consiste em um domínio variável (V) N-terminal ao domínio da Ig, um domínio constante (C), também semelhante ao domínio C da Ig, uma região transmembrana hidrofóbica e uma região citoplasmática curta. Desse modo, a parte extracelular do heterodímero do TCR αβ é estruturalmente semelhante ao fragmento de ligação aos antígenos (Fab) de uma molécula de Ig, que é formada pelas regiões V e C de uma cadeia leve e pela região V e uma região C da cadeia pesada (Cap. 5).
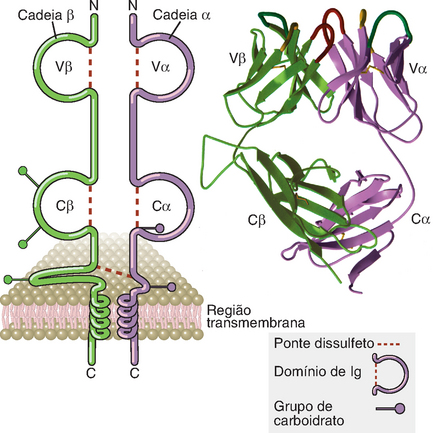
FIGURA 7-6 Estrutura do receptor de células T. O diagrama esquemático do TCR αβ (à esquerda) demonstra os domínios de um TCR típico e específico para um complexo de peptídeo-MHC. A porção de ligação dos antígenos ao TCR é formada pelos domínios Vβ e Vα. O diagrama de fita (à direita) ilustra a estrutura da parte extracelular de um TCR, conforme se evidencia pela cristalografia de raios X. As alças do segmento hipervariável que constituem o sítio de ligação do peptídio-MHC estão na parte superior do diagrama.
(Modificada de Bjorkman PJ. MHC restriction in three dimensions: a view of T cell receptor/ligand interactions. Cell 89:167-170, 1997. Direitos autorais da Cell Press.)
As regiões V das cadeias α e β do TCR contêm duas sequências curtas de aminoácidos, nas quais se concentra a maior taxa de variabilidade entre os diferentes TCR; estas sequências formam as regiões hipervariáveis, ou regiões determinantes de complementaridade (CDR). Três CDR para cadeia α e três CDR da cadeia β formam, em conjunto, a parte do TCR que reconhece especificamente os complexos de peptídeos-MHC (Fig. 7-7). O domínio V da cadeia β contém uma quarta região hipervariável, que não parece participar do reconhecimento de antígenos, mas é o sítio de ligação de produtos microbianos conhecidos como superantígenos (Cap. 15). Assim como ocorre com as cadeias leves e pesadas das Ig, cada cadeia do TCR é codificada por vários segmentos de genes que passam por recombinações somáticas durante a maturação dos linfócitos T (Cap. 8).
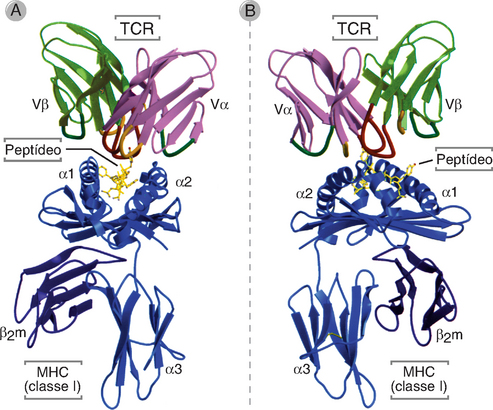
FIGURA 7-7 Ligação de um TCR a um complexo peptdeo-MHC. A figura ilustra os domínios V do TCR interagindo com uma molécula do MHC de classe I (HLA-A2), que apresenta um peptídeo viral (em amarelo). A é uma visão frontal e B é uma visão lateral da estrutura evidenciada pela cristalografia de raios X do complexo trimolecular de MHC-peptídeo-TCR.
(Modificada de Bjorkman PJ. MHC restriction in three dimensions: a view of T cell receptor/ligand interactions. Cell 89:167-170, 1997. Direitos autorais da Cell Press.)
As regiões C das cadeias α e β estendem-se para dentro das regiões globulares, que contêm moléculas de cisteína necessárias para interação intercadeias vias pontes dissulfeto. O domínio globular é seguido pelas regiões transmembrana hidrofóbicas, nas quais um aspecto incomum é a existência de moléculas de aminoácidos com cargas positivas, inclusive uma molécula de lisina (na cadeia α) ou uma molécula de lisina e arginina (na cadeia β). Essas moléculas interagem com as moléculas carregadas negativamente localizadas nas regiões transmembrana de outros polipeptídios (do complexo CD3 e ζ) que fazem parte do complexo do TCR. As cadeias α e β do TCR têm extremidades citoplasmáticas carboxiterminais com comprimentos de 5 a 12 aminoácidos. Como também ocorre com as Ig de membrana das células B (ver adiante), essas regiões citoplasmáticas são muito pequenas para transduzir sinais e as moléculas específicas associadas fisicamente ao TCR desempenham as funções de transdução de sinais por este complexo receptor de antígenos.
As proteínas CD3 e ζ estão associadas de forma não covalente ao heterodímero TCR αβ e, quando este receptor reconhece um antígeno, estas proteínas associadas transduzem os sinais que resultam em ativação da célula T. As Figuras 7-8 e 7-9 ilustram os componentes do complexo TCR. As proteínas CD3 e a cadeia ζ são idênticas em todas as células T, independentemente de sua especificidade, e isto é compatível com seu papel na sinalização e não no processo de reconhecimento dos antígenos. As proteínas CD3 são necessárias não apenas para a sinalização das células T, mas também para a expressão superficial do complexo receptor funcionalmente completo por essas células.
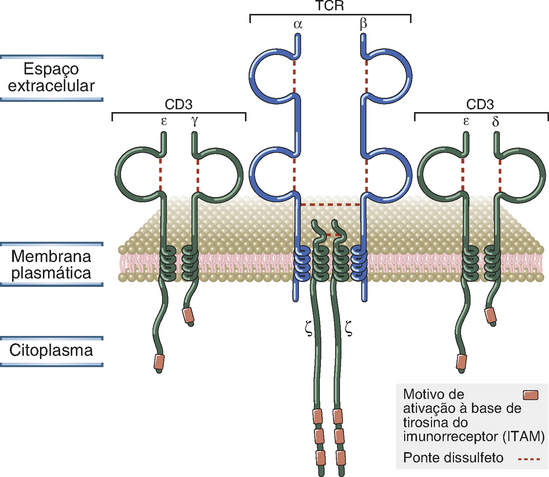
FIGURA 7-8 Componentes do complexo TCR. O complexo TCR das células específicos para o MHC consiste no TCR αβ ligado de forma não covalente ao CD3 e às proteínas ζ. A associação dessas proteínas entre si é mediada por regiões polares das suas porções transmembrana, que não estão ilustradas nesta figura.
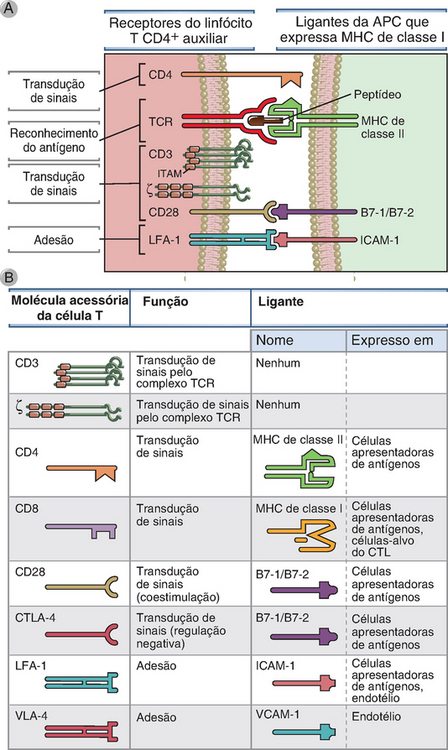
FIGURA 7-9 Pares de ligantes e receptores envolvidos na ativação das células T. A, A figura ilustra as principais moléculas de superfície das células T CD4+ envolvidas na ativação dessas células (os receptores) e as moléculas das APC (os ligantes) reconhecidas pelos receptores. As células T CD8+ utilizam quase todas as mesmas moléculas, exceto quanto ao fato de que o TCR reconhece complexos de peptídeos-MHC de classe I, e seu correceptor é o CD8, que reconhece o MHC de classe I. Os fragmentos de ativação baseados em tirosina do imunorreceptor (ITAM) são as regiões das proteínas de sinalização que têm seus resíduos de tirosina fosforiladas e transformam-se em sítios de atração para outras moléculas de sinalização. O CD3 é formado por três cadeias polipeptídicas (γ, δ e ε) dispostas em dois pares (γε e δε); por esta razão, encontramos o CD3 como três cadeias de proteínas. B, Resumo das principais propriedades das moléculas “acessórias” das células T, assim denominadas porque participam das respostas aos antígenos mas não são receptores de antígenos. O CTLA-4 (CD152) é um receptor para moléculas B7 e gera sinais inibitórios; sua função é interromper as respostas das células T, conforme está descrito no Capítulo 9. As moléculas VLA são integrinas envolvidas na ligação dos leucócitos ao endotélio (Cap. 3). APC, célula apresentadora de antígenos; ICAM-1, molécula 1 de adesão intercelular; LFA-1, antígeno 1 associado à função leucocitária; MHC, complexo principal de histocompatibilidade; TCR, receptor da célula T; VLA, antígeno muito tardio.
As proteínas CD3 γ, δ e ε são homólogas entre si. As regiões extracelulares N-terminais das cadeias γ, δ e ε contêm um único domínio semelhante à Ig e, por esta razão, estas três proteínas fazem parte da superfamília das Ig. Os segmentos transmembrana de todas as três cadeias CD3 contêm uma molécula carregada negativa de ácido aspártico, que se liga às moléculas carregadas positivamente dos domínios transmembrana das cadeias α e β do TCR. Cada complexo TRC contém um heterodímero TCR αβ associado a um heterodímero CD3 γε, um heterodímero CD3 δε e um homodímero ζ ligado por ponte dissulfídrica.
Os domínios citoplasmáticos das proteínas CD3 γ, δ e ε têm comprimentos de 44 a 81 aminoácidos, e cada um desses domínios contém um ITAM. A cadeia ζ tem uma região extracelular curta com nove aminoácidos, uma região transmembrana que contém o ácido aspártico de carga negativa (semelhante às cadeias CD3) e uma região citoplasmática longa (113 aminoácidos) que contém três ITAM. Em condições normais, essa proteína é expressa como homodímero. A cadeia ζ também está associada aos receptores de sinalização de outros linfócitos além das células T, inclusive ao receptor Fcγ (FcγRIII) das células NK.
Iniciação dos Sinais pelo Receptor das Células T
O acoplamento do TCR aos complexos de peptídeos-MHC resulta no agrupamento dos correceptores com o receptor de antígenos e na fosforilação das moléculas de tirosina do ITAM. A fosforilação das moléculas de tirosina do ITAM inicia a transdução de sinais e a ativação das tirosinocinases subsequentes que, por sua vez, fosforilam as moléculas de tirosina presentes em outras proteínas adaptadoras. As etapas subsequentes da transdução de sinais são geradas pelo recrutamento específico de enzimas essenciais, que iniciam diferentes processos de sinalização subsequente.
Como também ocorre com outros receptores imunológicos, o TCR aparentemente é ativado quando várias moléculas do receptor são aproximadas pela ligação aos epítopos antigênicos adjacentes. Entretanto, a ligação cruzada entre os TCR é difícil porque a indução do agrupamento dos receptores exigiria grande quantidade de complexos idênticos de peptídeo-MHC presentes nas APC; em geral, estas células expressam pouquíssimos complexos de peptídeo-MHC (talvez apenas 100 por célula) capazes de serem reconhecidos por determinado TCR (Cap. 6). Então, como o sinal inicial é gerado pelo TCR? Estudos demonstraram que o reconhecimento de antígenos pelo TCR induz a fosforilação do ITAM por cinases ativas pertencentes à família Src, mas o mecanismo real de iniciação da sinalização ainda não foi determinado conclusivamente. Existem evidências crescentes de que os ITAM do complexo TCR são mantidos numa conformação inacessível até que o receptor reconheça um antígeno. O reconhecimento dos complexos peptídeo-MHC pode provocar uma alteração de conformação do TCR, tornando os ITAM, associados ao CD3 ou às cadeias ζ, acessíveis à fosforilação da tirosina pelas cinases da família Src. Ou então a atividade das cinases dessa família pode ser ampliada depois da ligação do receptor (Fig. 7-10). Os correceptores CD4 e CD8 (descritos adiante) facilitam enormemente o processo de ativação aproximando a Lck (que está ligada com pouca afinidade à extremidade das proteínas correceptoras) dos ITAM do CD3 e ζ (Fig. 7-10). Por fim, forma-se uma interface relativamente estável entre a célula T e a APC, que é conhecida como sinapse imunológica (descrita adiante).
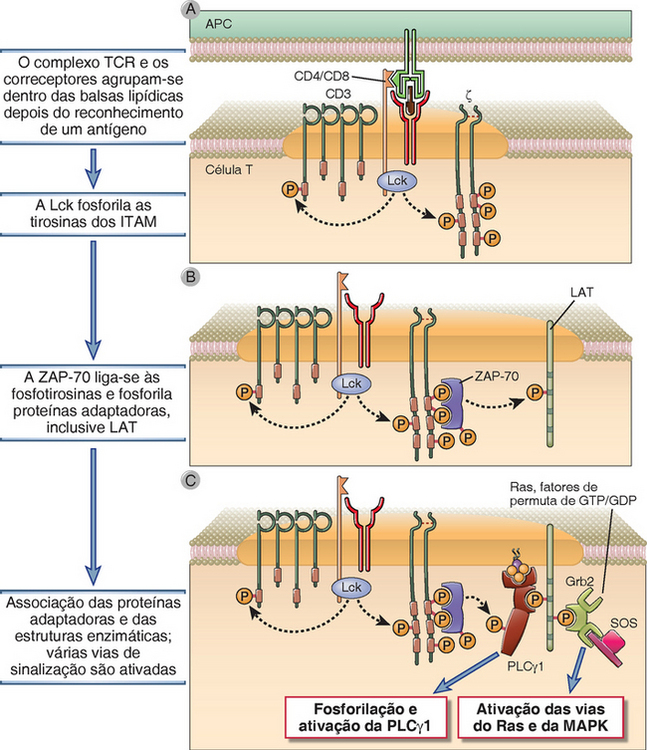
FIGURA 7-10 Primeiras reações de fosforilação das tirosinas durante a ativação das c´lulas T. Com o reconhecimento de um antígeno, há agrupamento dos complexos TCR com seus coreceptores (CD4, neste caso). A Lck associada ao CD4 torna-se ativa e fosforila as tirosinas dos ITAM do CD3 e das cadeias ζ (A). A ZAP-70 liga-se às fosfotirosinas das cadeias ζ e, em seguida, ela própria fica fosforilada e ativada. (A figura ilustra a ligação de uma molécula de ZAP-70 com duas fosfotirosinas de um ITAM da cadeia ζ, mas é provável que a iniciação da resposta da célula T necessite de aglomeração de várias moléculas de ZAP-70 em cada cadeia ζ.) Em seguida, a ZAP-70 ativada fosforila as tirosinas de várias moléculas adaptadoras, inclusive LAT (B). Os adaptadores transformam-se em sítios de atração para as enzimas celulares (inclusive PLCγ1) e fatores de permuta, que ativam a Ras e outras proteínas G pequenas subsequentes das MAP cinases (C) e estas enzimas ativam várias respostas celulares.
O Papel dos Correceptores CD4 e CD8 na Ativação das Células T
O CD4 e o CD8 são os correceptores das células T que se ligam às regiões não polimórficas das moléculas do MHC e facilitam a sinalização pelo complexo TCR durante a ativação dessas células (Fig. 7-9). Essas proteínas são conhecidas como correceptores porque se ligam às moléculas do MHC e, desse modo, reconhecem uma parte do mesmo ligante (complexos peptídeo-MHC) que interage com o TCR. Os linfócitos T αβ maduros expressam CD4 ou CD8, mas não ambos simultaneamente. O CD8 e o CD4 interagem com as moléculas do MHC de classes I e II, respectivamente, e são responsáveis pela restrição destes subtipos celulares do MHC de classe I ou II (Fig. 7-9 e Cap. 6).
O CD4 e o CD8 são glicoproteínas transmembrana que fazem parte da superfamília das Ig (Fig. 7-11). O CD4 é expresso como monômero na superfície das células T periféricas e dos timócitos e também está presente nos fagócitos mononucleares e algumas células dendríticas. Esse é o receptor das células T para a proteína do envoltório do vírus da imunodeficiência humana. O CD4 tem quatro domínios extracelulares semelhantes às Ig, uma região transmembrana hidrofóbica e uma extremidade citoplasmática altamente básica com 38 aminoácidos. Os dois domínios N-terminais (semelhantes às Ig) da proteína CD4 ligam-se ao domínio β2 não polimórfico da molécula do MHC de classe II.
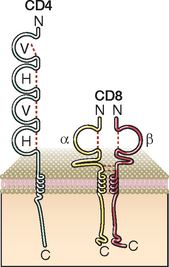
FIGURA 7-11 Ilustração esquemática da estrutura dos correceptores CD4 e CD8. A proteína CD4 é um monômero estrutural da membrana, que consiste em quatro domínios de Ig extracelulares, um domínio transmembrana e uma extremidade citoplasmática. A proteína CD8 é um heterodímero estrutural αβ ligado por ponte dissulfeto, ou um homodímero αα ligado por uma ponte dissulfeto (não ilustrado). Cada cadeia tem um único domínio de Ig extracelular. As partes citoplasmáticas do CD4 e do CD8 podem combinar-se com a Lck (não ilustrada).
A maioria das moléculas CD8 apresenta-se em forma de heterodímeros interligados por pontes dissulfetos e é formada por duas cadeias semelhantes conhecidas como CD8α e CD8β (Fig. 7-11). As cadeias α e β têm um único domínio extracelular de Ig, uma região transmembrana hidrofóbica e uma extremidade citoplasmática altamente básica com cerca de 25 aminoácidos. O domínio de Ig do CD8 liga-se ao domínio α3 não polimórfico das moléculas do MHC de classe I. Algumas células T expressam homodímeros CD8 αα, mas esta configuração diferente parece funcionar da mesma forma que os heterodímeros CD8 αβ mais comuns. Esses homodímeros também estão presentes em um subgrupo de células dendríticas dos camundongos (Cap. 6).
As extremidades citoplasmáticas do CD4 e do CD8 ligam-se à cinase LcK da família Src. A capacidade demonstrada por esses correceptores de se ligarem às moléculas do MHC ajuda estas proteínas a se aproximarem do TCR, que entra em contato com o mesmo complexo de peptídeo-MHC presente na APC. Por essa razão, na face citosólica da membrana, a Lck é atraída para bem perto dos ITAM das proteínas CD3 e ζ e provoca a fosforilação dos ITAM e, desse modo, facilita o recrutamento e a ativação subsequentes da cinase ZAP-70.
Ativação das Tirosinocinases e de uma Lipidocinase durante a Ativação das Células T
A fosforilação das moléculas das proteínas e dos lipídios desempenha uma função central na transdução dos sinais gerados pelo complexo TCR e pelos correceptores. Dentro de alguns segundos depois da ligação do TCR, muitas das moléculas de tirosina localizadas dentro dos ITAM do CD3 e das cadeias ζ são fosforiladas (Fig. 7-10). Além da Lck associada ao correceptor, outra cinase da família Src encontrada em combinação física com o complexo TCR é a Fyn associada ao CD3, que pode desempenhar uma função semelhante à da Lck. Os camundongos deficientes em Lck (knockout) apresentam algumas anormalidades do desenvolvimento das células T, enquanto os camundongos duplamente knockout para Lck e Fyn desenvolvem anormalidades ainda mais graves.
Os ITAM da cadeia ζ com tirosinas fosforiladas transformam-se em “sítios de atracação” para a tirosinocinase da família Syk conhecida como ZAP-70 (proteína de 70 kD associada à cadeia ζ). A ZAP-70 tem dois domínios SH2 que podem ligar-se às tirosinas fosforiladas dos ITAM. Cada ITAM tem duas moléculas de tirosina e as duas devem ser fosforiladas para formar um sítio de atracação para uma molécula de ZAP-70. A ZAP-70 acoplada funciona como substrato para a Lck adjacente, que fosforila resíduos específicos de tirosina da ZAP-70. Consequentemente, a ZAP-70 adquire sua própria atividade de tirosinocinase e, em seguida, consegue fosforilar algumas outras moléculas citoplasmáticas de sinalização. Como é necessário alcançar um limiar crítico de ativação da ZAP-70, antes que os processos de sinalização subsequentes tenham seguimento, portanto, várias moléculas de ZAP-70 são recrutadas para os ITAM fosforilados das extremidades das cadeias ζ e do CD3.
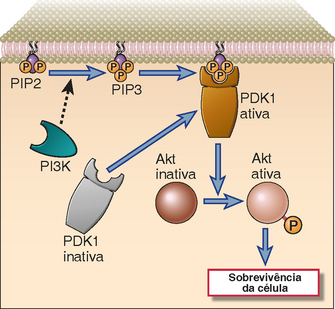
Outra via de sinalização das células T consiste na ativação da PI3-cinase, que fosforila o lipídio inositol associado à membrana (Fig. 7-12). Essa enzima é recrutada para o complexo TCR contendo proteínas adaptadoras associadas e produz fosfatidilinositol trifosfato (PIP3) do fosfatidilinositol bifosfato (PIP2) localizado na superfície interna da membrana plasmática. Algumas proteínas de sinalização presentes no citosol possuem domínios PH especializados com afinidade pelo PIP3 e, por esta razão, as proteínas que contêm estes domínios podem ligar-se à superfície interna da membrana celular apenas quando o PIP3 é produzido. Exemplos de proteínas que contêm domínios PH são as cinases como a Itk das células T e a Btk das células B. Outra importante cinase dependente de PIP3 é a PDK1, que é necessária para a fosforilação e a ativação de uma importante cinase subsequente conhecida como Akt. A Akt ativada fosforila alvos cruciais e contribui de várias maneiras para a sobrevivência celular. A fosforilação pela Akt resulta na inativação de dois membros pró-apoptóticos da família do Bcl-2 (BAD e BAX). Além disso, a Akt inativa um fator de transcrição da família Forkhead que induz a expressão do ligante Fas, e esta cinase também degrada a caspase-9.
Recrutamento e Modificação das Proteínas Adaptadoras
A ZAP-70 ativada fosforila várias proteínas adaptadoras capazes de ligar-se às moléculas de sinalização (Fig. 7-10). Um dos primeiros eventos cruciais para a ativação da célula T é a fosforilação dos resíduos de tirosinas das proteínas adaptadoras (inclusive SLP-76 e LAT) mediada pela ZAP-70. A LAT fosforilada liga-se diretamente à PLCγ1 (uma enzima essencial para ativação das células T; ver adiante) e coordena o recrutamento de várias outras proteínas adaptadoras, inclusive SLP-76, GADS e Grb-2 de forma a agrupar os TCR e as proteínas associadas – estrutura também conhecida como sinalossomo. Desse modo, a LAT ajuda a aproximar vários componentes subsequentes das vias de sinalização do TCR, trazendo-os para perto dos seus ativadores precedentes. Como a função de muitas dessas proteínas adaptadoras depende da fosforilação de suas tirosinas pela ZAP-70 ativada, apenas o reconhecimento de antígenos (estímulo fisiológico da ativação da ZAP-70) desencadeia a transdução de sinais que resultam nas respostas funcionais das células T.
Formação da Sinapse Imunológica
Quando o complexo TCR reconhece peptídios ligados ao MHC na APC, várias proteínas de superfície e moléculas de sinalização intracelular das células T são rapidamente mobilizadas para o ponto de contato entre estas células e a APC (Fig. 7-13). Essa região de contato físico entre a célula T e a APC forma uma estrutura semelhante a um olho de boi, que é conhecida como sinapse imunológica ou agrupamento de ativação supramolecular (SMAC). Entre as moléculas da célula T que são mobilizadas rapidamente para o centro da sinapse estão o complexo TCR (o TCR, o CD3 e as cadeias ζ), os correceptores CD4 ou CD8, os receptores dos coestimuladores (inclusive CD28), as enzimas como a PKC-θ e as proteínas adaptadoras que se combinam com as extremidades citoplasmáticas dos receptores transmembrana. Nessa região da sinapse conhecida como c-SMAC (agrupamento central de ativação supramolecular), a distância entre as membranas plasmáticas da célula T e da APC é de cerca de 15 nm. As integrinas permanecem na periferia da sinapse, onde atuam de modo a estabilizar a ligação da célula T com a APC, formando a região periférica do SMAC (conhecida como p-SMAC). Nessa região mais externa da sinapse, a distância entre as duas membranas é de cerca de 40 nm. Muitas moléculas de sinalização presentes nas sinapses localizam-se inicialmente nas regiões da membrana plasmática com teores lipídicos diferentes do restante da membrana celular (regiões conhecidas como balsas lipídicas ou microdomínios ricos em glicolipídios). A sinalização gerada pelo TCR e pelos receptores coestimuladores é iniciada nessas balsas e desencadeia rearranjos do citoesqueleto, que permitem a coalescência das balsas e a formação da sinapse imunológica.
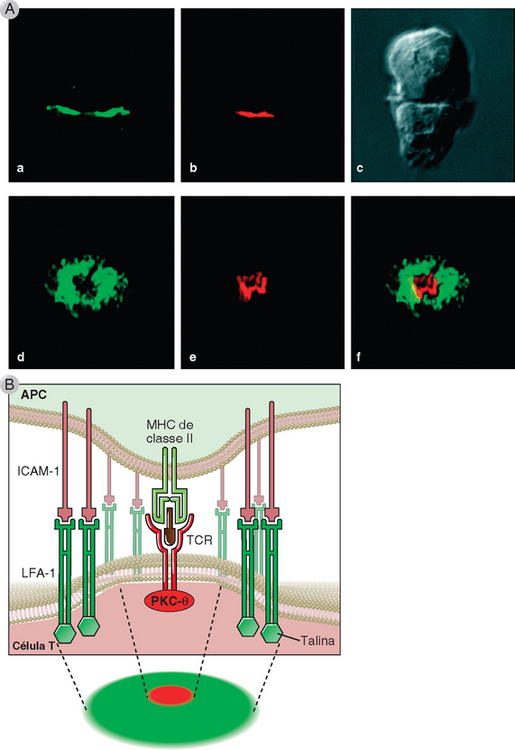
FIGURA 7-13 A sinapse imunológica. A, Esta figura mostra duas visões da sinapse imunológica de um complexo formado por uma célula T e uma APC (mostrado como imagem de Nomarski no painel c). A talina, uma proteína que se associa com a extremidade citoplasmática da integrina LFA-1, foi revelada por um anticorpo marcado com um fluorógeno verde; a PKC-θ, que se associa ao complexo TCR, foi demonstrada por anticorpos conjugados a um fluorógeno vermelho. Os painéis a e b ilustram um corte óptico bidimensional do contato celular ao longo do eixo x-y, demonstrando a localização central da PKC-θ e a posição periférica da talina, ambas na célula T. Os painéis d a f mostram uma visão tridimensional de toda a região de contato intercelular ao longo do eixo x-z. Observe também a localização central da PKC-θ e o acúmulo periférico de talina. B, Ilustração esquemática da sinapse, mostrando a talina e a LFA-1 no p-SMAC (verde) e a PKC-θ e o TCR no c-SMAC (vermelho).
(Reproduzida com autorização de Macmillan Publishers Ltd., de Monks CRF, BA Freiburg, H Kupfer, N Sciaky, and A Kupfer. Three dimensional segregation of supramolecular activation clusters in T cells. Nature 395:82-86, © 1998.)
As sinapses imunológicas podem desempenhar algumas funções durante e após a ativação das células T:
• A sinapse estabelece um contato estável entre uma célula T específica de antígeno e uma APC que apresenta esse antígeno, tornando a região de aglomeração dos sinalizadores, inclusive complexo TCR, correceptores, receptores coestimuladores e adaptadores. Embora a transdução de sinais via TCR certamente comece antes da formação da sinapse e seja necessária para sua criação, a própria sinapse imunológica pode oferecer uma interface única para a ativação do TCR. A ativação da célula T precisa superar os problemas da afinidade geralmente baixa entre os TCR e os ligantes de peptídeo-MHC e da reduzida disponibilidade de moléculas de MHC que exibem qualquer peptídeo na superfície da APC. A sinapse constitui um local no qual o acoplamento repetido dos TCR pode ser sustentado por esse número reduzido de complexos de peptídeo-MHC da APC e, desse modo, facilita a sinalização eficaz e prolongada da célula T.
• A sinapse pode assegurar que a liberação específica do conteúdo dos grânulos secretórios e das citocinas por uma célula T ocorra diante de uma APC, ou outros alvos celulares que estão em contato com esta primeira célula. Estudos demonstraram que a liberação direcionada do conteúdo granular, ricos em perforina e granzimas, pelos CLT para as células-alvo ocorre nessa sinapse (Cap. 10). Do mesmo modo, as interações entre o CD40L e o CD40 são facilitadas pelo acúmulo destas moléculas nas interfaces da sinapse imunológica entre a célula T e a APC. Algumas citocinas também são secretadas especificamente dentro da fenda sináptica, de onde são liberadas preferencialmente para a célula que apresenta o antígeno ao linfócito T.
• A sinapse também pode ser um local importante para o turnover das moléculas de sinalização, principalmente por monoubiquitinação e liberação dos endossomos e lisossomos subsequentes. Essa degradação das proteínas de sinalização pode contribuir para a interrupção da ativação das células T, conforme está descrito adiante.
Vias de Sinalização da Cinase MAP dos Linfócitos T
As pequenas proteínas de ligação ao nucleotídeo de guanina (proteínas G) ativadas pelo reconhecimento de um antígeno estimulam no mínimo três proteinocinases ativadas por mitógeno (MAP) que, por sua vez, ativam diferentes fatores de transcrição. As proteínas G participam de várias respostas de ativação em diferentes tipos de células. Dois membros dessa família ativados depois do TCR são a Ras e a Rac. Cada uma ativa um componente diferente ou um conjunto de fatores de transcrição e, em conjunto, elas medeiam muitas respostas celulares dos linfócitos T.
• A viaRas é ativada nas células T depois da ligação do TCR e resulta na ativação da cinase ativada por receptor extracelular (ERK), que é um componente importante da família das cinases MAP e, por fim, provoca a ativação dos fatores de transcrição subsequentes. A Ras está ligada frouxamente à membrana plasmática por lipídios acoplados de forma covalente. Em sua forma inativa, o sítio de ligação do nucleotídio guanina da Ras está ocupado pelo difosfato de guanosina (GDP). Quando o GDP ligado é substituído pelo trifosfato de guanosina (GTP), a Ras sofre uma alteração conformacional e depois pode recrutar ou ativar várias enzimas celulares, das quais a mais importante é a c-Raf. A ativação da Ras pela permuta do GDP pelo GTP ocorre em resposta ao acoplamento de muitos tipos de receptores existentes em muitas linhagens celulares, inclusive o complexo TCR das células T. As proteínas Ras mutantes que se encontram constitutivamente ativadas (ou seja, assumem constantemente a conformação ligada ao GTP) estão associadas à transformação neoplásica de muitos tipos celulares. Proteínas Ras sem mutações são ativas GTPases que convertem o GTP ligado à Ras em GDP e, desse modo, retornam a proteína Ras ao seu estado inativo normal.
O mecanismo de ativação da Ras das células T envolve as proteínas adaptadoras LAT e Grb-2 (Fig. 7-14). Quando a LAT é fosforilada pela ZAP-70 na região de agrupamento dos TCR, ela funciona como sítio de atração para o domínio SH2 da Grb-2. Depois de ligar-se à LAT, a Grb-2 recruta o fator de permuta GTP/GDP da Ras, também conhecido como SOS (assim denominado porque é o correspondente dos mamíferos de uma proteína da Drosophila conhecida como son of sevenless) da membrana plasmática. O SOS catalisa a permuta do GDP pelo GTP na Ras. Isso resulta na forma de Ras acoplada ao GTP (resumida como Ras.GTP) que, em seguida, ativa uma série de três MAP cinases, das quais as duas primeiras fosforilam e ativam a cinase seguinte da série. A última cinase da cascata iniciada pela Ras é uma MAP cinase conhecida como ERK. A Ras.GTP ativa uma cinase conhecida como c-Raf que, por sua vez, ativa uma cinase de especificidade dupla que fosforila a ERK nas moléculas de treonina e tirosina situadas muito próximas uma da outra. Essa cinase de especificidade dupla é um exemplo de cinase que ativa MAP cinase. A MAP cinase ativada pela ERK dirige-se ao núcleo e fosforila uma proteína conhecida como Elk que, depois de ser fosforilada, estimula a transcrição do c-Fos, um componente do fator de transcrição conhecido como proteína 1 de ativação (AP-1).
• Simultaneamente à ativação da Ras pelo recrutamento da Grb-2 e do SOS, os adaptadores fosforilados pelas cinases ligadas ao TCR também recrutam e ativam uma proteína de permuta de GTP/GDP conhecida como Vav, que atua em uma outra proteína pequena de ligação do nucleotídio guanina denominada Rac (Fig. 7-14). A Rac.GTP gerada inicia uma cascata paralela de MAP cinases, resultando na ativação de outra MAP cinase conhecida como cinase N-terminal c-Jun (JNK). A JNK também é conhecida como proteinocinase ativada pelo estresse (SAP) porque, em muitas células, ela é ativada por vários tipos de estímulos nocivos, como luz ultravioleta, estresse osmótico, ou citocinas pró-inflamatórias, como o fator de necrose tumoral (TNF) e a IL-1. Em seguida, a JNK ativada fosforila a c-Jun, que é o segundo componente do fator de transcrição AP-1. Além da ERK e da JNK, o terceiro membro da família das MAP cinases é a p38, que também é ativada pela Rac.GTP e, por sua vez, ativa vários fatores de transcrição. A Rac.GTP também estimula a reorganização do citoesqueleto e pode desempenhar uma função importante no agrupamento dos complexos TCR, dos correceptores e de outras moléculas de sinalização na sinapse.
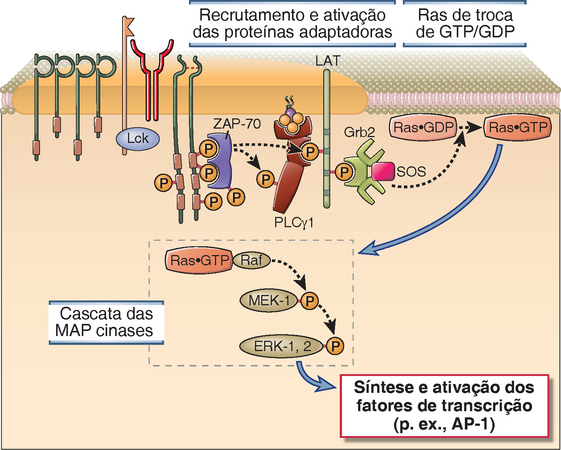
FIGURA 7-14 Via da Ras-MAP cinase durante a ativação da célula T. A ZAP-70 ativada pelo reconhecimento de um antígeno fosforila as proteínas adaptadoras associadas à membrana (inclusive LAT) que, em seguida, liga-se a outro adaptador (Grb-2) que forma um sítio de atração para o fator de permuta de GTP/GDP conhecido como SOS. O SOS converte a Ras.GDP em Ras.GTP. A Ras.GTP ativa uma cascata enzimática que culmina na ativação da MAP cinase ERK. Uma via paralela dependente da Rac produz outra MAP cinase ativa (JNK) (não ilustrada).
Por fim, as atividades da ERK e da JNK são bloqueadas pela ação das fosfatases proteicas com especificidade dupla para tirosina/treonina. Essas fosfatases são induzidas ou ativadas pelas próprias ERK e JNK, estabelecendo o mecanismo de retroalimentação negativo necessário para supressão da ativação das células T.
Vias de Sinalização Mediadas pelo Cálcio e pela PKC dos Linfócitos T
A sinalização via TCR resulta na ativação da isoforma γ1 da enzima fosfolipase C (PLCγ1), e os produtos da hidrólise dos lipídios de membrana, mediada pela PLCγ1, ativam outras enzimas, que induzem fatores de transcrição específicos das células T (Fig. 7-15). A PLCγ1 é uma enzima citosólica específica para fosfolipídios de inositol e é recrutada para a membrana plasmática para as tirosinas fosforiladas do LAT dentro de alguns minutos depois do acoplamento do antígeno ao TCR. Nesse local, a enzima é fosforilada pela ZAP-70 e por outras cinases, inclusive a cinase da família Tec conhecida como Itk. A PLCγ1 fosforilada catalisa a hidrólise de um fosfolipídio de membrana plasmática conhecido como PIP2, que forma dois produtos quando é decomposto: o inositol-1,4,5-trifosfato (IP3), que é um açúcar solúvel contendo trifosfato, e o diacilglicerol (DAG), que permanece ligado à membrana. Em seguida, o IP3 e o DAG ativam duas vias de sinalização subsequente das células T.
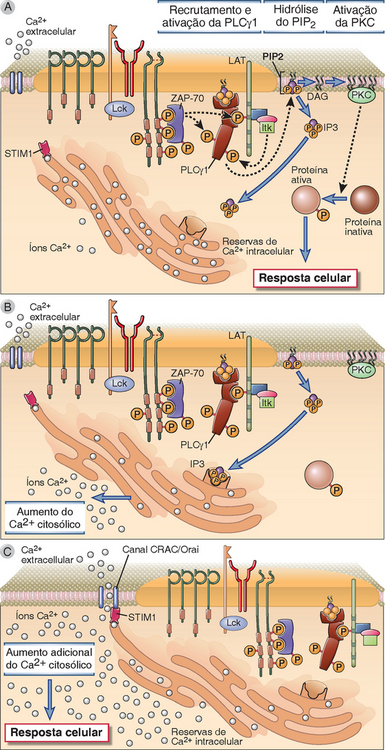
FIGURA 7-15 Sinalização da célula T subsequente à PLCγ1. A, A proteína adaptadora LAT, que é fosforilada com a ativação da célula T, liga-se à enzima citosólica PLCγ1, que é fosforilada e ativada pela ZAP-70 e outras cinases (inclusive Itk). A PLCγ1 ativa hidrolisa o PIP2 da membrana e produz IP3 (que estimula o aumento do cálcio citosólico) e DAG (que ativa a enzima PKC). B, A depleção do cálcio do retículo endoplasmático é “percebida” pelo STIM1. C, O STIM1 induz a abertura do canal CRAC que facilita a entrada no cálcio extracelular no citosol. A Orai é um componente do canal CRAC. Em seguida, o cálcio citosólico aumentado e a PKC ativam vários fatores de transcrição e desencadeiam as respostas celulares.
O IP3 induz aumento de cálcio livre no citosol dentro de alguns minutos depois da ativação da célula T. O IP3 difunde-se do citosol para o retículo endoplasmático, onde se liga ao seu receptor (um canal de cálcio controlado por ligante) e estimula a liberação das reservas de cálcio sequestradas na membrana. O cálcio liberado aumenta rapidamente (em alguns minutos) a concentração do íon cálcio livre no citosol do nível em repouso, cerca de 100 nM, para o valor máximo de 600 a 1.000 nM. A depleção do cálcio do retículo endoplasmático é “percebida” por uma proteína da membrana do retículo endoplasmático conhecida como STIM1, que ativa um canal iônico da membrana plasmática conhecido como canal CRAC (canal de cálcio ativado pela liberação de cálcio). O resultado é a entrada do cálcio extracelular, que mantém os níveis citosólicos em torno de 300 a 400 nM por mais de 1 hora. Um componente fundamental do canal CRAC é uma proteína denominada Orai, que foi descoberta como um gene anormal associado a uma forma rara de imunodeficiência humana. O cálcio livre no citosol atua como molécula de sinalização ligando-se a uma proteína reguladora ubíqua dependente de cálcio, conhecida como calmodulina. Os complexos de cálcio-calmodulina ativam várias enzimas, incluindo a calcineurina, que é uma serina/treonina fosfatase importante para a ativação dos fatores de transcrição, conforme está descrito adiante.
O diacilglicerol (DAG), segundo produto da decomposição do PIP2, é um lipídio acoplado à membrana que ativa a enzima proteinacinase C (PKC). Várias isoformas da PKC participam da produção dos fatores de transcrição ativos, conforme descritos adiante. A combinação de níveis altos de cálcio citosólico livre e DAG ativam determinadas isoformas da PKC associada à membrana por indução de uma alteração de conformação, que torna o sítio catalítico da cinase acessível aos seus substratos. Várias proteínas subsequentes são fosforiladas pela PKC. A isoforma PKC-θ localiza-se na sinapse imunológica e participa da ativação e da translocação nuclear do fator nuclear κB (NF-κB), que também é um fator de transcrição. As vias de ativação do NF-κB estão descritas nas seções subsequentes deste capítulo.
Até aqui, descrevemos várias vias de transdução de sinais iniciadas pelo acoplamento do ligante ao TCR, resultando na ativação de diferentes tipos de enzimas: as vias das MAP cinases – pequenas proteínas G resultam na ativação das enzimas como a ERK e a JNK; uma via dependente da PLCγ1-cálcio leva à ativação da fosfatase calcineurina; e uma via dependente do DAG provoca a ativação da PKC. Todas essas vias contribuem para a expressão dos genes que codificam proteínas necessárias à expansão clonal, à diferenciação e às funções efetoras das células T. Na seção subsequente, descreveremos os mecanismos pelos quais essas diferentes vias de sinalização estimulam a transcrição de vários genes das células T.
Ativação dos Fatores de Transcrição que Regulam a Expressão dos Genes das Células T
As enzimas geradas pela sinalização do TCR ativam fatores de transcrição que se ligam às regiões reguladoras de diversos genes das células T e, desse modo, aumentam a transcrição desses genes (Fig. 7-16). Grande parte dos nossos conhecimentos sobre a regulação transcricional dos genes das células T baseia-se nas análises da expressão dos genes das citocinas. A regulação transcricional da maioria dos genes das citocinas das células T é controlada pelo acoplamento dos fatores de transcrição às sequências nucleotídicas das regiões promotoras e amplificadoras desses genes. Por exemplo, o promotor da IL-2 localizado na posição 5′ dos éxons codificadores deste gene contém um segmento com cerca de 300 pares de bases, que são sítios de ligação localizada para vários fatores de transcrição diferentes. Todos esses sítios precisam ser ocupados pelos fatores de transcrição para que haja transcrição máxima do gene da IL-2. Os diferentes fatores de transcrição, ativados pelas diversas vias de transdução de sinais citoplasmáticos, e a exigência de vários fatores de transcrição explicam a necessidade de ativar muitas vias de sinalização seguindo o reconhecimento de um antígeno. É provável que os mesmos princípios sejam aplicáveis a muitos genes das células T, inclusive os que codificam os receptores das citocinas e as moléculas efetoras, embora diferentes genes possam responder a diversas combinações de fatores de transcrição.
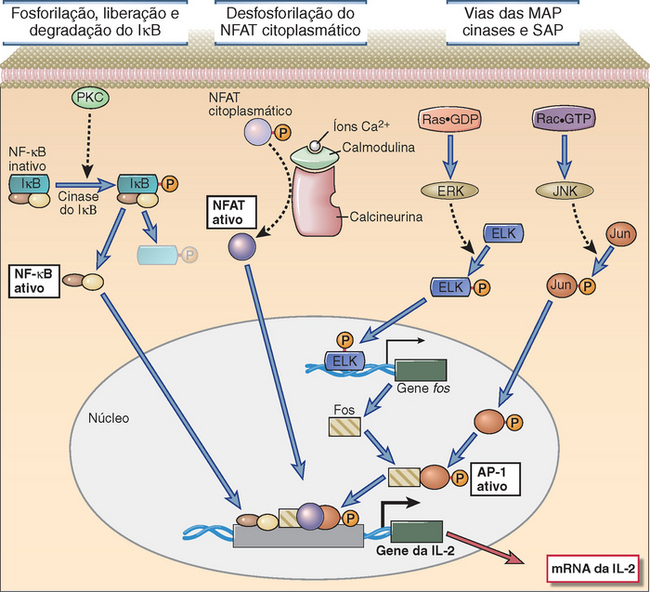
FIGURA 7-16 Ativação dos fatores de transcrição das células T. Várias vias de sinalização convergem nas células estimuladas por antígenos para produzir fatores de transcrição que estimulam a expressão de vários genes (neste caso, o gene da IL-2). A via do cálcio-calmodulina ativa o NFAT e as vias do Ras e do Rac produzem os dois componentes do AP-1. Existem menos informações sobre a ligação entre os sinais do TCR e a ativação do NF-κB. (O NF-κB está ilustrado como um complexo formado de duas subunidades que, nas células T, geralmente são as proteínas p50 e p65, assim denominadas em virtude de seus pesos moleculares em quilodáltons.) A PKC é importante para a ativação das células T e a isoforma PKC-θ é particularmente importante para a ativação do NF-κB. Esses fatores de transcrição atuam de forma coordenada para regular a expressão dos genes. Observe também que as várias vias de sinalização estão ilustradas demonstrando a ativação de seus fatores de transcrição específicos, mas pode haver considerável sobreposição; além disso, cada via pode desempenhar funções na ativação de vários fatores de transcrição.
Os três fatores de transcrição ativados nas células T pelo reconhecimento de um antígeno e que parecem ser fundamentais para a maioria das respostas das células T são: fator nuclear das células T ativadas (NFAT), AP-1 e NF-κB.
• O NFAT é um fator de transcrição necessário à expressão dos genes da IL-2, da IL-4, do TNF e de outras citocinas. O NFAT está presente em uma forma inativa (serina fosforilada) no citoplasma dos linfócitos T em repouso. Esse fator é ativado pela fosfatase dependente do cálcio-calmodulina conhecida como calcineurina. A calcineurina desfosforila o NFTA citoplasmático e, desta forma, expõe um sítio sinal de localização nuclear que permite a translocação desse fator ao núcleo. Depois de chegar ao núcleo, o NFAT liga-se às regiões reguladoras dos genes da IL-2, da IL-4 e de outras citocinas, geralmente em combinação com outros fatores de transcrição, como o AP-1.
O mecanismo de ativação do NFAT foi descoberto indiretamente por estudos do mecanismo de ação do agente imunossupressor ciclosporina (Cap. 16). Esse fármaco e um composto funcionalmente semelhante chamado FK506 são produtos naturais dos fungos e são agentes terapêuticos amplamente utilizados para evitar rejeição de aloenxertos. Esses fármacos atuam basicamente bloqueando a transcrição dos genes das citocinas das células T. A ciclosporina liga-se a uma proteína citosólica conhecida como ciclofilina, enquanto o FK506 liga-se a uma proteína denominada proteína de ligação do FK506 (FKBP). A ciclofilina e a FKBP também são conhecidas como imunofilinas. Os complexos de ciclosporina-ciclofilina e os complexos de FK506-FKBP ligam-se à calcineurina, provocam sua inativação e, desse modo, bloqueiam a translocação do NFAT para dentro do núcleo.
• O AP-1 é um fator de transcrição encontrado em muitos tipos celulares e é ativado especificamente pelos sinais mediados pelo TCR nos linfócitos T. Na verdade, a sigla AP-1 é usada para descrever uma família de fatores de ligação ao DNA formados por dímeros de duas proteínas, que se ligam uma à outra por meio de um domínio estrutural compartilhada conhecida como zíper de leucina. O fator AP-1 mais bem caracterizado é formado pelas proteínas Fos e Jun. Os sinais gerados pelo TCR resultam no aparecimento do AP-1 ativo no núcleo das células T. Em geral, a ativação do AP-1 requer a síntese da proteína Fos e a fosforilação da proteína Jun preexistente. A transcrição e a síntese da Fos podem ser aumentadas pela via da ERK, conforme foi descrito antes, assim como pela PKC. A JNK fosforila c-Jun, e os complexos de AP-1 contendo a forma fosforilada da Jun demonstram atividade ampliada de estimulação da transcrição. O AP-1 parece estar associado fisicamente a outros fatores de transcrição no núcleo (inclusive NFAT) e atua mais eficazmente em presença do NFAT. Desse modo, a ativação do AP-1 constitui um ponto de convergência de várias vias de sinalização desencadeada pelo TCR.
• O NF-κB é um fator de transcrição ativado em resposta aos sinais gerados pelo TCR e é essencial para a síntese das citocinas. As proteínas do NF-κB são homodímeros ou heterodímeros das proteínas semelhantes ao produto de um proto-oncogene celular conhecido como c-rel e são importantes na transição de muitos genes de diversos tipos de células, principalmente nas células imunes inatas (Cap. 4). Nas células T em repouso, o NF-κB está presente no citoplasma em complexos com outras proteínas conhecidas como inibidores do κB (IκBs), que impedem a exposição da sequência sinal de localização nuclear do NF-κB e, desse modo, impedem a entrada deste fator no núcleo. Os sinais gerados pelo TCR resultam na fosforilação da serina do IκBα e, em seguida, na sua ubiquitinação e degradação proteossômica. As enzimas responsáveis pela fosforilação do IκB são conhecidas como IκB-cinases e estão descritas no final deste capítulo. Depois de ser liberado do IκB, o NF-κB consegue migrar ao núcleo e ligar-se e regular os promotores dos genes-alvo.
As inter-relações das diferentes proteínas de sinalização, a ativação dos fatores de transcrição e as respostas funcionais das células T geralmente são difíceis de definir porque ocorrem interações complexas e parcialmente esclarecidas entre as vias de sinalização. Além disso, para simplificar a questão geralmente descrevemos a sinalização no contexto de vias lineares, mas é provável que isto não reflita a realidade complexa e inter-relacionada. Por fim, até aqui enfatizamos determinadas vias para ilustrar como o reconhecimento de um antígeno pode desencadear alterações bioquímicas, mas é evidente que muitas outras moléculas de sinalização também participam da ativação dos linfócitos depois da exposição aos antígenos.
Modulação da Sinalização das Células T por Tirosinofosfatases Proteicas
As tirosinofosfatases removem as moléculas de fosfato dos resíduos de tirosina das proteínas e, em geral, inibem a sinalização pelo TCR. As duas tirosinofosfatases que desempenham funções inibitórias importantes nos linfócitos e outras células hematopoiéticas são conhecidas como SHP-1 e SHP-2 (para as fosfatases 1 e 2 que possuem domínios SH2). Em geral, as fosfatases inibitórias são recrutadas pelos receptores inibitórios induzidos depois da ativação dos linfócitos pelas tirosinocinases. Essas fosfatases inibem a transdução de sinais porque removem os fosfatos das tirosinas das moléculas sinalizadoras fundamentais e, desse modo, atuam como antagonistas funcionais das tirosinocinases. Outra fosfatase inibitória que não parece atuar nas fosfoproteínas, mas é específica de um fosfolipídio de inositol é conhecida como SHIP (fosfatase de inositol contendo domínio SH2). Assim como ocorre com a SHP-1 e a SHP-2, a SHIP liga-se às sequências do ITIM fosforilado dos receptores inibitórios específicos. A SHIP remove um grupo fosfato do PIP3 (um fosfolipídio localizado na superfície interna da membrana plasmática) e, desse modo, antagoniza a sinalização da PI3-cinase nos linfócitos.
Embora a maioria das fosfatases atenue a sinalização dos linfócitos, uma tirosinofosfatase (CD45) facilita a ativação destas células. A proteína CD45 é uma tirosinofosfatase expressa por todas as células hematopoiéticas, e é uma proteína estrutural da membrana, cuja extremidade citoplasmática contém domínios paralelos de tirosinofosfatase proteica. A CD45 remove moléculas de fosfato dos resíduos de tirosina que são inibitórias das cinases da familiar Src (Lck e Fyn) e, desse modo, contribui para a formação das cinases ativas.
Receptores Coestimuladores das Células T
Os sinais coestimuladores são gerados pelos receptores que reconhecem ligantes induzidos nas APC pelos micro-organismos e cooperam com os sinais originados do TCR para ampliar a sinalização e ativar as células T. A hipótese dos dois sinais necessários para ativação das células T foi descrita no Capítulo 1. A sinalização do TCR facilitada pelos correceptores desencadeia a resposta dos linfócitos T às estruturas estranhas. No jargão da imunologia, essa resposta do TCR ao complexo peptídeo:MHC presentes em uma APC é conhecida como sinal 1. As células ficam plenamente ativadas apenas quando um peptídeo estranho é reconhecido no contexto da ativação do sistema imune inato por um patógeno ou algum outro estímulo que seja pró-inflamatório. Os ligantes coestimuladores constituem os sinais de perigo (ou sinal 2) induzido pelos agentes infecciosos nas células apresentadoras de antígenos.
A Família CD28 de Receptores Coestimuladores
Os coestimuladores mais bem definidos dos linfócitos T são duas proteínas relacionadas, conhecidas como B7-1 (CD80) e B7-2 (CD86), que estão expressas nas células dendríticas, nos macrófagos e nos linfócitos B ativados. A molécula CD28 das células T é o principal receptor coestimulador para a liberação dos sinais secundários para ativação dessas células. As funções biológicas das proteínas B7 e CD28 estão descritas em mais detalhes no Capítulo 9.
Outro componente ativador importante da família CD28 é um receptor conhecido como ICOS (coestimulador indutível), que desempenha um papel importante no desenvolvimento das células T auxiliares foliculares e está descrito nos Capítulos 9 e 11.
A Família CD2/SLAM de Receptores Coestimuladores
Embora a família de receptores coestimuladores das células T mais bem estudada e mais importante seja a família CD28, outras proteínas também contribuem para a ativação e a diferenciação plenas dos linfócitos T. Uma família importante de proteínas que participam da ativação dos linfócitos T e das células NK é o grupo das proteínas estruturalmente relacionadas com um receptor conhecido como CD2 (Fig. 7-17). O CD2 é uma glicoproteína presente em mais de 90% das células T maduras, em 50% a 70% dos timócitos e nas células NK. Essa molécula tem dois domínios extracelulares de Ig, uma região transmembrana hidrofóbica e uma extremidade citoplasmática longa (116 moléculas de aminoácidos). Nos seres humanos, o ligante principal do CD2 é uma molécula conhecida como antígeno 3 associado à função do leucócito (LFA-3 ou CD58), que também faz parte da família CD2. O LFA-3 é expresso em grande variedade de células hematopoiéticas e de outras linhagens, seja como proteína estrutural de membrana ou como molécula de membrana ancorada ao fosfatidilinositol. Nos camundongos, o ligante principal do CD2 é o CD48, que também faz parte da família CD2 e é diferente do LFA-3, embora tenha com este algumas semelhanças estruturais.
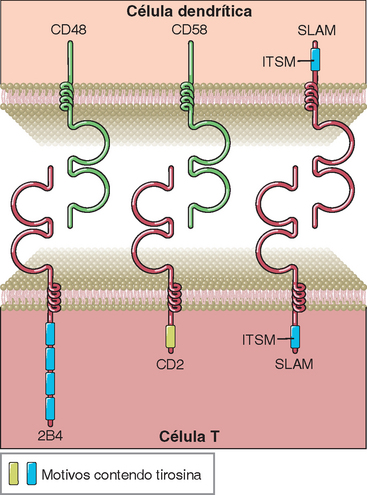
FIGURA 7-17 Alguns receptores coestimuladores da família CD2 e seus ligantes. O 2B4, o CD2 e o SLAM contêm dois domínios extracelulares semelhantes à Ig, e suas extremidades citoplasmáticas também têm sequências que contêm tirosina. A região com tirosina das porções distais do SLAM e dos outros membros dessa família (inclusive 2B4) é conhecido como ITSM e liga-se à SAP ou outras proteínas semelhantes (não ilustradas).
O CD2 funciona como molécula de adesão intercelular e transdutor de sinais. Alguns anticorpos anti-CD2 aumentam a secreção de citocinas e a proliferação das células T cultivadas com anticorpos anti-TCR/CD3, indicando que os sinais do CD2 podem ampliar as respostas das células T desencadeadas pelo TCR. Alguns anticorpos anti-CD2 bloqueiam a ligação das células T com outras células que expressam LFA-3, indicando que a ligação do CD2 ao LFA-3 também facilita a adesão intercelular. Esses anticorpos inibem a atividade do CTL e as respostas das células T auxiliares dependentes dos antígenos. Os camundongos nocauteados (knockouts) para os genes CD28 e CD2 apresentam anormalidades mais graves das respostas das células T do que os animais que não expressam apenas um desses dois genes. Isso indica que as moléculas CD28 e o CD2 podem compensar a ausência uma da outra, ou seja, este é um exemplo de redundância dos receptores coestimuladores das células T. Com base nessas observações, hoje os anticorpos anti-CD2 estão sendo avaliados quanto à eficácia no tratamento da psoríase.
Outro subgrupo de proteínas da família CD2 é conhecido como família SLAM (molécula de ativação da sinalização linfocítica). Assim como ocorre com todos os membros da família CD2, a SLAM é uma proteína estrutural de membrana que possui dois domínios extracelulares de Ig e uma extremidade citoplasmática relativamente longa. Ao contrário do CD2, a extremidade citoplasmática da SLAM possui um motivo à base de tirosina específico, o TxYxxV/I (onde T representa o aminoácido de treonina, Y é uma molécula de tirosina, V é valina, I é isoleucina e x é qualquer aminoácido), conhecido como motivo de troca do imunorreceptor à base de tirosina (ITSM), que é diferente dos motivos de ITAM e ITIM presentes em outros receptores ativadores e inibidores. O ITSM é conhecido como motivo de troca porque, em alguns receptores, este motivo pode orquestrar uma troca, isto é, deixa de ligar-se a uma tirosinofosfatase (SHP-2) na ausência de um adaptador e passa a se associar a outras enzimas na presença de um adaptador conhecido como SAP (proteína associada ao SLAM) e, desse modo, essa troca permite que essa molécula execute tanto função inibitória quanto estimulatória.
Os domínios extracelulares de Ig do SLAM participam das interações homofílicas. O SLAM da célula T pode interagir com o SLAM da célula dendrítica e, consequentemente, a extremidade citoplasmática do SLAM pode liberar sinais às células T. O ITSM liga-se à SAP e esta forma uma ponte entre o SLAM e a Fyn (uma cinase da família Src que também está relacionada fisicamente com as proteínas CD3 das células T). O SLAM e os outros membros dessa família funcionam como receptores coestimuladores das células T, das células NK e de alguns linfócitos B. Como está descrito no Capítulo 20, as mutações do gene SH2D1A que codifica a SAP causam uma doença conhecida como síndrome linfoproliferativa ligada ao X (XLP).
Um membro importante da família SLAM das células NK, dos linfócitos T CD8+ e das células T γδ é conhecido como 2B4 (Fig. 7-17). O 2B4 reconhece um ligante do CD2 conhecido como CD48. Assim como ocorre com o SLAM, a extremidade citoplasmática do 2B4 contém sequências de ITSM, liga-se à proteína adaptadora SAP e gera sinais por meio do recrutamento da Fyn. A sinalização anormal do 2B4 pode contribuir significativamente para a imunodeficiência dos pacientes portadores de síndrome linfoproliferativa ligada ao X.
O COMPLEXO DO RECEPTOR DE ANTÍGENOS DO LINFÓCITO B
O receptor de antígenos do linfócito B é um tipo de molécula de anticorpo transmembrana associada a duas cadeias de sinalização. A estrutura dos anticorpos está descrita em detalhe no Capítulo 5. Neste capítulo, enfatizaremos alguns aspectos mais importantes das formas de Ig de membrana e suas proteínas associadas e descreveremos como elas enviam sinais às células B. Como essas vias de sinalização são semelhantes às utilizadas pelas células T, sua descrição não será muito detalhada. Entretanto, existem semelhanças e diferenças significativas entre os receptores de antígenos das células B e T (Tabela 7-1).
Estrutura do Receptor de Antígenos das Células B
A IgM e a IgD de membrana são os receptores de antígenos das células B virgens (naïve), e possuem extremidades citoplasmáticas curtas formadas com apenas três aminoácidos (lisina, valina e lisina). Essas extremidades são muito pequenas para transduzir os sinais gerados depois do reconhecimento de um antígeno. Os sinais mediados por Ig são transduzidos por duas outras moléculas (conhecidas como Igα e Igβ) que se interligam por uma ponte dissulfeto e são expressas nas células B ligadas de forma não covalente à Ig de membrana (Fig. 7-18). Cada uma dessas proteínas contém um motivo de ITAM em sua extremidade citoplasmática, e essas moléculas são necessárias para o transporte das moléculas de Ig de membrana em direção à superfície da célula B e, em combinação com a Ig de membrana, essas moléculas formam o complexo receptor da célula B (BCR). Nas células B com troca de classe (inclusive células de memória), os complexos receptores das células contêm imunoglobulinas de membrana que podem pertencer às classes IgG, IgA ou IgE (Cap. 11).
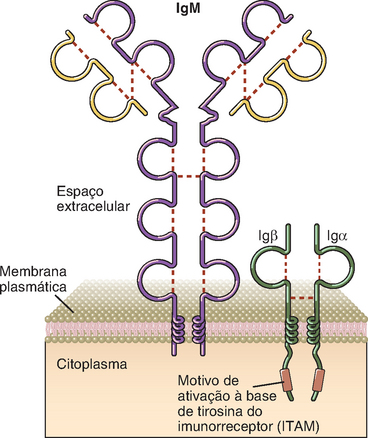
FIGURA 7-18 Complexo receptor de antígenos da célula B. A IgM (e a IgD) de membrana da superfície das células B maduras está associada às moléculas Igβ e Igα invariáveis, que contêm ITAM em suas extremidades citoplasmáticas que regulam as funções de sinalização. Observe a semelhança com o complexo TCR.
Iniciação dos Sinais pelo Receptor das Células B
A iniciação dos sinais por antígenos ocorre com a ligação cruzada dos BCR e é facilitada pelo correceptor do BCR. Aparentemente, a ligação cruzada da Ig de membrana por antígenos polivalentes reúne as cinases da família Src e, com a aproximação física desses complexos BCR, essas cinases são plenamente ativadas permitindo que essas enzimas fosforilem os resíduos de tirosina dos ITAM da Igα e da Igβ. Também é possível que, assim como ocorre com as células T, a ligação de um antígeno facilite a mudança conformacional dos ITAM associados ao BCR, tornando-os acessíveis às cinases da família Src que já estão ativadas e, portanto, aptas a fosforilar os resíduos de tirosinas dos ITAM, mas hoje não existem evidências definitivas para confirmar essa hipótese. A fosforilação das moléculas de tirosina dos ITAM desencadeia todos os processos de sinalização subsequente à ligação do BCR ao antígeno (Fig. 7-19). As ligações cruzadas das Ig de membrana também recrutam balsas lipídicas, onde muitas proteínas adaptadoras e moléculas de sinalização estão concentradas. A Igα e a Igβ estão frouxamente ligadas às tirosinocinases da família Src (inclusive Lyn, Fyn e Blk) e estas enzimas também estão ligadas por âncoras lipídicas à superfície interna da membrana plasmática. A fosforilação dos resíduos de tirosina dos ITAM da Igα e Igβ forma um sítio de atração para os domínios SH2 paralelos da tirosinocinase Syk. Essa enzima é ativada quando se combina com as tirosinas fosforiladas dos ITAM e também pode ser fosforilada em seus respectivos resíduos de tirosina pelas cinases da família Src associadas ao BCR, resultando na ampliação da ativação. Quando o antígeno é monovalente e não consegue formar ligações cruzadas com várias moléculas de Ig, ainda assim pode ocorrer alguma sinalização, mas a ativação adicional pelas células T auxiliares pode ser necessária para ativar plenamente os linfócitos B, conforme está descrito no Capítulo 11.
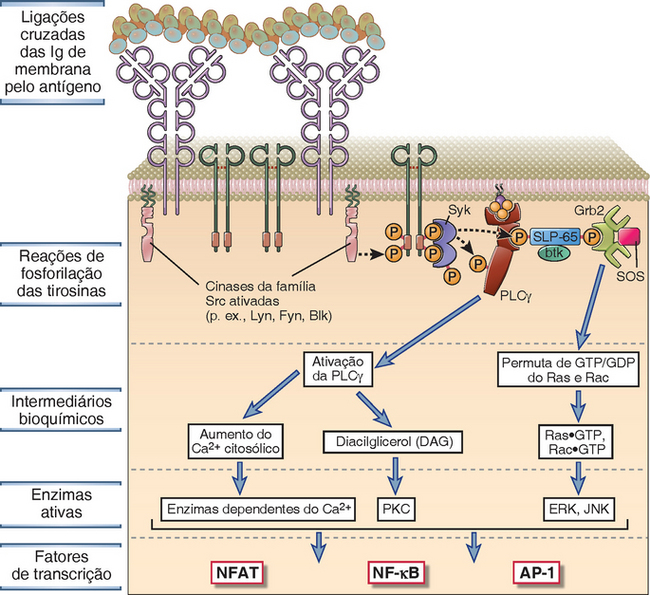
FIGURA 7-19 Transdução de sinais pelo complexo BCR. A ligação cruzada da Ig de membrana induzida por um antígeno nas células B resulta no agrupamento e na ativação das tirosinocinases da família Src e na fosforilação das tirosinas dos ITAM presentes nas extremidades citoplasmáticas das moléculas de Igα e Igβ. Isso resulta no acoplamento da Syk e as reações subsequentes de fosforilação da tirosina estão ilustradas. Como se pode observar, várias cascatas de sinalização ocorrem depois dessas reações, resultando na ativação de vários fatores de transcrição. Essas vias de transdução de sinais são semelhantes às descritas para as células T.
O Papel do Receptor de Complemento CR2/CD21 como Correceptor das Células B
A ativação das células B é ampliada pelos sinais gerados pelas proteínas do sistema complemento e pelo complexo correceptor CD21, que inter-relaciona a imunidade inata com as respostas imunes humorais adaptativas (Fig. 7-20). O sistema complemento é formado por um conjunto de proteínas plasmáticas que são ativadas pela ligação às moléculas de anticorpo acopladas aos antígenos (via clássica) ou pela ligação direta a algumas superfícies microbianas e polissacarídios na ausência de anticorpos (vias alternativas e de lectinas) (Caps. 4 e 12). Desse modo, os polissacarídios e outros componentes microbianos podem ativar diretamente o sistema complemento durante as respostas imunológicas inatas. As proteínas e os outros antígenos que não ativam diretamente o complemento podem ser ligados aos anticorpos preexistentes ou produzidos nas fases iniciais da resposta imune, e esses complexos antígeno-anticorpo ativam o complemento pela via clássica. É importante lembrar que a ativação do complemento resulta na clivagem proteolítica das proteínas que o compõem. O componente fundamental desse sistema é uma proteína conhecida como C3 e sua clivagem resulta na produção de uma molécula denominada C3b, que se liga de forma covalente ao micro-organismo ou ao complexo antígeno-anticorpo. O C3b é degradado ainda mais em um fragmento conhecido como C3d, que permanece ligado à superfície microbiana ou ao complexo antígeno-anticorpo. Os linfócitos B expressam um receptor para o C3d conhecido como receptor de complemento do tipo 2 (CR2, ou CD21). O complexo formado por C3d e antígeno ou C3d e complexo antígeno-anticorpo liga-se às células B e, nesse processo, a Ig de membrana reconhece o antígeno e o CR2 reconhece o C3d acoplado (Fig. 7-20).
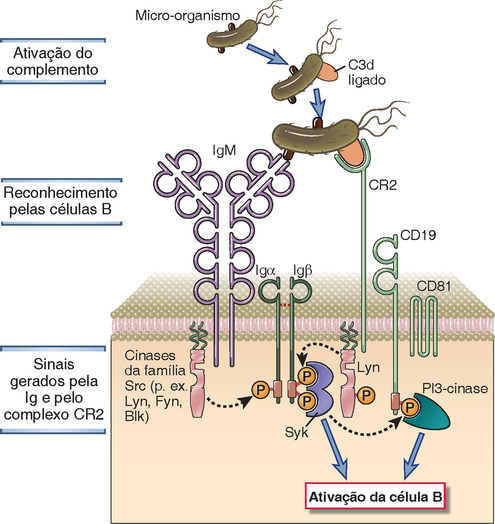
FIGURA 7-20 Função do complemento na ativação das células B. As células B expressam um complexo formado pelo receptor de complemento CR2, CD19 e CD81. Os agentes microbianos ligados a um fragmento Cd3 do complemento podem, simultaneamente, combinar-se com a molécula CR2 e com a Ig de membrana expressa na superfície da célula B. Isso inicia as cascatas de sinalização pelo complexo BCR e pelo complexo CR2 e, em consequência, as respostas aos complexos C3d-antígeno são acentuadamente ampliadas em comparação com a resposta gerada apenas por um antígeno.
O CR2 é expresso nas células B maduras em associação a um complexo com duas outras proteínas da membrana – CD19 e CD81 (também conhecida como TAPA-1). O complexo CR2-CD19-CD81 geralmente é conhecido como complexo correceptor da célula B porque o CR2 liga-se indiretamente ao antígeno por meio do C3d acoplado, ao mesmo tempo que a Ig de membrana liga-se diretamente ao antígeno. A ligação do C3d ao receptor de complemento da célula B aproxima o CD19 das cinases associadas ao BCR, e a extremidade citoplasmática do CD19 tem suas tirosinas rapidamente fosforiladas. A fosforilação da extremidade do CD19 resulta no recrutamento eficiente da Lyn (uma cinase da família Src), que pode amplificar a sinalização do BCR porque aumenta acentuadamente a fosforilação das tirosinas dos ITAM da Igα e da Igβ. O CD19 fosforilado também ativa outras vias de sinalização, principalmente uma que é dependente da enzima PI3-cinase que, por sua vez, amplia ainda mais a sinalização iniciada pela ligação do antígeno à Ig de membrana. A PI3-cinase é necessária para a ativação da Btk e da PLCγ2, porque estas enzimas precisam ligar-se ao PIP3 na superfície interna da membrana plasmática para que sejam plenamente ativadas, algo semelhante ao que está ilustrado na Figura 7-12. O resultado final da ativação dos correceptores é que a resposta da célula B estimulada por um antígeno é acentuadamente ampliada.
Vias de Sinalização Subsequentes ao Receptor das Células B
Depois da ligação do antígeno ao BCR, a Syk e outras tirosinocinases ativam várias vias de sinalização subsequentes, que são reguladas pelas proteínas adaptadoras (Fig. 7-19). A ligação cruzada do BCR ou a ativação deste complexo receptor por um mecanismo dependente de correceptores resulta na fosforilação dos ITAM e no recrutamento da Syk para os ITAM, seguidos da ativação desta cinase que contém dois domínios SH2. A Syk ativada fosforila resíduos críticos de tirosina das proteínas adaptadoras, inclusive SLP-65 (fosfoproteína leucocitária de ligação à SH2 de 65 kD, também conhecida como BLNK, ou proteína de ligação da célula B). Isso facilita o recrutamento, para essas proteínas adaptadoras, de outro domínio SH2 – e de enzimas que contêm o domínio de ligação da fosfotirosina (PTB), inclusive proteínas de troca do nucleotídio guanina, que podem ativar separadamente as vias Ras e o Rac, a PLCγ2 e a tirosinocinase Btk, entre outras. O recrutamento facilita a ativação de outros eventos bioquímicos subsequentes, cada qual geralmente contribuindo para a ativação de uma via de sinalização diferente.
• A via da cinase Ras-MAP é ativada nas células B estimuladas por antígenos. O fator de troca de GTP/GDP chamado SOS é recrutado para a BLNK por meio de ligação da proteína adaptadora Grb-2; em seguida, a Ras é convertida por esse fator de troca de sua forma inativa, ligada ao GDP, para sua forma ativa, ligada ao GTP. A Ras ativada contribui para a ativação da via da MAP cinase ERK, que foi descrita antes no contexto da sinalização das células T. Paralelamente, a ativação da pequena proteína de GTP Ras pode contribuir para a ativação da via da cinase MAP JNK.
• Uma fosfolipase C específica (PLC) para fosfatidilinositol é ativada em resposta à sinalização do BCR e isto, por sua vez, facilita a ativação das vias de sinalização subsequentes. Nas células B, a isoforma predominante da PLC é a γ2, enquanto as células T expressam a isoforma γ1 relacionada desta enzima. A PLCγ2 é ativada quando se liga à BLNK e é fosforilada pela Syk e pela Btk. Conforme foi descrito no contexto da sinalização pelo TCR, a PLC ativa degrada o PIP2 da membrana e produz IP3 solúvel e deixa o DAG na membrana plasmática. O IP3 mobiliza o cálcio das reservas intracelulares, resultando em elevação rápida do cálcio citoplasmático que, em seguida, é amplificado pela entrada de mais cálcio proveniente do meio extracelular. Em presença do cálcio, o DAG ativa algumas isoformas da proteinocinase C (principalmente PKC-β nas células B), que fosforilam as proteínas subsequentes em seus resíduos de serina/treonina.
• A ativação da PKC-β depois da ligação do BCR contribui para a ativação do NF-κB das células B estimuladas por antígenos. Esse processo é semelhante ao que ocorre nas células T estimuladas pela PKC-θ (a isoforma da PKC presente nessas células), e a via de ativação do NF-κB subsequente às PKC está descrita no final deste capítulo.
Por fim, essa sequência de sinalização resulta na ativação de alguns fatores de transcrição que induzem a expressão dos genes cujos produtos são necessários para as respostas normais das células B. Alguns dos fatores de transcrição ativados pela transdução de sinais mediados pelos receptores de antígenos das células B são a Fos (subsequente à ativação da Ras e da ERK), a JunB (subsequente à ativação da Rac e da JNK) e o NF-κB (subsequente à ativação da Btk, da PLCγ2 e da PKC-β). Esses fatores já foram descritos quando as vias de sinalização das células T foram analisadas. Esses e outros fatores de transcrição, dos quais muitos não foram mencionados neste capítulo, estimulam a proliferação e a diferenciação dos linfócitos B (Cap. 11).
Assim como acontece com as células T, nossos conhecimentos sobre as vias de sinalização induzidas nas células B pelos antígenos e suas ligações com as respostas funcionais subsequentes ainda estão incompletos. Neste capítulo, descrevemos algumas dessas vias para ilustrar os aspectos principais, mas outras vias podem desempenhar funções importantes na ativação das células B. As mesmas vias de sinalização são utilizadas pela IgM e pela IgD de membrana das células B virgens e pela IgG, pela IgA e pela IgE das células B que realizaram a mudança de isotipos, porque todos esses isotipos da membrana combinam-se com a Igα e a Igβ.
ATENUAÇÃO DA SINALIZAÇÃO DOS RECEPTORES IMUNOLÓGICOS
A ativação dos linfócitos precisa ser rigorosamente controlada para limitar as respostas imunes aos micro-organismos e evitar lesões dos tecidos do hospedeiro secundárias à inflamação. Além disso, o sistema imune necessita de mecanismos que impeçam reações contra os antígenos próprios. A biologia desses mecanismos de controle está descrita nos capítulos subsequentes, principalmente o Capítulo 14. A atenuação da sinalização é essencial para evitar inflamação e linfoproliferação descontroladas. A seguir, descrevemos os mecanismos bioquímicos que ajudam a limitar e interromper a ativação dos linfócitos.
A sinalização inibitória dos linfócitos é mediada principalmente por receptores inibidores e também por enzimas conhecidas como ligases de ubiquitina E3, que marcam determinadas moléculas de sinalização para posterior degradação. Em geral, os receptores inibitórios recrutam e ativam fosfatases que se contrapõem aos efeitos sinalizadores induzidos pelos receptores de antígenos (Fig. 7-21). As respostas funcionais de todas as células são reguladas por um equilíbrio entre sinais estimuladores e inibidores, e inicialmente descreveremos em termos gerais os mecanismos pelos quais os receptores inibitórios podem atuar nas células NK e nos linfócitos B e T. Em seguida, veremos como as ligases de ubiquitina E3 podem atenuar a sinalização nos linfócitos. A importância biológica da atenuação de sinais por meio dos receptores inibitórios das células NK e dos linfócitos B e T está descrita nos Capítulos 4, 9 e 11, respectivamente.
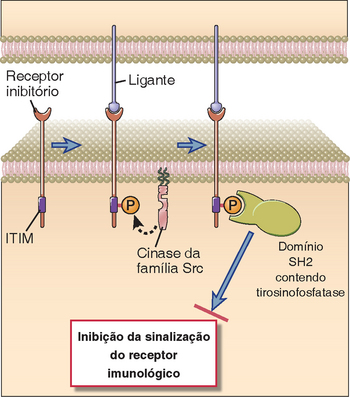
FIGURA 7-21 Sinalização inibitória dos linfócitos. A figura ilustra o diagrama de um receptor inibitório com um domínio extracelular de acoplamento ao ligante e um motivo de ITIM citosólico. O acoplamento ao ligante resulta na fosforilação da tirosina do ITIM por uma cinase da família Src, seguida do recrutamento de uma tirosinofosfatase com domínio SH2, que pode atenuar a sinalização do receptor imunológico.
Receptores Inibitórios das Células NK e dos Linfócitos B e T
Quase todos os receptores inibitórios do sistema imune contêm motivos de ITIM orientados para o citosol, que podem recrutar fosfatases que possuem domínios SH2 e, desse modo, atenuam a sinalização por um mecanismo geral semelhante (Fig. 7-21). Os receptores inibitórios desempenham funções essenciais nas células NK e nos linfócitos B e T, assim como em outras células da imunidade inata.
Nas células NK humanas, os principais receptores inibitórios podem ser classificados em três grupos: KIR ou receptores semelhantes às Ig matadoras (Cap. 4); família ILT (transcrito semelhante à Ig) de proteínas muito semelhantes aos KIR; e lectinas do tipo C, entre as quais a principal é um heterodímero formado pela lectina tipo C NKG2A e pelo CD94. Esses receptores inibitórios não se limitam às células NK e também podem ser encontrados em algumas células T ativadas. Os KIR têm domínios de Ig extracelulares capazes de reconhecer moléculas HLA de classe I, e um subgrupo desses receptores contém motivos de ITIM citosólico. O ILT-2, que faz parte de uma família evolutivamente mais antiga de receptores inibitórios que os KIR, também tem domínios de Ig extracelulares que se ligam ao HLA de classe I e motivos de ITIM citosólico. O dímero CD94/NKG2A liga-se a uma classe atípica de moléculas MHC de classe I conhecidas como HLA-E, enquanto a cadeia de NKG2A desse dímero contém motivos de ITIM citosólicos.
Os resíduos de tirosina dos ITIM desses e de outros receptores inibitórios podem ser fosforilados pelas cinases da família Src associadas à ativação dos linfócitos e, conforme foi mencionado antes, recrutam tirosinofosfatases que contêm domínios SH2, inclusive SHP-1 e SHP-2 e uma inositolfosfatase com domínio SH2 conhecida como SHIP. A SHP-1 e a SHP-2 atenuam a sinalização desencadeada pelas tirosinocinases durante a ativação dos receptores das células NK e também do BCR e do TCR dos linfócitos B e T, respectivamente. A SHIP remove as moléculas de fosfato do PIP3 e, desse modo, inibe a atividade da IP3-cinase dos linfócitos, das células NK e das células imunes inatas.
O protótipo dos receptores inibitórios da família CD28, o CTLA-4 (também conhecido como CD152), tem a capacidade de inibir as respostas das células T induzidas depois da ativação e demonstra maior afinidade pelas proteínas B7 do que o CD28. O CTLA-4 participa da manutenção da tolerância aos antígenos próprios e, neste contexto, está descrito no Capítulo 14. Outro receptor inibitório da mesma família é denominado PD-1 (morte programada 1), que também está descrito no Capítulo 14. O CTLA-4 possui uma região que contém tirosina em sua extremidade e que pode ter função inibitória; o PD-1 contém motivos de ITIM e ITSM citosólicos e sua extremidade citosólica é essencial para a iniciação dos sinais inibitórios. Os principais receptores inibitórios dos linfócitos B são o FcγRIIB e o CD22/Siglec-2. O FcγRIIB – um atenuador importante da sinalização das células B ativadas e também das células dendríticas e dos macrófagos – pode ligar-se aos complexos imunes que contêm IgG por meio de seus domínios de Ig extracelulares. Esse receptor recruta principalmente a SHIP e antagoniza a sinalização da PI3-cinase. O FcγRIIB atenua a ativação das células B na última fase da resposta imunológica humoral e está descrito em mais detalhes no Capítulo 11.
Ligases de Ubiquitina E3 e Degradação das Proteínas de Sinalização
Uma das principais vias de degradação das proteínas citosólicas e nucleares consiste na ligação covalente das moléculas de ubiquitina a estas proteínas. Embora a ubiquitinação das proteínas geralmente esteja ligada à sua destruição nos proteassomos, as proteínas podem ser ubiquitinadas de algumas formas diferentes, e cada tipo de ubiquitinação desempenha uma função diferente. No contexto da transdução de sinais, os diferentes tipos de ubiquitinação medeiam a atenuação dos sinais em um sentido, e a geração dos sinais, no outro.
A ubiquitinação está descrita sucintamente no Capítulo 6 no contexto da apresentação e do processamento de antígenos dependentes do MHC de classe I. A ubiquitina é uma proteína com 76 aminoácidos, que é ativada por um mecanismo dependente do ATP e de uma enzima E1, depois “carreada” por uma enzima E2 e transferida para as moléculas de lisina existentes nos substratos específicos que são reconhecidos pelas ligases de ubiquitina E3. Em muitos casos, depois que a terminação C de uma molécula de ubiquitina é ligada covalentemente a uma molécula de lisina da proteína-alvo, as extremidades C-terminais das moléculas de ubiquitina subsequentes podem ser ligadas covalentemente às moléculas de lisina da ubiquitina precedente de modo a gerar uma cadeia de poliubiquitina. A conformação tridimencional da cadeia de poliubiquitina é muito diferente, dependendo de qual molécula de lisina da molécula de ubiquitina precedente funciona como local da ligação covalente da próxima molécula de ubiquitina, e a configuração da cadeia de ubiquitinas tem consequências funcionais importantes. Quando a lisina da posição 48 da primeira molécula de ubiquitina forma uma ligação isopeptídica com a terminação C da ubiquitina seguinte, e assim por diante, forma-se uma cadeia de ubiquitina do tipo lisina-48, que pode ser reconhecida pelo proteassomo e a proteína é marcada como alvo para degradação dentro do proteassomo. Algumas ligases E3 produzem um tipo diferente de cadeia de poliubiquitina conhecida como cadeia do tipo lisina-63, que não direcionam as proteínas para degradação, mas, em vez disso, gera uma estrutura para o acoplamento das proteínas acopladas a outras proteínas específicas; isto é importante para a sinalização do NF-κB, conforme está descrito adiante. Em algumas funções, principalmente na determinação do direcionamento das proteínas da membrana para os lisossomos em vez dos proteassomos, pode ser necessário ligar à proteína-alvo apenas uma molécula de ubiquitina.
Várias ligases E3 estão presentes nas células T e algumas participam da ativação dos sinais, enquanto outras estão envolvidas na sua atenuação. O protótipo das ligases E3 envolvidas na interrupção das respostas das células T é a Cbl-b, mas várias outras desempenham funções semelhantes. O recrutamento da Cbl-b para o complexo TCR e as proteínas adaptadoras associadas causa monoubiquitinação, endocitose e degradação lisossômica do complexo, e este pode ser um dos mecanismos da atenuação da sinalização pelo TCR (Fig. 7-22). Os sinais do CD28 bloqueiam a atividade inibitória da Cbl-b e este é um dos mecanismos pelos quais a coestimulação amplia os sinais do TCR. Em camundongos geneticamente deficientes (knockout) que não possuem Cbl-b, as células T respondem ao antígeno mesmo sem coestimulação mediada pelo CD28 e produzem quantidades anormalmente elevadas de IL-2. Esses camundongos desenvolvem autoimunidade em consequência da ativação exagerada de suas células T.
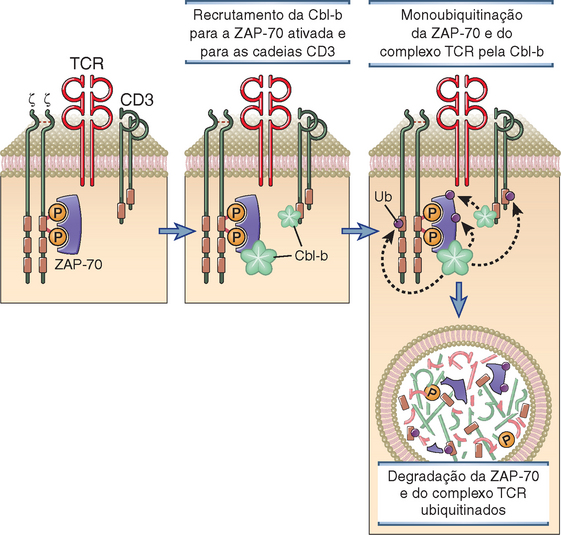
FIGURA 7-22 Função da ligase de ubiquitina Cbl-b na interrupção das respostas das células T. A Cbl-b é recrutada ao complexo TCR, onde facilita a monoubiquitinação do CD3, da ZAP-70 e de outras proteínas do complexo TCR. Essas proteínas são direcionadas para a degradação proteolítica nos lisossomos e em outras organelas (não ilustradas).
RECEPTORES DE CITOCINA E SINALIZAÇÃO
As citocinas – ou “moléculas mensageiras” secretadas pelo sistema imune – estão descritas inicialmente no Capítulo 1 e detalhadas no Capítulo 4 no contexto da imunidade inata; suas funções nas respostas imunes adaptativas mediadas pelas células T estão descritas nos Capítulos 9 e 10. Neste capítulo, veremos os receptores de citocinas e seus mecanismos de sinalização.
Todos os receptores de citocinas consistem em uma ou mais proteínas transmembrana cujas partes extracelulares são responsáveis pela ligação às citocinas e cujas partes citoplasmáticas são responsáveis pela iniciação das vias de sinalização intracelular. Na maioria dos receptores das citocinas, essas vias de sinalização geralmente são ativadas pelo agrupamento dos receptores induzido pelo ligante, aproximando as partes citoplasmáticas de duas ou mais moléculas do receptor e, desse modo, estimulando a atividade de tirosinocinases não específicas para as receptoras. No caso da família de citocinas como o TNF, o receptor pré-formado aparentemente desencadeia uma alteração de conformação depois do contato com seus ligantes triméricos cognatos.
Classes dos Receptores de Citocinas
A classificação mais amplamente utilizada para os receptores das citocinas baseia-se nas semelhanças estruturais dos domínios extracelulares de ligação às citocinas e dos mecanismos comuns de sinalização intracelular (Fig. 7-23). A sinalização por meio dos receptores de citocinas dos tipos I e II ocorre por um mecanismo semelhante conhecido como sinalização JAK-STAT, que está descrito em mais detalhes adiante. Os receptores de citocinas pertencentes à família do receptor do TNF ativam algumas vias, entre as quais uma das mais importantes é a via do NF-κB, que também está descrita detalhadamente adiante. A sinalização por meio das famílias do IL-1R e do TLR utiliza um domínio citoplasmático comum, e um dos principais processos subsequentes é a ativação da via do NF-κB dependente da ligase de ubiquitina E3. As quimiocinas (citocinas quimiotáxicas) ativam uma subfamília numerosa de receptores e estão descritas no Capítulo 3. Os receptores das quimiocinas são GPCR transmembrana com sete alças e estão descritos nas seções iniciais deste capítulo, e não são considerados aqui.
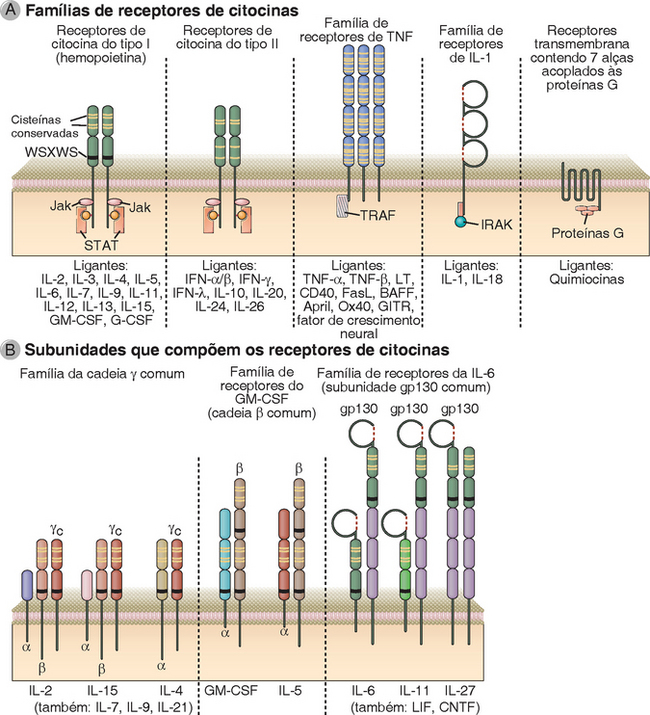
FIGURA 7-23 Estrutura dos receptores de citocinas. A, Os receptores das diferentes citocinas são classificados em famílias com base nas estruturas dos domínios extracelulares conservados e nos mecanismos de sinalização. As citocinas ou os outros ligantes que se ligam a cada família de receptor estão relacionadas abaixo das ilustrações esquemáticas. WSXWS, triptofano-serina-X-triptofano-serina. B, Os grupos de receptores de citocinas compartilham cadeias de subunidades idênticas ou extremamente semelhantes. A figura ilustra alguns exemplos de receptores de citocinas de cada grupo.
Receptores de Citocinas do Tipo I (Família do Receptor de Hematopoietina)
Os receptores de citocinas do tipo I são dímeros ou trímeros que geralmente consistem em cadeias únicas capazes de acoplar os ligantes e uma ou mais cadeias destinadas à transdução dos sinais, que comumente são também compartilhadas pelos receptores de diferentes citocinas. Essas cadeias possuem um ou dois domínios contendo um par conservado de resíduos de cisteína e um motivo peptídico proximal membranar contendo a sequência triptofano-serina-X-triptofano-serina (WSXWS), na qual X é qualquer aminoácido (Fig. 7-23A). As sequências conservadas dos receptores formam estruturas que se ligam às citocinas que têm quatro alças de hélices α e são conhecidas como citocinas do tipo I, mas a especificidade para cada citocina é determinada pelos aminoácidos que variam de um receptor para outro. Essa família de receptores pode ser dividida em subgrupos com base nas semelhanças estruturais ou na utilização dos polipeptídios sinalizadores compartilhados (Fig. 7-23B). Um grupo contém um componente de sinalização conhecido como cadeia γ comum (CD132); nesse grupo estão os receptores de IL-2, IL-4, IL-7, IL-9, IL-15 e IL-21. Outro subgrupo de receptores do tipo I inclui aqueles que compartilham a subunidade da cadeia β comum (CD131). Esse grupo inclui os receptores da IL-3, da IL-5 e do GM-CSF. Outro subgrupo de receptores utiliza o componente de sinalização gp130 e inclui os receptores da IL-6, da IL-11 e da IL-27. Todos os receptores de citocinas do tipo I utilizam as vias de sinalização JAK-STAT.
Receptores de Citocinas do Tipo II (Família de Receptores dos Interferons)
Os receptores do tipo II são semelhantes aos do tipo I porque possuem dois domínios extracelulares com cisteínas conservadas, mas os receptores do tipo II não têm o motivo WSXWS. Esses receptores consistem em uma cadeia polipeptídica de acoplamento aos ligantes e uma cadeia de transdução dos sinais. Como também ocorre com os receptores do tipo I, todos os receptores de citocinas do tipo II utilizam as vias de sinalização JAK-STAT. Essa família inclui os receptores para os interferons dos tipos I e II e da IL-10, IL-20 e IL-26.
Família de Receptores do TNF
Esses receptores fazem parte de uma grande família de trímeros pré-formados (entre os quais alguns não são considerados receptores de citocinas) com domínios extracelulares conservados ricos em cisteína e mecanismos de sinalização intracelular comuns, que geralmente estimulam a expressão dos genes mas em alguns casos induzem a apoptose. Alguns receptores importantes dessa família, cuja maioria está descrita em outros capítulos relativos aos seus contextos biológicos, incluem os receptores de TNF TNFRI e TNFRII, a proteína CD40, o Fas, o receptor de linfotoxina e a família de receptores BAFF. Os ligantes desses receptores também formam trímeros e alguns estão ligados à membrana, enquanto outros são solúveis.
O acoplamento dos ligantes aos receptores triméricos pré-formados geralmente provoca uma alteração de conformação e recruta proteínas adaptadoras para o complexo receptor. Por sua vez, esses adaptadores recrutam enzimas como as ligases de ubiquitina E3 (que participam da poliubiquitinação não degradativa) e proteinocinases (que iniciam a sinalização subsequente). No caso do receptor de TNF ilustrado na Figura 7-24, o receptor recruta a proteína adaptadora TRADD (domínio de morte associado ao receptor de TNF) e, por sua vez, esta proteína pode recrutar outras proteínas conhecidas como TRAF (fatores associados ao receptor de TNF) que demonstra um tipo único de atividade de ligase E3 descrita na seção subsequente sobre sinalização do NF-κB. O receptor de TNF do tipo I (existem dois receptores de TNF) e o Fas (CD95) também podem recrutar adaptadores que estimulam a ativação da caspase 8 e, em algumas células, esses receptores podem induzir apoptose.
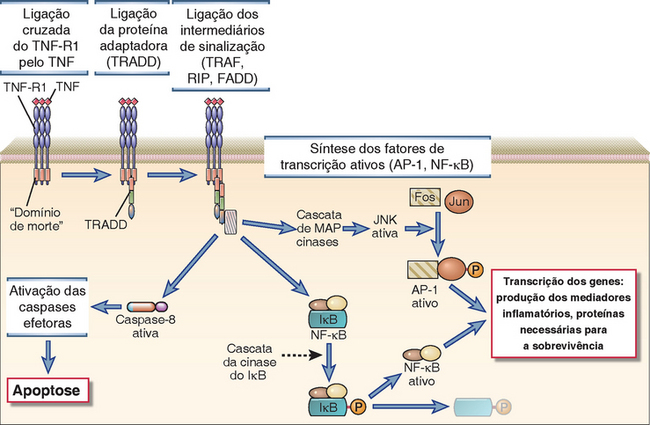
FIGURA 7-24 A sinalização por meio do receptor de TNF pode causar a ativação do NF-κB e da MAP cinase, ou a indução da morte por apoptose. A ligação do receptor de TNF do tipo 1 resulta no recrutamento de uma proteína adaptadora conhecida como TRADD que, por sua vez, pode ativar as moléculas TRAF (ligase de ubiquitina E3) e a cinase RIP1. Os eventos subsequentes incluem a ativação da via do NF-κB e da via da cinase MAP JNK, ou a indução da morte por apoptose.
Família da IL-1/TLR
Os receptores dessa família compartilham uma sequência citosólica conservada conhecida como domínio do receptor de IL-1 (TIR)/semelhante a Toll e utilizam vias de transdução de sinais semelhantes às que ativam a transcrição de novos genes. A sinalização do receptor do semelhante a Toll (TLR – Toll-like receptors) está descrita no Capítulo 4. Resumidamente, a ativação do IL-1R ou dos TLR resulta na dimerização do receptor e no recrutamento de uma ou mais das quatro proteínas adaptadoras que contêm domínio TIR para esta região da extremidade citoplasmática do receptor. Os adaptadores permitem que os TLR possam se ligar aos diferentes membros da família IRAK (cinase associada ao IL-1R). Por sua vez, os IRAK podem ligar os adaptadores à TRAF6, uma ligase de ubiquitina E3 necessária para a ativação do NF-κB. Outras vias ativadas pela sinalização dos TLR incluem a ativação da MAP cinase e a fosforilação do IRF3 e do IRF7, que são indutores transcricionais dos interferons do tipo I. Esse último aspecto da sinalização dos TLR foi descrito no contexto do estado antiviral no Capítulo 4. Em sentido amplo, o par de adaptadores MAL/MyD88 liga aos TLR para a indução inicial da sinalização do NF-κB e a ativação da MAP cinase, enquanto o par de adaptadores TRAM/TRIF resulta na ativação tardia do NF-κB e na ativação do IRF3. Por exemplo, o TLR4 ativa a sinalização por MAL/Myd88 inicialmente da superfície celular e, em seguida, a sinalização por TRAM/TRIF depois da endocitose do receptor. Os mecanismos que interligam a sinalização do IL-1R/TLR e a ativação do NF-κB estão descritos a seguir.
Sinalização por JAK-STAT
Os receptores de citocinas das famílias de receptores dos tipos I e II utilizam as vias de transdução de sinais que envolvem as tirosinocinases não receptoras conhecidas como cinases de Janus (ou JAK) e fatores de transcrição denominados transdutores de sinais e ativadores da transcrição (ou STAT). A descoberta das vias JAK-STAT foi possível graças às análises genéticas e bioquímicas da sinalização dos interferons. Existem duas cinases de Janus conhecidas (JAK1 a 3 e TYK2) e sete STAT (STAT 1 a 4, 5a, 5b e 6).
Hoje, a sequência de eventos das vias de sinalização envolvendo JAK-STAT está bem definida (Fig. 7-25). As enzimas JAK inativas ligam-se de forma não covalente aos domínios citoplasmáticos dos receptores de citocina dos tipos I e II. Quando duas moléculas do receptor são reunidas pela ligação a uma molécula de citocina, as JAK associadas ao receptor são ativadas e fosforilam as moléculas de tirosina dos domínios citoplasmáticas dos receptores reunidos. Em seguida, algumas dessas moléculas de fosfotirosina dos receptores são reconhecidas e ligam-se aos domínios de homologia 2 (SH2) da Src das proteínas monoméricas STAT do citosol. Desse modo, as proteínas STAT ficam próximas das JAK e são fosforiladas por cinases associadas ao receptor. O domínio SH2 de um monômero de STAT consegue ligar-se a uma molécula de fosfotirosina de uma proteína STAT adjacente. Os dímeros de STAT gerados migram para o núcleo, onde se ligam às sequências específicas de DNA nas regiões promotoras dos genes responsáveis pelas citocinas e ativam sua transcrição.
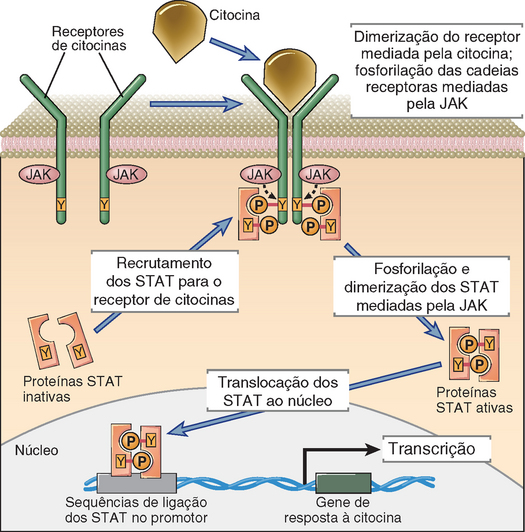
FIGURA 7-25 As citocinas dos tipos I e II induzem a sinalização JAK-STAT. A ligação dos receptores das citocinas dos tipos I e II resulta na ativação de uma tirosinocinase JAK associada, na fosforilação da extremidade do receptor e no recrutamento de um ativador da transcrição contendo domínio SH2 (STAT) para o receptor. O STAT recrutado é ativado por fosforilação pela JAK, forma dímeros, entra no núcleo e ativa a expressão dos genes-alvo das citocinas.
Uma questão intrigante é como se estabelece a especificidade das respostas às diferentes citocinas, tendo em vista os números restritos de JAK e STAT usados pelos diversos receptores de citocinas. A resposta provável é que as sequências únicas de aminoácidos dos diferentes receptores de citocinas fornecem a estrutura básica para a ligação específica e, desse modo, a ativação de diferentes combinações de JAK e STATs. Os domínios SH2 das diferentes proteínas STAT ligam-se seletivamente às fosfotirosinas e às moléculas adjacentes dos diferentes receptores de citocinas. Isso é responsável em grande parte pela ativação de determinadas STAT a diversos receptores de citocinas e, consequentemente, pela especificidade da sinalização das citocinas. Vários receptores de citocinas dos tipos I e II são heterodímeros com duas cadeias polipeptídicas diferentes, e cada uma liga-se a uma JAK diferente. Além disso, duas STAT diferentes podem formar heterodímeros depois da fosforilação. Desse modo, há um número significativo de combinações diversas na sinalização, que podem ser geradas por um número limitado de JAK e proteínas STAT.
Ademais, as citocinas ativam outras vias de sinalização e fatores de transcrição além das STAT. Por exemplo, a cadeia β do receptor da IL-2 ativa as vias das MAP cinases que são dependentes do RAS, que podem estar envolvidas na transcrição dos genes e na estimulação do crescimento. Outros receptores de citocinas também podem ativar outras vias de sinalização em conjunto com as vias JAK-STAT de modo a produzir as respostas biológicas às citocinas.
Existem descritos vários mecanismos de regulação negativa das vias JAK-STAT. As proteínas conhecidas como supressores da sinalização das citocinas (SOCS) podem ser identificadas pela presença de um domínio SH2 e uma região C-terminal conservada de 40 aminoácidos conhecida como boxe SOCS. As proteínas SOCS funcionam como adaptadores para a atividade das ligases E3 com várias subunidades. Essas proteínas podem ligar-se às JAK e STAT ativadas, e as ligases E3 diretamente associadas provocam a ubiquitinação das JAK e dos STAT e, desse modo, marcam estas proteínas para a decomposição proteossômica. Os níveis das proteínas SOCS podem ser regulados pelos ligantes dos TLR pelas próprias citocinas e por outros estímulos. Desse modo, as SOCS funcionam como autorreguladores negativos da ativação celular mediada pelas citocinas. Outros inibidores da sinalização JAK-STAT são as tirosinofosfatases, como a SHP-1 e a SHP-2, que podem desfosforilar e, portanto, desativar as moléculas de JAK. Outra família de proteínas inibitórias conhecidas como inibidores proteicos das STAT ativadas (PIAS) foi definida originalmente como reguladores negativos das STAT. As proteínas PIAS ligam-se às STAT fosforiladas e impedem sua interação com o DNA. Hoje, está claro que as proteínas PIAS também interagem com e bloqueiam a função de outros fatores de transcrição associados à sinalização das citocinas, inclusive NF-κB e SMAD (fatores de transcrição subsequentes aos membros da família de receptores do TGF-β).
Vias de Ativação do NF-κB
O NF-κB é um fator de transcrição que desempenha funções essenciais na inflamação, na ativação dos linfócitos, na sobrevivência celular e na formação dos órgãos linfoides secundários. O NF-κB também é um componente importante do desenvolvimento linfocitário e da patogênese de muitos cânceres, inclusive neoplasias malignas derivadas dos linfócitos ativados. Esse fator de transcrição é ativado por muitas citocinas, estímulação via TLR e pelo reconhecimento dos antígenos e está descrito a seguir como protótipo dos fatores de transcrição que desempenham papéis fundamentais nos mecanismos imunes inatos e adaptativos.
Existem cinco proteínas NF-κB. O domínio comum a todas essas proteínas é um domínio de ligação ao DNA conhecido como domínio de homologia Rel. Para que um fator de transcrição seja ativo, ele precisa ligar-se ao DNA e conter um domínio de ativação que possa facilitar a iniciação da transcrição. Três proteínas NF-κB têm domínios de homologia Rel e domínios de ativação: p65/RelA, RelB e c-Rel. As proteínas NF-κB/p50 e NF-κB/p52 contêm um domínio de homologia Rel de ligação ao DNA, mas não possuem domínios de ativação. Em geral, o NF-κB1 forma heterodímeros ativos com a p65/RelA ou com a c-Rel, e esses heterodímeros geralmente são considerados heterodímeros “canônicos” de NF-κB (Fig. 7-26). Os heterodímeros canônicos de NF-κB ficam no citosol ligados a um inibidor de NF-κB conhecido como IκBα. Os heterodímeros canônicos são ativados por alguns receptores de sinalização que desencadeiam a inflamação ou a ativação dos linfócitos.
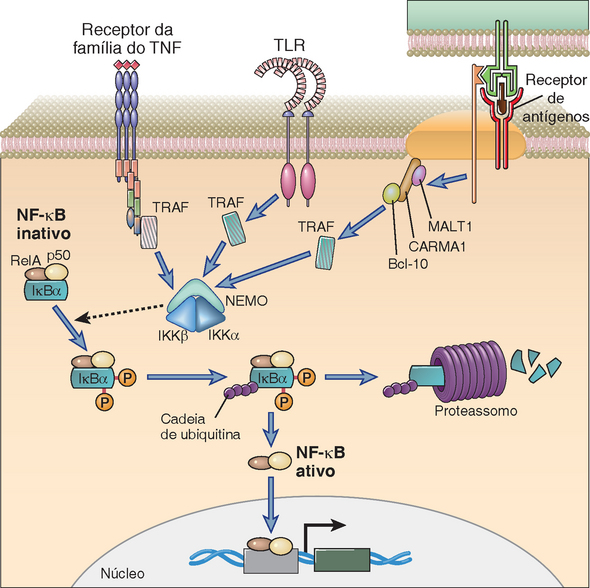
FIGURA 7-26 Via canônica do NF-κB. Os receptores de antígenos ativam PKC específicas, que ativam o complexo CARMA1/Bcl-10/MALT1 que, por sua vez, contribui para a indução de uma ligase E3 TRAF que pode realizar a poliubiquitinação da NEMO/KKγ, um componente do complexo da cinase do IκB (IKK), formando cadeias de ubiquitina do tipo lisina-63. Isso resulta na fosforilação e na ativação do IKKβ por uma cinase subsequente. O IKKβ fosforila o inibidor do NF-κB (IκBα), que é direcionado para a poliubiquitinação do tipo lisina-48 com subsequente degradação proteossômica. A degradação do IκBα resulta na entrada do NF-κB ativo no núcleo. Os TLR (membros da família do IL-1R) e muitos membros da família de receptores de TNF ativam os componentes da família TRAF, que podem ativar esta via.
Como já foi mencionado nas seções precedentes deste capítulo, os TLR, o BCR e o TCR e muitos receptores de citocinas das famílias dos TNF e do IL-1R ativam o NF-κB, e a seguir descreveremos a via comum que a ativação da sinalização do NF-κB canônico envolve. Essa via do NF-κB induz o direcionamento do IκBα a degradação, permitindo que o fator de transcrição NF-κB heterodimérico liberado migre para o núcleo. A maioria dos receptores que ativam o NF-κB o faz por indução dessa via. Dois tipos muito diferentes de reações de poliubiquitinação são necessários para a ativação do NF-κB canônico. Existem algumas etapas comuns na via canônica que também se aplicam a todos os eventos de sinalização subsequentes.
• A sinalização precedente resulta na ativação de um tipo singular de ligase de ubiquitina E3, que consegue adicionar uma cadeia de ubiquitina do tipo lisina-63 a uma proteína conhecida como NEMO ou IKKγ, que é uma subunidade não catalítica de um complexo enzimático denominado complexo da cinase do IκB (IKK). Esse complexo tem duas subunidades adicionais conhecidas como IKKα e IKKβ, ambas capazes de ativar cataliticamente as cinases de serina/treonina. A ubiquitinação da NEMO permite que a IKKβ seja ativada por uma cinase precedente.
• A IKKβ ativa fosforila a proteína inibidora ligada ao NF-κB (IκBα) em duas moléculas de serina e, desse modo, marca esta proteína para ubiquitinação do tipo lisina-48.
• O IκBα poliubiquitinado é direcionado para degradação no proteassomo, e em seguida o heterodímero de NF-κB canônico é liberado para entrar no núcleo (Fig. 7-26).
Nas seções anteriores, descrevemos como as sinalizações do TCR e do BCR contribuem para a ativação da PKC-θ e da PKC-β, respectivamente. Essas PKC podem fosforilar uma proteína conhecida como CARMA1, que forma um complexo com duas outras proteínas denominadas Bcl-10 e MALT1. O complexo CARMA1/MALT1/Bcl-10 pode contribuir para a ativação de uma ligase de ubiquitina E3 do tipo lisina-63 (a TRAF6). A TRAF6 ativada pode ativar a TAK1 e também acrescentar uma cadeia de ubiquitina do tipo lisina-63 à NEMO e, desse modo, facilitar a ativação da IKKβ. Os TLR e o IL-1R também ativam a TRAF6 e iniciam a ativação do IKK. Muitos componentes da família de receptores dos TNF, inclusive o receptor de TNF e o CD40, podem ativar a sinalização do NF-κB canônico por meio da ativação de outras proteínas TRAF, inclusive TRAF2, TRAF3 e TRAF5.
Os heterodímeros de NF-κB2 e RelB constituem uma forma “não canônica” do NF-κB e estes heterodímeros são ativados por uma via de sinalização diferente, que é particularmente importante para a biogênese dos órgãos linfoides e a sobrevivência dos linfócitos B virgens. Os dois receptores fundamentais que induzem a via alternativa ou não canônica do NF-κB – o LTβR (receptor β da linfotoxina) e o BAFFR (receptor de BAFF) – ativam um complexo semelhante à IKK que contém homodímeros de IKKα. Isso resulta na ubiquitinação e na degradação de parte do dímero de NF-κB2-RelB e na liberação da proteína ativa.
• Os receptores de sinalização geralmente localizam-se na superfície celular e iniciam a sinalização no citosol e, em seguida, no compartimento nuclear.
• Muitos tipos diferentes de receptores de sinalização contribuem para os componentes inato e adaptativo da imunidade, entre os quais o grupo mais importante é o dos receptores imunológicos que pertencem a uma família de receptores nos quais as tirosinocinases não receptoras fosforilam os motivos de ITAM contendo tirosina nas extremidades citoplasmáticas das proteínas do complexo receptor.
• Outros tipos de receptores importantes do ponto de vista imunológico incluem os da família de tirosinocinases não receptoras, os receptores nucleares, os receptores serpentinos heterotriméricos acoplados às proteínas G e os receptores da família Notch.
• Os receptores de antígenos das células B e T fazem parte da família dos receptores imunológicos.
• Os receptores de antígenos podem produzir respostas amplamente variáveis, dependendo da afinidade e da valência do antígeno, que pode recrutar diferentes quantidades de ITAMs.
• Os receptores de antígenos utilizam coreceptores para ampliar a sinalização. Os coreceptores ligam-se ao mesmo complexo antigênico que está sendo reconhecido pelo receptor de antígenos.
• A sinalização dos receptores de antígenos pode ser atenuada por receptores inibitórios.
• O complexo TCR é formado por cadeias α e β do TCR (que contribuem para o reconhecimento dos antígenos) e pelas cadeias de sinalização contendo ITAM do CD3 γ, δ e ε, assim como o heterodímero ζ. Cada cadeia CD3 contém um ITAM, enquanto cada cadeia ζ tem três ITAM.
• A ligação do TCR resulta na fosforilação das tirosinas do CD3 e dos ITAM ζ pelas cinases da família Src e no recrutamento da ZAP-70 para os fosfo-ITAM, no qual cada domínio SH2 da ZAP-70 liga-se a uma tirosina fosforilada do ITAM.
• A ZAP-70 ativada fosforila os resíduos de tirosina dos adaptadores e as enzimas subsequentes são recrutadas para o sinalossomo.
• As enzimas que realizam a permuta do GTP pelo GDP nas proteínas G pequenas como a Ras e a Rac ajudam a iniciar as vias das MAP cinases. Essas vias resultam na indução ou na ativação dos fatores de transcrição como Jun e Fos, que fazem parte do fator de transcrição AP-1.
• A ativação da PLCγ1 resulta na liberação do IP3 do PIP2, e a liberação deste primeiro composto estimula a liberação do cálcio das reservas intracelulares. A depleção do cálcio das reservas intracelulares facilita a abertura do CRAC, que é um canal operado por reserva na superfície celular que mantém os níveis intracelulares altos de cálcio. O cálcio liga-se à calmodulina e ativa as proteínas subsequentes, inclusive a calcineurina, uma fosfatase que facilita a entrada do fator de transcrição NFAT no núcleo.
• O diacilglicerol é formado na membrana quando a PLCγ1 libera o IP3 do PIP2. O DAG pode ativar a PKC-θ que, entre outras coisas, pode contribuir para a ativação do NF-κB.
• Uma lipidocinase conhecida como PI3-cinase converte o PIP2 em PIP3. O PIP3 pode recrutar e ativar proteínas que contêm domínios PH para a membrana plasmática. O PIP3 ativa a Itk das células T e a Btk das células B. Além disso, ele ativa a PDK1, uma cinase capaz de fosforilar outra cinase subsequente conhecida como Akt, que controla a sobrevivência celular.
• Os receptores coestimuladores iniciam a sinalização independentemente dos receptores de antígenos, mas os estímulos de sinalização gerados pelos receptores de antígenos e pelos receptores coestimuladores produzem efeitos sinérgicos no núcleo. O principal receptor coestimulador das células T é o CD28.
• A sinalização das células T pode ser inibida pelas fosfatases que podem ser recrutadas pelos receptores inibitórios, inclusive CTLA-4 e PD-1.
• A sinalização das células T também é atenuada pelas ligases de ubiquitina E3, que podem contribuir para a monoubiquitinização e a degradação proteossômica das proteínas de sinalização ativadas.
• O receptor das células B é formado por imunoglobulinas ligadas à membrana e um heterodímero de Igα e Igβ ligadas por pontes dissulfetos. A Igα e a Igβ contêm fragmentos de ITAM em suas extremidades citoplasmáticas. As vias de sinalização ligadas ao BCR são semelhantes em seus aspectos gerais às vias de sinalização subsequentes à ligação do TCR.
• O correceptor do BCR é o CD21, também conhecido como CR2 (receptor de complemento do tipo 2).
• A atenuação da sinalização dos receptores imunes dos linfócitos B e T e das células NK, entre outras, é mediada por receptores inibitórios que comumente contêm motivos inibitórios contendo tirosina ou ITMs em suas extremidades citoplasmáticas.
• Outro mecanismo importante de atenuação dos sinais envolve a ubiquitinação das proteínas de sinalização pelas ligases de ubiquitina E3.
• Os receptores de citocinas podem ser divididos em alguns grupos gerais baseados em seus aspectos estruturais e nos mecanismos de sinalização.
• Muitos receptores de citocinas utilizam tirosinocinases não receptoras conhecidas como JAK para fosforilar os fatores de transcrição denominados STAT.
• Alguns receptores de citocinas, como os que pertencem à família dos receptores de TNF, ativam a sinalização canônica ou não canônica do NF-κB.
• A sinalização canônica do NF-κB é ativada por muitos receptores diferentes, inclusive a família de receptores de TNF, os TLR, os componentes da família do IL-1R e os receptores de antígenos. Essa via envolve a ativação da IKKβ do complexo IKK, a fosforilação do inibidor IκBα pela IKKβ ativada, a ubiquitinação e a degradação proteossômica do IκBα e o transporte do NF-κB ao núcleo.
Sinalização pelos Receptores Imunológicos
Call ME, Wucherpfennig KW. Common themes in the assembly and architecture of activating immune receptors. Nature Reviews Immunology. 2007;7:841-850.
Cannons JL, Tangye SG, Schwartzberg PL. SLAM family receptors and SAP adaptors in immunity. Annual Review of Immunology. 29, 2011.
Vallabhapurapu S, Karin M. Regulation and function of NF-κB transcription factors in the immune system. Annual Review of Immunology. 2009;27:693-733.
Yuan JS, Kousis PC, Suliman S, Visan I, Guidos CJ. Functions of notch signaling in the immune system: consensus and controversies. Annual Review of Immunology. 2010;28:343-365.
Estrutura e Sinalização dos Receptores das Células T
Burkhardt JK, Carrizosa E, Shaffer MH. The actin cytoskeleton in T cell activation. Annual Review of Immunology. 2008;26:233-259.
Fooksman DR, Vardhana S, Vasiliver-Shamis G, Liese J, Blair DA, Waite J, Sacristan C, Victora GD, Zanin-Zhorov A, Dustin ML. Functional anatomy of T cell activation and synapse formation. Annual Review of Immunology. 2010;28:79-105.
Gallo EM, Cante-Barrett K, Crabtree GR. Lymphocyte calcium signaling from membrane to nucleus. Nature Immunology. 2006;7:25-32.
Hogan PG, Lewis RS, Rao A. Molecular basis of calcium signaling in lymphocytes: STIM and ORAI. Annual Review of Immunology. 2010;28:491-533.
Kuhns MS, Davis MM, Garcia KC. Deconstructing the form and function of the TCR/CD3 complex. Immunity. 2006;24:133-139.
Rudolph MG, Stanfield RL, Wilson IA. How TCRs bind MHCs, peptides, and coreceptors. Annual Review of Immunology. 2006;24:419-466.
Smith-Garvin JE, Koretzky GA, Jordan MS. T cell activation. Annual Review of Immunology. 2009;27:591-619.
van der Merwe P, Dushek O. Mechanisms for T cell receptor triggering. Nature Reviews Immunology. 2011;11:47-55.
Weil R, Israel A. Deciphering the pathway from the TCR to NF-κB. Cell Death and Differentiation. 2006;13:826-833.
Estrutura e Sinalização dos Receptores das Células B
Harwood NE, Batista FD. Early events in B cell activation. Annual Review of Immunology. 2010;28:185-210.
Kurosaki T, Shinohara H, Baba Y. B cell signaling and fate decision. Annual Review of Immunology. 2010;28:21-55.
Atenuação dos Sinais nos Linfócitos
Acuto O, Bartolo VD, Michel F. Tailoring T-cell receptor signals by proximal negative feedback mechanisms. Nature Reviews Immunology. 2008;8:699-712.
Pao LI, Badour K, Siminovitch KA, Neel BG. Nonreceptor protein-tyrosine phosphatases in immune cell signaling. Annual Review of Immunology. 2007;25:473-523.
Smith KG, Clatworthy MR. FcγRIIB in autoimmunity and infection: evolutionary and therapeutic implications. Nature Reviews Immunology. 2010;10:328-343.
Sun SC. Deubiquitylation and regulation of the immune response. Nature Reviews Immunology. 2008;8:501-511.