CAPÍTULO 9 Ativação dos Linfócitos T
O objetivo da ativação das células T é gerar, a partir de um pequeno pool de linfócitos virgens (naïve) com receptores predeterminados para qualquer antígeno, um grande número de células efetoras funcionais capazes de eliminar esse antígeno assim como de uma população de células de memória que durem por períodos longos, sendo capazes de reagir rapidamente contra um antígeno caso ele seja reintroduzido. Uma característica fundamental da célula T, como todas as respostas imunes adaptativas, é que ela é altamente específica em relação ao antígeno que provoca a resposta. Tanto a ativação inicial das células T virgens quanto as fases efetoras das respostas imunes adaptativas mediadas pela célula T são desencadeadas pelo reconhecimento do antígeno através dos receptores de antígenos dos linfócitos T. No Capítulo 6 foi descrita a especificidade das células T para fragmentos de peptídeos, derivados de antígenos proteicos, ligados à molécula do complexo principal de histocompatibilidade (MHC). No Capítulo 7 foram descritos os receptores de antígenos e outras moléculas envolvidas na ativação das células T pelos antígenos. Neste capítulo, descrevemos a biologia da ativação da célula T. Começaremos com uma breve revisão da ativação da célula T, discutiremos o papel dos coestimuladores e de outros sinais fornecidos pelas células apresentadoras de antígenos (APCs) na ativação da célula T, além disso descreveremos a sequência de proliferação e diferenciação que ocorre nas respostas das células T CD4+ e CD8+ aos antígenos estranhos. As funções das células efetoras diferenciadas na defesa do hospedeiro são descritas no Capítulo 10. Assim, juntos, os Capítulos 9 e 10 cobrem a biologia dos linfócitos T.
REVISÃO DA ATIVAÇÃO DOS LINFÓCITOS T
A ativação inicial dos linfócitos T virgens ocorre principalmente nos órgãos linfoides secundários, pelos quais essas células normalmente circulam e onde podem encontrar os antígenos apresentados pelas células dendríticas maduras (Fig. 9-1). O sistema imune foi desenvolvido para realizar suas funções de eliminação de antígenos apenas quando necessário, isto é, quando encontra patógenos. Os linfócitos T com diversas especificidades são gerados no timo antes da exposição ao antígeno. Os linfócitos T virgens, que não foram reconhecidos e responderam aos antígenos, circulam por todo o corpo em estado de repouso e adquirem habilidades funcionais potentes apenas depois de terem sido ativados. Essa ativação dos linfócitos virgens ocorre em órgãos linfoides especializados, onde os linfócitos virgens e as APC se encontram (Cap. 2). Antígenos proteicos que cruzam as barreiras epiteliais ou são produzidos nos tecidos são capturados por células dendríticas imaturas e transportados para os gânglios linfáticos. Os antígenos que entram na circulação podem ser capturados pelas células dendríticas no baço. Se esses antígenos forem produzidos por micro-organismos ou administrados com coadjuvantes (como nas vacinas), a resposta imune inata resultante leva à ativação das células dendríticas e à expressão de coestimuladores, como as proteínas B7 (descritas mais adiante neste capítulo). As células dendríticas que encontraram micro-organismos e internalizaram seus antígenos começam a amadurecer e migram para as zonas de células T dos gânglios linfáticos regionais. Como abordado no Capítulo 6, as células T virgens e as células dendríticas são atraídas para as zonas de células T dos órgãos linfoides secundários por quimiocinas produzidas nessas áreas, que ativam o receptor de quimiocina CCR7 nas células. No momento em que a células dendríticas maduras atingem as áreas da célula T, elas exibem não apenas peptídeos derivados dos antígenos acoplados às moléculas MHC como também expressam os coestimuladores. Quando uma célula virgem de especificidade correta reconhece os complexos de peptídeos-MHC e recebe sinais coestimuladores concomitantes das células dendríticas, esse linfócito virgem é ativado.
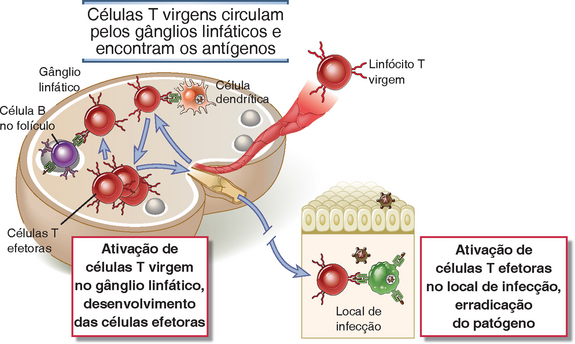
FIGURA 9-1 Ativação das células T virgens e efetoras pelo antígeno. Os antígenos que são transportados pelas células dendríticas para os gânglios linfáticos são reconhecidos pelos linfócitos T virgens que recirculam através desses órgãos linfoides secundários. As células T são induzidas a se diferenciar em efetoras e de memória, podendo permanecer nos órgãos linfoides ou migrar para tecidos não linfoides. Nos locais de infecção, as células efetoras são novamente ativadas pelos antígenos e executam suas várias funções como a ativação do macrófago.
O reconhecimento do antígeno e outros estímulos ativadores induzem várias respostas: a secreção de citocina nas células T; a proliferação dos linfócitos específicos ao antígeno, levando ao aumento nos números de clones de células específicos ao antígeno (chamada de expansão clonal); e a diferenciação das células virgens em linfócitos efetores e de memória (Fig. 9-2). Além disso, o processo de ativação da célula T é associado a mudanças características nas moléculas de superfície, muitas das quais executam funções importantes em promover e limitar as respostas. A expansão clonal e a diferenciação prosseguem rapidamente devido a vários mecanismos positivos de autoamplificação. Por exemplo, as citocinas feitas pelas células T ativadas estimulam a proliferação e a diferenciação das células T em células efetoras. Além disso, as células T ativadas mandam sinais de volta para as APC, amplificando mais ainda sua capacidade de ativar as células T. Ao mesmo tempo, algumas moléculas de superfície expressadas nas células T ativadas, e também as citocinas secretadas por essas células, executam funções regulatórias que servem para estabelecer limites seguros para a resposta. As etapas das respostas da célula T e a natureza das alças de retroalimentação positiva e negativa são descritas mais adiante no capítulo.
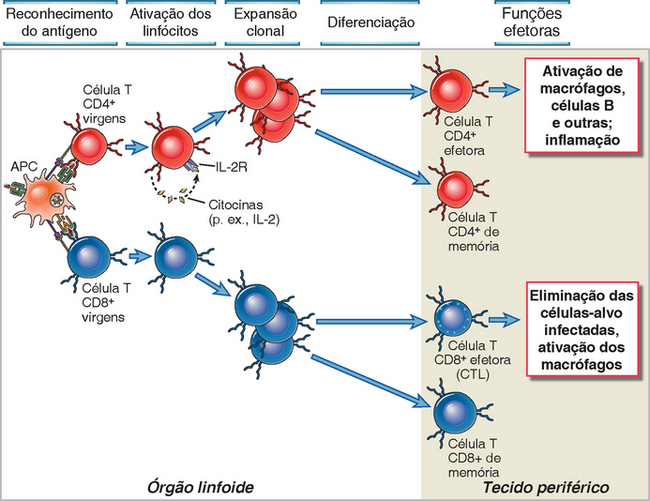
FIGURA 9-2 Fases das respostas da célula T. O reconhecimento do antígeno pelas células T induz a secreção de citocinas (p. ex., IL-2), particularmente nas células T CD4+, e a expansão clonal como resultado da proliferação das células e a diferenciação das células T em efetoras ou de memória. Na fase efetora da resposta, as células T CD4+ efetoras respondem ao antígeno produzindo citocinas que executam várias ações, como o recrutamento e a ativação dos leucócitos e a ativação dos linfócitos T, e os CTL CD8+ respondem matando outras células.
As células T efetoras reconhecem os antígenos nos órgãos linfoides ou nos tecidos não linfoides periféricos e são induzidas a cumprir funções responsáveis pela eliminação dos micro-organismos e, nos estados patológicos, pela inflamação e o dano ao tecido. Sempre que as células virgens são ativadas principalmente nos órgãos linfoides, as células efetoras diferenciadas podem funcionar em qualquer tecido (Fig. 9-1). O processo de diferenciação das células virgens para efetoras é associado à aquisição da capacidade de realizar as suas funções especializadas e à habilidade de migrar para qualquer local de infecção ou inflamação. Nesses locais, as células efetoras encontram novamente o antígeno para o qual são específicas e montam uma resposta capaz de eliminar a fonte do antígeno. As células T CD4+ efetoras da linhagem auxiliar são classificadas em vários subtipos com base nos seus perfis e funções das citocinas. Algumas dessas células auxiliares (helper) diferenciadas expressam moléculas de membrana e secretam as citocinas que ativam (ajudam) os macrófagos a matar os micro-organismos fagocitados; outras secretam citocinas que recrutam leucócitos e assim estimulam a inflamação; outras amplificam as funções de barreira da mucosa; e outras ainda permanecem nos órgãos linfoides e ajudam as células B a se diferenciarem em células que secretam anticorpos. Os linfócitos T citotóxicos CD8+ (CTL), células efetoras da linhagem CD8+, destroem células infectadas e células tumorais que expressam antígenos associados ao MHC de classe I.
As células T de memória que são geradas pela ativação da célula T são células de vida longa, com uma capacidade elevada de reagir contra o antígeno. Essas células estão presentes no conjunto de linfócitos circulantes e são abundantes nos tecidos de mucosa e na pele, bem como nos órgãos linfoides. Depois que a resposta da célula T cessa, existem muitas outras células de memória do clone respondente que persistem, em número maior do que as células T virgens antes da resposta. Essas células de memória respondem rapidamente ao encontro subsequente com o antígeno e geram novas células efetoras que eliminam o antígeno.
As respostas das células T declinam depois que o antígeno é eliminado pelas células efetoras. Esse processo de contração é importante para que o sistema imunológico retorne a um estado de equilíbrio ou homeostasia. Ele ocorre principalmente porque a maioria das células T efetoras ativadas pelo antígeno morre por apoptose. Isso ocorre porque, à medida que o antígeno é eliminado, os linfócitos são privados dos estímulos de sobrevivência que normalmente são fornecidos pelo antígeno, coestimuladores e citocinas produzidos durante a reação inflamatória ao antígeno. Estima-se que mais de 90% das células T específicas para o antígeno, geradas durante a expansão clonal, morrem por apoptose conforme o antígeno é eliminado.
Com essa revisão, prosseguimos para uma discussão dos sinais exigidos para a ativação da célula T e as etapas que são comuns para as células T CD4+ e CD8+. Depois, descrevemos as células efetoras e de memória nas linhagens CD4+ e CD8+, com ênfase nos subtipos das células T CD4+auxiliares e das citocinas que elas produzem. Concluímos com uma discussão do declínio das respostas imunes.
SINAIS DE ATIVAÇÃO DOS LINFÓCITOS T
A proliferação dos linfócitos T e sua diferenciação em células efetoras e de memória requer o reconhecimento do antígeno, coestimulação e citocinas que são produzidas pelas próprias células T, pelas APC e por outras células no local do reconhecimento do antígeno. Nesta seção, resumimos a natureza dos antígenos reconhecidos pelas células T e discutimos os coestimuladores específicos e os receptores que contribuem para a ativação da célula T. As citocinas serão discutidas mais adiante no capítulo.
Reconhecimento do Antígeno
O antígeno é sempre o primeiro sinal necessário para a ativação de linfócitos, garantindo que a resposta imune resultante permaneça específica ao antígeno. Uma vez que os linfócitos T CD4+ e CD8+ reconhecem os complexos de peptídeos-MHC exibidos pelas APCs, eles podem responder apenas aos antígenos proteicos ou os agentes químicos ligados às proteínas. Além dos peptídeos reconhecidos pelo TCR que são exibidos pelas moléculas de MHC, várias outras proteínas de superfície da célula T participam do processo de ativação da célula T (Fig. 7-9, Cap. 7). Isso inclui moléculas de adesão que estabilizam a interação das células T com as APC, e os coestimuladores que serão descritos mais adiante. A natureza dos sinais bioquímicos transportados pelos receptores do antígeno e a função desses sinais nas respostas funcionais das células T serão discutidas no Capítulo 7.
A ativação das células T virgens requer o reconhecimento do antígeno apresentado pelas células dendríticas. Os motivos pelos quais as células dendríticas são as APC mais eficientes para iniciar as respostas da célula T foram discutidos no Capítulo 6. Nos órgãos linfoides, as células dendríticas apresentam peptídeos derivados dos antígenos proteicos endocitados em associação das moléculas de MHC da classe II para células T CD4+ virgens e peptídeos derivados das proteínas citosólicas exibidas pelas moléculas da classe I para as células T CD8+. As reações imunes mediadas pelas células T CD4+ são desencadeadas por antígenos proteicos de micro-organismos ingeridos pelas células dendríticas ou por antígenos proteicos solúveis administrados com adjuvantes, no caso das vacinas, que são capturados pelas células dendríticas. Esses antígenos microbianos ou solúveis são internalizados em vesículas pelas células dendríticas, processados e apresentados em associação às moléculas do MHC de classe II. As respostas da célula T CD8+ são induzidas por antígenos produzidos no citoplasma das células dendríticas (p. ex., pelos vírus que infetam essas células) ou ingeridas pelas células dendríticas, processadas e acoplados através da “apresentação cruzada” às moléculas de MHC de classe I. Algumas substâncias químicas introduzidas pela pele também desencadeiam reações das células T, chamadas de reações de sensibilidade de contato. As substâncias químicas capazes de induzir sensibilização de contato podem se ligar estreitamente ou modificar covalentemente as autoproteínas, criando novos determinantes peptídicos que são apresentados às células T CD4+ ou CD8+.
As células T efetoras diferenciadas podem responder aos antígenos apresentados por células diferentes das dendríticas. Nas respostas imunes humorais, as células B apresentam antígenos para as células T auxiliares e são receptoras dos sinais de ativação das células auxiliares (Cap. 11); nas respostas imunes mediadas pela célula, os macrófagos apresentam antígenos e respondem às células T (Cap. 10) e praticamente qualquer célula nucleada pode apresentar o antígeno e ser morta pelos CTL CD8+.
Papel dos Coestimuladores na Ativação das Células T
A proliferação e diferenciação das células T virgens requer sinais fornecidos por moléculas das APC, chamadas de coestimuladores, além dos sinais induzidos pelos antígenos (Fig. 9-3). A exigência de sinais coestimuladores foi descrita pela primeira vez através do achado experimental de que apenas o acoplamento do receptor de antígeno da célula T (p. ex., seguindo a ligação cruzada do CD3 por anticorpos anti-CD3) resultou em respostas muito inferiores às observadas quando os antígenos forem apresentados pelas APCs ativadas. Esse resultado indicou que as APC devem expressar moléculas além do antígeno exigido para a ativação da célula T. Essas moléculas são chamadas de coestimuladores e o “segundo sinal” para a ativação da célula T é chamado de coestimulação, pois funciona junto com o antígeno (“sinal 1”) para estimular as células T. Na ausência da coestimulação, as células T que encontram seus antígenos não respondem, e entram em um estado de não responsividade chamado de anergia, ou morrem por apoptose (Cap. 14).
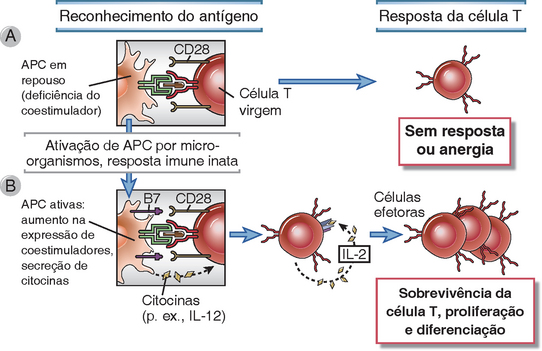
FIGURA 9-3 Funções dos coestimuladores na ativação da célula T. A, A APC em repouso expressa pouco ou nenhum coestimulador e falha em ativar células T virgens. (O reconhecimento do antígeno sem coestimulação pode tornar as células T anérgicas; esse fenômeno será discutido no Cap. 14). B, Micro-organismos e citocinas produzidos durante as respostas imunes inatas induzem as APC a expressar coestimuladores como as moléculas B7. Então, as APC se tornam capazes de ativar células T virgens. As APC ativadas também produzem citocinas como a IL-12, que estimulam a diferenciação de células T virgens em efetoras.
A Família de Coestimuladores B7:CD28
A via coestimuladora da ativação das células T mais conhecida envolve o receptor de superfície das células T, o CD28, que se liga às moléculas coestimuladoras B71 (CD80) e B72 (CD86) expressas nas APC ativadas. O CD28 foi descoberto quando a ativação das células T usando anticorpos contra as moléculas de superfície da célula T humana foi submetida a uma triagem para identificar a capacidade desses anticorpos em amplificar as respostas da célula T quando adicionados às células junto com um anticorpo ativador anti-CD3 (que foi usado como estímulo que simulava o antígeno). Os ligantes do CD28 foram descobertos pela triagem das bibliotecas de expressão do DNA para as moléculas que se ligam ao CD 28. A clonagem dos genes que codificam B7-1 e CD28 abriu o caminho para uma variedade de experiências em camundongos que esclareceram o papel dessas moléculas e levaram à identificação de outras proteínas homólogas envolvidas na coestimulação das células T. Por exemplo, a atividade coestimuladora residual das APC em camundongos knockout deficientes em B7-1 sugeriu a existência de outras moléculas coestimuladoras, e estratégias de clonagem baseadas na homologia levaram à identificação da molécula B7-2. A função essencial do CD28 e do B7-1 e B7-2 na ativação da célula T foi estabelecida não apenas por experimentos com anticorpos de ligação cruzada, mas também pela grave deficiência imune da célula T causada pelo ausência dessas moléculas em camundongos e pela capacidade de agentes que se ligam e bloqueiam o B7 de inibir uma variedade de respostas da célula T. O desenvolvimento de agentes terapêuticos baseados nesses princípios é descrito adiante.
B7-1 e B7-2 são glicoproteínas de membrana, de cadeia única, estruturalmente semelhantes, cada uma contendo dois domínios extracelulares semelhantes à imunoglobulina (Ig), apesar da molécula B7-1 ser expressa como um dímero na superfície celular e a B7-2 como um monômero. O CD28 é um homodímero ligado por pontes dissulfeto, e cada uma de suas subunidades possui um único domínio de Ig extracelular. Ele é expressado em mais de 90% das células T CD4+ e 50% das células T CD8+ em humanos (e em todas as células T virgens em camundongos).
A expressão dos coestimuladores B7 é regulada e assegura que as respostas dos linfócitos T sejam iniciadas no tempo e lugar corretos. As moléculas B7 são expressas principalmente nas APC, incluindo células dendríticas, macrófagos e linfócitos B. Elas estão ausentes ou expressas em níveis baixos nas APCs em repouso e são induzidas por vários estímulos, incluindo produtos microbianos que acoplam receptores semelhantes ao Toll (Toll-like receptors) e citocinas como o interferon-γ (IFN-γ) produzido durante as reações imunes inatas aos micro-organismos. A indução de coestimuladores pelos patógenos e pelas citocinas do sistema imune natural promove as respostas das células T aos agentes infecciosos. Essa é uma excelente ilustração da função das respostas imunes inatas para amplificar a imunidade adaptativa (Cap. 4). Além disso, as células T ativadas expressam o ligante CD40 em sua superfície, que se liga ao CD40 expressado pelas APC, enviando sinais que aumentam a expressão dos coestimuladores B7. Essa alça de retroalimentação serve para amplificar as respostas da célula T (descritas adiante). De todas as APCs potenciais, as células dendríticas expressam os maiores níveis de coestimuladores e, consequentemente, são os estimuladores mais potentes das células T virgens. No Capítulo 6 é mencionado o papel essencial dos adjuvantes na indução das respostas primárias das células T aos antígenos proteicos, como as vacinas. Muitos adjuvantes são produtos de micro-organismos ou mimetizam esses agentes, e uma de suas principais funções na ativação das células T é estimular a expressão de coestimuladores nas APC. As APC desativadas ou “em repouso” nos tecidos normais são capazes de apresentar autoantígenos às células T, mas como as APC teciduais expressam apenas níveis baixos de coestimuladores, as células T potencialmente autorreativas que enxergam os autoantígenos não são ativadas e podem se tornar anérgicas (Cap. 14). As células T reguladoras (Cap. 14) também são dependentes da coestimulação mediada pelo B7:CD28 para sua geração e manutenção. É possível que os níveis baixos de coestimuladores de B7 constitutivamente expressados pelas APC em repouso sejam necessários para manter as células reguladoras, que são importantes para a tolerância aos autoantígenos. Os padrões temporais de expressão de B7-1 e B7-2 são diferentes; o B7-2 é expresso constitutivamente em níveis baixos e sua expressão aumenta logo após a ativação das APCs, enquanto B7-1 não é expresso constitutivamente, sendo induzido depois de horas ou dias seguindo a ativação.
Os sinais do CD28 trabalham em cooperação com o reconhecimento do antígeno para iniciar as respostas das células T virgens. O acoplamento do CD28 leva à ativação de diversas vias de sinalização, algumas dos quais podendo amplificar os sinais deflagrados via complexo TCR e outras sendo independentes, mas paralelas aos sinais induzidos pelo TCR (Fig. 9-4). A cauda citoplasmática do CD28 inclui um motivo que contém tirosina que, após a fosforilação, pode recrutar a subunidade reguladora da fosfatidilinositol 3-cinase (PI3 cinase). A cauda do CD28 também contém dois outros motivos ricos em prolina, um dos quais pode se ligar à tirosina cinase Itk pertencente à família Tec e o outro pode se ligar a proteína tirosina cinase Lck pertencente a família Src. O CD28 ligado pelos seus ligantes do B7 pode ativar as cinases PI-3 e a Akt, além de facilitar a ativação da via de MAP cinase Ras/ERK. A PI-3 cinase, como discutido no Capítulo 7, gera moléculas de fosfatidilinositol trifosfato (PIP-3) na camada interna da membrana plasmática, o que pode contribuir para o recrutamento e ativação da proteína tirosina cinase Itk, da fosfolipase PLCγ, e de outra cinase chamada de PDK1. A PDK1 fosforila e ativa a Akt. Por sua vez, a Akt fosforila diversos alvos, desativando proteínas pró-apoptóticas e ativando fatores antiapoptóticos, contribuindo, assim, para a sobrevivência elevada da célula. O CD28 também fornece uma via independente de ativação do fator de troca Vav e a ativação subsequente da via de MAP cinase Rac/JNK. Além disso, foi demonstrado que os sinais do CD28 induzem a ligação do NF-κB a um sítio do promotor do gene da IL-2, chamado de elemento de resposta ao CD28, que não é ativado pelos sinais disparados pelo TCR. O resultado final dessas vias de sinalização são a expressão elevada de proteínas antiapoptóticas como Bcl-2 e Bcl-XL, que promovem a sobrevivência das células T; a atividade metabólica elevada das células T; a proliferação elevada das células T; a produção de citocinas como IL-2 e a diferenciação de células T virgens em células efetoras e de memória (Fig. 9-4). Células T efetoras e de memória previamente ativadas são menos dependentes da coestimulação pela via B7:CD28 do que as células virgens. Essa propriedade das células efetoras e de memória as capacita em responder aos antígenos apresentados por diversas APC que residem em tecidos não linfoides e que podem expressar níveis baixos de B7. Por exemplo, a diferenciação das células T CD8+ em CTL efetoras requer a coestimulação, mas as CTL efetoras podem destruir outras células que não expressam coestimuladores.
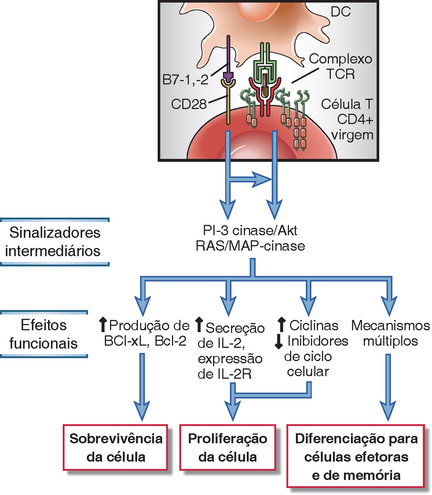
FIGURA 9-4 Mecanismos de estimulação da célula T pelo CD28. O acoplamento do CD28 induz vias de sinalização que fortalecem ou trabalham juntas com os sinais disparados via TCR para estimular a expressão das proteínas de sobrevivência, citocinas e receptores da citocina, para promover a proliferação das células e induzir a diferenciação em células efetoras e de memória. Esses eventos de diferenciação podem ser secundários à expansão clonal elevada e também podem envolver a produção elevada de vários fatores de transcrição.
Numerosos receptores são homólogos ao CD28 e seus ligantes homólogos ao B7 foram identificados; essas proteínas regulam positiva e negativamente as respostas da célula T (Fig. 9-5). Após a demonstração da importância do B7 e CD28, várias outras proteínas estruturalmente relacionadas ao B7-1 e B7-2 ou CD28 foram identificadas pela clonagem dos genes baseada na homologia. Surgiu uma conclusão surpreendente que alguns dos membros das famílias B7:CD28 estão envolvidos na ativação da célula T (e portanto são coestimuladores) e outros são inibidores críticos da célula T (e às vezes foram chamados de coinibidores). O receptor coestimulador (além do CD28), cuja função é bem estabelecida é o ICOS (coestimulador induzível, CD278). O seu ligante, chamado de ICOS-L (CD275), é expressado nas células dendríticas, células B e outras populações celulares. O ICOS cumpre uma função essencial nas respostas humorais (anticorpo) dependente da célula T, particularmente na reação do centro germinal. Ele é exigido para o desenvolvimento e a ativação das células T auxiliares foliculares, que fornecem sinais críticos de ativação para células B nos centros germinais (Cap. 11).
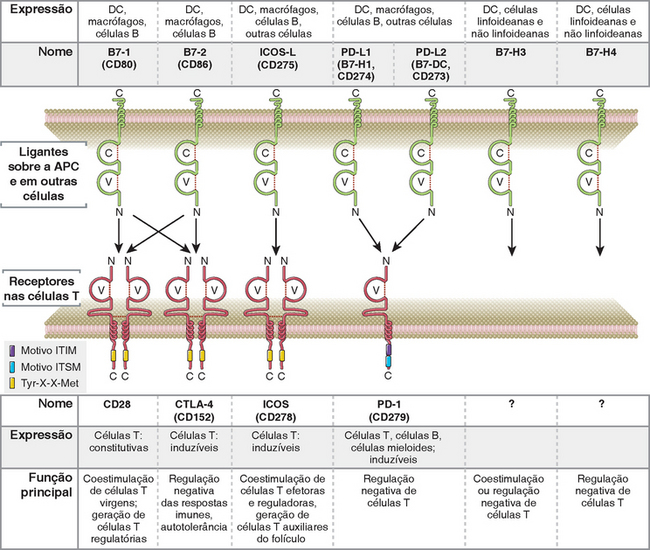
FIGURA 9-5 As famílias B7 e CD28. Os ligantes da família B7 expressados nas APC e os seus ligantes, receptores da família CD28 expressados nas células T, são mostrados com seus padrões de expressão e provavelmente as principais funções. Outros receptores inibidores foram identificados, tal como o BTLA, mas eles não são homólogos ao CD28 e portanto não são mostrados aqui.
O resultado da ativação da célula T é influenciado por um equilíbrio entre o acoplamento dos receptores ativadores e inibidores da família CD28. Os receptores inibidores da família CD28 são o CTLA-4 (antígeno 4 do linfócito T citotóxico, que tem esse nome porque a molécula foi a quarta proteína identificada na pesquisa de moléculas expressadas nos CTL) e PD-1 (morte programada 1). (Os nomes dessas duas proteínas não refletem precisamente sua distribuição ou função.) O conceito de que um equilíbrio entre os receptores ativadores e inibidores controla a magnitude das respostas do sistema imune foi mencionado no Capítulo 4, no conceito das células assassinas naturais (natural killer – NK) (Fig. 4-6, Cap. 4). Uma ideia semelhante é aplicada às respostas dos linfócitos T e B, embora os receptores envolvidos sejam bastante diferentes. Uma vez que os receptores inibidores CTLA-4 e PD-1 estão envolvidos no fenômeno da tolerância e que as anormalidades na expressão ou função dessas moléculas causam doenças autoimunes, nós as discutiremos em mais detalhes no Capítulo 14, no contexto da tolerância e da autoimunidade. É suficiente dizer aqui que o CD28 e o CTLA-4 fornecem um exemplo ilustrativo de dois receptores que reconhecem os mesmos ligantes (as moléculas B7), mas possuem efeitos funcionais opostos na ativação da célula T. O CTLA-4 é um receptor de alta afinidade para a molécula B7 e foi postulado que este é acoplado quando os níveis de B7 nas APCs são baixos (como nas APC em repouso que mostram autoantígenos ou as APC que não são mais expostas a micro-organismos, depois que eles foram removidos e a resposta imune inata é cessada). O CD28 possui uma afinidade 20 a 50 vezes menor para o B7 e pode ser acoplado quando os níveis de B7 são relativamente altos (p. ex., na exposição aos micro-organismos e seguindo respostas imunes inatas). De acordo com esse modelo, o nível de expressão do B7 nas APC influencia o acoplamento diferencial do CD28 ou CTLA-4, que por sua vez determina se as respostas são iniciadas ou terminadas. Uma vez acoplado, o CTLA-4 pode inibir competitivamente o acesso do CD28 às moléculas de B7 nas APC, remover o B7 da superfície das APCs ou liberar sinais inibidores que bloqueiam sinais ativadores do TCR e do CD28.
Outras Vias Coestimuladoras
Demonstrou-se que muitas outras moléculas de superfície das células T, incluindo o CD2 e integrinas, fornecem sinais coestimuladores in vitro, mas seu papel fisiológico para promover a ativação da célula T é menos claro que o da família CD28. Discutimos as funções das proteínas da família CD2 no Capítulo 7 e das integrinas no Capítulo 3. Foi demonstrado que vários outros receptores que pertencem à superfamília do receptor do fator de necrose de tumor maior (TNFR) e seus ligantes, que são homólogos ao TNF, estimulam e inibem as células T em várias condições experimentais. As funções dessas proteínas em controlar as respostas imunes normais e patológicas continuam sendo uma área de investigação ativa.
A interação do CD40L nas células T com o CD40 nas APCs amplifica as respostas da célula T, ativando as APCs. O ligante do CD40 (CD40L) é uma proteína de membrana pertencente à superfamília TNF que é expressada principalmente nas células T ativadas, e o CD40 é um membro da superfamília de receptores TNF expressados nas células B, macrófagos e células dendríticas. As funções do CD40 para ativar os macrófagos na imunidade mediada pela célula e ativar as células B nas respostas imunes humorais são descritas nos Capítulos 10 e 11, respectivamente. As células T auxiliares ativadas expressam o CD40L, que acopla o CD40 das APCs e ativa essas células torná-las APC mais potentes por fortalecera expressão das moléculas B7 e a secreção de citocinas como o IL-12, que promove a diferenciação da célula T (Fig. 9-6). Às vezes, esse fenômeno é chamado de licenciamento, pois as células T ativadas licenciam as APC para se tornarem ativadoras mais potentes das respostas imunes. Portanto, a via do CD40 amplifica indiretamente as respostas da célula T por induzir coestimuladores nas APCs, mas o CD40L não funciona sozinho como coestimulador das células T.
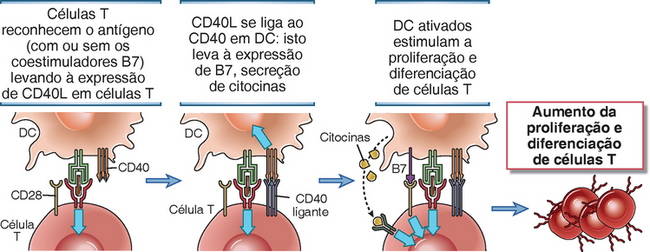
FIGURA 9-6 Função do CD40 na ativação da célula T. As células T virgens são ativadas pelos complexos peptídeos-MHC nas APC ativadas. O reconhecimento do antígeno pelas células T junto com a coestimulação (não mostrado na figura) induz a expressão do ligante do CD40 (CD40L) nas células T ativadas. O CD40L acopla o CD40 nas APC e pode estimular a expressão das moléculas B7 e a secreção das citocinas que ativam as células T. O CD40L nas células T torna as APC mais eficientes em ativar a célula T.
Bloqueio Terapêutico do Coestimulador
Novos agentes terapêuticos estão sendo desenvolvidos para suprimir respostas imunes nocivas, com base no entendimento dessas vias coestimuladoras (Fig. 9-7). A CTLA-4-Ig, uma proteína de fusão, formada pelo domínio extracelular do CTLA4 e a porção Fc da IgG humana, se liga ao B7-1 e B7-2, bloqueando a interação B7: CD28. O motivo do uso do domínio extracelular do CTLA-4 em vez do CD28 para bloquear as moléculas B7 é que o CTLA-4 se liga ao B7 com uma afinidade 20 a 50 vezes maior, como mencionado anteriormente. A fixação da parte Fc da IgG aumenta a meia-vida in vivo da proteína. O CTLA-4-Ig é um tratamento aprovado para a artrite reumatoide, e ensaios clínicos estão sendo conduzidos para avaliar sua eficácia no tratamento de rejeição aos transplantes, psoríase e doença de Crohn. Os anticorpos que bloqueiam os receptores inibidores CTLA-4 e PD-1 estão em estudos clínicos como ferramentas imunoterapêuticas contra tumores. Como era de se prever da função do CTLA-4 para manter a autotolerância, o bloqueio desse receptor inibidor induz reações imunes em alguns pacientes. Os inibidores das vias CD40L:CD40 também estão em estudos clínicos no contexto da rejeição de transplantes e doenças autoimunes inflamatórias crônicas.
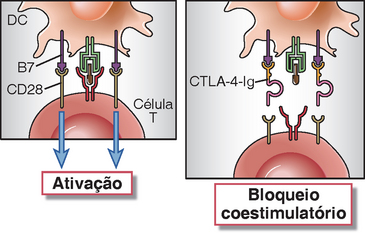
FIGURA 9-7 O mecanismo terapêutico do bloqueio do coestimulador. Uma proteína de fusão contendo a parte extracelular do CTLA-4 e a cauda Fc de uma molécula de IgG são usadas para ligar e bloquear as moléculas B7, impedindo assim sua interação com o receptor ativador CD28 e inibindo a ativação da célula T.
RESPOSTAS FUNCIONAIS DOS LINFÓCITOS T
As primeiras respostas das células T seguindo estimulação pelo antígeno incluem alterações na expressão de várias moléculas de superfície, secreção de citocinas e expressão de receptores de citocina. Elas são seguidas pela proliferação das células específicas ao antígeno, induzida em parte pelas citocinas secretadas e depois pela diferenciação das células ativadas em células efetoras e de memória. No restante deste capítulo, iremos descrever cada uma dessas suas etapas, seus mecanismos subjacentes e consequências funcionais.
Alterações nas Moléculas de Superfície durante a Ativação da Célula T
Depois da ativação, ocorrem alterações características na expressão de várias moléculas de superfície nas células T, que são mais bem definidas nas células T CD4+ auxiliares (Fig. 9-8). Muitas das moléculas expressadas nas células T ativadas também estão envolvidas nas respostas funcionais dessas células. Algumas das moléculas funcionalmente importantes induzidas na ativação estão a seguir.
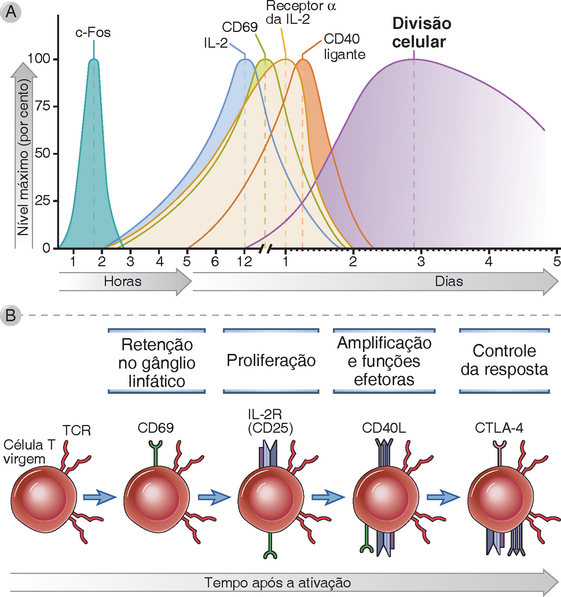
FIGURA 9-8 Alterações nas moléculas de superfície seguindo a ativação da célula T. A, Cinética da expressão de moléculas expressas seguindo a ativação das células T pelos antígenos e coestimuladores. O exemplo ilustrativo inclui um fator de transcrição (c-Fos), uma citocina (IL-2) e proteínas de superfície. Normalmente, essas proteínas são expressadas em níveis baixos nas células T virgens e são induzidas pelos sinais de ativação. O CTLA-4 é induzido 1 a 2 dias depois da ativação. A cinética é uma estimativa e varia conforme a natureza do antígeno, sua dose e persistência e o tipo de adjuvante. B, As principais funções das moléculas de superfície selecionadas são mostradas e descritas no texto.
• CD69. Dentro de algumas horas depois da ativação, as células T aumentam a expressão da molécula CD69, uma proteína de membrana plasmática. Essa proteína se liga e reduz a expressão da superfície do receptor 1 para a esfingosina 1 fosfato (S1PR1) que descrevemos no Capítulo 3 como um receptor que media a saída das células T dos órgãos linfoides. A consequência da expressão reduzida do S1PR1 é que a células T ativadas são retidas nos órgãos linfoides tempo suficiente para receber os sinais que iniciam sua proliferação e diferenciação em células efetoras e de memória. Depois da divisão celular, a expressão do CD69 diminui, as células T ativadas então voltam a expressar altos níveis de S1PR1, permitindo assim que as células efetoras e de memória podem sair dos órgãos linfoides (Cap. 3).
• CD25 (IL-2Rα). A expressão desse receptor de citocina permite que as células T ativadas respondam à citocina promotora do crescimento IL-2. Esse processo é descrito adiante.
• Ligante do CD40 (CD40L, CD154). Dentro de 24 a 48 horas depois da ativação, as células T expressam altos níveis de ligantes para o CD40. A expressão do CD40L permite que as células T ativadas mediam sua principal função de efetora, que é ajudar os macrófagos e células B. Além disso, como já foi discutido, o CD40L nas células T ativa as células dendríticas para que se tornem APC melhores, fornecendo assim um mecanismo de alça de retroalimentação positiva para amplificar as respostas da célula T.
• CTLA-4 (CD152). A expressão do CTLA-4 nas células T também aumenta dentro de 24 a 48 horas depois da ativação. Mencionamos o CTLA-4 anteriormente como um membro da família CD28 que funciona como inibidor da ativação da célula T e, portanto, regulador da resposta. O mecanismo de ação do CTLA-4 é descrito no Capítulo 14 (Fig. 14-5).
• Moléculas de adesão e receptores de quimiocina. Depois da ativação, as células T reduzem a expressão das moléculas que as direcionam até os órgãos linfoides (como a L-selectina e receptor de quimiocina CCR7) e aumentam a expressão das moléculas que estão envolvidas na sua migração para locais periféricos de infecção e lesão do tecido (como as integrinas LFA-1 e VLA-4, os ligantes para as E- e P-selectinas e vários receptores de quimiocina). Essas moléculas e suas funções na migração da célula T foram descritas no Capítulo 3. A ativação também aumenta a expressão do CD44, um receptor da molécula da matriz extracelular, o ácido hialurônico. A ligação do CD44 com o seu ligante ajuda a reter a células T efetoras nos tecidos que são alvo de infecção e dano (Cap. 10).
Secreção de IL-2 e Expressão do Receptor de IL-2
As citocinas executam funções críticas nas respostas imunes adaptativas; nessas respostas, as principais fontes de citocinas são as células T, principalmente (mas não exclusivamente) as células T CD4+auxiliares. A citocina mais importante produzida pelas células T logo após sua ativação, frequentemente dentro de 2 a 4 horas após o reconhecimento do antígeno e dos coestimuladores, é a interleucina 2 (IL-2), que será descrita aqui. As citocinas secretadas pelas células efetoras são descritas no Capítulo 10, quando discutimos as funções das células T CD4+ efetoras.
A IL-2 é um fator de crescimento, sobrevivência e diferenciação para os linfócitos T e executa uma função importante na regulação das respostas da célula T em virtude de sua função crucial na manutenção das células T reguladoras. Devido à sua capacidade de dar suporte à proliferação das células T estimuladas pelo antígeno, a IL-2 foi originalmente chamada de fator de crescimento da célula T (TCGF). Ela age nas mesmas células que a produzem ou nas células adjacentes (i. e., funciona como uma citocina autócrina ou parácrina).
A IL-2 é produzida principalmente pelos linfócitos T CD4+. A ativação das células T pelos antígenos e coestimuladores estimula a transcrição do gene IL-2 e a síntese e secreção da proteína. A produção da IL-2 é rápida e transitória, começando dentro de 2 a 3 horas da ativação da célula T, atingindo um pico dentro de 8 a 12 horas e declinando em 24 horas. As células T CD4+ secretam IL-2 na sinapse imunológica formada entre a célula T e a APC (Cap. 7). Os receptores da IL-2 nas células T também tendem a se localizar na sinapse, de forma que a citocina e seu receptor atinjam concentrações locais suficientemente altas para iniciar respostas celulares.
A IL-2 secretada é uma glicoproteína de 14 a 17 kD que se enovela numa conformação globular que contém quatro hélices α (Fig. 9-9). Ela é o protótipo das citocinas que contém quatro hélices α que interagem com os receptores de citocina do tipo I (Cap. 7).
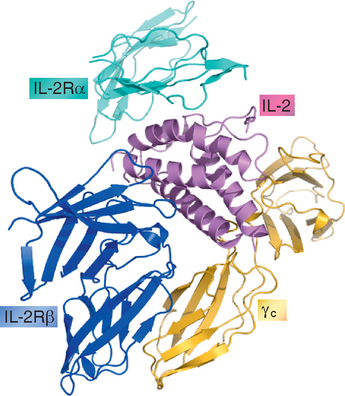
FIGURA 9-9 Estrutura da IL-2 e de seu receptor. A estrutura cristal da IL-2 e seu receptor trimérico mostra como a citocina interage com as três cadeias do receptor.
(Reproduzido de Wang X, M Rickert, e KC Garcia. Structure of the quaternary complex of interleukin-2 with its α, β and γc receptors. Science 310:1159-1163, 2005, com a permissão dos editores. Cortesia dos Drs. Patrick Lupardus e K. Christopher Garcia, Stanford University School of Medicine, Palo Alto, California.)
Os receptores funcionais da IL-2 são transitoriamente expressados na ativação das células T virgens e efetoras; as células T reguladoras sempre expressam os receptores da IL-2. O receptor da IL-2 (IL-2R) consiste em três proteínas associadas não covalentemente, incluindo IL-2Rα (CD25), IL-2/15Rβ (CD122) e γc (CD132). Entre as três cadeias, apenas o IL-2Rα é exclusivo do IL-2R. A IL-2 se liga à cadeia α sozinha, com baixa afinidade e isso não leva a qualquer sinalização citoplasmática ou resposta biológica detectável. A cadeia IL-2/15Rβ, que também é parte do receptor IL-15, contribui com a ligação do IL-2 e acopla vias de transdução do sinal dependente do JAK3-STAT5 (Cap. 7). A cadeia γ é compartilhada com vários receptores de citocina, incluindo os receptores para a IL-4, IL-7, IL-9, IL-15 e IL-21, e por isso é chamada de cadeia γ comum (γc). Embora a cadeia γc não esteja diretamente envolvida na ligação da IL-2, sua associação com o complexo do receptor é exigida para que a ligação da IL-2 seja de alta afinidade e conduza à ativação completa das vias de transmissão do sinal. Os complexos IL-2Rβγc são expressos em níveis baixos nas células T em repouso (e células NK) e ligam a IL-2 com um Kd de aproximadamente 10−9 M (Fig. 9-10). A expressão da subunidade IL-2Rα e, em menor extensão, do IL-2Rβ é elevada seguindo a ativação das células T CD4+ e CD8+ virgens. As células que expressam o IL-2Rα e formam os complexos IL-2Rαβγc podem ligar a IL-2 com maior afinidade, com um Kd de aproximadamente 10−11 M, e o estímulo do crescimento dessas células ocorre em uma concentração similarmente baixa de IL-2. A IL-2, produzida em resposta à estimulação do antígeno é um estímulo para a indução do IL-2Rα, promovendo um mecanismo pelo qual as respostas da célula T se amplificam. As células T CD4+ reguladoras (Cap. 14) expressam o complexo IL-2R inteiro e, portanto, são eficientes em responder à citocina. A estimulação crônica da célula T leva à secreção do IL-2Rα e nível elevado do IL-2Rα secretado no soro é usado clinicamente como marcador de uma forte estimulação antigênica (p. ex., rejeição aguda a um órgão transplantado).
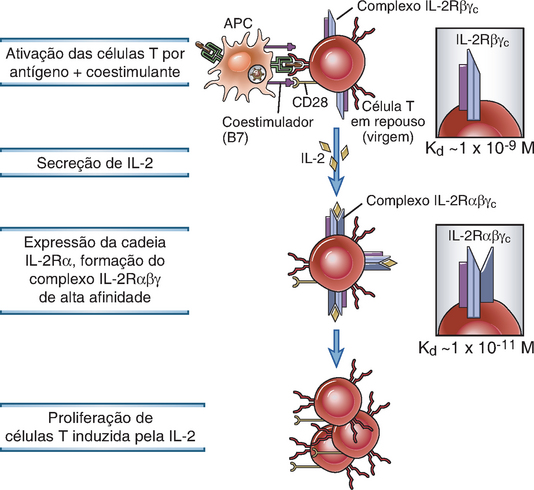
FIGURA 9-10 Regulação da expressão do receptor da IL-2. Os linfócitos T em repouso (virgem) expressam o complexo IL-2Rβγ que possui uma afinidade moderada com a IL-2. A ativação das células T pelo antígeno, coestimuladores e a própria IL-2 leva à expressão da cadeia IL-2Rα e altos níveis do complexo IL-2Rαβγ de alta afinidade.
Funções da IL-2
A biologia da IL-2 é fascinante, porque ele executa funções críticas para promover e controlar as respostas e funções da célula T (Fig. 9-11).
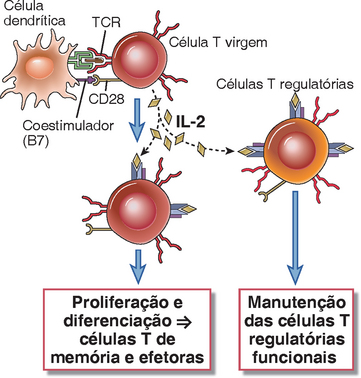
FIGURA 9-11 Ações biológicas da IL-2. A IL-2 estimula a sobrevivência e proliferação dos linfócitos T, agindo como um fator de crescimento autócrino. AIL-2 também mantém as células T reguladoras funcionais e, portanto, controla as respostas imunes (p. ex., contra os autoantígenos).
• A IL-2 estimula a sobrevivência, proliferação a diferenciação das células T ativadas pelo antígeno. A IL-2 promove a sobrevivência das células, induzindo a proteína antiapoptótica Bcl-2. Ela estimula a progressão do ciclo da célula T através da síntese de citocinas e atenua o bloqueio na progressão do ciclo da célula T por induzir a degradação da p27. Além disso, a IL-2 aumenta a produção da citocinas efetoras tais como IFN-γ e IL-4 pelas células T.
• A IL-2 é necessária para a sobrevivência e funcionamento das células T reguladoras, que suprimem as respostas imunes contra os autoantígenos e antígenos estranhos. Na verdade, camundongos deficientes em IL-2 ou nos receptores da IL-2 desenvolvem uma proliferação descontrolada da célula T e B e doença autoimune, por causa de um defeito nas células T reguladoras. Estes estudos indicam que outros fatores de crescimento podem substituir a IL-2 para a expansão das células T efetoras, mas nenhuma outra citocina pode substituir a IL-2 na manutenção das células T reguladoras funcionais. Discutiremos essa função da IL-2 em detalhes no Capítulo 14, quando descrevemos as propriedades e a geração das células T reguladoras. Uma característica interessante dessa função da IL-2 é que as células T reguladoras não produzem quantidades significativas da citocina, implicando que sua sobrevivência depende da IL-2 produzida por outras células T, que respondem a antígenos estranhos.
• Também foi demonstrado que a IL-2 estimula a proliferação e diferenciação das células B e NK in vitro. A importância fisiológica dessas ações não está estabelecida.
Expansão Clonal das Células T
A proliferação da célula T em resposta ao reconhecimento do antígeno é mediada principalmente por uma combinação dos sinais do receptor do antígeno, coestimuladores e fatores de crescimento autócrinos, principalmente a IL-2. As células que reconhecem o antígeno produzem a IL-2 e também respondem a ela preferencialmente, garantindo que as células T específicas ao antígeno sejam as que mais proliferam. O resultado dessa proliferação é a expansão clonal, que cria de um pequeno pool de linfócitos virgens específicos para o antígeno, grande número de células necessárias para eliminar o antígeno. Antes da exposição ao antígeno, a frequência de células T virgens específicas para qualquer antígeno é 1 em 105 a 106 linfócitos. Depois da exposição ao antígeno microbiano, a frequência de todas as células T CD8+ específicas para esses micro-organismos pode aumentar para cerca de 1 em 3 a 1 em 10, representando uma expansão > 50.000 vezes das células T CD8+ específicas ao antígeno, e o número das células T CD4+ específicas aumenta para cerca de 1 em 100 a 1 em 1.000 linfócitos (Fig. 9-12). Os estudos em camundongos mostraram essa imensa expansão da população específica ao antígeno em algumas infecções virais agudas e, notavelmente, que ocorria dentro de apenas uma semana depois da infecção. Igualmente impressionante foi a descoberta de que durante essa expansão clonal maciça, específica para o antígeno, outras células T, que não eram específicas para o vírus, não proliferaram. A expansão das células T específicas para o vírus Epstein Barr e vírus da imunodeficiência humana (HIV), em seres humanos com infecção aguda, é também dessa magnitude. Essa conclusão foi obtida pela análise das respostas da célula T específica ao antígeno em seres humanos, usando multímeros fluorescentes das moléculas do MHC acopladas com peptídeos específicos ou através da marcação de citocina intracelular das células T estimuladas com peptídeos derivados desses vírus (Apêndice IV).
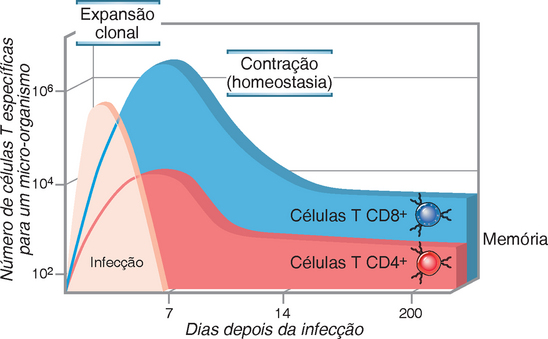
FIGURA 9-12 Expansão clonal das células T. Os números de células T CD4+ e CD8+ específicas aos antígenos microbianos e a expansão e declínio das células durante as respostas imunes são ilustrados. Os números são aproximações baseadas em estudos de modelo em camundongos isogênicos seguindo estimulação com antígenos microbianos e outros.
Grande parte da progênie das células estimuladas pelo antígeno se diferencia em células efetoras. Uma vez que existem diferenças importantes nas células efetoras das linhagens CD4+ e CD8+, elas serão descritas separadamente a seguir. As células efetoras têm vida curta e os números de células específicas ao antígeno declinam rapidamente à medida que o antígeno é eliminado. Depois que a resposta imune é resolvida, as células de memória sobreviventes específicas ao antígeno são encontradas na ordem de 1 em 104.
Diferenciação das Células T CD4+ em Células Efetoras TH1, TH2 e TH17
As células efetoras da linhagem CD4+ são caracterizadas pela sua capacidade de expressar moléculas de superfície e secretar citocinas que ativam outras células (linfócitos B, macrófagos e células dendríticas). Enquanto as células T CD4+ virgens produzem a IL-2 principalmente seguindo sua ativação, as células efetoras são capazes de produzir um grande número e uma variedade de citocinas que possuem atividades biológicas diversificadas.
Existem três subtipos distintos de células T CD4+ chamados de TH1, TH2 e TH17, que funcionam na defesa do hospedeiro contra diferentes tipos de agentes infecciosos e estão envolvidos em tipos diferentes de lesão ao tecido nas patologias imunomediadas (Fig. 9-13). Uma quarta população, chamada de células T auxiliares foliculares, é importante nas respostas do anticorpo e é descrita no Capítulo 11. As células T reguladoras são outra população distinta das células T CD4+. Sua função é controlar as reações imunes aos antígenos próprios e estranhos, e elas são descritas no Capítulo 14 no contexto da tolerância imunológica. Embora esses subtipos sejam identificáveis nas reações imunes (e geralmente possam ser gerados na cultura celular), muitas células T CD4+ efetoras produzem várias combinações de citocinas ou apenas algumas das citocinas características de um subtipo particular, e não são prontamente classificáveis em populações separadas. Não se sabe se essas populações com padrões mistos ou limitados de citocinas são intermediárias no desenvolvimento das células efetoras polarizadas ou se são populações fixas propriamente ditas. Também está claro que algumas dessas células T diferenciadas podem se converter de uma população em outra por meio de alterações nas condições de ativação. A extensão e importância dessa “plasticidade” são tópicos de uma pesquisa ativa.
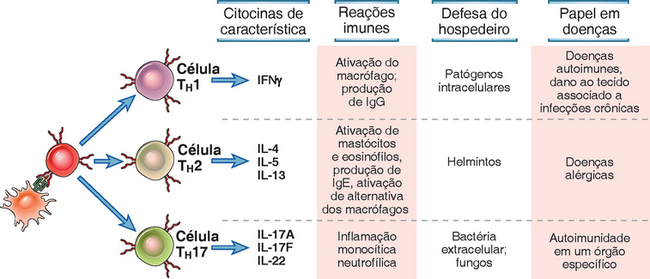
FIGURA 9-13 Propriedades dos subtipos TH1, TH2 e TH17 das células T CD4+ auxiliares. As células T CD4+ virgens podem se diferenciar em subtipos distintos de células efetoras em resposta ao antígeno, coestimuladores e citocinas. As colunas à direita listam as principais diferenças entre os fenótipos mais bem definidos.
Propriedades dos Subtipos TH1, TH2 e TH17
A elucidação do desenvolvimento, propriedades e funções do subtipo das células T CD4+ efetoras tem sido uma das conquistas mais notáveis da pesquisa em imunologia. Há muitos anos, foi descrito que as respostas do hospedeiro às diferentes infecções variavam muito, assim como as reações nas diferentes doenças imunomediadas. Por exemplo, a reação imune a bactérias intracelulares como o Mycobacterium tuberculosis é dominada por macrófagos ativados, enquanto a reação aos helmintos consiste na produção do anticorpo IgE e na ativação de eosinófilos. Seguindo as mesmas linhas, em muitas doenças autoimunes crônicas, o dano ao tecido é causado pela inflamação marcada por um acúmulo de neutrófilos, macrófagos e células T, enquanto nas doenças alérgicas a lesão contém eosinófilos abundantes junto com outros leucócitos. A percepção de que todas essas reações imunológicas fenotipicamente diversificadas são dependentes das células T CD4+ levantou uma questão óbvia: como as próprias células T CD4+ podem mediar respostas tão diferentes? A resposta, como sabemos agora, é que as células T CD4+ consistem em subtipos de células efetoras que produzem conjuntos distintos de citocinas, que provocam reações bastante diferentes e estão envolvidas na defesa do hospedeiro contra diferentes micro-organismos, bem como em tipos distintos de doenças imunológicas. Os primeiros subtipos descobertos foram chamados de TH1 e TH2 (recebendo esses nomes porque foram os dois primeiros identificados). Subsequentemente, foi observado que algumas doenças inflamatórias que pensávamos serem causadas pelas reações imediatas pelo TH1 claramente não eram dependentes desse tipo de célula T e essa percepção levou à descoberta das células TH17 (que receberam esse nome porque sua citocina característica é a IL-17). Na próxima seção, descrevemos as propriedades desses subtipos e como eles se desenvolvem das células T virgens. Retornaremos aos seus produtos de citocina, funções efetoras e funções na imunidade mediada pela célula no Capítulo 10.
As características que definem os tipos diferenciados das células efetoras são as citocinas que eles produzem, os fatores de transcrição que eles expressam e as alterações epigenéticas nos loci do gene da citocina. Essas características das células TH1, TH2 e TH17 serão descritas a seguir.
As citocinas características produzidas pelos principais subtipos de célula T CD4+ são IFN-γ para as células TH1; IL-4, IL-5 e IL-13 para as células TH2; e IL-17 e IL-22 para as células TH17 (Fig. 9-13). As citocinas produzidas por esses subtipos da célula T determinam suas funções efetoras contra patógenos e em doenças imunomediadas. As citocinas também participam no desenvolvimento e expansão dos respectivos subtipos (descrito adiante). Além disso, esses subtipos de células T se diferenciam na expressão das moléculas de adesão e receptores de quimiocinas e outras citocinas, que estão envolvidas na migração de subtipos distintos para os diferentes tecidos (Cap. 10).
Desenvolvimento dos Subtipos TH1, TH2 e TH17
As células diferenciadas TH1, TH2 e TH17 se desenvolvem a partir de linfócitos T CD4+ virgens, principalmente em resposta às citocinas presentes no início das respostas imunes; a diferenciação envolve a ativação transcripcional e a modificação epigenética dos genes da citocina. O processo de diferenciação, que às vezes é chamado de polarização das células T, pode ser dividido em indução, comprometimento estável e amplificação (Fig. 9-14). As citocinas atuam sobre as células T estimuladas pelo antígeno para induzir a transcrição dos genes de citocina característicos da diferenciação na direção de cada subtipo. À medida que a ativação prossegue, as alterações epigenéticas ocorrem de tal forma que os genes que codificam as citocinas características do subtipo sejam mais acessíveis para a transcrição, e os genes que codificam as citocinas não características do subtipo se tornam inacessíveis. Devido a essas alterações, a célula T em diferenciação torna-se cada vez mais comprometida com uma via específica. As citocinas produzidas por qualquer subtipo promovem o desenvolvimento desse subtipo e inibem a diferenciação na direção de outras populações de células T CD4+. Portanto, as alças de retroalimentação positiva e negativa contribuem com a geração de uma população cada vez mais polarizada de células efetoras.
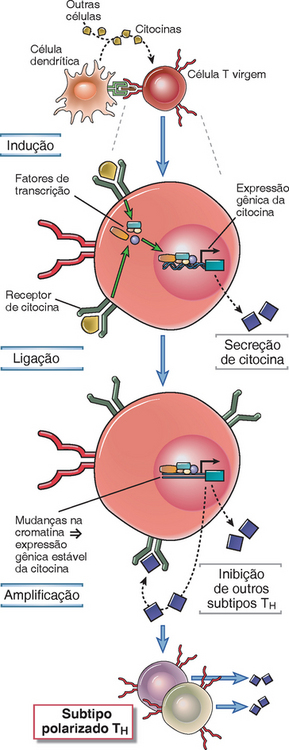
FIGURA 9-14 Desenvolvimento dos subtipos TH1, TH2 e TH17. As citocinas produzidas no início da resposta imune inata ou adaptativa aos agentes infecciosos promovem a diferenciação de células T CD4+ virgens em células TH1, TH2 ou TH17, ativando fatores de transcrição que estimulam a produção das citocinas características de cada fenótipo (a primeira etapa de indução). A ativação progressiva leva a alterações estáveis nos genes expressados (comprometimento) e as citocinas promovem o desenvolvimento de cada população e suprimem o desenvolvimento de outros subtipos (amplificação). Esses princípios se aplicam aos três principais fenótipos das células T CD4+ efetoras.
Existem várias características gerais importantes da diferenciação do subtipo de célula T.
• As citocinas que induzem o desenvolvimento do subtipo de célula T CD4+ são produzidas pelas APCs (principalmente, células dendríticas e macrófagos) e por outras células imunes (como as células NK, basófilos ou mastócitos) presentes no local da resposta imune. As células dendríticas que encontram os micro-organismos e exibem os antígenos microbianos são ativadas a produzir citocinas (bem como coestimuladores, descritos anteriormente) como parte das respostas imunes inatas aos agentes infecciosos (Cap. 4). Os diferentes micro-organismos podem estimular as células dendríticas a produzir conjuntos distintos de citocinas, talvez porque os patógenos sejam reconhecidos por diferentes sensores microbianos nas células. Outras células de imunidade inata, como NK e os mastócitos, também produzem citocinas que influenciam o padrão do desenvolvimento do subtipo de célula T.
• Estímulos diferentes das citocinas também podem influenciar o padrão de diferenciação das células T auxiliares. Alguns estudos indicam que diferentes subtipos de células dendríticas promovem seletivamente a diferenciação de TH1 ou TH2; o mesmo princípio pode ser verdadeiro para as células TH17. Além disso, a constituição genética do hospedeiro é um determinante importante na determinação do padrão de diferenciação da célula T. Camundongos isogênicos de algumas cepas desenvolvem respostas TH2 para os mesmos micro-organismos que estimulam a diferenciação de TH1 na maioria das outras cepas. Cepas de camundongos que desenvolvem respostas dominantes do tipo TH2 são suscetíveis a infecções por patógenos intracelulares (Cap. 15).
• Os perfis distintos de citocina das populações de células diferenciadas são controlados por fatores de transcrição particulares, que ativam a transcrição do gene de citocina e pelas modificações da cromatina que afetam os loci do gene de citocina. Os próprios fatores de transcrição são ativados ou induzidos pelas citocinas, bem como pela estimulação via receptores de antígeno. Cada subtipo expressa seus próprios fatores de transcrição característicos. À medida que os subtipos tornam-se cada vez mais polarizados, os loci do gene que codifica as citocinas características desses subtipos passam por modificações na histona (alterações de metilação e acetilação) e, consequentemente, por eventos de remodelação da cromatina, de forma que esses loci sejam “acessíveis” e estejam em uma configuração “aberta” da cromatina, enquanto os loci de outras citocinas (que não sejam produzidas por esse subtipo) se encontram em um estado de cromatina inacessível. Essas alterações epigenéticas garantem que cada subtipo possa produzir apenas seu padrão característico de citocinas. É provável que as alterações epigenéticas nos loci do gene da citocina sejam correlacionadas com fenótipos estáveis, e antes que essas alterações sejam estabelecidas, os subtipos devem ser plásticos e conversíveis.
• Cada subtipo de células efetoras diferenciadas produz citocinas que promovem seu próprio desenvolvimento e podem suprimir o desenvolvimento de outros subtipos. Essa característica do desenvolvimento do subtipo das células T fornece um mecanismo de amplificação potente. Por exemplo, o IFN-γ secretado pelas células TH1 promove a diferenciação adicional de TH1 e inibe a geração de células TH2. Da mesma forma, a IL-4 produzida pelas células TH2 promove a diferenciação do TH2 e a IL-21 produzida pelas células TH17 promove a diferenciação do fenótipo TH17. Assim, cada subtipo amplifica a si mesmo e pode inibir outros subtipos. Por essa razão, uma vez que uma resposta imunológica se desenvolve ao longo de uma via efetora, ela se torna cada vez mais polarizada naquela direção, e a polarização mais extrema é vista nas infecções crônicas ou na exposição crônica a antígenos ambientais, quando a estimulação imunológica é prolongada.
• A diferenciação de cada subtipo é induzida pelos tipos de patógenos que cada subtipo possa combater melhor. Por exemplo, o desenvolvimento das células TH1 a partir das células T estimuladas pelo antígeno é induzido pelos micro-organismos intracelulares, contra os quais a principal defesa é mediada pelo TH1. Por sua vez, o sistema imune responde aos helmintos através do desenvolvimento das células TH2 e as citocinas produzidas por essas células são críticas para combater esses parasitos. Da mesma forma, as respostas do tipo TH17 são induzidas por algumas bactérias e fungos e esta é a resposta mais efetivas na defesa contra esses patógenos. As funções efetoras polarizadas executadas por essas células T diferenciadas são uma excelente ilustração do conceito da especialização da imunidade adaptativa, que se refere à capacidade do sistema imune em responder aos diferentes micro-organismos de maneira adequada para conseguir combatê-los.
Ainda dentro desse contexto, prosseguimos com a descrição dos sinais e mecanismos do desenvolvimento de cada subtipo.
Diferenciação de TH1
A diferenciação do fenótipo TH1 é induzida principalmente pelas citocinas IL-12 e IFN-γ e ocorrem em resposta aos micro-organismos que ativam as células dendríticas, macrófagos e células NK (Fig. 9-15). A diferenciação das células T CD4+ ativadas por antígeno em efetoras TH1 é estimulada por muitas bactérias intracelulares, tais como Listeria e micobactérias, e por alguns parasitas, tais como Leishmania, todos esses patógenos capazes de infectar as células dendríticas e macrófagos. Essa resposta também é estimulada por vírus e por antígenos proteicos administrados com adjuvantes fortes. Uma característica comum de todas essas condições de infecção e imunização é que elas desencadeiam respostas imunes inatas que são associadas à produção de certas citocinas, incluindo IL-12, IL-18 e interferons do tipo I. Todas essas citocinas promovem o desenvolvimento do fenótipo TH1; entre elas, a IL-12 é provavelmente a mais potente. Os camundongos deficientes em IL-12 são extremamente suscetíveis a infecções por micro-organismos intracelulares. IL-18 sinergiza com IL-12, e os interferons tipo I podem ser importantes para diferenciação de TH1 em resposta a infecções virais, particularmente em humanos. Outros micro-organismos estimulam as células NK a produzir IFN-γ, que por si só é uma forte citocina indutora do fenótipo TH1 e também age sobre células dendríticas e macrófagos para induzir mais secreção da IL-12. Uma vez que as células TH1 se desenvolveram, elas secretam o IFN-γ, que promove mais diferenciação do TH1 e, portanto, amplifica fortemente o padrão induzido. Além disso, o IFN-γ inibe a diferenciação de células T virgens nos subtipos TH2 e TH17, promovendo assim a polarização da resposta imune em uma direção. As células T podem, adicionalmente, acentuar a produção de citocina por células dendríticas e macrófagos através do ligante do CD40 (CD40L) expresso nas células T ativadas que reconhece o CD40 nas APCs e estimula a secreção da IL-12.
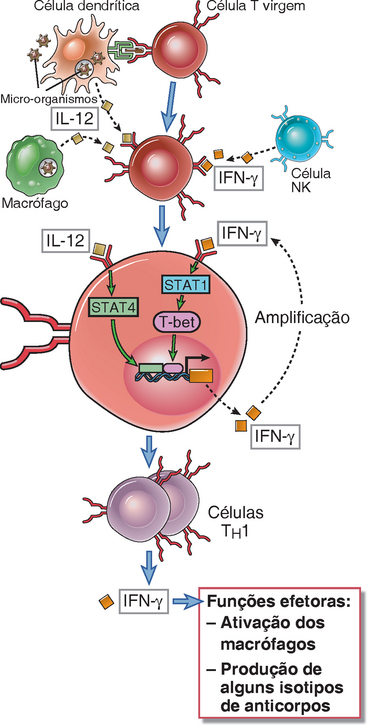
FIGURA 9-15 Desenvolvimento das células TH1. A IL-12 produzida pelas células dendríticas e macrófagos em resposta aos micro-organismos, incluindo os patógenos intracelulares e o IFN-γ produzido pelas células NK (todos como parte da resposta imune inata inicial aos agentes infecciosos) ativam os fatores de transcrição T-bet, STAT1 e STAT4, que estimulam a diferenciação das células T CD4+ virgem ao subtipo TH1. O IFN-γ produzido pelas células TH1 amplifica essa resposta e inibe o desenvolvimento das células TH2 e TH17.
IFN-γ e IL-12 estimulam a diferenciação do TH1 ativando os fatores de transcrição T-bet, STAT1 e STAT4 (Fig. 9-15). T-bet, um membro da família T-box de fatores de transcrição, é considerado o regulador-mestre da diferenciação de TH1. A expressão de T-bet é induzida nas células T CD4+ virgens em resposta ao antígeno e ao IFN-γ. O IFN-γ ativa o fator de transcrição STAT1, o qual, por sua vez, estimula expressão de T-bet. Em seguida, o T-bet promove a produção do IFN-γ através de uma combinação de ativação transcripcional direta do gene IFN-γ e de indução de modelagem da cromatina do lócus do IFN-γ. A capacidade do IFN-γ em estimular a expressão do T-bet, e a capacidade do T-bet em fortalecer a transcrição do IFN-γ, configuram uma alça de amplificação positiva que induz a diferenciação das células T em direção do fenótipo TH1. A IL-12 contribui para o comprometimento do TH1 ao se ligar a receptores nas células T CD4+ estimuladas por antígeno e ativar o fator de transcrição STAT4, o que intensifica ainda mais a produção de IFN-γ. Camundongos deficientes em IL-12, no receptor de IL-12, em T-bet ou STAT4 não são capazes de montar respostas do tipo TH1 efetivas seguindo infecções, e os humanos com deficiências genéticas na via de sinalização do IL-12R têm respostas prejudicadas a infecções por vários tipos de bactérias intracelulares.
Diferenciação do TH2
A diferenciação do TH2 é estimulada pela citocina IL-4 e ocorre em resposta aos helmintos e alérgenos (Fig. 9-16). Helmintos e alérgenos causam estimulação crônica das células T, frequentemente sem a indução de respostas imunes naturais fortes que são necessárias para diferenciação de TH1. Assim, células TH2 podem se desenvolver em resposta a patógenos e antígenos que causam estimulação persistente ou repetida das células T com pouca inflamação ou pouca produção das citocinas pró-inflamatórias que induzem as respostas do TH1 e TH17. A diferenciação das células T estimuladas pelo antígeno no subtipo TH2 é dependente da IL-4, o que levanta uma questão interessante: como às células TH2 diferenciadas são a principal fonte de IL-4 durante as respostas imunológicas a antígenos proteicos, de onde vem, portanto, a IL-4 antes das células TH2 se desenvolverem? Em algumas situações, como infecções por helmintos, a IL-4 produzida por mastócitos e, possivelmente, outras populações de células como os basófilos recrutados para os órgãos linfoides e eosinófilos podem contribuir para o desenvolvimento de TH2. Outra possibilidade é que as células T CD4+ estimuladas por antígenos secretam pequenas quantidades de IL-4 na sua fase inicial de ativação. Se o antígeno é persistente e presente em altas concentrações, a concentração local de IL-4 aumenta gradualmente. Se o antígeno também não desencadeia a inflamação com a produção concomitante de IL-12, o resultado é uma diferenciação crescente de células T no subtipo TH2. Uma vez que as células TH2 se desenvolveram, a IL-4 que elas produzem serve para amplificar a reação e inibir o desenvolvimento das células TH1 e TH17.
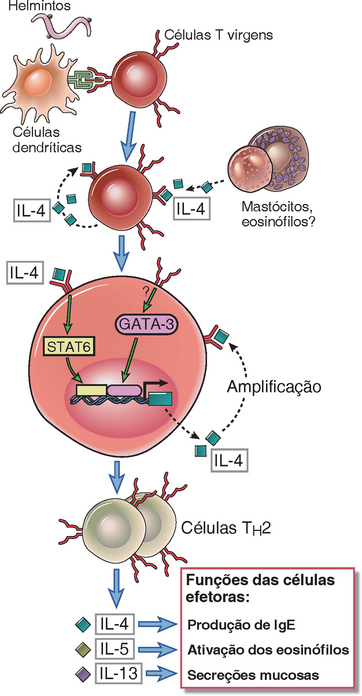
FIGURA 9-16 Desenvolvimento das células TH2. AIL-4 produzida pelas próprias células T ativadas ou pelos mastócitos e eosinófilos, particularmente em resposta aos helmintos, ativam os fatores de transcrição GATA-3 e STAT6, que estimulam a diferenciação das células T CD4+ virgem no fenótipo TH2. A IL-4 pelas células TH2 amplifica essa resposta e inibe o desenvolvimento das células TH1 e TH17.
A IL-4 estimula o desenvolvimento do fenótipo TH2 por ativar o fator de transcrição STAT6, e o STAT6, junto com os sinais vias TCR, induz a expressão do GATA-3 (Fig. 9-16). O GATA-3 é um fator de transcrição que age como um regulador-mestre da diferenciação do TH2, amplificando a expressão dos genes para as citocina definidoras do fenótipo TH2 IL-4, IL-5 e IL-13, que estão localizados no mesmo lócus genético. GATA-3 opera interagindo diretamente com os promotores destes genes, mas também causando remodelação da cromatina, o que abre o lócus mantendo-o mais acessibilidade a outros fatores de transcrição. Isso é semelhante à maneira pela qual o T-bet influencia a expressão do IFN-γ. O GATA-3 funciona para comprometer estavelmente as células que estão se diferenciando na direção do fenótipo TH2, fortalecendo sua própria expressão através de alça de retroalimentação positiva. Além disso, ele bloqueia a diferenciação do fenótipo TH1 inibindo a expressão da cadeia β do receptor do IL-12 envolvido na sinalização. Os camundongos nocauteados (knockouts) para IL-4, STAT6 ou GATA-3 são deficientes em montar respostas do tipo TH2.
Diferenciação do TH17
O desenvolvimento das células TH17 é estimulado por citocinas pró-inflamatórias produzidas em resposta a bactérias e fungos (Fig. 9-17). Diversas bactérias e fungos que agem sobre as células dendríticas estimulam a produção de citocinas, incluindo IL-6, IL-1 e IL-23. O acoplamento do receptor Dectin-1 semelhante à lectina nas células dendríticas por produtos fúngicos é um sinal para a produção dessas citocinas. A combinação de citocinas que induzem o desenvolvimento das células TH17 pode ser produzida não apenas em resposta a patógenos particulares como os fungos, mas também quando as células infectadas com várias bactérias e fungos passam por apoptose e são ingeridas pelas células dendríticas. A IL-23 pode ser mais importante para a proliferação e manutenção das células TH17 que para sua indução. A diferenciação do fenótipo TH17 é inibida pelo IFN-γ e IL-4; portanto, respostas fortes do tipo TH1 e TH2 tendem a suprimir o desenvolvimento do fenótipo TH17. Um aspecto surpreendente da diferenciação do TH17 é que o TGF-β, que é uma citocina anti-inflamatória produzida por muitos tipos de células (Cap. 14), promove o desenvolvimento das células TH17 pró-inflamatórias quando outros mediadores da inflamação, como IL-6 ou IL-1, estão presentes. Alguns resultados experimentais indicam que o TGF-β não estimula diretamente o desenvolvimento do fenótipo TH17, mas por ser um supressor potente da diferenciação dos fenótipos TH1 e TH2 e, essa citocina, portanto, remove o efeito inibidor desses dois subtipos permitindo assim que a resposta do tipo TH17 se desenvolva sob a influência d IL-6 ou IL-1. De acordo com essa hipótese, a ação do TGF-β em promover respostas do tipo TH17 é indireta. As células TH17 produzem o IL-21, o que pode favorecer ainda mais o seu desenvolvimento, fornecendo um mecanismo de amplificação.
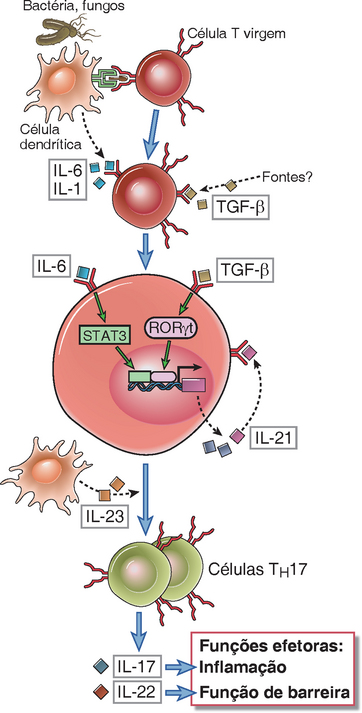
FIGURA 9-17 Desenvolvimento das células TH17. O IL-1 e o IL-6 produzidos pelas APCs e o fator-β de crescimento transformante (TGF-β) produzido por várias células ativam os fatores de transcrição RORγt e STAT3, que estimulam a diferenciação das células T CD4+ virgens no conjunto subtipo TH17. A IL-23, que também é produzida pelas APCs, principalmente em resposta aos fungos, estabiliza as células TH17. O TGF-β pode favorecer as respostas do TH17 indiretamente, por suprimir as células TH1 e TH2, que inibem a diferenciação do TH17 (não mostrada na figura). A IL-21 produzida pelas células TH17 amplifica essa resposta.
O desenvolvimento das células TH17 é dependente dos fatores de transcrição RORγt e STAT3 (Fig. 9-17). O TGF-β e as citocinas inflamatórias, principalmente IL-6 e IL-1, trabalham de maneira cooperativa para induzir a produção do RORγt, um fator de transcrição que é membro da família de receptores do ácido retinoico. O RORγt é uma proteína restrita da célula T codificada pelo gene RORC, portanto às vezes a proteína pode ser chamada de RORc. As citocinas inflamatórias, principalmente o IL-6, ativam o fator de transcrição STAT3, que funciona com o RORγt para induzir resposta do tipo TH17. Alterações no gene que codifica a proteína STAT3 humana causam uma rara doença associada à deficiência imune que é chamada de síndrome de Jó, porque os pacientes apresentam diversos abscessos bacterianos e fúngicos de pele, semelhantes às punições bíblicas recebidas por Jó. Esses pacientes apresentam respostas do tipo TH17 defeituosas.
As células TH17 parecem ser particularmente abundantes nos tecidos de mucosa, principalmente no trato gastrointestinal, sugerindo que o ambiente tecidual influencia a geração desse subtipo, fornecendo talvez altas concentrações locais de TGF-β e outras citocinas. Essa observação também sugere que as células TH17 podem ser particularmente importantes para combater infecções intestinais e no desenvolvimento de inflamação intestinal. O desenvolvimento das células TH17 no trato gastrointestinal também depende da população microbiana local.
As funções das células efetoras diferenciadas da linhagem CD4+ são mediadas pelas moléculas da superfície, principalmente o ligante do CD40, e pelas citocinas secretadas. Descreveremos as citocinas produzidas pelas células efetoras CD4+ diferenciadas e suas funções no Capítulo 10.
Diferenciação das Células T CD8+ em Linfócitos T Citotóxicos
A ativação das células T CD8+ virgens exige o reconhecimento do antígeno e os segundos sinais, mas a natureza dos segundos sinais pode ser diferente daquela necessária para as células T CD4+. Previamente, descrevemos a função das células dendríticas como células apresentadoras de antígenos para estimular as células CD8+ virgens.
A ativação completa das células T CD8+ virgens e a sua diferenciação em CTL funcionais e células de memória podem exigir a participação das células T CD4+ auxiliares. Em outras palavras, as células T auxiliares podem fornecer os segundos sinais para as células T CD8+. A necessidade da participação das células auxiliares varia de acordo com o tipo de exposição antigênica. Na presença de uma resposta acentuada do sistema imune natural ao micro-organismo, ou se as APC forem infectadas diretamente por esses patógenos, ou ainda se a apresentação cruzada de antígenos microbianos for eficaz, o auxílio das células T CD4+ pode não ser necessário. As células T CD4+ auxiliares podem ser necessárias para que haja uma resposta das células T CD8+ a infecções virais latentes, aos órgãos transplantados e tumores, os quais tendem a desencadear reações relativamente fracas do sistema imune natural. A participação das células T CD4+ no desenvolvimento das respostas das CTL é ilustrada pelos estudos com camundongos que não possuem células T auxiliares. Nesses camundongos, algumas infecções virais não induzem uma resposta eficaz das CTL ou de células T CD8+ de memória, consequentemente a infecção não é erradicadas, enquanto outros vírus estimulam respostas eficientes das CTL. A deficiência funcional das células T CD4+ auxiliares é a explicação mais provável para os defeitos na geração de CTL observados nos indivíduos infectados com o HIV, que infecta e elimina apenas as células T CD4+.
As células T auxiliares podem promover a ativação das células T CD8+ por diferentes mecanismos (Fig. 9-18). As células T auxiliares podem secretar citocinas que estimulam a diferenciação das células T CD8+. As células T auxiliares estimuladas por antígenos expressam o ligante do CD40 (CD40L), que, ao se ligar ao CD40 nas APC, induz ativação dessas APC tornando-as células mais eficazes em induzir a diferenciação das células T CD8+.
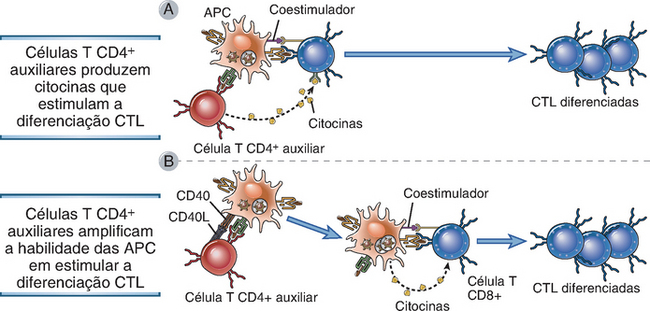
FIGURA 9-18 Função das células T auxiliares na diferenciação dos linfócitos T CD8+. As células T CD4+ auxiliares promovem o desenvolvimento das CD8+ em CTL secretando citocinas que agem diretamente nas células T CD8+ (A) ou ativando as APC para que se tornem mais eficientes na estimulação da diferenciação das células T CD8+ (B).
A diferenciação das células T CD8+ em CTLs efetoras envolve a aquisição de maquinaria necessária para destruir as células-alvo. A característica mais importante da diferenciação das CTL é o desenvolvimento de grânulos citoplasmáticos que contêm proteínas, incluindo a perforina e granzimas, cuja função é destruir outras células (descrito no Cap. 10). Além disso, as CTL diferenciadas são capazes de secretar citocinas, principalmente o IFN-γ que ativa os fagócitos. Os eventos moleculares da diferenciação das CTL envolvem a transcrição dos genes que codificam essas moléculas efetoras. Dois fatores de transcrição necessários para esse programa de expressão de novos genes incluem o fator T-bet (discutido anteriormente como sendo necessário para a diferenciação das células TH1) e a eomesodermina, que é estruturalmente relacionada com o fator T-bet.
Desenvolvimento das Células T da Memória
As respostas imunes mediadas pelas células T a um antígeno usualmente resultam na geração de células T de memória específicas para esse antígeno, as quais podem persistir durante anos, ou mesmo por toda a vida. Portanto, as células de memória fornecem uma defesa ideal contra os patógenos que prevalecem no ambiente e podem ser encontrados repetidamente. O sucesso da vacinação é atribuído em grande parte à capacidade de gerar células de memória seguindo exposição inicial ao antígeno. O experimento clássico de Edward Jenner sobre o sucesso na vacinação infantil contra a catapora é uma demonstração de uma resposta de memória. Apesar da importância dessa observação histórica, muitas questões fundamentais sobre a geração das células de memória ainda não foram esclarecidas.
Como esperado, o tamanho do pool de memória é proporcional ao tamanho da população de células virgens específicas ao antígeno. As células de memória podem se desenvolver a partir das células efetoras ao longo de uma via linear, ou as populações efetoras e de memória seguem uma diferenciação divergente e são dois destinos alternativos dos linfócitos quando esses são ativados pelo antígeno e por outros estímulos (Fig. 9-19). Ainda não foi estabelecido o mecanismo que determina se uma célula T estimulada pelo antígeno se tornará uma célula efetora de vida curta ou entrará no pool da célula de memória de vida longa. Os sinais que induzem o desenvolvimento das células de memória também não foram estabelecidos. Uma possibilidade é que as células de memória contenham fatores de transcrição diferentes daqueles presentes nas células efetoras, e que a natureza dos fatores de transcrição influencie a escolha da via de diferenciação.
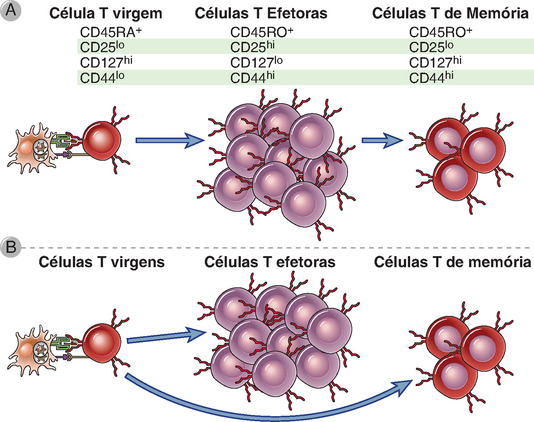
FIGURA 9-19 Desenvolvimento das células T de memória. Em resposta ao antígeno e a coestimulação, as células T virgens se diferenciam em células efetoras e de memória. Alguns dos marcadores fenotípicos dessas populações celulares são mostrados em A. A, De acordo com o modelo linear da diferenciação da célula T de memória, a maioria das células efetoras morre e algumas sobreviventes se desenvolvem em células de memória. B, De acordo como o modelo de diferenciação ramificada, as células efetoras e de memória são destinos alternativos das células T ativadas.
Propriedades das Células T da Memória
As células T de memória possuem várias características que são responsáveis pela sua sobrevivência e a ativação rápida.
• As propriedades que definem as células de memória são a sua capacidade de sobreviver em um estado quiescente depois que o antígeno é eliminado e de montar respostas melhores e mais rápidas aos antígenos quando comparadas às células virgens. Enquanto as células T virgens vivem por semanas ou meses e são substituídas por células maduras que se desenvolvem no timo, as células T de memória podem sobreviver por meses ou anos. Portanto, à medida que os humanos envelhecem no ambiente em que são constantemente expostos e respondem aos agentes infecciosos, a proporção das células de memória induzida por esses micro-organismos aumenta progressivamente, em comparação com as células virgens. Em pessoas com 50 anos ou mais, metade ou mais das células T circulantes podem ser células de memória. A resposta rápida das células de memória ao desafio antigênico foi documentada em muitos estudos realizados em humanos e animais experimentais. Por exemplo, nos estudos em camundongos, as células T virgens responderam a um antígeno in vivo em 5 a 7 dias, e as células de memória em 1 a 3 dias (Fig. 1-4, Cap. 1).
• O número das células T de memória específicas para qualquer antígeno é maior que o número de células virgens específicas para o mesmo antígeno. Como discutimos previamente, a proliferação leva a uma maior expansão clonal em todas as respostas imunes e à diferenciação em células efetoras, a maioria das quais morre depois que o antígeno é eliminado. As células que sobrevivem do clone expandido são células de memória e tipicamente são 10 a 100 vezes mais numerosas que o pool de células virgens antes do encontro com o antígeno. Um aumento na frequência do clone é o principal motivo pelo qual o redesafio antigênico em um indivíduo previamente imunizado induz uma resposta mais robusta que a imunização primária em uma pessoa não imunizada.
• As células de memória expressam níveis elevados de proteínas antiapoptóticas, que podem ser responsáveis pela sua sobrevivência prolongada. Essas proteínas incluem Bcl-2 e Bcl-XL, que estabilizam as mitocôndrias bloqueando assim a apoptose induzida por deficiência dos sinais de sobrevivência (Fig. 14-7, Cap. 14). A presença dessas proteínas permite que as células de memória sobrevivam mesmo depois que o antígeno é eliminado e que as respostas imunes inatas tenham sido finalizadas, e os sinais normais de sobrevivência e proliferação da célula T não estejam mais presentes.
• As células de memória são submetidas a um baixo nível de proliferação e essa capacidade de se autorrenovar pode contribuir para a vida longa do pool de memória. O ciclo dessas células pode ser estimulado pelas citocinas. Devido à capacidade de autorrenovação, as células de memória foram vinculadas às células-tronco.
• A manutenção das células de memória depende das citocinas, mas não requer o reconhecimento do antígeno. A citocina mais importante para a manutenção das células T CD4+ e CD8+ memória é a IL-7, que também executa uma função importante no desenvolvimento inicial de linfócitos (Cap. 8) e na sobrevivência das células T virgens (Cap. 2). Portanto, a alta expressão do receptor para IL-7 (CD127) é uma característica das células T de memória. As células T CD8+ de memória também dependem da citocina relacionada a IL-15 para sua sobrevivência. IL-7 e IL-15 induzem a expressão de proteínas antiapoptóticas e estimulam a proliferação de baixo nível, permitindo que populações de células T de memória persistam por longos períodos. A melhor demonstração da independência das células de memória do reconhecimento do antígeno foi descrita em experimentos com camundongos, nos quais os receptores do antígeno foram geneticamente excluídos apenas depois que os linfócitos maduros haviam se desenvolvido. Nesses camundongos, o número de linfócitos virgens cai rapidamente, mas as células de memória são mantidas.
• Os loci do gene para as citocinas e outras moléculas efetoras podem ser mantidos em uma configuração acessível nas células de memória. Existem algumas evidências de que a cromatina ao redor dos genes da citocina nas células T CD4+ de memória e os genes que codificam as moléculas como a perforina nas células T CD8+ de memória estão em uma configuração acessível, talvez por alterações na metilação e acetilação das histonas. Como resultado, esses genes podem ser rapidamente transcritos em resposta ao desafio antigênico, explicando assim como as respostas efetoras das células de memória são mais rápidas. As células T de memória também são menos dependentes de coestimulação que as células virgens, permitindo que as células de memória respondam aos antígenos apresentados por uma ampla variedade de APCs nos tecidos periféricos; por sua vez, como discutimos previamente neste capítulo e no Capítulo 6, as células T virgens são dependentes da apresentação do antígeno pelas células dendríticas maduras nos órgãos linfoides. A independência relativa de coestimulação das células T de memória também pode ser relacionada com o estado acessível dos loci que codificam as moléculas envolvidas nas respostas da célula T.
Os marcadores fenotípicos mais confiáveis das células T de memória parecem ser a expressão de superfície do receptor da IL-7 e uma proteína de função desconhecida chamada CD27, bem como a ausência dos marcadores de células T virgens e recém-ativadas (Tabela 2-3, Cap. 2 e Fig. 9-19). Nos seres humanos, a maioria das células T virgens expressa uma isoforma de 200 kD da molécula de superfície chamada CD45 que contém um segmento codificado por um exon designado como A. Essa isoforma do CD45 pode ser reconhecida por anticorpos específicos para esse segmento, sendo, então, denominada CD45RA (do inglês, “restrito para A”). Por sua vez, a maioria das células T de memória expressa a isoforma de 180 kD do CD45, na qual o exon A do RNA foi retirado; essa isoforma é chamada CD45RO. Entretanto, essa maneira de distinguir células T virgens das de memória não é perfeita e já foi documentada interconversão das populações entre CD45RA+ e CD45RO+.
Tanto as células T CD4+ quanto T CD8+ de memória são heterogêneas e podem ainda ser adicionalmente subdivididas em subtipos com base nas suas propriedades de enderaçamento e funções. As células T de memória centrais expressam o receptor da quimiocina CCR7 e selectina-L, e se dirigem (homing) principalmente nos gânglios linfáticos. Elas têm capacidade limitada de desempenhar funções efetoras quando encontram o antígeno, mas sofrem respostas proliferativas intensas e geram muitas células efetoras quando desafiadas pelo antígeno. As células T de memória efetoras, por sua vez, não expressam CCR7 ou selectina-L, e se dirigem (homing) para os sítios periféricos, especialmente tecidos de mucosa. Com estimulação antigênica, as células T de memória efetoras produzem citocinas efetoras como IFN-γ, ou rapidamente se tornam citotóxicas, mas não proliferam muito. Este subtipo efetor, portanto, é preparado para executar uma resposta rápida a uma exposição repetida a um micro-organismo, mas a erradicação completa da infecção também pode exigir grandes números de efetores gerados das células T de memória centrais. Não está claro se todas as células T de memória podem ser classificadas em centrais e efetoras.
As células T de memória também são heterogêneas com relação aos seus perfis de citocina. Por exemplo, algumas células T CD4+ de memória podem ser derivadas de precursores antes mesmo que haja o comprometimento com os fenótipos TH1, TH2 ou TH17, e quando ativadas pela reexposição ao antígeno e às citocinas, estas podem se diferenciar em qualquer um desses fenótipos. Outras células T de memória podem ser derivadas de efetores TH1, TH2 ou TH17 completamente diferenciados e reter seus respectivos perfis de citocinas quando são reativadas. Também podem existir células T CD8+ de memória que mantêm algumas das características fenotípicas de CTL diferenciados.
DECLÍNIO DAS RESPOSTAS DA CÉLULA T
A eliminação do antígeno leva à contração da resposta da célula T, e esse declínio é responsável por manter a homeostasia do sistema imune. Existem vários motivos para o declínio da resposta. À medida que o antígeno é eliminado e a resposta imune inata associada à exposição ao antígeno cessa, os sinais que normalmente mantêm os linfócitos ativados vivos e em proliferação deixam de ser ativos. Como já foi mencionado, a coestimulação e os fatores de crescimento como o IL-2 estimulam a expressão das proteínas antiapoptóticas Bcl-2 e Bcl-XL nos linfócitos ativados, e essas proteínas mantêm as células vivas. À medida que o nível de coestimulação e a quantidade do IL-2 disponível diminuem, caem também os níveis de proteínas antiapoptóticas nas células. Ao mesmo tempo, a privação do fator de crescimento ativa os sensores de estresse celular (como a proteína Bim do BH3), que desencadeiam a via mitocondrial de apopotose e deixam de expressar as proteínas antiapoptóticas (Fig. 14-7, Cap. 14). O resultado final dessas alterações é que a maioria das células produzida pela ativação morre e a geração das células recém-ativadas declina, portanto o pool dos linfócitos ativados pelo antígeno contrai.
Nesse sentido, houve um grande interesse no conhecimento dos possíveis mecanismos capazes de executar uma função na contração normal das respostas imunes. Esses mecanismos poderiam incluir os receptores inibidores CTLA-4 e PD-1, a apoptose induzida pelos receptores de morte da superfamília do receptor para o TNF (como TNFRI e Fas), e as células T reguladoras. No entanto, ainda não foi estabelecido se esses mecanismos de controle são essenciais para o declínio normal da maioria das respostas imunes.
• As respostas das células T são iniciadas por sinais gerados pelo reconhecimento dos complexos peptídeo-MHC na superfície da uma APC e através de sinais fornecidos ao mesmo tempo por coestimuladores expressados pelas APCs.
• Os coestimuladores mais bem definidos são os membros da família B7, que são reconhecidos pelos receptores da família CD28 expressados nas células T. A expressão dos coestimuladores B7 nas APCs é elevada pelo encontro com os micro-organismos, fornecendo um mecanismo capaz de gerar respostas ideais contra patógenos. Alguns membros da família CD28 inibem as respostas da célula T e o resultado do reconhecimento do antígeno da célula T é determinado pelo equilíbrio entre o acoplamento de receptores ativadores e inibidores dessa família.
• As respostas da célula T ao antígeno e aos coestimuladores incluem alterações na expressão das moléculas de superfície, síntese das citocinas e receptores de citocina, proliferação celular e diferenciação em células efetoras e de memória.
• As moléculas de superfície cuja expressão é induzida seguindo a ativação da célula T incluem proteínas que estão envolvidas na retenção das células T nos órgãos linfoides, fatores de crescimento, moléculas efetoras e reguladoras e moléculas que influenciam a migração das células T.
• Logo depois da ativação, as células T produzem a citocina IL-2 e expressam altos níveis do receptor de alta afinidade para a IL-2. A IL-2 induz a proliferação das células, que pode resultar na expansão acentuada dos clones específicos ao antígeno.
• Os linfócitos T CD4+ auxiliares podem se diferenciar em células TH1 efetoras especializadas que secretam IFN-γ, que media a defesa contra os micro-organismos intracelulares, ou em células TH2 que secretam IL-4 e IL-5, as quais favorecem reações de imunidade mediadas por IgE, e reações imunes mediadas pelos eosinófilos e mastócitos contra os helmintos ou em células TH17, que promovem a inflamação e mediam a defesa contra fungos e bactérias extracelulares.
• A diferenciação das células T CD4+ virgens em subtipos é induzida pela citocinas produzidas pelas APCs e pelas próprias células T. O programa de diferenciação é governado por fatores de transcrição que promovem a expressão de gene de citocina nas células T e por alterações epigenéticas no loci do gene de citocina, que podem ser associadas à diferenciação a subtipo específico de célula T. Cada subtipo produz citocinas que amplificam o seu próprio desenvolvimento e inibem o desenvolvimento dos outros subtipos, levando assim a uma polarização crescente da resposta.
• As células T CD8+ proliferam e se diferenciam em linfócitos T citotóxicos (CTLs), que expressam os grânulos citotóxicos e podem matar as células infectadas.
• Algumas células T ativadas podem se diferenciar em células de memória, que sobrevivem por longos períodos e respondem rapidamente ao desafio antigênico. A manutenção das células de memória é dependente de citocinas como IL-7, que promovem a expressão de proteínas antiapoptóticas e estimulam o ciclo celular de baixo nível. As células T de memória são heterogêneas e consistem em populações que diferem em suas propriedades de migração e respostas funcionais.
Ativação e Proliferação da Célula T
Boyman O, Letourneau S, Krieg C, Sprent J. Homeostatic proliferation and survival of naive and memory T cells. European Journal of Immunology. 2009;39:2088-2094.
Jenkins MK, Chu HH, McLachlan JB, Moon JJ. On the composition of the pre-immune repertoire of T cells specific for peptide–major histocompatibility complex ligands. Annual Review of Immunology. 2010;28:275-294.
Von Andrian UH, Mackay CR. T-cell function and migration. New England Journal of Medicine. 2000;343:1020-1034.
Coestimulação: B7, CD28 e Mais
Chen L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity. Nature Reviews Immunology. 2004;4:336-347.
Croft M. Co-stimulatory members of the TNFR family: keys to effective T cell immunity? Nature Reviews Immunology. 2003;3:609-620.
Greenwald RJ, Freeman GJ, Sharpe AH. The B7 family revisited. Annual Review of Immunology. 2005;23:515-548.
Keir ME, Butte MJ, Freeman GJ, Sharpe AH. PD-1 and its ligands in tolerance and immunity. Annual Review of Immunology. 2008;26:677-704.
Watts TH. TNF/TNFR family members in costimulation of T cell responses. Annual Review of Immunology. 2005;23:23-68.
Huse M, Quann EJ, Davis MM. Shouts, whispers and the kiss of death: directional secretion in T cells. Nature Immunology. 2008;9:1105-1111.
Malek TR. The biology of interleukin-2. Annual Review of Immunology. 2008;26:453-479.
Rochman Y, Spolski R, Leonard WJ. New insights into the regulation of T cells by γc family cytokines. Nature Reviews Immunology. 2009;9:169-173.
Diferenciação das Células T CD4+ em Subtipos de Células Efetoras: TH1, TH2 e TH17
Amsen D, Spilanakis CG, Flavell RA. How are TH1 and TH2 cells made? Current Opinion in Immunology. 2009;21:153-160.
Annunziato F, Romagnani S. Heterogeneity of human effector CD4+ T cells. Arthritis Research and Therapy. 2009;11:257-264.
Bettelli E, Korn T, Oukka M, Kuchroo VK. Induction and effector functions of TH17 cells. Nature. 2008;453:1051-1057.
Dong C. TH17 cells in development: an updated view of their molecular identity and genetic programming. Nature Reviews Immunology. 2008;8:337-348.
Korn T, Bettelli E, Oukka M, Kuchroo VK. IL-17 and TH17 cells. Annual Review of Immunology. 2009;27:485-517.
Lee GR, Kim ST, Spilianakis CG, Fields PE, Flavell RA. T helper cell differentiation: regulation by cis elements and epigenetics. Immunity. 2006;24:369-379.
Locksley RM. Nine lives: plasticity among helper T cell subsets. Journal of Experimental Medicine. 2009;206:1643-1646.
McGeachy MJ, Cua DJ. Th17 cell differentiation: the long and winding road. Immunity. 2008;28:445-453.
Murphy KM, Reiner SL. The lineage decisions of helper T cells. Nature Reviews Immunology. 2002;2:933-944.
Murphy KM, Stockinger B. Effector T cell plasticity: flexibility in the face of changing circumstances. Nature Immunology. 2010;11:674-680.
Paul WE, Zhu J. How are TH2 responses initiated and amplified? Nature Reviews Immunology. 2010;10:225-235.
Placek K, Coffre M, Maiella S, Bianchi E, Rogge L. Genetic and epigenetic networks controlling T helper cell 1 differentiation. Immunology. 2009;127:155-162.
Steinman L. A brief history of TH17, the first major revision in the TH1/ TH2 hypothesis of T cell–mediated tissue damage. Nature Medicine. 2007;13:139-145.
Wilson CB, Rowell E, Sekimata M. Epigenetic control of T-helper cell differentiation. Nature Reviews Immunology. 2009;9:91-105.
Zhu J, Yamane H, Paul WE. Differentiation of effector CD4 T cell populations. Annual Review of Immunology. 2010;28:445-489.
Castellino F, Germain RN. Cooperation between CD4+ and CD8+ T cells: when, where, and how. Annual Review of Immunology. 2006;24:519-540.
Masopust D, Vezys V, Wherry EJ, Ahmed R. A brief history of CD8 T cells. European Journal of Immunology. 2007;37:S103-S110.
Prlic M, Williams MA, Bevan MJ. Requirements for CD8 T-cell priming, memory generation, and maintenance. Current Opinion in Immunology. 2007;19:315-319.
Gourley TS, Wherry EJ, Masopust D, Ahmed R. Generation and maintenance of immunological memory. Seminars in Immunology. 2004;16:323-333.
Sallusto F, Geginat J, Lanzavecchia A. Central memory and effector memory T cell subsets: function, generation, and maintenance. Annual Review of Immunology. 2004;22:745-763.
Sallusto F, Lanzavecchia A. Heterogeneity of CD4+ memory T cells: functional modules for tailored immunity. European Journal of Immunology. 2009;39:2076-2082.
Schluns KS, Lefrancois L. Cytokine control of memory T cell development and survival. Nature Reviews Immunology. 2003;3:269-279.