CAPÍTULO 12 Mecanismos Efetores da Imunidade Humoral
A imunidade humoral é mediada por anticorpos secretados e tem a função fisiológica de defender o organismo contra micro-organismos extracelulares e toxinas microbianas. Esse tipo de imunidade contrasta com a imunidade mediada por células, o outro braço efetor do sistema imune adaptativo, que é mediado por linfócitos T e que tem a função de erradicar micro-organismos que infectam e vivem dentro de células do hospedeiro (Cap. 10). A imunidade humoral contra toxinas microbianas foi descoberta por von Behring e Kitasato em 1890 como uma forma de imunidade que poderia ser transferida de indivíduos imunizados para indivíduos não imunes por meio da transferência do soro. Dentre os tipos de micro-organismos que são combatidos pela imunidade humoral estão bactérias, fungos e micro-organismos intracelulares obrigatórios, como os vírus, que são alvo de anticorpos antes de infectarem as células ou quando são liberados de células infectadas. Defeitos na produção de anticorpos resultam em aumento da suscetibilidade a infecções por vários micro-organismos, incluindo bactérias, fungos e vírus. As vacinas atualmente utilizadas induzem proteção, primariamente, pela estimulação da produção de anticorpos. Além de seus papéis essenciais como protetores, em indivíduos alérgicos e em certas doenças autoimunes, muitos anticorpos específicos podem ser prejudiciais e causar danos aos tecidos. Neste capítulo, discutiremos os mecanismos efetores que são usados por anticorpos para eliminar antígenos. A estrutura dos anticorpos é descrita no Capítulo 5 e os processos de produção de anticorpos, no Capítulo 11.
VISÃO GERAL DA IMUNIDADE HUMORAL
Antes de discutirmos os principais mecanismos pelos quais os anticorpos proporcionam proteção contra micro-organismos, resuminos algumas das características marcantes da defesa do hospedeiro mediada por anticorpos.
• As principais funções dos anticorpos são de neutralizar e eliminar micro-organismos infecciosos e toxinas microbianas (Fig. 12-1). Como veremos posteriormente, a eliminação de antígenos mediada por anticorpos envolve diversos mecanismos efetores e requer a participação de vários componentes do sistema imune celular e humoral, incluindo fagocitose e proteínas complemento.
• Anticorpos são produzidos por plasmócitos em órgãos linfoides e na medula óssea, mas os anticorpos desempenham suas funções efetoras em lugares distantes do seu local de produção. Os anticorpos produzidos nos gânglios linfáticos, baço e medula óssea podem entrar no sangue e, então, circular por todo o corpo. Anticorpos produzidos por tecidos linfoides associados a mucosas são transportados através de barreiras epiteliais para o interior da luz de órgãos mucosos, como intestino e vias aéreas, onde esses anticorpos secretados bloqueiam a entrada de micro-organismos ingeridos e inalados (Cap. 13). Os anticorpos também são transportados ativamente através da placenta para a circulação do feto em desenvolvimento. Na imunidade mediada por células, linfócitos T ativados são capazes de migrar para sítios periféricos de infecção e inflamação, mas não são transportados para secreções mucosas ou através da placenta.
• Os anticorpos que medeiam a imunidade protetora podem ser derivados de plasmócitos produtores de anticorpos de vida curta ou de vida longa que são gerados pela ativação de células B virgens (naïve) ou de memória. A primeira exposição a um antígeno, seja através de uma infecção ou por vacinação, leva à ativação de linfócitos B virgens e à sua diferenciação em plasmócitos secretores de anticorpos e células de memória (Cap. 11). A exposição subsequente ao mesmo antígeno leva à ativação de células B de memória e a uma resposta maior e mais rápida da produção de anticorpos. Os primeiros plasmócitos gerados no início de uma resposta imune ou na zona marginal ou células B B-1 tendem a ser de vida curta. Em contraste, os plasmócitos secretores de anticorpos derivados de centros germinativos, que já sofreram mudança de classe de anticorpo, migram para a medula óssea, onde permanecem e continuam a produzir anticorpos por anos, mesmo após a eliminação do antígeno. Muitas das imunoglobulinas G (IgG) encontradas no soro de indivíduos normais são derivadas desses plasmócitos de vida longa, que são induzidos pela exposição de células B, virgens ou de memória, há vários antígenos ao longo da vida de um indivíduo. Se um indivíduo imune for exposto a um micro-organismo previamente encontrado, a concentração de anticorpos circulantes produzidos pelos plasmócitos de vida longa proporciona proteção imediata contra a infecção. Ao mesmo tempo, a ativação de células B de memória gera maior explosão de anticorpos que promove uma segunda e mais efetiva onda de proteção.
• Muitas das funções efetoras dos anticorpos são mediadas por regiões constantes da cadeia pesada da molécula de Ig, e diferentes isotipos de cadeias pesadas de Ig atuam com funções efetoras distintas (Tabela 12-1). Por exemplo, algumas subclasses de IgG ligam-se a receptores Fc de fagócitos e promovem a fagocitose de partículas cobertas por anticorpos; IgM e algumas subclasses de IgG ativam o sistema complemento e IgE liga-se a receptores Fc de mastócitos e dispara sua ativação. Cada um desses mecanismos efetores será discutido posteriormente neste capítulo. O sistema imune humoral é especializado de tal forma que exposições a diferentes micro-organismos ou antígenos estimulam a mudança de classe de isotipos na célula B para aqueles que são mais adequados para combater esses micro-organismos. Os principais estímulos para a mudança de classe de isotipos durante o processo de ativação do linfócito B são as citocinas derivadas de células T auxiliares (helper) juntamente com o ligante de CD40 expresso por células T auxiliares ativadas (Cap. 11). Como foi discutido nos Capítulos 10 e 11, os isotipos de anticorpos estimulados por TH1 são induzidos por vírus e bactérias e particularmente efetivos na eliminação destes, e os anticorpos dependentes de TH2 são induzidos por parasitas helmintos, sendo especialmente eficazes contra os mesmos. A neutralização é a única função dos anticorpos que é inteiramente mediada pela ligação com o antígeno, não sendo necessária a participação das regiões constantes de Ig.
• Apesar de várias funções efetoras dos anticorpos serem mediadas por regiões constantes da cadeia pesada de Ig, todas essas funções são iniciadas pela ligação de antígenos às regiões variáveis do anticorpo. A ligação de anticorpos a antígenos multivalentes, como polissacarídeos ou epítopos repetitivos presentes na superfície de micro-organismos, faz com que as regiões Fc dos anticorpos fiquem próximas umas das outras, e este agrupamento de moléculas de anticorpo leva à ativação do complemento e possibilita que os anticorpos se liguem aos receptores Fc de fagócitos e os ative. A necessidade da ligação ao antígeno assegura que os anticorpos ativem vários mecanismos efetores apenas quando for necessário, ou seja, quando os anticorpos encontram e ligam-se específicamente a antígenos, não quando os anticorpos estão sob a forma circulante e livre de antígeno.
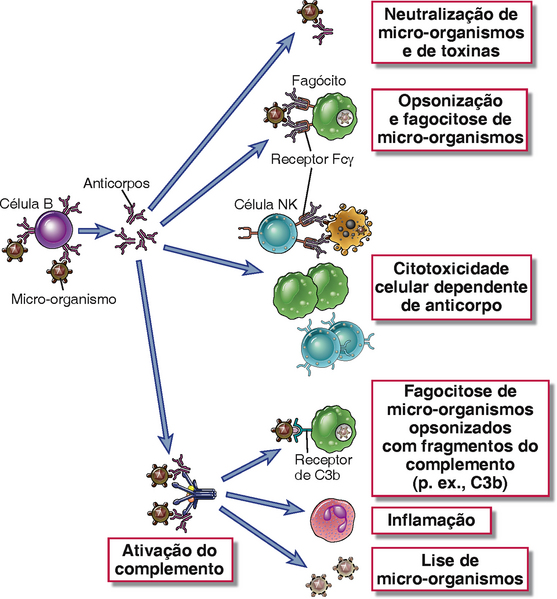
FIGURA 12-1 Funções efetoras dos anticorpos. Os anticorpos contra micro-organismos (e suas toxinas, não mostradas aqui) neutralizam esses agentes, fazem a opsonização dos mesmos para os fagócitos, sensibilizando-os para citotoxicidade celular dependente de anticorpo, e ativam o sistema complemento. Essas diversas funções efetoras podem ser mediadas por diferentes isotipos de anticorpos.
TABELA 12-1 Funções dos Isótipos de Anticorpos
| Isotipo de Anticorpo | Funções Efetoras Específicas do Isotipo |
|---|---|
| IgG | |
| IgM |
Ativação da via clássica do complemento Receptor de antígeno dos linfócitos B virgens (naïve)* |
| IgA | |
| IgE | Desgranulação de mastócitos (reações de hipersensibilidade imediata) |
| IgD | Receptor de antígeno dos linfócitos B virgens* |
* Essas funções são mediadas por anticorpos não secretados, ligados à membrana.
Com esta introdução à imunidade humoral, podemos avançar na discussão sobre as diversas funções dos anticorpos na defesa do hospedeiro.
NEUTRALIZAÇÃO DE MICRO-ORGANISMOS E DE TOXINAS MICROBIANAS
Anticorpos contra micro-organismos e toxinas microbinas bloqueiam a ligação desses micro-organismos e dessas toxinas a receptores celulares (Fig. 12-2). Dessa forma, os anticorpos inibem ou “neutralizam” a infectividade dos micro-organismos, bem como seu potencial de produzir efeitos danosos. Vários micro-organismos entram nas células do hospedeiro por meio da ligação de moléculas particulares de superfície microbiana a proteínas ou lipídios de membrana na superfície da célula hospedeira. Por exemplo, o vírus da influenza usa a hemaglutinina de seu envelope para infectar as células epiteliais respiratórias, e bactérias gram-negativas usam suas pilosidades para aderir e infectar uma variedade de células hospedeiras. Anticorpos capazes de se ligar a essas estruturas microbinas interferem na habilidade desses micro-organismos de interagir com os receptores celulares por meio de um bloqueio estérico e podem, assim, prevenir a infecção. Em alguns casos, algumas poucas moléculas de anticorpo podem se ligar a micro-organismos e induzir alterações conformacionais em moléculas de superfície que impedem que o micro-organismo interaja com receptores celulares; tais interações são exemplos do efeito alostérico dos anticorpos. Muitas toxinas microbianas também medeiam seus efeitos patológicos pela ligação a receptores celulares específicos. Por exemplo, a toxina tetânica liga-se a receptores da placa terminal motora das junções neuromusculares e inibe a transmissão neuromuscular, o que leva à paralisia; e a toxina difitérica liga-se a receptores celulares e adentra várias células, onde é capaz de inibir a síntese de proteínas. Os anticorpos contra tais toxinas bloqueiam estericamente as interações das toxinas com as células hospedeiras e, dessa forma, previnem o dano tissular e a doença.
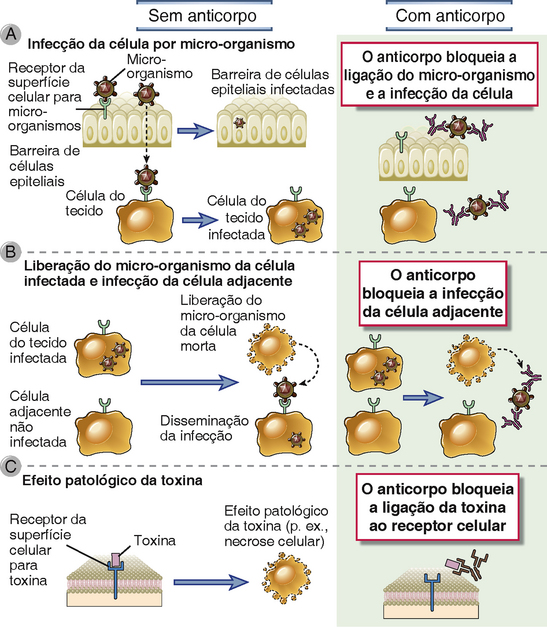
FIGURA 12-2 Neutralização de micro-organismos e de toxinas por anticorpos. A, Os anticorpos impedem a ligação de micro-organismos às células e, assim, bloqueiam a habilidade desses agentes de infectar as células do hospedeiro. B, Os anticorpos inibem a disseminação dos micro-organismos de uma célula infectada para outra célula adjacente não infectada. C, Os anticorpos bloqueiam a ligação de toxinas às células e, assim, inibem os efeitos patológicos dessas toxinas.
Para a neutralização de micro-organismos e toxinas mediada por anticorpos, são requeridas apenas as regiões do anticorpo ligadas ao antígeno. Dessa forma, tal neutralização pode ser mediada por anticorpos de qualquer classe isotípica presente na circulação e nas secreções mucosas e pode também, experimentalmente, ser mediada por fragmentos Fab ou F(ab’)2 de anticorpos específicos, os quais perderam as regiões Fc das cadeias pesadas. A maior parte dos anticorpos neutralizantes presentes no sangue é do isotipo IgG; nos órgãos mucosos, eles são, em sua maioria, do isotipo IgA. Os anticorpos neutralizantes mais eficazes são aqueles que possuem altas afinidades por seus antígenos. Anticorpos de alta afinidade são produzidos por processos de maturação de afinidade (Cap. 11). Muitas vacinas profiláticas funcionam por estimular a produção de anticorpos neutralizantes de alta afinidade (Tabela 12-2). Um dos mecanismos desenvolvidos pelos micro-organismos para se evadir da imunidade do hospedeiro é a mutação de genes que codificam os antígenoss de superfície que são alvo dos anticorpos neutralizantes (Cap. 15).
TABELA 12-2 Imunidade Humoral Induzida por Vacina
| Doença Infecciosa | Vacina | Mecanismo de Imunidade Protetora |
|---|---|---|
| Pólio | Poliovírus atenuado oral | Neutralização do vírus por anticorpos IgA de mucosa |
| Tétano, difteria | Toxoides | Neutralização da toxina por anticorpo IgG sistêmico |
| Hepatite A ou B | Proteínas recombinantes do envelope viral | Neutralização do vírus por anticorpo IgG sistêmico |
| Pneumonia pneumocócica, por Haemophilus | Vacinas conjugadas compostas de polissacarídeos da cápsula bacteriana ligados a uma proteína carreadora | Opsonização e fagocitose mediadas por anticorpos IgM e IgG, diretamente ou por meio da ativação do complemento |
Estão listados exemplos selecionados de vacinas que funcionam pela estimulação da imunidade humoral.
OPSONIZAÇÃO MEDIADA POR ANTICORPOS E FAGOCITOSE
Anticorpos do isotipo IgG cobrem (opsonizam) micro-organismos e promovem sua fagocitose pela ligação com receptores Fc em fagócitos. Fagócitos mononucleares e neutrófilos ingerem micro-organismos como um requisito para a morte e degradação intracelular. Esses fagócitos expressam uma variedade de receptores de superfície que se ligam diretamente aos micro-organismos e os ingerem, mesmo sem a presença de anticorpos, realizando, assim, um mecanismo de imunidade inata (Cap. 4). A eficiência desse processo é notadamente aumentada se o fagócito puder se ligar à partícula com alta afinidade. Os fagócitos mononucleares e os neutrófilos expressam receptores para as porções Fc de anticorpos IgG que ligam especificamente as partículas recobertas (opsonizadas) por anticorpos. Micro-organismos também podem ser opsonizados por um produto da ativação do complemento chamado C3b e são fagocitados pela ligação em receptores para C3b (descrito posteriormente neste capítulo) em leucócitos. O processo de cobertura de partículas para promover a fagocitose é chamado de opsonização, e as substâncias responsáveis por esta função, incluindo anticorpos e proteínas do complemento, são chamadas de opsoninas.
Receptores Fc de Leucócitos
Leucócitos expressam receptores Fc que se ligam às regiões constantes dos anticorpos e, desse modo, promovem a fagocitose de partículas cobertas de Ig e liberam sinais que estimulam as atividades microbicidas dos leucócitos e induzem a inflamação. Os receptores Fc de diferentes isotipos de cadeia pesada de Ig são expressos em diversas populações de leucócitos e apresentam funções variadas na imunidade. Desses receptores Fc, os mais importantes para a fagocitose de partículas opsonizadas são os receptores para a cadeia pesada de anticorpos IgG, denominados receptores Fcγ, os quais serão os receptores primariamente considerados neste capítulo. Os receptores Fc que se ligam à IgE serão discutidos no Capítulo 19. Já consideramos os receptores Fc neonatais (FcRn), que são expressos na placenta, em células do epitélio intestinal, e no endotélio vascular, no Capítulo 5. O receptor poli-Ig, que está envolvido na transcitose de IgA e de IgM, será discutido no Capítulo 13.
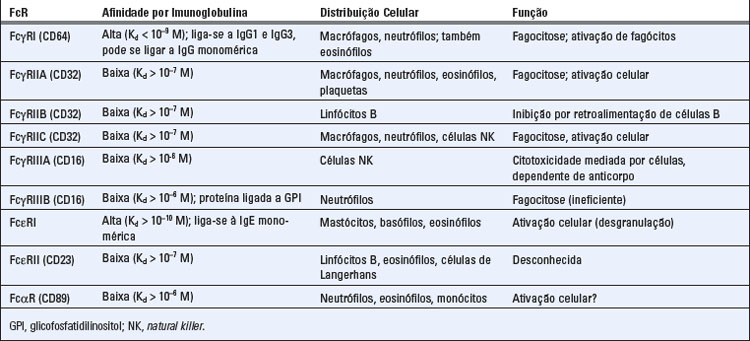
Existem vários receptores Fcγ diferentes que possuem diversas afinidades para as cadeias pesadas de várias subclasses de IgG e que são expressos em vários tipos celulares. A maior parte dos receptores Fc resulta em ativação celular quando estimulados, exceto o FcγRII, que é um receptor inibidor. Todos os receptores Fcγ contêm uma cadeia que se liga ao ligante chamada cadeia α, que reconhece seus ligantes de IgG. As diferenças de especificidade ou de afinidade de cada FcγR para os vários isotipos de IgG baseiam-se em diferenças na estrutura dessas cadeias α. Todos os receptores Fcγ são ativados de maneira ideal pela ligação do anticorpo com seu antígeno e não por anticorpos circulantes na forma livre. Em todos os FcRs, exceto FcRII, a cadeia α está associada a uma ou mais cadeias polipeptídicas adicionais envolvidas na transdução do sinal (Fig. 12-3). As funções de sinalização do FcγRII são mediadas pela cauda citoplasmática da cadeia α.
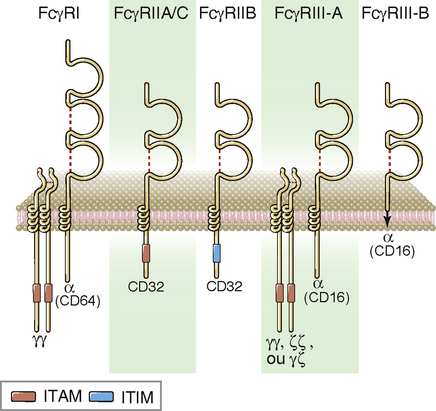
FIGURA 12-3 Composição da subunidade do receptores Fcγ. Modelos esquemáticos dos diferentes receptores Fc humanos ilustram as cadeias α ligantes de Fc e as subunidades sinalizantes. FcγRIII-B é uma proteína de membrana ancorada em glicofosfatidilinositol com funções desconhecidas de sinalização. FcγRII-A e II-C são receptores ativadores de baixa afinidade estruturalmente similares, com padrões de expressão ligeiramente diferentes.
Os receptores Fcγ foram classificados em três grupos com base em suas afinidades para as cadeias pesadas de diferentes subclasses de IgG (Tabela 12-3). Alguns desses receptores Fc possuem múltiplas isoformas que podem diferir em estrutura e função.
• FcγRI (CD64) é o principal receptor Fcγ de fagócitos. É expresso em macrófagos e neutrófilos e é um receptor de alta afinidade que se liga à IgG1 e à IgG3, com uma Kd de 10−8 a 10−9 M. (Em camundongos, FcγRI liga-se preferenciamente a anticorpos IgG2a e IgG2b). A grande região aminoterminal extracelular da cadeia α ligante de Fc dobra-se em três domínios tandem semelhantes à Ig. A cadeia α do FcγRI está associada a uma ponte dissulfeto homodimérica de uma proteína de sinalização chamada de cadeia γ do FcR. Essa cadeia γ também é encontrada nos complexos de sinalização associados a FcγRIII, FcαR e FcεRI. A cadeia γ tem apenas uma pequena terminação amino extracelular, mas uma grande terminação carboxílica citoplasmática, a qual é estruturalmente homóloga à cadeia ζ do complexo receptor de célula T (TCR). Da mesma forma que a cadeia ζ do TCR, a cadeia γ do FcR contém um imunorreceptor com motivo de ativação baseado em tirosina (ITAM) que se acopla a um grupo de receptores para ativar a proteína tirosina-cinase. O FcγRI, como receptor de alta afinidade para IgE (Cap. 19), está constantemente saturado com seus ligantes Ig. A ativação de receptores Fc exige que estes receptores estejam agrupados no plano da membrana; o agrupamento e a consequente ativação de receptores FcγRI são mediados por uma ligação cruzada de um antígeno multivalente às moléculas de IgG ligadas ao receptor.
A transcrição do gene FcγRI e sua expressão em macrófagos são estimuladas por interferon-γ (IFN-γ). Os isótipos de anticorpo que melhor se ligam aos receptores Fcγ (como IgG2a/2c em camundongos) também são produzidos, em parte, como resultado da troca de isotipo mediada por IFN-γ em células B. Além disso, IFN-γ estimula diretamente as atividades microbicidas dos fagócitos (Cap. 10).
• FcγRII (CD32) liga-se a subclasses de IgG humana (IgG1 e IgG3) com baixa afinidade (Kd 10−6 M). Em humanos, a duplicação gênica e a diversificação resultaram na geração de três formas, chamadas FcγRII A, B e C. Estas isoformas possuem domínios extracelulares e especificidade de ligantes similares, mas diferem na estrutura da cauda citoplasmática, distribuição celular e funções. O FcγRIIA é expresso por neutrófilos e fagócitos mononucleares e participa da fagocitose de partículas opsonizadas, ao passo que o FcγRIIC é expresso em fagócitos mononucleares, neutrófilos, e células NK. As caudas citoplasmáticas de FcγRIIA e de FcγRIIC contêm ITAM e, nos agrupados de partículas recobertas por IgG1 ou IgG3 ou células, podem liberar um sinal de ativação para os fagócitos. O FcγRIIB é um receptor inibidor expresso em todas as células do sistema imune, exceto células NK, e é o único receptor Fc em células B. Sua função é descrita posteriormente.
• FcγRIII (CD16) também é um receptor de baixa afinidade para IgG. A porção extracelular que se adere ao ligante do FcγRIII é similar à do FcγRII em estrutura, afinidade e especificidade para IgG. Esse receptor possui duas formas, cada uma codificada por um gene separado. A isoforma FcγRIIIA é uma proteína transmembrana expressa principalmente em células NK. O FcγRIIIA se associa a homodímeros de cadeias γ de FcR, homodímeros de cadeia ζ de TCR ou heterodímeros compostos de cadeia γ de FcR e cadeia ζ. Esta associação é necessária para a expressão na superfície celular e para a função desses FcRs, uma vez que os sinais de ativação intracelular nessas cadeias de sinalização são realizados através de ITAM. A isoforma FcγRIIIB é uma proteína ligada a glicofosfatidilinositol (GPI), expressa em neutrófilos; ela não medeia fagocitose ou dispara a ativação de neutrófilos, e sua função é muito pouco conhecida.
A maior parte dos FcR serve para ativar as células nas quais são expressos. O FcεRI é descrito no Capítulo 19, no contexto da ativação de mastócitos. A função do FcαR não está bem estabelecida.
Papel dos Receptores Fcγ na Fagocitose e na Ativação de Fagócitos
A fagocitose de partículas recobertas por IgG é mediada pela ligação das porções Fc de anticorpos opsonizantes a receptores Fcγ em fagócitos. Dessa forma, as subclasses de IgG que se ligam melhor a esses receptores (IgG1 e IgG3) são as opsoninas mais eficientes para promover a fagocitose. Como foi discutido anteriormente, o FcγRI (CD64) é um receptor Fcγ de alta afinidade presente em fagócitos e é o receptor mais importante para a fagocitose de partículas opsonizadas.
A ligação de receptores Fc em fagócitos a partículas multivalentes, cobertas de anticorpos, leva ao englobamento dessas partículas e à ativação de fagócitos (Fig. 12-4). As partículas são internalizadas em vesículas conhecidas como fagossomos, que se fundem com lisossomos, e, então, as partículas fagocitadas são destruídas dentro desses fagolisossomos. A ativação requer a ligação cruzada de FcR por várias moléculas de Ig adjacentes (p. ex., sobre micro-organismos cobertos por anticorpos ou sobre imunocomplexos). A ligação cruzada de cadeia α aderida ao ligante de um FcR resulta em eventos de transdução de sinal semelhantes aos que ocorrem após a ligação cruzada do receptor de antígeno nos linfócitos (Cap. 7). Entre esses eventos, estão incluídos: a fosforilação de tirosina dos ITAM mediada pela cinase Src na sinalização das cadeias de FcR; o recrutamento da família das cinases Syk para os ITAM mediado pelo domínio SH2; a ativação da cinase fosfatidilinositol-3; o recrutamento de moléculas adaptadoras, incluindo SLP-76 e BLNK; e o recrutamento de enzimas como as da família de cinases fosfolipase Cγ e Tec. Esses eventos levam à geração de trifosfato de inositol e de diaglicerol e sustentam a mobilização de cálcio. As respostas nos leucócitos a esses mediadores inclui a transcrição de genes codificadores de citocinas, mediadores inflamatórios, e enzimas microbicidas e a mobilização do citoesqueleto, o que leva a fagocitose, exocitose de grânulos e migração celular. Uma das consequências da ativação da fagocitose é a produção da enzima fagócito oxidase, a qual catalisa a produção intracelular de espécies reativas de oxigênio que são citotóxicas para os micro-organismos fagocitados. Esse processo é chamado de explosão respiratória. Outra consequência da ativação de FcγRI é a ativação de uma enzima chamada óxido nítrico sintase induzível (iNOS), que ativa a produção de óxido nítrico, o que também contribui para a morte de patógenos. Além disso, os leucócitos que são ativados por seus receptores Fc secretam enzimas hidrolíticas e intermediários reativos de oxigênio para o meio externo, capazes de matar micro-organismos extracelulares muito grandes para serem fagocitados. Os mesmos produtos tóxicos podem causar danos em tecidos; esse mecanismo de dano ao tecido mediado por anticorpos é importante nas doenças de hipersensibilidade (Cap. 18). Camundongos geneticamente deficientes da cadeia α ligadora de ligantes do FcγRI ou da cadeia γ de transdução de sinal do FcR são deficientes na defesa contra micro-organismos mediada por anticorpos e não desenvolvem algumas formas de dano ao tecido mediado por anticorpos IgG, demonstrando, assim, o papel essencial dos receptores Fc nesses processos.
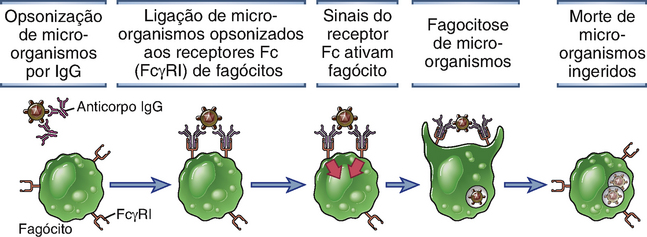
FIGURA 12-4 Opsonização mediada por anticorpos e fagocitose de micro-organismos. Anticorpos de certas subclasses de IgG ligam-se a micro-organismos e são, então, reconhecidos pelos receptores Fc de fagócitos. Sinais provenientes desses receptores Fc promovem a fagocitose de micro-organismos opsonizados e ativam os fagócitos para destruí-los. Os mecanismos microbicidas dos fagócitos estão descritos nos Capítulos 4 (Fig. 4-13) e 10 (Fig. 10-7).
Sinalização Inibidora pelo Receptor FcγRIIB
O receptor FcγRIIB é um receptor Fc inibidor que foi inicialmente descrito no contexto da sinalização inibidora de células B e no fenômeno de resposta de anticorpos (Cap. 11). O FcγRIIB é o único receptor Fc que possui um motivo ITIM em sua cauda citoplasmática. Quando os anticorpos são produzidos durante uma resposta imune, esses anticorpos se ligam a antígenos remanescentes e o complexo é simultaneamente reconhecido pelo receptor de antígeno e pelo FcγRIIB nas células B antígeno-específicas. A ligação cruzada do FcγRIIB inibidor mediada por imunocomplexos leva à fosforilação da tirosina do ITIM da cauda citoplasmática, ao recrutamento e à ativação de inositol fosfatase SHIP, e à inibição subsequente das vias de ativação dependentes de ITAM mediada pelo receptor da célula B. O FcγRIIB também é expresso em células dendríticas, neutrófilos, macrófagos e mastócitos e pode exercer um papel na regulação de respostas dessas células à ativação de receptores Fc e outros estímulos. De forma empírica, porém muitas vezes útil, o tratamento de muitas doenças autoimunes é a administração intravenosa de uma mistura de IgG humana (IVIG). A IVIG pode se ligar ao FcγRIIB para liberar sinais inibidores aos linfócitos B e outras células, reduzindo, dessa forma, a produção de anticorpos e amenizando a inflamação. Outro mecanismo pelo qual a IVIG pode melhorar a doença ocorre por meio da competição com autoanticorpos circulantes pelo receptor Fc neonatal, o que resulta na eliminação aumentada dos anticorpos (Cap. 5).
Citotoxicidade Mediada por Células Dependente de Anticorpos
Células assassinas naturais (natural killer - NK) e outros leucócitos ligam-se a células recobertas por anticorpos através dos receptores Fc e destroem essas células. Este processo é chamado de citotoxicidade celular dependente de anticorpo (ADCC) (Fig. 12-5). Foi primeiramente descrita como uma função das células NK, que usa seu receptor Fc, FcγRIIIA, para se ligar a células recobertas por anticorpos. O FcγRIIIA (CD16) é um receptor de baixa afinidade que se liga a aglomerados de moléculas de IgG dispostas sobre as superfícies celulares, mas não se liga à IgG monomérica circulante. Dessa forma, a ADCC ocorre apenas quando as células-alvo estão recobertas com moléculas de anticorpos e a IgG livre no plasma não ativa as células NK nem compete efetivamente com a IgG ligada à célula pela ligação com FcγRIII. A ligação do FcγRIII por células-alvo recobertas por anticorpos ativa as células NK a sintetizar e secretar citocinas como o IFN-γ, bem como a fazer a descarga do conteúdo de seus grânulos, os quais medeiam as funções de morte desse tipo celular (Cap. 4). A ADCC pode ser facilmente demonstrada in vitro, mas seu papel na defesa do hospedeiro contra micro-organismos não está completamente estabelecido. Este é provavelmente um importante mecanismo para a eliminação de células que estão recobertas por anticorpos monoclonais terapêuticos específicos, como as células B e células B derivadas de células tumorais que são alvo de anticorpos anti-CD20.
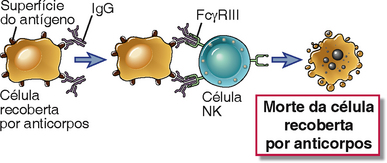
FIGURA 12-5 Citotoxicidade mediada por células dependente de anticorpos. Os anticorpos de certas subclasses de IgG ligam-se a células (p. ex., células infectadas), e as regiões do Fc dos anticorpos ligados são reconhecidas por um receptor Fcγ em células NK. As células NK são ativadas e matam as células recobertas por anticorpos. Presumivelmente, as células NK podem lisar até mesmo alvos que expressam moléculas de CHP de classe I quando essas células-alvo estão opsonizadas, uma vez que a estimulação mediada pelo receptor Fc pode superar as ações inibidoras de receptores inibidores da célula NK que reconhecem as moléculas de CHP de classe I (Cap. 12).
Eliminação de Helmintos Mediada por Anticorpos
Anticorpos, mastócitos e eosinófilos com anticorpos medeiam a expulsão e morte de alguns parasitas helmínticos. Os helmintos (vermes) podem também ser engolidos por fagócitos, e seus tegumentos são relativamente resistentes a produtos microbicidas de neutrófilos e macrófagos. Eles podem, no entanto, ser mortos por uma proteína catiônica tóxica, conhecida como a proteína básica principal, presente em grânulos de eosinófilos. Anticorpos IgE, IgG e IgA que cobrem os helmintos podem se ligar a receptores Fc em eosinófilos e causar a desgranulação dessas células, liberando a proteína básica e outros conteúdos dos grânulos dos eosinófilos que matam o parasita. O receptor Fcε de alta afinidade dos eosinófilos (FcεRI) não possui sinalização de cadeia β e pode apenas emitir sinais relativamente fracos por meio da associação da cadeia γ. Além disso, os anticorpos IgE que reconhecem antígenos de superfície de helmintos podem iniciar a desgranulação de mastócitos locais através do receptor IgE de alta afinidade (Cap. 19). Os mediadores dos mastócitos podem induzir broncoconstrição e motilidade localmente aumentada, contribuindo para a expulsão dos vermes de locais como as vias aéreas e a luz do trato gastrointestinal. As quimiocinas e citocinas liberadas por mastócitos ativados podem atrair eosinófilos e também provocar sua desgranulação.
O SISTEMA COMPLEMENTO
O sistema complemento é um dos principais mecanismos efetores da imunidade humoral e também é um importante mecanismo efetor da imunidade inata. Discutimos sucintamente o papel do complemento na imunidade inata no Capítulo 4. Descrevemos agora a ativação e regulação do complemento com mais detalhes.
O nome “complemento” é derivado de pequenos experimentos realizados por Jules Bordet pouco depois da descoberta dos anticorpos. Ele demonstrou que ao se adicionar soro fresco contendo um anticorpo antibacteriano a bactérias à temperatura ambiente (37oC), a bactéria é lisada. Se, no entanto, o soro for aquecido a 56oC ou mais, ele perde sua capacidade lítica. Esta perda da capacidade lítica não se deve ao decaimento da atividade dos anticorpos, uma vez que os anticorpos são relativamente termoestáveis e, ainda assim, o soro aquecido é capaz de aglutinar bactérias. Bordet concluiu que o soro deve conter outro componente termolábil que auxilia, ou complementa, a função lítica dos anticorpos, e a esse componente foi dado, posteriormente, o nome de complemento.
O sistema complemento consiste em proteínas séricas e de superfície celular que interagem umas com as outras e com outras moléculas do sistema imune de uma maneira altamente regulada para gerar produtos que têm a função de eliminar micro-organismos. As proteínas complemento são proteínas plasmáticas que, normalmente, se encontram inativas; somente são ativadas sob condições particulares para gerar produtos que medeiam diversas funções efetoras do complemento. Várias características da ativação do complemento são essenciais para sua função normal.
• O sistema complemento é ativado por micro-organismos e por anticorpos que estão ligados a micro-organismos e outros antígenos. O mecanismo de ativação inicial será descrito posteriormente.
• A ativação do complemento envolve a proteólise sequencial de proteínas para gerar complexos enzimáticos com atividade proteolítica. As proteínas que adquirem atividade enzimática proteolítica pela ação de outras proteases são chamadas zimógenos. O processo de ativação zimogênica sequencial, uma característica que define a cascata de enzimas proteolíticas, também é característico dos sistemas da coagulação e das cininas. As cascatas proteolíticas possibilitam enormes amplificações porque cada molécula enzimática ativada em uma etapa pode gerar múltiplas moléculas de enzimas ativadas em uma etapa seguinte.
• Os produtos da ativação do complemento tornam-se covalentemente ligados às superfícies celulares dos micro-organismos ou aos anticorpos ligados a micro-organismos e a outros antígenos. Na fase líquida, proteínas complemento se encontram inativas ou transitoriamente ativas (por segundos), e elas se tornam ativadas de maneira estável após sua ligação a micro-organismos ou a anticorpos. Muitos dos produtos de clivagem biologicamente ativos das proteínas do complemento também se ligam covalentemente a micro-organismos, anticorpos e tecidos nos quais o complemento é ativado. Essas características asseguram que a total ativação e, portanto, as funções biológicas do sistema complemento sejam limitadas às superfícies celulares microbianas ou aos locais de ligação de anticorpos aos antígenos e não ocorram no sangue.
• A ativação do complemento é inibida por proteínas reguladoras presentes nas células normais do hospedeiro e ausentes nos micro-organismos. As proteínas reguladoras são uma adaptação de células normais que minimizam danos causados pelo complemento às células do hospedeiro. Os micro-organismos não possuem essas proteínas reguladoras, o que possibilita a ativação do complemento sobre as superfícies dos micro-organismos.
Vias de Ativação do Complemento
Existem três vias principais de ativação do complemento: a via clássica, que é ativada por certos isotipos de anticorpos ligados aos antígenos; a via alternativa, que é ativada sobre as superfícies das células microbianas, na ausência de anticorpos; e a via das lectinas, que é ativada por uma lectina plasmática, que se liga aos resíduos de manose presentes nas superfícies celulares microbianas (Fig. 12-6). O nome clássica surgiu porque esta foi a primeira via de ativação do complemento a ser descoberta e caracterizada, e o nome alternativa deve-se ao fato de esta via ser filogeneticamente mais antiga. Embora as vias de ativação do complemento difiram da maneira como são iniciadas, todas resultam na geração de complexas enzimas que podem clivar a maioria das proteínas do complemento, C3. As vias das lectinas e alternativa são mecanismos efetores da imunidade inata, ao passo que a via clássica é o principal mecanismo da imunidade humoral adaptativa.
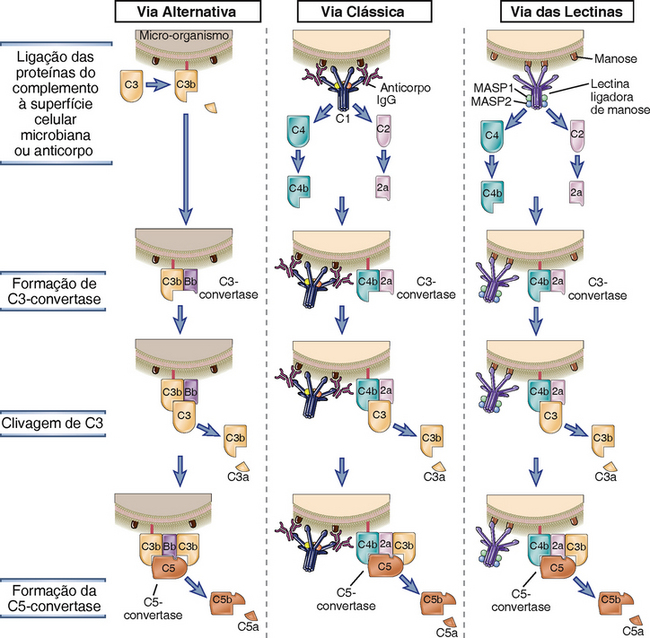
FIGURA 12-6 As primeiras etapas de ativação do complemento pelas vias alternativa, clássica e das lectinas. A via alternativa é ativada pela ligação de C3b a várias superfícies ativadoras, como a parede celular dos micro-organismos; a via clássica é iniciada pela ligação de C1 a complexos antígeno-anticorpo; e a via das lectinas é ativada pela ligação de uma lectina plasmática a micro-organismos. O C3b que é produzido pela ação da C3-convertase liga-se à superfície da célula microbiana ou a anticorpos e se torna um componente da enzima que cliva C5 (C5-convertase) e inicia as etapas finais da ativação do complemento. As etapas finais das três vias são as mesmas (não mostradas aqui) e o complemento ativado pelas três vias possui as mesmas funções.
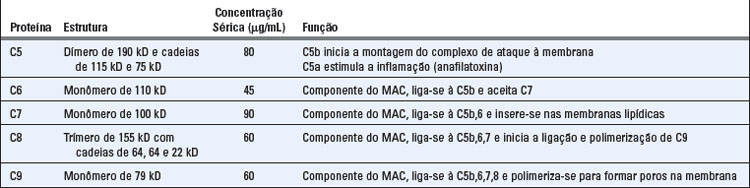
O evento central na ativação do complemento é a proteólise da proteína do complemento C3 para gerar produtos biologicamente ativos e a subsequente ligação covalente de um produto de C3, denominado C3b, às superfícies celulares microbianas ou ao anticorpo ligado ao antígeno (Fig. 12-6). A ativação do complemento depende da geração de dois complexos proteolíticos: a C3-convertase, que cliva C3 em dois fragmentos proteolíticos denominados C3a e C3b; e a C5-convertase, que cliva C5 em C5a e C5b. Por convenção, os produtos proteolíticos de cada proteína do complemento são identificados por sufixos em letras minúsculas, sendo a referente ao menor produto, e b, ao maior produto. C3b torna-se covalentemente aderido à superfície celular microbiana ou às moléculas de anticorpos no local da ativação do complemento. Todas as funções biológicas do complemento são dependentes da clivagem proteolítica de C3. Por exemplo, a ativação do complemento promove a fagocitose porque os fagócitos (neutrófilos e macrófagos) expressam receptores para C3b. Os peptídeos produzidos pela proteólise de C3 (e de outras proteínas do complemento) estimulam a inflamação. A C5-convertase se forma após a geração prévia de C3b, e essa convertase contribui tanto para a inflamação (pela geração do fragmento C5a) quanto para a formação de poros na membrana de alvos microbianos. As vias de ativação do complemento diferem no modo como são produzidas, mas seguem uma sequência comum de reações após a clivagem de C5.
Com esse conhecimento, passamos às descrições mais detalhadas das vias alternativa, clássica e das lectinas.
Via Alternativa
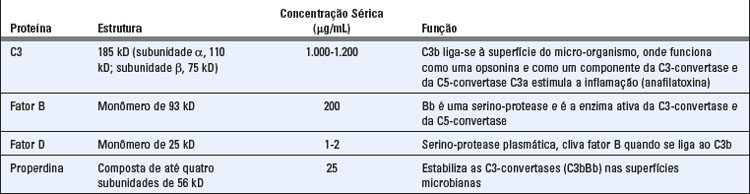
A via alternativa de ativação do complemento resulta na proteólise de C3 e na ligação estável de seu produto de clivagem C3b a superfícies microbianas, sem a participação de anticorpos (Fig. 12-7 e Tabela 12-4). A proteína C3 contém uma ligação tioéster reativa que se encontra escondida em uma região da proteína conhecida como domínio tioéster. Quando C3 é clivado, a molécula C3b sofre uma alteração conformacional extrema e o domínio tioéster se move (um grande desvio de 85 Å), expondo a ligação tioéster reativa previamente escondida. Normalmente, o C3 plasmático é continuamente clivado em taxas baixas para gerar C3b em um processo que é conhecido como hidrólise espontânea de C3. Uma pequena quantidade de C3b pode se ligar covalentemente a superfícies celulares, inclusive de micro-organismos, através do domínio tioéster, que reage com os grupos amino ou hidroxila das proteínas da superfície celular ou polissacarídeos para formar ligações amida ou éster (Fig. 12-8). Se não houver formação dessas ligações, o C3b permanece na fase fluida e a ligação tioéster reativa e agora exposta é rapidamente hidrolisada, tornando a proteína inativa. Como resultado, a ativação do complemento não pode prosseguir.
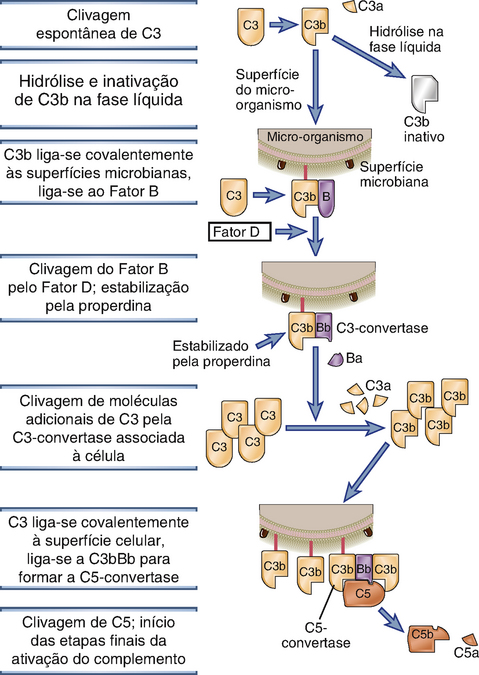
FIGURA 12-7 Via alternativa de ativação do complemento. C3 solúvel no plasma sofre lenta hidrólise espontânea de sua ligação tioéster interna, o que leva à formação da C3-convertase da fase líquida (não mostrada) e à geração de C3b. Se o C3b for depositado sobre a superfície de micro-organismos, ele se liga ao fator B e forma a C3-convertase da via alternativa. Esta convertase cliva C3 para produzir mais C3b, o qual se liga à superfície microbiana e participa da formação da C5-convertase. A C5-convertase cliva C5 para gerar C5b, iniciando os eventos das etapas finais da ativação do complemento.
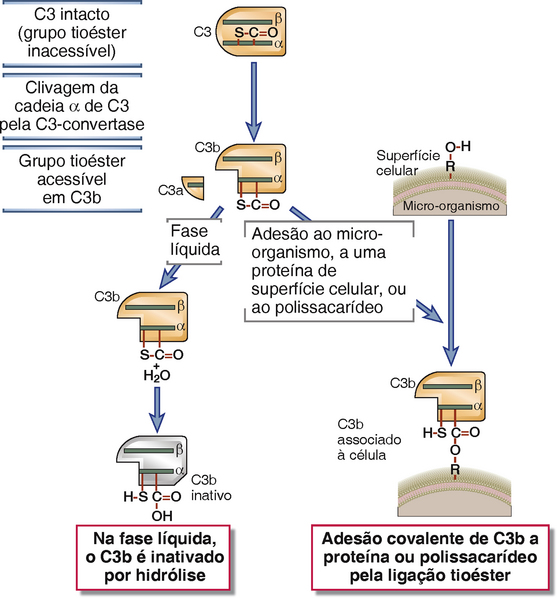
FIGURA 12-8 Ligação tioéster interna das moléculas de C3. A figura mostra uma visão esquemática dos grupos tioéster internos em C3 e seu papel na formação de ligações covalentes com outras moléculas. A clivagem proteolítica da cadeia α de C3 converte essa molécula em uma forma metaestável, na qual as ligações tioéster são expostas e suscetíveis a ataque nucleofílico por átomos de oxigênio (como ilustrado) ou de nitrogênio. O resultado é a formação de ligações covalentes com proteínas ou carboidratos das superfícies celulares. C4 é estruturalmente homólogo a C3 e possui um grupo toéster idêntico.
Quando o C3b sofre a alteração conformacional pós-clivagem, também ocorre a exposição de um sítio de ligação para uma proteína plasmática denominada fator B. O fator B, então, liga-se à proteína C3b que se encontra covalentemente aderida à superfície de um micro-organismo ou de uma célula hospedeira. O fator B ligado é, por sua vez, clivado por uma serinoprotease plasmática chamada fator D, liberando um pequeno fragmento denominado Ba e gerando um fragmento maior denominado Bb, que permanece ligado ao C3b. O complexo C3bBb é a C3-convertase da via alternativa e tem como função clivar mais moléculas de C3, produzindo uma sequência de amplificação. Mesmo quando o C3b é gerado pelas vias clássica ou das lectinas, ele pode formar um complexo com Bb e esse complexo é capaz de clivar mais C3. Logo, a C3-convertase da via alternativa funciona para amplificar a ativação do complemento quando ela é iniciada pela via alternativa ou pelas vias clássica ou das lectinas. Quando C3 é clivado, o C3b permanece aderido às células e o C3a é liberado. Esse fragmento solúvel possui diversas atividades biológicas que serão discutidas posteriormente.
A via alternativa de ativação ocorre espontaneamente sobre as superfícies celulares microbianas e não sobre as células de mamíferos. Se o complexo C3bBb se formar sobre células de mamíferos, ele é rapidamente degradado e a reação é finalizada pela ação de várias proteínas reguladoras presentes nessas células (discutida posteriormente). A falta de proteínas reguladoras sobre as células microbianas permite a adesão e ativação da C3-convertase da via alternativa. Além disso, outra proteína da via alternativa, denominada properdina, pode se ligar e estabilizar o complexo C3bBb, e a ligação da properdina é favorecida nos micro-organismos, em oposição às células do hospedeiro. A properdina é o único regulador positivo conhecido.
Algumas das moléculas de C3b geradas pela C3-convertase da via alternativa ligam-se à própria convertase. Isso resulta na formação de um complexo que contém uma metade Bb e duas moléculas de C3b, que funciona como a C5-convertase da via alternativa, a qual cliva C5 e inicia a etapa posterior da ativação do complemento.
Via Clássica
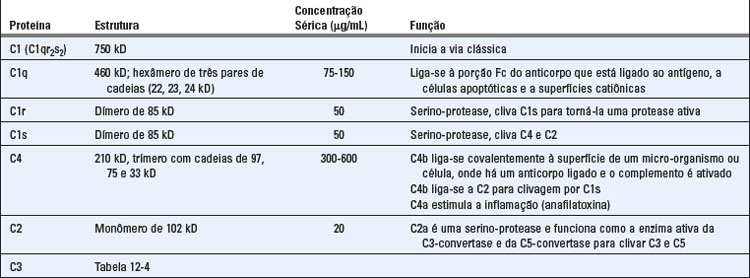
A via clássica é iniciada pela ligação da proteína C1 do complemento aos domínios CH2 de IgG ou aos domínios CH3 das moléculas de IgM que possuem antígenos ligados (Fig. 12-9 e Tabela 12-5). Dentre os anticorpos IgG, a IgG3 e a IgG1 (em humanos) são ativadoras mais eficientes do complemento em comparação às outras subclasses. C1 é um complexo proteico grande e multimérico, composto das subunidades C1q, C1r e C1s. C1q se liga ao anticorpo, e C1r e C1s são proteases. A subunidade C1q é composta de seis cadeias dispostas em formato radial similar ao de um guarda-chuva, sendo que cada cadeia possui uma cabeça globular conectada à haste central por um braço semelhante a colágeno. Esse hexâmero realiza a função de reconhecimento da molécula e se liga especificamente às regiões Fc das cadeias pesadas μ e de algumas cadeias pesadas γ (Fig. 12-10). Cada região Fc da imunoglobulina possui um único sítio de ligação para C1q, e cada molécula de C1q deve se ligar a, no mínimo, duas cadeias pesadas de Ig para ser ativada. Essa necessidade explica porque apenas anticorpos ligados a antígenos podem iniciar a via clássica de ativação e nunca anticorpos livres circulantes (Fig. 12-11). Uma vez que cada molécula de IgG possui apenas uma região Fc, é preciso reunir múltiplas moléculas de IgG antes que o C1q possa se ligar, e múltiplos anticorpos IgG reúnem-se apenas quando se ligam a antígenos multivalentes. Ainda que livre (circulante), a IgM é pentamérica e não se liga ao C1q porque as regiões Fc da IgM livre se encontram em uma configuração plana que é inacessível a C1q. A ligação da IgM ao antígeno induz uma alteração conformacional para um formato de “grampo” que expõe os sítios de ligação a C1q nas regiões Fc e permite que o C1q seja ligado. Devido à sua estrutura pentamérica, uma única molécula de IgM pode se ligar a duas moléculas de C1q, e essa é uma das razões pelas quais a IgM é um anticorpo ligante de complemento mais eficiente (também chamado de fixador do complemento) que a IgG.
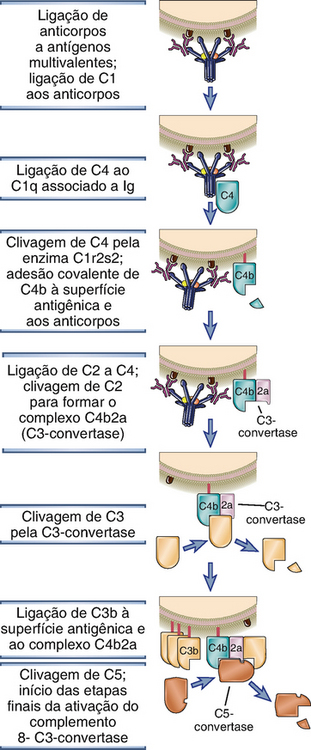
FIGURA 12-9 Via clássica de ativação do complemento. Os complexos antígeno-anticorpo que ativam a via clássica podem estar solúveis, fixados sobre uma superfície celular (como mostrado) ou depositados na matriz extracelular. A via clássica é iniciada pela ligação de C1 à molécula de anticorpo complexada ao antígeno, o que leva à produção de C3-convertase e C5-convertase aderidas às superfícies onde o anticorpo foi depositado. A C5-convertase cliva C5 para iniciar as etapas finais da ativação do complemento.
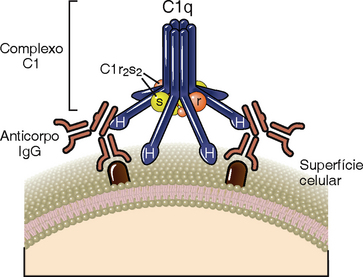
FIGURA 12-10 Estrutura de C1. C1 consiste em seis subunidades idênticas arranjadas para formar um núcleo central e projeta, simetricamente, braços radiais. As cabeças globulares ao final de cada braço, indicadas como C, são as regiões de contato com a imunoglobulina. C1r e C1s formam um tetrâmero, composto de duas moléculas C1r e duas C1s. As terminações de C1r e de C1s contêm os domínios catalíticos dessas proteínas. Um tetrâmero C1r2s2 enrola-se em volta dos braços radiais do complexo C1q de uma forma que os domínios catalíticos de C1r e de C1r ficam justapostos.
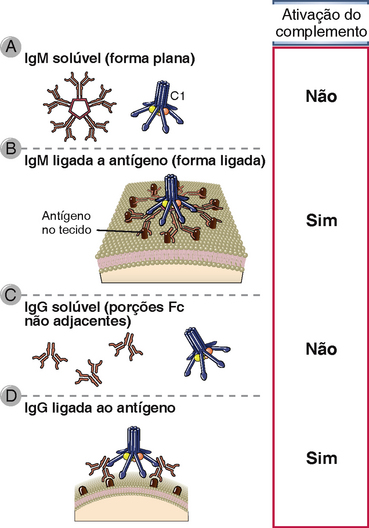
FIGURA 12-11 Ligação de C1 às porções Fc de IgM e de IgG. C1 deve se ligar a duas ou mais porções Fc para iniciar a cascata do complemento. As porções Fc da IgM pentamérica não estão acessíveis a C1 (A). Após a IgM se ligar aos antígenos aderidos a uma superfície, ela sofre uma mudança conformacional que permite a ligação e ativação de C1 (B). As moléculas solúveis de IgG também não irão ativar C1 porque cada IgG possui apenas uma região Fc (C), mas após se ligarem aos antígenos aderidos a uma superfície, as porções Fc de IgG adjacentes podem se ligar a C1 e ativá-lo (D).
C1r e C1s são serino-proteases que formam um tetrâmero contendo duas moléculas de cada proteína. A ligação de duas ou mais cabeças globulares de C1q às regiões Fc de IgG ou de IgM leva à ativação enzimática do C1r associado, o qual cliva e ativa C1s (Fig. 12-9). C1s ativado cliva a proteína seguinte da cascata, C4, para gerar C4b (C4a, o fragmento menor, é liberado e possui atividades biológicas que serão descritas posteriormente). C4 é homólogo a C3, e C4b contém uma ligação tioéster, de maneira similar à encontrada em C3b, que forma ligações covalentes do tipo amida ou éster com o complexo antígeno-anticorpo ou com a superfície adjacente de uma célula que se encontra ligada a um anticorpo. Essa adesão do C4b assegura que a via clássica de ativação prossiga sobre uma superfície celular ou um imunocomplexo. A proteína do complemento seguinte, C2, forma, então, um complexo com o C4b aderido à superfície celular e é clivada por uma molécula C1s próxima para gerar um fragmento C2b solúvel de importância desconhecida e um fragmento maior, C2a, que permanece fisicamente associado ao C4b na superfície celular. (Observe que a nomenclatura dos fragmentos de C2 que é agora aceita é diferente das outras proteínas porque o fragmento aderido é denominado a e o liberado é o fragmento b. Para o C2, o fragmento a é maior.) O complexo resultante C4b2a é a C3-convertase da via clássica; ela possui a habilidade de se ligar ao C3 e clivá-lo proteoliticamente. A ligação desse complexo enzimático ao C3 é mediada pelo componente C4b, e a proteólise é catalisada pelo componente C2a. A clivagem de C3 resulta na remoção do fragmento menor, C3a, e C3b pode formar ligações covalentes com as superfícies celulares ou, onde a ativação do complemento já foi iniciada, com um anticorpo. Uma vez depositado, o C3b pode se ligar ao fator B e gerar mais C3-convertase pela via alternativa, como discutido anteriormente. O efeito em cascata dos múltiplos passos enzimáticos e sua amplificação faz com que uma única molécula de C3-convertase leve à deposição de centenas ou milhares de moléculas de C3b sobre a superfície da célula onde ocorre a ativação do complemento. As etapas iniciais principais das vias alternativa e clássica são análogas: C3 na via alternativa é homólogo a C4 na via clássica, e o fator B é homólogo a C2.
Algumas moléculas de C3b geradas pela C3-convertase da via clássica ligam-se à própria convertase (como na via alternativa) para formar o complexo C4b2a3b. Esse complexo funciona como a C5-convertase da via clássica: cliva C5 e inicia as etapas finais da ativação do complemento.
Nas infecções por pneumococos ocorre uma forma variante da via clássica, pouco comum, independente de anticorpo, e que é ativada por carboidratos que se ligam a lectinas sobre a superfície celular. Os macrófagos da zona marginal esplênica expressam uma lectina do tipo C em sua superfície celular, denominada SIGN-R1, que pode reconhecer o polissacarídeo do pneumococo e também pode se ligar ao C1q. Ligações multivalentes de uma bactéria inteira ou de um polissacarídeo ao SIGN-R1 ativam a via clássica e permitem que o pneumococo seja eventualmente recoberto por C3b. Esse é um exemplo de uma lectina de superfície celular que medeia a ativação da via clássica mas sem necessidade de anticorpo.
Via das Lectinas
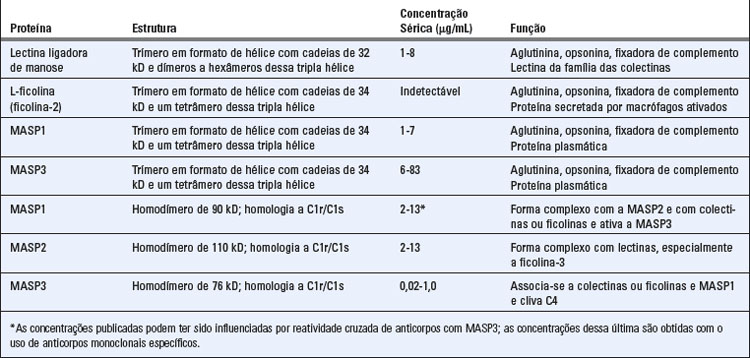
A via das lectinas de ativação do complemento ocorre na ausência de anticorpos por meio da ligação de polissacarídeos microbianos às lectinas circulantes, como a lectina ligadora de manose (ou manana) plasmática (MBL), ou às ficolinas (Tabela 12-6). Essas lectinas solúveis são proteínas similares ao colágeno e que lembram estruturalmente o C1q (Fig. 4-10, Cap. 4). A MBL, a L-ficolina e a H-ficolina são proteínas plasmáticas; a M-ficolina é secretada principalmente por macrófagos ativados nos tecidos. A MBL é um membro da família das colectinas e possui um domínio similar ao colágeno N-terminal e um domínio C-terminal que reconhece carboidrato. As ficolinas têm uma estrutura similar, com um domínio similar ao colágeno N-terminal e um domínio similar ao fibrinogênio C-terminal. Os domínios similares ao colágeno auxiliam na montagem das estruturas básicas de tripla hélice que podem formar oligômeros de ordem superior. A MBL liga-se aos resíduos de manose nos polissacarídeos; os domínios similares ao fibrinogênio das ficolinas ligam-se às N-acetilglicosaminas ricas em glicanos. A MBL e as ficolinas se associam às serino-proteases associadas a MBL (MASP), incluindo MASP1, MASP2 e MASP3 (Tabela 12-6). As proteínas MASP são estruturalmente homólogas às proteínas C1r e C1s e possuem uma função semelhante, a saber, a clivagem de C4 e de C2 para ativar a via do complemento. Oligômeros de ordem superior de MBL associam-se a MASP1 e MASP2, embora complexos MASP3/MASP2 possam ser encontrados. MASP1 (ou MASP3) pode formar um complexo tetramérico com MASP2 semelhante àquele formado por C1r e C1s, e é a MASP2 que cliva C4 e C2. Os eventos subsequentes dessa via são idênticos aos que ocorrem na via clássica.
Etapas Finais da Ativação do Complemento
As C5-convertases geradas pelas vias alternativa, clássica ou das lectinas iniciam a ativação dos componentes finais do sistema complemento, que culmina na formação do complexo de ataque à membrana (MAC) com atividade lítica (Tabela 12-7 e Fig. 12-12). As C5-convertases clivam C5 em um fragmento menor, C5a, que é liberado, e em um fragmento de duas cadeias, C5b, que permanece ligado às proteínas do complemento depositadas sobre a superfície celular. C5a possui potentes efeitos biológicos sobre diversas células e isso será discutido posteriormente neste capítulo. Os componentes remanescentes da cascata do complemento, C6, C7, C8 e C9, são proteínas estruturalmente relacionadas e sem atividade enzimática. O C5b mantém, transitoriamente, uma conformação capaz de se ligar às proteínas seguintes da cascata, C6 e C7. O componente C7 do complexo resultante C5b, 6, 7 é hidrofóbico e é inserido na bicamada lipídica das membranas celulares, onde se transforma em um receptor de alta afinidade para a molécula C8. A proteína C8 é um trímero composto de três cadeias distintas, uma das quais se liga ao complexo C5b, 6, 7 e forma um heterodímero covalente com a segunda cadeia; a terceira cadeia é inserida na bicamada lipídica da membrana. Esse complexo C5b, 6, 7, 8 (C5b-8) inserido de maneira estável possui uma habilidade limitada para lisar células. A formação do MAC completamente ativo é acompanhada pela ligação de C9, o componente final das cascatas do complemento, ao complexo C5b-8. C9 é uma proteína sérica que se polimeriza no local da ligação ao C5b-8 para formar poros nas membranas plasmáticas. Esses poros possuem cerca de 100 Å de diâmetro e formam canais que possibilitam a livre movimentação de água e íons. A entrada de água resulta no aumento de volume osmótico e na ruptura das células em cujas superfícies houve deposição de MAC. Os poros formados por C9 polimerizado são similares aos poros de membrana formados por perforina, a proteína granular citolítica encontrada nos linfócitos T citotóxicos e nas células NK (Cap. 10), e o C9 é estruturalmente homólogo à perforina.
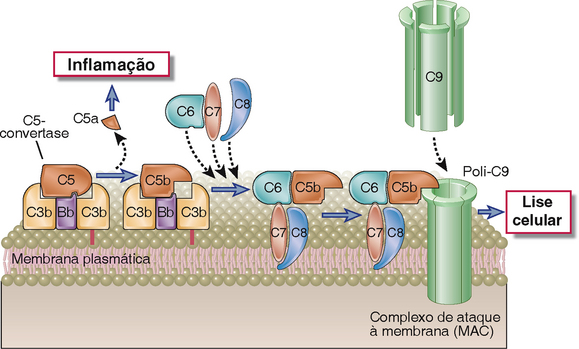
FIGURA 12-12 Etapas finais da ativação do complemento e formação do MAC. Ilustração esquemática dos eventos que ocorrem na superfície celular e levam à formação do MAC. A C5-convertase associada à célula cliva C5 e gera C5b, o qual se liga à convertase. C6 e C7 ligam-se sequencialmente, e o complexo C5b, 6, 7 é inserido diretamente na bicamada lipídica da membrana plasmática, seguido pela inserção estável de C8. Até 15 moléculas de C9 podem, então, polimerizar-se ao redor do complexo para formar o MAC, o qual cria poros na membrana e induz a lise celular. O C5a liberado na proteólise de C5 estimula a inflamação.
Receptores para Proteínas do Complemento
Muitas das atividades biológicas do sistema complemento são mediadas pela ligação dos fragmentos dos componentes do complemento aos receptores de membranas expressos em diferentes tipos celulares. Os mais bem caracterizados dentre esses receptores são específicos para os fragmentos C3 e serão descritos adiante (Tabela 12-8). Outros receptores incluem aqueles para C3a, C4a e C5a, os quais estimulam a inflamação, e alguns que regulam a ativação do complemento.
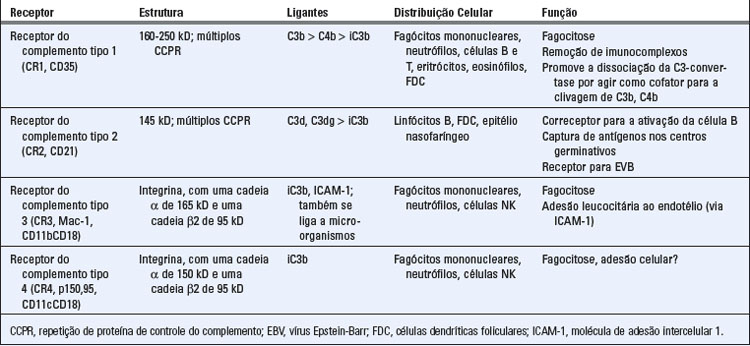
• O receptor do complemento tipo 1 (CR1 ou CD35) funciona principalmente para promover a fagocitose de partículas recobertas por C3b e C4b e para eliminar os imunocomplexos da circulação. O CR1 é um receptor de alta afinidade para C3b e C4b. É expresso principalmente nas células derivadas da medula óssea, incluindo eritrócitos, neutrófilos, monócitos, macrófagos, eosinófilos e linfócitos T e B; também é encontrado nas células dendríticas foliculares dos folículos dos órgãos linfoides periféricos. Os fagócitos utilizam esse receptor para se ligar e internalizar partículas opsonizadas com C3b ou C4b. A ligação das partículas recobertas de C3b ou de C4b ao CR1 também faz transdução de sinais que ativa mecanismos microbicidas dos fagócitos, especialmente quando o receptor Fcγ estiver simultaneamente ocupado por partículas recobertas de anticorpos. O CR1 sobre os eritrócitos liga-se aos imunocomplexos aderidos a C3b e C4b e os transporta para o fígado e para o baço. Nesses locais, os imunocomplexos são removidos da superfície dos eritrócitos pelos fagócitos e os eritrócitos continuam a circular. O CR1 também é um regulador da ativação do complemento (ver próxima seção).
• O receptor do complemento tipo 2 (CR2 ou CD2) funciona principalmente para estimular as respostas imunes humorais por meio do aumento da ativação da célula B pelo antígeno e pela promoção da captura dos complexos antígeno-anticorpo nos centros germinativos. O CR2 está presente em linfócitos B, em células dendríticas foliculares e em algumas células epiteliais. Liga-se, especificamente, aos produtos de clivagem de C3b, chamados C3d, C3dg e iC3b (i refere-se a inativado), que são gerados por proteólise mediada pelo fator I (discutida posteriormente). Nas células B, o CR2 é expresso como parte de um complexo trimolecular que inclui duas outras proteínas ligadas não covalentemente, denominadas CD19 e alvo do anticorpo antiproliferativo 1 (TAPA-1 ou CD81). Esse complexo produz sinais direcionados à célula B, aumentando sua resposta a antígenos (Fig. 7-20, Cap. 7). Nas células dendríticas foliculares, o CR2 serve para capturar complexos antígeno-anticorpo recobertos por iC3b e C3dg nos centros germinativos. As funções do complemento na ativação das células B serão discutidas posteriormente.
Em humanos, o CR2 é o receptor de superfície celular para o vírus Epstein-Barr, um herpesvírus que causa a mononucleose infecciosa e também é relacionado a diversos tumores malignos. O vírus Epstein-Barr infecta as células B e pode permanecer latente nessas células por toda a vida.
• O receptor do complemento tipo 3, também chamado Mac-1 (CR3, CD11bCD18), é uma integrina que funciona como um receptor para o fragmento iC3b gerado pela proteólise de C3b. O Mac-1 é expresso nos neutrófilos, fagócitos mononucleares, mastócitos e células NK. É um membro da família das integrinas de receptores da superfície celular (Cap. 3) e consiste em uma cadeia α (CD11b) ligada não covalentemente à cadeia β (CD18), que é idêntica às cadeias β de duas moléculas de integrinas intimamente relacionadas, antígeno associado à função do leucócito 1 (LFA-1) e p150,95. Nos neutrófilos e nos monócitos, o Mac-1 promove fagocitose de micro-organismos opsonizados com iC3b. Além disso, o Mac-1 pode reconhecer diretamente a bactéria para fagocitose por meio da ligação com algumas moléculas microbianas desconhecidas (Cap. 4). Também se liga à molécula de adesão intercelular 1 (ICAM-1) nas células endoteliais e promove adesão estável dos leucócitos ao endotélio, mesmo sem a ativação do complemento. Essa ligação leva ao recrutamento de leucócitos para os sítios de infecção e de injúria tecidual (Cap. 3).
• O receptor do complemento tipo 4 (CR4, p150,95, CD11c/CD18) é outra integrina com uma cadeia α diferente (CD11c) e a mesma cadeia β vista no Mac-1. Também se liga ao iC3b e a função desse receptor provavelmente é similar à do Mac-1. CD11c é também expresso em abundância nas células dendríticas e é utilizado como um marcador para esse tipo celular.
• O receptor do complemento da família das imunoglobulinas (CRIg) é expresso na superfície de macrófagos do fígado conhecidos como células de Kupffer. O CRIg é uma proteína integral de membrana com uma região extracelular constituída de domínios Ig. Liga-se aos fragmentos C3b e iC3b do complemento e está envolvido na depuração de bactérias opsonizadas e de outros patógenos de origem sanguínea.
Regulação da Ativação do Complemento
A ativação da cascata do complemento e a estabilidade das proteínas ativas do complemento são finamente reguladas para evitar a ativação do complemento sobre células normais do hospedeiro e para limitar a duração da ativação da cascata, mesmo sobre células microbianas e sobre complexos antígeno-anticorpo. A regulação do complemento é mediada por várias proteínas circulantes e de membrana celular (Tabela 12-9). Muitas dessas proteínas, bem como diversas proteínas da via clássica e da via alternativa, pertencem a uma família chamada reguladoras da atividade do complemento (RCA) e são codificadas por genes homólogos que estão localizados em posições adjacentes no genoma.
A ativação do complemento precisa ser regulada por duas razões. Primeira, a ativação espontânea do complemento ocorre em baixos níveis e, se for permitido que essa ativação prossiga, o resultado pode ser danoso para as células e tecidos normais. Segunda, mesmo quando o complemento é ativado onde é preciso, como sobre células microbianas ou complexos antígeno-anticorpo, ele precisa ser controlado porque os produtos de degradação das proteínas do complemento podem se difundir para as células adjacentes e produzir lesão nas mesmas. Diferentes mecanismos reguladores inibem a formação das C3-convertases nas etapas iniciais da ativação do complemento, quebram e inativam as C3- e C5-convertases e inibem a formação do MAC nas etapas finais da via do complemento.
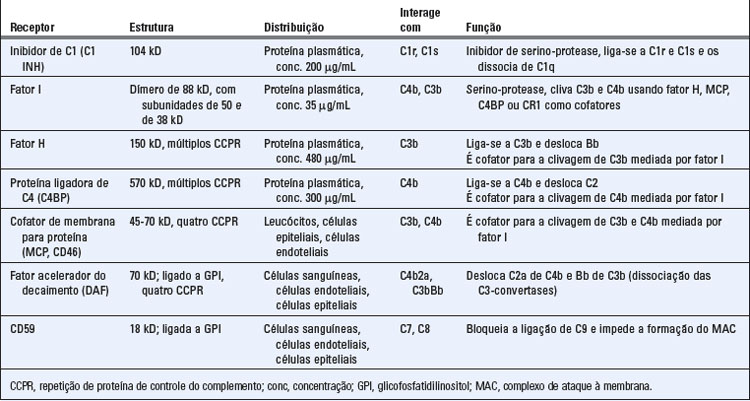
• A atividade proteolítica de C1r e de C1s é inibida por uma proteína plasmática denominada inibidor de C1 (C1 INH). C1 INH é um inibidor de serino-proteases (serpina) que mimetiza o substrato normal de C1r e de C1s. Se o C1q se ligar a um anticorpo e iniciar o processo de ativação do complemento, o C1 INH torna-se um alvo da atividade enzimática da ligação C1r2-C1s2. C1 INH é clivado por e se torna covalentemente ligado a essas proteínas do complemento, e como resultado, o tetrâmero C1r2-C1s2 dissocia-se do C1q, interrompendo, assim, a ativação pela via clássica (Fig. 12-13). Dessa maneira, o C1 INH previne o acúmulo de C1r2-C1s2 enzimaticamente ativo no plasma e limita o tempo de disponibilidade desse tetrâmero para ativar os passos subsequentes na cascata do complemento. Uma doença hereditária autossômica dominante chamada edema angioneurótico hereditário ocorre devido a uma deficiência de C1 INH. As manifestações clínicas da doença incluem acúmulo agudo intermitente de líquido edematoso na pele e mucosa, que produz dor abdominal, vômitos, diarreia e obstrução aérea com potencial risco de morte. Nesses pacientes, as concentrações plasmáticas da proteína C1 INH são suficientemente reduzidas (< 20% a 30% do normal) e, dessa forma, a ativação de C1 por imunocomplexos não é adequadamente controlada e ocorre clivagem aumentada de C4 e de C2. Os mediadores da formação do edema nos pacientes com edema angioneurótico hereditário incluem um fragmento proteolítico de C2, denominado C2-cinina, e bradicinina. C1 INH é um inibidor de outras serino-proteases plasmáticas além de C1, incluindo calicreína e o fator XII da coagulação, que, ativados, promovem a formação aumentada de bradicinina.
• A montagem dos componentes das C3- e C5-convertases é inibida pela ligação de proteínas reguladoras ao C3b e C4b depositados nas superfícies celulares (Fig. 12-14). Se o C3b for depositado em superfícies celulares de mamíferos, pode se ligar a diversas proteínas de membrana, incluindo a proteína cofator de membrana (MCP ou CD46), o receptor do complemento tipo 1 (CR1), o fator de aceleração do decaimento (DAF) e a proteína plasmática chamada fator H. O C4b depositado na superfície celular liga-se, de maneira semelhante, ao DAF, CR1 e a outra proteína plasmática chamada proteína ligadora de C4 (C4BP). Ao se ligar a C3b ou C4b, essas proteínas inibem competitivamente a ligação de outros componentes da C3-convertase, como Bb da via alternativa e C2b da via clássica, bloqueando, assim, a continuidade da cascata do complemento (o fator H inibe apenas a ligação de Bb a C3b e é, portanto, um regulador da via alternativa, mas não da via clássica). MCP, CR1 e DAF são produzidos por células de mamíferos, mas não por micro-organismos. Dessa forma, esses reguladores do complemento inibem seletivamente a ativação do complemento sobre células do hospedeiro e permitem o prosseguimento dessa ativação sobre micro-organismos. Além disso, as superfícies celulares ricas em ácido siálico favorecem a ligação da proteína reguladora fator H em relação à proteína da via alternativa fator B. As células de mamíferos expressam níveis mais altos de ácido siálico que a maior parte dos micro-organismos e essa é outra razão pela qual a ativação do sistema complemento é evitada em células normais do hospedeiro e permitida em micro-organismos.
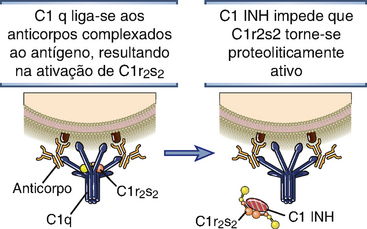
FIGURA 12-13 Regulação da atividade de C1 por C1 INH. C1 INH desloca C1r2s2 de C1q e encerra a ativação da via clássica.
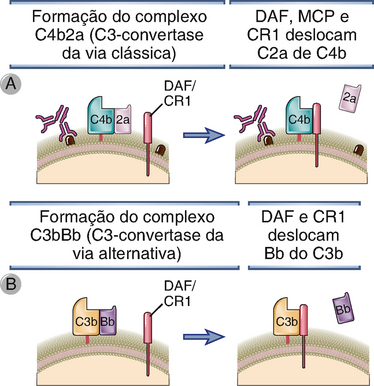
FIGURA 12-14 Inibição da formação das C3-convertases. Diversas proteínas de membrana presentes nas células normais deslocam C2a da C3-convertase da via clássica (A) ou Bb da C3-convertase da via alternativa (B) e interrompem a ativação do complemento.
DAF é uma proteína de membrana ligada a glicofosfatidilinositol, que é expressa em células endoteliais e em eritrócitos. A deficiência genética de uma enzima necessária para formar essas ligações entre proteína e lipídio resulta em falha na expressão de muitas proteínas de membrana ligadas a glicofosfatidilinositol, incluindo DAF e CD59 (ver a seguir), e produz uma doença chamada hemoglobinúria paroxística noturna. Essa doença é caracterizada por surtos recorrentes de hemólise intravascular, pelo menos parcialmente atribuída à ativação desregulada do complemento sobre a superfície de eritrócitos. A hemólise intravascular recorrente, por sua vez, leva a anemia hemolítica crônica e trombose venosa. Uma característica incomum dessa doença é que a mutação no gene defeituoso não é herdada, mas representa uma mutação adquirida nas células-tronco hematopoiéticas.
• O C3b associado à célula é proteoliticamente degradado por uma serino-protease plasmática chamada fator I, que somente permanece ativa na presença de proteínas reguladoras (Fig. 12-15). MCP, fator H, C4BP e CR1, todos funcionam como cofatores para a clivagem de C3b (e de C4b) mediada por fator I. Logo, essas proteínas reguladoras da célula hospedeira promovem a degradação proteolítica das proteínas do complemento; como foi discutido, as mesmas proteínas reguladoras produzem a dissociação de complexos que contêm C3b (e C4b). A clivagem de C3b mediada por fator I gera os fragmentos denominados iC3b, C3d e C3dg, que não participam da ativação do complemento, mas são reconhecidos por receptores presentes em fagócitos e linfócitos B.
• A formação do MAC é inibida por uma proteína de membrana chamada CD59. CD59 é uma proteína ligada a glicofosfatidilinositol expressa em muitos tipos celulares. Sua função é incorporar-se nos MAC em formação, após a inserção de C5b-8 na membrana, inibindo, assim, a subsequente adição de moléculas C9 (Fig. 12-16). CD59 está presente nas células normais do hospedeiro, onde limita a formação do MAC, mas não está presente em micro-organismos. A formação do MAC também é inibida por proteínas plasmáticas como a proteína S, que atua por meio da ligação aos complexos C5b, 6, 7 solúveis e, dessa forma, previne sua inserção nas membranas celulares próximas ao local onde a cascata do complemento foi iniciada. Os MAC em desenvolvimento podem se inserir em quaisquer membranas celulares vizinhas além da membrana na qual foram gerados. Os inibidores do MAC, presentes no plasma e nas membranas celulares do hospedeiro, asseguram a não ocorrência de lise em células próximas ao local de ativação do complemento.
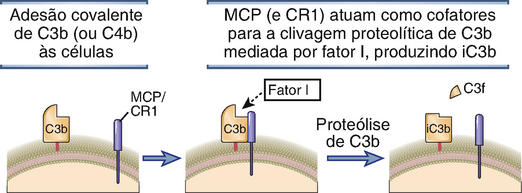
FIGURA 12-15 Clivagem de C3b mediada por fator I. Na presença de cofatores ligados à membrana celular (MCP ou CR1), o fator I plasmático cliva proteoliticamente o C3b aderido às superfícies celulares, deixando uma forma de C3b inativa (iC3b). O fator H e a proteína ligadora de C4 também podem servir de cofatores para a clivagem de C3b mediada por fator I. O mesmo processo está envolvido na proteólise de C4.
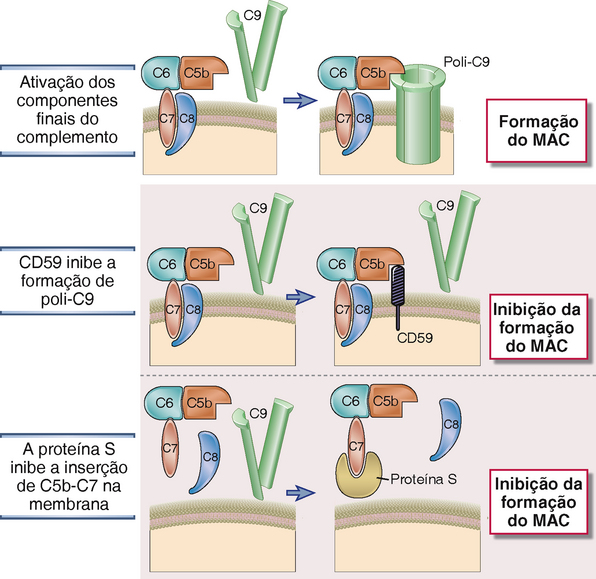
FIGURA 12-16 Regulação da formação do MAC. O MAC é formado sobre as superfícies celulares como resultado final da ativação do complemento. A proteína de membrana CD59 e a proteína S no plasma inibem a formação do MAC.
Grande parte da análise da função das proteínas reguladoras do complemento foi baseada em experimentos in vitro e a maior parte desses experimentos foi concentrada em ensaios que mensuram a lise celular mediada por MAC como resultado de avaliação. Com base nesses estudos, acredita-se que a hierarquia de importância para a inibição da ativação do complemento seja CD59 > DAF > MCP; essa hierarquia pode refletir a abundância dessas proteínas nas superfícies celulares.
A função das proteínas reguladoras pode ficar sobrecarregada pela ativação excessiva do complemento. Temos enfatizado a importância dessas proteínas reguladoras para prevenir a ativação do complemento em células normais. No entanto, a fagocitose mediada por complemento e os danos às células normais são mecanismos patogênicos em muitas doenças imunológicas (Cap. 18). Nessas doenças, grandes quantidades de anticorpos podem ser depositadas sobre as células do hospedeiro, gerando proteínas ativas do complemento suficientes para que as moléculas reguladoras sejam incapazes de controlar a ativação da cascata.
Funções do Complemento
As principais funções efetoras do sistema complemento na imunidade inata e na imunidade humoral específica são promover a fagocitose de micro-organismos sobre os quais o complemento é ativado, estimular a inflamação e induzir a lise desses micro-organismos. Além disso, os produtos da ativação do complemento facilitam a ativação de linfócitos B e a produção de anticorpos. Fagocitose, inflamação e estimulação da imunidade humoral são todas mediadas pela ligação de fragmentos proteolíticos de proteínas do complemento a vários receptores de superfície celular, ao passo que a lise celular é mediada pelo MAC. Na seção a seguir, descrevemos cada uma dessas funções do sistema complemento e seu papel na defesa do hospedeiro.
Opsonização e Fagocitose
Os micro-organismos sobre os quais o complemento é ativado pela via alternativa ou clássica tornam-se cobertos por C3b, iC3b ou C4b e são fagocitados pela ligação dessas proteínas a receptores específicos em macrófagos e neutrófilos (Fig. 12-17A). Como foi discutido, a ativação do complemento leva à geração de C3b e iC3b ligados covalentemente a superfícies celulares. C3b e iC3b agem como opsoninas pelo fato de se ligarem especificamente a receptores em neutrófilos e macrófagos. C3b e C4b (este último formado apenas na via clássica) ligam-se ao CR1 e o iC3b liga-se ao CR3 (Mac-1) e CR4. Por si mesmo, o CR1 é ineficiente na indução da fagocitose de micro-organismos recobertos por C3b, mas essa habilidade é aumentada se, simultaneamente, os micro-organismos estiverem recobertos por anticorpos IgG ligados aos receptores Fcγ. A ativação de macrófagos pela citocina IFN-γ também aumenta a fagocitose mediada por CR1. A fagocitose de micro-organismos dependente de C3b e de iC3b é o principal mecanismo de defesa contra infecções na imunidade inata e adaptativa. Um exemplo da importância do complemento é a defesa do hospedeiro contra bactérias encapsuladas ricas em polissacarídeos, tais como pneumococos e meningococos, que é mediada primariamente pela imunidade humoral. Anticorpos IgM contra polissacarídeos capsulares ligam-se à bactéria, ativam a via clássica do complemento e produzem eliminação fagocítica da bactéria no baço. Além disso, os macrófagos da zona marginal que expressam SIGN-R1 também podem se ligar aos polissacarídeos capsulares e ativar a via clássica na ausência de anticorpos. É por isto que os indivíduos que perderam o baço (p. ex., resultante de remoção cirúrgica após ruptura traumática ou em pacientes com anemia hemolítica ou trombocitopenia autoimunes) são suscetíveis a septicemias pneumocócica e meningocócica disseminadas. Humanos e camundongos deficientes em C3b são extremamente suscetíveis a infecções bacterianas letais.
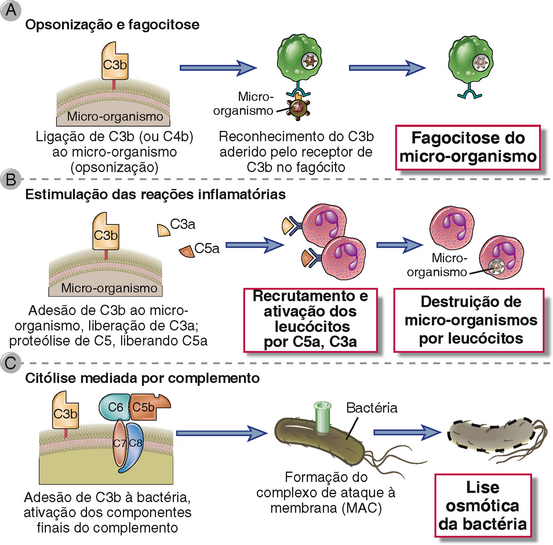
FIGURA 12-17 Funções do complemento. A figura mostra as principais funções do sistema complemento na defesa do hospedeiro. O C3b aderido à célula é uma opsonina que promove a fagocitose das células recobertas (A); os produtos proteolíticos C5a, C3a e (em menor extensão) C4a estimulam o recrutamento leucocitário e a inflamação (B); e o MAC promove a lise celular (C).
Estimulação das Respostas Inflamatórias
Os fragmentos proteolíticos do complemento C5a, C4a e C3a induzem inflamação aguda por meio da ativação de mastócitos e neutrófilos (Fig. 12-17B). Esses três peptídeos ligam-se a mastócitos e induzem sua desgranulação, com a liberação de mediadores vasoativos como a histamina. Esses peptídeos também são chamados de anafilatoxinas, porque as reações dos mastócitos que eles disparam são características da anafilaxia (Cap. 19). Nos neutrófilos, C5a estimula a motilidade, a firme adesão às células endoteliais e, em altas concentrações, a estimulação do burst respiratório e produção de espécies reativas de oxigênio. Além disso, C5a pode agir diretamente nas células endoteliais vasculares e induzir aumento da permeabilidade vascular e expressão de P-selectina, que promove a ligação de neutrófilos. Essa combinação da ação de C5a em mastócitos, neutrófilos e células endoteliais contribui para a inflamação nos locais de ativação do complemento. C5a é o mediador mais potente da desgranulação de mastócitos. C3a é cerca de 20 vezes menos potente; e C4a é aproximadamente 2.500 vezes menos potente. Os efeitos pró-inflamatórios de C5a, C4a e C3a são mediados pela ligação dos peptídeos a receptores específicos em diversos tipos celulares. O receptor de C5a é o que está mais completamente caracterizado. Esse receptor é um membro da família de receptores de sete α-hélices transmembranas acopladas à proteína G. O receptor de C5a é expresso em muitos tipos celulares, incluindo neutrófilos, eosinófilos, basófilos, monócitos, macrófagos, mastócitos, células endoteliais, células musculares lisas, células epiteliais e astrócitos. O receptor de C3a também é um membro da família de receptores acoplados à proteína G.
Citólise Mediada por Complemento
A lise de organismos estranhos mediada por complemento ocorre pela formação do MAC (Fig. 12-17C). A maior parte dos patógenos possui paredes celulares espessamente desenvolvidas ou cápsulas que impedem o acesso do MAC às suas membranas celulares. A lise mediada por complemento parece ser crucial para a defesa contra apenas alguns patógenos que são incapazes de resistir à inserção do MAC, como as infecções por bactérias do gênero Neisseria, que possuem paredes celulares muito finas.
Outras Funções do Sistema Complemento
Ao se ligar aos complexos antígeno-anticorpo, as proteínas do complemento promovem a solubilização desses complexos e sua depuração por fagócitos. Frequentemente, pequenas quantidades de imunocomplexos são formadas na circulação quando um indivíduo monta uma vigorosa resposta de anticorpos a um antígeno circulante. Se os imunocomplexos se acumularem no sangue, podem ser depositados nas paredes dos vasos e em tecidos adjacentes. A formação de imunocomplexos pode requerer não apenas a ligação multivalente das regiões Fab de imunoglobulinas aos antígenos, mas também interações monovalentes das regiões Fc de moléculas Ig justapostas. A ativação do complemento sobre as moléculas de Ig pode bloquear estericamente essas interações Fc-Fc, promovendo, assim, a dissolução dos imunocomplexos. Além disso, como foi discutido, os imunocomplexos com C3b aderido ligam-se a CR1 nos eritrócitos, e os complexos são removidos por fagocitose no fígado.
A proteína C3d gerada de C3 liga-se a CR2 nas células B e facilita sua ativação e o início da resposta imune humoral. O C3d é gerado quando o complemento é ativado por um antígeno, seja diretamente (p. ex., quando o antígeno é um polissacarídeo microbiano) ou após a ligação ao anticorpo. A ativação do complemento resulta na adesão covalente de C3b e seu produto de clivagem C3d ao antígeno. Os linfócitos B podem se ligar simultaneamente ao antígeno, por meio de seus receptores Ig, e ao C3d aderido, através de CR2 (o correceptor para o receptor de antígeno da célula B), aumentando dessa forma a sinalização induzida por antígeno nas células B (Cap. 7). Os antígenos opsonizados também se ligam às células dendríticas foliculares nos centros germinativos dos órgãos linfoides. As células dendríticas foliculares expõem os antígenos às células B nesses centros germinativos, e esse processo é importante para a seleção das células B de alta afinidade (Cap. 11, Fig. 11-13). A importância do complemento nas respostas imunes humorais é ilustrada por um grave prejuízo na produção de anticorpos e na formação dos centros germinativos observado nos camundongos deficientes na proteína C3, C4 ou CR2.
Embora nossa discussão tenha enfatizado as funções fisiológicas do complemento como um mecanismo efetor da defesa do hospedeiro, o sistema complemento também está envolvido em diversas condições patológicas. Algumas doenças autoimunes estão associadas à produção de autoanticorpos específicos para proteínas próprias expressas nas superfícies celulares (Cap. 18). A ligação desses anticorpos resulta na lise dependente de complemento e na fagocitose de células. Em outras doenças, imunocomplexos são depositados nos tecidos e induzem inflamação por meio do recrutamento e da ativação de leucócitos mediados pelo complemento.
Deficiências do Complemento
As deficiências genéticas das proteínas do complemento e das proteínas reguladoras são as causas de várias doenças humanas. Em humanos, foram descritas deficiências herdadas e espontâneas em muitas das proteínas do complemento.
• As deficiências genéticas dos componentes da via clássica já descritas incluem C1q, C1r, C4, C2 e C3; a deficiência de C2 é a deficiência do complemento mais comum em humanos. Mais de 50% dos pacientes com deficiências de C2 e de C4 desenvolvem lúpus eritematoso sistêmico. A razão para essa associação é desconhecida, mas defeitos na ativação do complemento podem levar a falhas na remoção de imunocomplexos circulantes. Se os imunocomplexos normalmente produzidos não forem retirados da circulação, eles podem ser depositados em paredes de vasos sanguíneos e em tecidos, onde ativam leucócitos por vias dependentes do receptor Fc e produzem inflamação local. O complemento também pode exercer um importante papel na remoção de corpos apoptóticos que contêm DNA fragmentado. Esses corpos apoptóticos são prováveis fontes de antígenos nucleares que induzem respostas de autoanticorpos no lúpus. Além disso, as proteínas do complemento regulam os sinais mediados por antígeno recebidos pelas células B; em sua ausência, antígenos próprios podem não induzir tolerância na célula B e resultar na autoimunidade. De forma surpreendente, as deficiências de C2 e de C4 não estão geralmente associadas à suscetibilidade aumentada a infecções, o que sugere que a via alternativa e os mecanismos efetores mediados pelo receptor Fc são adequados para a defesa do hospedeiro contra a maior parte dos micro-organismos. A deficiência de C3 está associada a infecções bacterianas piogênicas frequentemente severas que podem ser fatais, ilustrando o papel central do C3 na opsonização, fagocitose aumentada e destruição desses organismos.
• As deficiências nos componentes da via alternativa, incluindo properdina e fator D, resultam em suscetibilidade aumentada a infecções por bactérias piogênicas. A mutação do gene que codifica a lectina ligadora de manose (MBL) contribui para a imunodeficiência em alguns pacientes; isso é discutido no Capítulo 20.
• As deficiências dos componentes da via terminal do complemento já descritas incluem C5, C6, C7, C8 e C9. De maneira interessante, como já mencionado, o único problema clínico consistente nesses pacientes é a propensão para infecções disseminadas pela bactéria Neisseria, incluindo Neisseria meningitidis e Neisseria gonorrhoeae, indicando que a lise bacteriana mediada por complemento é particularmente importante para a defesa contra esses organismos.
• Deficiências das proteínas reguladoras do complemento estão associadas à ativação anormal do complemento e a uma variedade de anormalidades clínicas relacionadas. As deficiências do inibidor de C1 e do fator acelerador do decaimento foram mencionadas anteriormente no texto. Em pacientes com deficiência de fator I, ocorre depleção de C3 plasmático como resultado da formação desregulada da C3-convertase de fase líquida (pelo mecanismo normal de amplificação). A consequência clínica é o aumento de infecções com bactérias piogênicas. A deficiência de fator H é rara e é caracterizada pela ativação excessiva da via alternativa, consumo de C3, e glomerulonefrite produzida pela remoção inadequada de imunocomplexos e deposição de produtos de clivagem do complemento nos rins. Uma forma atípica de síndrome hemolítico-urêmica envolve a regulação defeituosa do complemento, e as mutações mais comuns nessa condição encontram-se no gene do fator H. Variantes alélicas específicas de fator H estão fortemente associadas à degeneração da mácula relacionada à idade. Os efeitos da falta de fator I ou de fator H são similares aos efeitos de um autoanticorpo denominado fator nefrítico de C3 (C3NeF), que é específico para a C3-convertase da via alternativa (C3bBb). C3NeF estabiliza C3bBb e protege o complexo da dissociação mediada por fator H, o que resulta no consumo desregulado de C3. Pacientes com esse anticorpo frequentemente apresentam glomerulonefrite, possivelmente causada por remoção inadequada de imunocomplexos circulantes.
• As deficiências dos receptores do complemento incluem a ausência de CR3 e CR4, resultante de mutações raras no gene da cadeia β (CD18), comum à família de moléculas de integrina CD11CD18. A doença congênita causada por esse defeito genético é chamada de deficiência de adesão leucocitária (Cap. 20). Este distúrbio é caracterizado por infecções piogênicas recorrentes e é produzido por uma aderência inadequada de neutrófilos ao endotélio nos locais de infecção dos tecidos e talvez pelo prejuízo de uma fagocitose de bactérias dependente de C3.
Efeitos Patológicos de um Sistema Complemento Normal
Mesmo quando está adequadamente regulado e ativado, o sistema complemento pode causar dano tecidual significativo. Alguns dos efeitos patológicos associados a infecções bacterianas podem ser provocados pelas respostas inflamatórias agudas a organismos infecciosos mediadas pelo complemento. Em algumas situações, a ativação do complemento está associada a trombose intravascular e pode levar à lesão isquêmica dos tecidos. Por exemplo, anticorpos antiendoteliais contra transplantes de órgãos vascularizados e os imunocomplexos produzidos em doenças autoimunes podem se ligar ao endotélio vascular e ativar o complemento, levando, assim, à inflamação e à geração do MAC, com dano à superfície endotelial, o que favorece a coagulação. Também há evidências de que algumas proteínas terminais do complemento podem ativar pró-trombinases na circulação que podem iniciar tromboses independentemente do dano endotelial mediado por MAC.
O exemplo mais claro de patologia mediada por complemento são as doenças mediadas por imunocomplexos. Vasculite sistêmica e glomerulonefrite por imunocomplexo são resultantes da deposição de complexos antígeno-anticorpo nas paredes dos vasos e nos glomérulos renais (Cap. 18). O complemento ativado por esses imunocomplexos depositados inicia respostas inflamatórias agudas que destroem as paredes dos vasos e os glomérulos e levam a trombose, dano isquêmico nos tecidos e cicatrização. Estudos com camundongos deficientes nas proteínas do complemento C3 ou C4 ou nos receptores Fcγ sugerem que a ativação leucocitária mediada pelo receptor Fc também pode produzir inflamação e lesão aos tecidos como resultado de deposição de IgG, mesmo na ausência de ativação do complemento.
Evasão do Complemento por Micro-organismos
Os patógenos possuem diversos mecanismos evoluídos para fugir do sistema complemento. Alguns micro-organismos expressam paredes celulares espessas que impedem a ligação de proteínas do complemento, como o MAC. As bactérias gram-positivas e alguns fungos são exemplos de micro-organismos que utilizam essa estratégia de evasão relativamente inespecífica. Consideraremos aqui alguns dos mecanismos mais específicos empregados por uma pequena população de patógenos. Esses mecanismos de evasão podem ser divididos em três grupos.
• Os micro-organismos podem se evadir do sistema complemento recrutando proteínas reguladoras do complemento do próprio hospedeiro. Muitos patógenos, ao contrário de micro-organismos não patogênicos, expressam ácido siálico, que pode inibir a via alternativa do complemento por meio do recrutamento de fator H, o qual desloca C3b de Bb. Alguns patógenos, como esquistossomas, Neisseria gonorrhoeae e certas espécies de Haemophilus, retiram ácidos siálicos do hospedeiro e transferem o açúcar enzimaticamente para a superfície de suas células. Outros, incluindo a Escherichia coli K1 e alguns meningococos, possuem rotas especiais biossintéticas desenvolvidas para a geração de ácido siálico. Alguns micro-organismos sintetizam proteínas que podem recrutar a proteína reguladora fator H para a superfície celular. A GP41 do vírus da imunodeficiência humana (HIV) pode se ligar ao fator H e acredita-se que essa propriedade contribua para a proteção do virion. Muitos outros patógenos possuem proteínas desenvolvidas que facilitam o recrutamento do fator H para suas paredes celulares. Isso inclui bactérias como Streptococcus pyogenes, Borrelia burgdorferi (o agente causativo da doença de Lyme), Neisseria gonorrhoeae, Neisseria meningitidis, o fungo patogênico Candida albicans e nematódeos como Echinococcus granulosus. Outros micro-organismos, como o HIV, incorporam múltiplas proteínas reguladoras do hospedeiro em seus envelopes. Por exemplo, o HIV incorpora as proteínas reguladoras do complemento ancoradas em GPI, DAF e CD59, quando brota de uma célula infectada.
• Numerosos patógenos produzem proteínas específicas que mimetizam proteínas reguladoras do complemento humano. Escherichia coli produz uma proteína que se liga a C1q (C1qBP), que inibe a formação de um complexo entre C1q e C1r e C1s. Staphylococcus aureus faz uma proteína denominada SCIN (inibidor estafilocócico de complemento) que se liga a C3-convertase das vias clássica e alternativa e a inibe de forma estável, inibindo, dessa forma, as três vias de ativação do complemento. A glicoproteína C-1 do vírus herpes simples desestabiliza a convertase da via alternativa por impedir que o componente C3b se ligue à properdina. A GP160, uma proteína de membrana do Trypanosoma cruzi, o agente causador da doença de Chagas, liga-se a C3b e impede a formação da C3-convertase e também acelera seu decaimento. VCP-1 (proteína inibidora do complemento proveniente do vírus vacínia-1), uma proteína produzida pelo vírus vacínia e que se assemelha estruturalmente ao C4BP humano, pode se ligar tanto a C4 quanto a C3 e acelera o decaimento da C3-convertase e da C5-convertase.
• A inflamação mediada por complemento também pode ser inibida por produtos gênicos microbianos. O Staphylococcus aureus sintetiza uma proteína chamada CHIPS (proteína inibidora de quimiocina de estafilococos), que é um antagonista da anafilatoxina C5a.
Esses exemplos ilustram como os micro-organismos possuem a habilidade adquirida de se evadir do sistema complemento, presumivelmente contribuindo para sua patogenicidade.
IMUNIDADE NEONATAL
Os mamíferos neonatos são protegidos de infecção pelos anticorpos maternos transportados através da placenta para a circulação fetal e por anticorpos ingeridos no leite e transportados através do epitélio intestinal dos recém-nascidos por um processo especializado conhecido como transcitose. Neonatos não têm habilidade para montar respostas imunes efetivas contra micro-organismos e, por muitos meses após o nascimento, sua principal defesa contra infecção é a imunidade passiva proporcionada pelos anticorpos maternos. A IgG materna é transportada através da placenta, e a IgA e IgG presentes no leite são ingeridas pelo lactente. O transporte transepitelial de IgA materna para o leite materno depende do receptor poli Ig descrito no Capítulo 13. A IgA e a IgG ingeridas podem neutralizar organismos patogênicos que tentam colonizar o intestino do bebê, e os anticorpos IgG ingeridos também são transportados através do epitélio intestinal para a circulação do neonato. Assim, o neonato contém, essencialmente, os mesmos anticorpos IgG que sua mãe possui.
O transporte de IgG materna através da placenta e do epitélio intestinal do neonato é mediado pelo receptor Fc específico para IgG denominado receptor Fc neonatal (FcRn). O FcRn é único entre os receptores Fc, já que se assemelha a uma molécula do complexo principal de histocompatibilidade (MHC), e que contém uma cadeia pesada transmembrana que não está covalentemente associada à β2-microglobulina. No entanto, a interação da IgG com o FcRn não envolve a porção da molécula que é análoga à fenda que se liga ao peptídeo usada pelas moléculas de CHP classe I para expor peptídeos ao reconhecimento da célula T.
Adultos também expressam FcRn no endotélio e em muitos tecidos epiteliais. No período pós-neonatal, esse receptor funciona para proteger os anticorpos IgG plasmáticos do catabolismo. Esse processo foi descrito no Capítulo 5.
• A imunidade humoral é mediada por anticorpos e é o braço efetor do sistema imune adaptativo responsável pela defesa contra micro-organismos extracelulares e toxinas microbianas. Os anticorpos que proporcionam proteção contra infecção podem ser produzidos por células secretoras de anticorpos de vida longa geradas durante a primeira exposição ao antígeno microbiano ou pela reativação das células B de memória pelo antígeno.
• As funções efetoras dos anticorpos incluem neutralização de antígenos, fagocitose dependente do receptor Fc de partículas opsonizadas, e ativação do sistema complemento.
• Os anticorpos bloqueiam ou neutralizam a infectividade de micro-organismos pela ligação aos micro-organismos e por interações de bloqueio estérico dos micro-organismos com receptores celulares. Os anticorpos bloqueiam de maneira similar as ações patológicas de toxinas ao impedir a ligação das toxinas às células do hospedeiro.
• Os anticorpos cobertos (opsonizados) de partículas são fagocitados pela ligação das porções Fc dos anticorpos aos receptores Fc dos fagócitos. Existem muitos tipos de receptores Fc específicos para diferentes subclasses de IgG e para anticorpos IgA e IgE, e diferentes receptores Fc ligam-se aos anticorpos com afinidades variadas. A adesão de Ig complexada ao antígeno aos receptores Fc dos fagócitos também libera sinais que estimulam as atividades microbicidas dos fagócitos.
• O sistema complemento consiste em proteínas séricas e de membrana que interagem de uma maneira altamente regulada para produzir produtos proteicos biologicamente ativos. As três principais vias de ativação do complemento são a via alternativa, que é ativada em superfícies microbianas na ausência de anticorpos; a via clássica, que é ativada por complexos antígeno-anticorpo; e a via das lectinas, iniciada por colectinas que se ligam a antígenos. Essas vias geram enzimas que clivam a proteína C3, e os produtos clivados de C3 tornam-se covalentemente aderidos às superfícies microbianas ou a anticorpos, de forma que os passos subsequentes da ativação do complemento fiquem limitados a esses locais. Todas as vias convergem para uma via comum que envolve a formação de um poro na membrana, após a clivagem proteolítica de C5.
• A ativação do complemento é regulada por várias proteínas plasmáticas e de membrana celular que inibem diferentes passos na cascata.
• As funções biológicas do sistema complemento incluem opsonização de organismos e de imunocomplexos por fragmentos proteolíticos de C3, seguida pela ligação aos receptores para fragmentos do complemento nos fagócitos e depuração fagocítica, ativação de células inflamatórias por fragmentos proteolíticos de proteínas do complemento denominadas anafilatoxinas (C3a, C4a, C5a), citólise mediada pela formação do MAC sobre as superfícies celulares, solubilização e remoção de imunocomplexos e aumento das respostas imunes humorais.
• A imunidade protetora nos neonatos é uma forma de imunidade passiva fornecida pelos anticorpos maternos transportados através da placenta por um receptor Fc neonatal especializado.
Carroll MC. Complement and humoral immunity. Vaccine. 2008;26:128-133.
Gros P, Milder FJ, Janssen BJ. Complement driven by conformational changes. Nature Reviews Immunology. 2008;8:48-58.
Manderson AP, Botto M, Walport MJ. The role of complement in the development of systemic lupus erythematosus. Annual Review of Immunology. 2004;22:431-456.
Roozendaal R, Carroll MC. Emerging patterns in complement-mediated pathogen recognition. Cell. 2006;125:29-32.
Funções Efetoras de Anticorpos e de Receptores Fc
Gould HJ, Sutton BJ. IgE in allergy and asthma today. Nature Reviews Immunology. 2008;8:205-217.
Lencer WI, Blumberg RS. A passionate kiss, then run: exocytosis and recycling of IgG by FcRn. Trends in Cell Biology. 2005;15:5-9.
Nimmerjahn F, Ravetch JV. Fcγ receptors as regulators of immune responses. Nature Reviews Immunology. 2008;8:34-47.
Smith KG, Clatworthy MR. FcγRIIB in autoimmunity and infection: evolutionary and therapeutic implications. Nature Reviews Immunology. 2010;10:328-343.