CAPÍTULO 10 Mecanismos Efetores da Imunidade Mediada por Células
TIPOS DE REAÇÕES IMUNOLÓGICAS MEDIADAS POR CÉLULAS,
MIGRAÇÃO DOS LINFÓCITOS T EFETORES PARA OS SÍTIOS DE INFECÇÃO,
FUNÇÕES EFETORAS DAS CÉLULAS T CD4+ AUXILIARES, 229
FUNÇÕES EFETORAS DOS LINFÓCITOS T CITOTÓXICOS CD8+, 237
A imunidade mediada pelas células é o tipo de defesa dos hospedeiros que é mediada pelos linfócitos T, e serve como mecanismo de defesa contra os micro-organismos que sobrevivem e se replicam dentro dos fagócitos e das células não fagocíticas. Historicamente, os imunologistas dividiram a imunidade adaptativa em imunidade humoral, que pode ser transferida adotivamente de um doador imunizado a um hospedeiro não imunizado por anticorpos na ausência das células, e a imunidade mediada pelas células, que pode ser adotivamente transferida apenas por linfócitos T viáveis. A fase efetora da imunidade humoral é desencadeada pelo reconhecimento do antígeno por anticorpos secretados; portanto, a imunidade humoral neutraliza e elimina micro-organismos extracelulares e toxinas que são acessíveis aos anticorpos, mas não é eficaz contra os micro-organismos dentro das células. Em contraste, na imunidade mediada pelas células, a fase efetora é iniciada pelo reconhecimento dos antígenos pelas células T. Os linfócitos T reconhecem os antígenos proteicos dos micro-organismos que são exibidos nas superfícies das células infectadas como peptídeos ligados às próprias moléculas do complexo principal de histocompatibilidade (MHC). Portanto, a imunidade mediada pelas células é específica para os micro-organismos associados às células. Os defeitos na imunidade mediada pela célula resultam no aumento da suscetibilidade às infecções por vírus e bactérias intracelulares, bem como por algumas bactérias extracelulares e fungos que são ingeridos por fagócitos. As reações mediadas pela célula T também são importantes na rejeição de aloenxerto (Cap. 16), imunidade antitumoral (Cap. 17) e doenças inflamatórias mediadas pela imunidade (Cap. 18). No Capítulo 9, descreveremos a ativação dos linfócitos T e a diferenciação das células T virgens (naïve) em células efetoras e de memória. Neste capítulo, discutimos as reações das células T efetoras na imunidade mediada pelas células.
TIPOS DE REAÇÕES IMUNOLÓGICAS MEDIADAS POR CÉLULAS
Diferentes populações de células T evoluíram para combater diferentes tipos de patógenos infecciosos. Assim, a imunidade mediada pelas células proporciona excelentes exemplos da especialização da imunidade adaptativa. Há diversos princípios gerais importantes de reações imunológicas mediadas por células.
• A linhagem das células T efetoras CD4+ liga o reconhecimento específico dos micro-organismos com o recrutamento e a ativação de outros leucócitos que destroem os micro-organismos (Fig. 10-1A). A natureza dos leucócitos que são recrutados e ativados é determinada pelo subgrupo de células T efetoras CD4+ que são induzidas na resposta imunológica. Em geral, as células TH1 ativam os macrófagos, as reações TH17 são dominadas pelos neutrófilos (e números variáveis de macrófagos), e as células TH2 recrutam e ativam os eosinófilos. Cada tipo de leucócito é especialmente adaptado para destruir certos tipos de micro-organismos. Essa cooperação dos linfócitos T e de outros leucócitos ilustra uma importante ligação entre a imunidade adaptativa e a inata: por meio de secreção de citocina, as células T estimulam a função e se concentram na atividade das células efetoras não específicas da imunidade inata (como os fagócitos e os eosinófilos), convertendo assim essas células em agentes da imunidade adaptativa.
• A resposta imunológica adaptativa aos micro-organismos que são fagocitados e vivem dentro dos fagossomos dos macrófagos é mediada pelas células TH1, que reconhecem antígenos microbianos e ativam os fagócitos para destruir os micro-organismos ingeridos. Os macrófagos são as principais células de defesa do hospedeiro imediatamente após a infecção, ou seja, durante as respostas imunológicas inatas (Cap. 4). Sua função é ingerir e matar os micro-organismos. Muitos micro-organismos desenvolveram mecanismos que permitem que eles sobrevivam e até mesmo se repliquem dentro dos fagócitos, de modo que a imunidade inata seja incapaz de erradicar infecções por esses micro-organismos. Nessas situações, a função das células TH1 é potencializar as ações microbicidas dos macrófagos e, assim, eliminar a infecção.
• A resposta aos micro-organismos extracelulares, incluindo muitos fungos e bactérias, é mediada pelas células TH17. Essas células recrutam neutrófilos (e alguns monócitos), que ingerem e destroem os micro-organismos.
• A resposta aos parasitas helmintos é mediada pelas células TH2, que estimula a produção de anticorpos de imunoglobulina E (IgE) e ativa os eosinófilos e os mastócitos para eliminar os helmintos.
• A resposta imunológica adaptativa aos micro-organismos que infectam o citoplasma e se replicam nele dos diversos tipos de células, incluindo as células não fagocíticas, é mediada pelos linfócitos citotóxicos T CD8+ (CTL), que matam as células infectadas e eliminam os reservatórios de infecção (Fig. 10-1B). Se as células infectadas não têm capacidade microbicida intrínseca, a infecção pode ser erradicada somente pela destruição dessas células. A morte mediada por CTL também é um mecanismo para eliminação de micro-organismos que são capturados por fagócitos, mas escapam dos fagossomos para dentro do citosol, onde eles não estão suscetíveis às atividades microbicidas dos fagócitos.
• A inflamação dependente da célula T pode danificar os tecidos normais. A inflamação, que consiste no agrupamento e na ativação de leucócitos, acompanha muitas das reações dos linfócitos T CD4+. Essa reação prejudicial dependente da célula T é chamada de hipersensibilidade do tipo tardia (DTH), o termo hipersensibilidade se refere à lesão tecidual provocada por uma resposta imunológica. A DTH ocorre frequentemente junto com a imunidade mediada pela célula de proteção contra os micro-organismos e pode ser a causa de muitas das patologias associadas a certos tipos de infecção (Caps. 15 e 18).
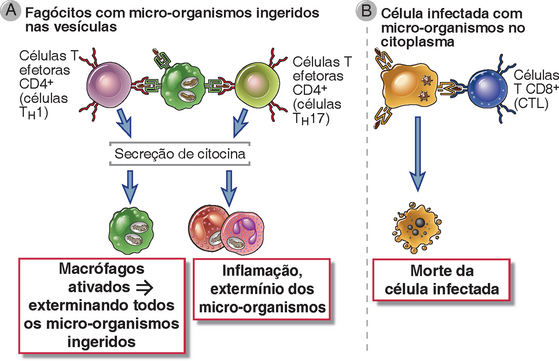
FIGURA 10-1 Tipos de reações imunológicas mediadas por células T. A, As células T CD4+ reconhecem os antígenos dos micro-organismos fagocitados e extracelulares e produzem citocinas que ativam os fagócitos para matar os micro-organismos e estimulam a inflamação. As células T CD8+ também podem secretar citocinas e participar de reações semelhantes. B, os linfócitos T citotóxicos (CTL) CD8+ reconhecem os antígenos dos micro-organismos que residem no citoplasma de células infectadas e as matam.
As respostas imunológicas mediadas por células consistem no desenvolvimento de células T efetoras de células virgens nos órgãos linfoides periféricos, na migração dessas células T efetoras e de outros leucócitos para os sítios de infecção, e/ou a ativação dos leucócitos mediada por citocinas para destruir micro-organismos ou a morte direta das células infectadas (Fig. 10-2). O desenvolvimento de células T efetoras envolve a sequência de reconhecimento antígeno, expansão clonal e diferenciação que é característica de todas as respostas imunológicas adaptativas; esses processos foram descritos no Capítulo 9. Neste capítulo, descreveremos as reações das células T efetoras e seus papéis na defesa do hospedeiro e na lesão tecidual. Começaremos com o processo que traz as células T efetoras para o sítio da infecção ou para a lesão tecidual.
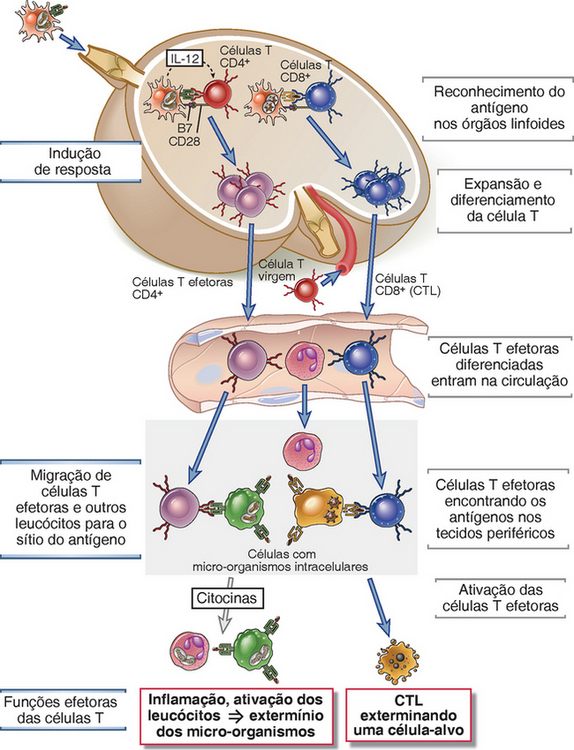
FIGURA 10-2 A indução e as fases efetoras da imunidade mediada por células.
Indução da resposta: as células T CD4+ e as células T CD8+ reconhecem os peptídeos que são derivados dos antígenos de proteínas e apresentados pelas células dendríticas nos órgãos linfoides periféricos. Os linfócitos T são estimulados a proliferar e a se diferenciar em células efetoras (e de memória), que entram na circulação.
A migração de células T efetoras e outros leucócitos para o sítio do antígeno: as células T efetoras e outros leucócitos migram por meio dos vasos sanguíneos nos tecidos periféricos pela ligação às células endoteliais que foram ativadas pelas citocinas produzidas em resposta à infecção nesses tecidos.
Funções efetoras das células T: as células T efetoras reconhecem o antígeno nos tecidos e respondem pelas secreções de citocinas que recrutam mais leucócitos e ativam os fagócitos para erradicar a infecção. As CTL também migram para os tecidos e matam as células infectadas.
MIGRAÇÃO DOS LINFÓCITOS T EFETORES PARA OS SÍTIOS DE INFECÇÃO
Algumas células T efetoras saem dos órgãos linfoides, onde elas foram geradas, e preferencialmente se abrigam em sítios de infecção nos tecidos periféricos, onde elas são necessárias para eliminar micro-organismos durante a fase efetora das respostas imunológicas adaptativas (Fig. 10-3). No Capítulo 3, descrevemos a recirculação das células T virgens através dos tecidos linfoides e a migração das células T efetoras nos tecidos não linfoides e os papéis das moléculas de adesão e quimiocinas nesses processos. A diferenciação das células T virgens em células efetoras, que ocorre nos órgãos linfoides periféricos, está associada a uma mudança na expressão dos receptores de quimiocina e nas moléculas de adesão que determinam o comportamento migratório dessas células. A expressão das moléculas envolvidas na chegada das células T virgens nos linfonodos, incluindo a L-selectina e o CCR7, diminui brevemente após a ativação das células T virgens induzida por antígenos, e a expressão na superfície celular do receptor S1PR1 de esfingosina 1-fosfato aumenta. Como resultado, as células efetoras que se desenvolvem não são mais obrigadas a ficar no nodo e são atraídas para entrar no sangue ou nos vasos linfáticos, que, por último, drenam para o sangue através do ducto torácico. Além disso, diferentemente das células T virgens, as células T efetoras expressam os receptores de quimiocina que se ligam às quimiocinas produzidas nos sítios das infecções e moléculas de adesão que se ligam às moléculas de adesão endoteliais, que são induzidas nas vênulas pós-capilares pelas citocinas, incluindo a IL-1 e o fator de necrose tumoral (TNF), produzidos nos sítios de infecção. Portanto, depois que elas entram na circulação, a permanência das células efetoras é, preferencialmente, nos sítios de infecção.
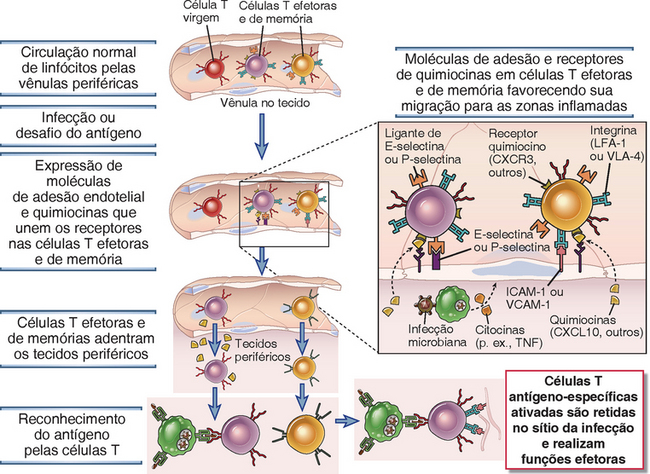
FIGURA 10-3 Migração e retenção das células T efetoras e de memória nos sítios de infecção. As células T efetoras e de memória ativadas previamente, mas não as células não virgens, migram através do endotélio, que é ativado pelas citocinas (p. ex., o TNF) produzidas no sítio da infecção. As células endoteliais ativadas expressam as E-selectinas e P-selectinas e ligantes para as integrinas, e as células T efetoras expressam os ligantes e integrinas das selectinas. Essas moléculas de adesão medeiam a interação entre as células T e o endotélio. As quimiocinas desempenham papéis críticos adicionais na migração das células T pela parede do vaso. No tecido extravascular, as células T que reconhecem especificamente o antígeno são ativadas e mantidas, enquanto as células T que não encontram o antígeno para o qual elas são específicas morrem ou voltam para a circulação, em grande parte por meio dos vasos linfáticos (não mostrados).
Os subgrupos TH1, TH2 e TH17 das células T CD4+ têm diferentes fenótipos que as direcionam para migrar para sítios diferentes das infecções. Por exemplo, durante a diferenciação dos precursores virgens, as células TH1 adquirem a capacidade de produzir ligantes funcionais que se ligam à E-selectina e à P-selectina, enquanto as células TH2 expressam níveis mais baixos de ligantes de selectina. Esse aspecto da diferenciação da TH1 envolve a expressão de glicosiltransferases dependentes de T-bet, que são necessárias para a síntese das metades dos carboidratos às quais as selectinas se ligam. Além disso, os receptores de quimiocina CXCR3 e CCR5, que se ligam às quimiocinas elaboradas nos tecidos durante as respostas imunológicas inatas, são expressos em altos níveis pelas células TH1, mas não pelas células TH2. Portanto, as células TH1 tendem a ser abundantes nos sítios de infecção, onde os agentes infecciosos desencadeiam fortes reações imunológicas inatas; esses agentes incluem muitas bactérias e vírus. Em geral, as CTL migram de maneira semelhante às células TH1. Em contraste, as células TH2 expressam os receptores CCR3, CCR4 e CCR8 de quimiocina, que reconhecem as quimiocinas, que são altamente expressas nos sítios de infecção por helminto ou reações alérgicas, especialmente nos tecidos da mucosa, e assim as células TH2 tendem a migrar para esses tecidos. As células TH17 expressam o CCR6, que se ligam à quimiocina CCL20, e a migração de células TH17 nos sítios inflamatórios é dependente do CCR6. O CCL20 é produzido por diversas células do tecido e macrófagos em muitas infecções bacterianas e fúngicas.
Depois que as células T efetoras entram no sítio da infecção e são ativadas uma vez mais pelo antígeno, elas produzem mais citocinas e quimiocinas e estimulam uma migração muito maior de leucócitos. Essa inflamação mais tardia, intensificada, é às vezes chamada de inflamação imune para indicar o papel dos linfócitos T (células imunes) no processo.
A migração das células T efetoras da circulação para os sítios periféricos da infecção é em grande parte independente do antígeno, mas as células que reconhecem o antígeno nos tecidos extravasculares podem ser preferencialmente retidas lá (Fig. 10-3). A migração das células T pelo sangue e pelos vasos linfáticos é controlada principalmente pelas moléculas de adesão e quimicionas, que ligarão as células T de qualquer especificidade antigênica. Portanto, esse processo de migração resulta no agrupamento de células T efetoras circulantes para sítios inflamatórios, independentemente da especificidade antigênica, que assegura que o maior número possível de células T previamente ativadas tenha a oportunidade de localizar micro-organismos infecciosos e erradicar a infecção. Algumas células T de memória também migram para os tecidos não linfoides periféricos, independentemente da especificidade do antígeno. Uma vez nos tecidos, as células T encontram antígenos microbianos apresentados por macrófagos e outras células apresentadoras de antígeno (APC). As células T que reconhecem especificamente antígenos recebem sinais por meio de seus receptores antigênicos, que aumentam a afinidade das integrinas por seus ligantes. Duas dessas integrinas, a VLA-4 e a VLA-5, se ligam à fibronectina nas matrizes extracelulares, e uma terceira à molécula de adesão, a CD44, que também é altamente expressa nas células efetoras e de memória T, se liga ao ácido hialurônico. Como resultado, as células T efetoras e de memória específicas para antígenos que encontram são preferencialmente retidas no sítio extravascular onde o antígeno está presente. As células T não específicas para o antígeno que migram para um lugar de inflamação podem morrer no tecido ou retornar por meio dos vasos linfáticos para a circulação.
FUNÇÕES EFETORAS DAS CÉLULAS T CD4+ AUXILIARES
As células T efetoras da linhagem CD4+ funcionam secretando citocinas secretadas e moléculas da superfície celular para ativar outras células a fim de eliminar micro-organismos. As células T CD4+ também participam indiretamente na defesa do hospedeiro, ajudando os linfócitos B a produzir anticorpos de alta afinidade contra os micro-organismos extracelulares e promovendo o desenvolvimento de CTL completamente funcionais que combatem micro-organismos intracelulares, como os vírus. Os papéis das células T auxiliares (helper) nas respostas dos anticorpos estão descritos no Capítulo 11 e nas respostas do CTL no Capítulo 9. Aqui nosso foco está nos papéis das células T CD4+ como células efetoras da imunidade mediada por células.
As funções das células efetoras CD4+ na imunidade mediada por células podem ser divididas em várias etapas (Fig. 10-4):
• Recrutamento de outros leucócitos. O recrutamento dos neutrófilos, monócitos e eosinófilos para o sítio da reação é mediado pelas quimiocinas produzidas pelas próprias células T e por outras células em resposta às citocinas secretadas pelas células T. Conforme já mencionamos e discutiremos com mais detalhes posteriormente, diferentes subgrupos de células efetoras CD4+ recrutam diferentes tipos de leucócitos para a reação.
• Ativação dos leucócitos recrutados. Os mecanismos pelos quais as células T CD4+ ativam outros leucócitos envolvem a expressão da proteína ligante de superfície CD40 (CD40L) na superfície da célula T e a secreção de citocinas. A via mediada pelo CD40L é mais bem definida pela ativação de macrófagos mediada pelo TH1 e é descrita nesse contexto posteriormente. Os papéis das citocinas na ativação de diferentes populações de leucócitos também são descritos posteriormente para cada subgrupo de células T efetoras.
• Amplificação da resposta. Como em todas as respostas imunológicas adaptativas, existem diversos circuitos de feedback positivo que servem para ampliar a resposta. Por exemplo, as citocinas produzidas pelos macrófagos que ativam as células T para produzir outras citocinas, que por sua vez agem sobre as células T e aumentam suas respostas.
• Regulação negativa da resposta. Como as células T efetoras são normalmente de vida curta, elas morrem depois de realizarem sua função. À medida que o antígeno é eliminado, os estímulos para a propagação da resposta são perdidos, e a resposta diminui ao longo do tempo. Os mecanismos de controle especial também podem operar para limitar as respostas efetoras. Por exemplo, tanto as células TH1 como os macrófagos ativados produzem a citocina IL-10, que funciona principalmente para inibir uma diferenciação adicional de TH1 e a ativação de macrófagos. Os mecanismos inibidores adicionais, tais como outras citocinas anti-inflamatórias e os receptores que desligam a ativação das células T, também podem estar envolvidos no controle das respostas mediadas por células T.
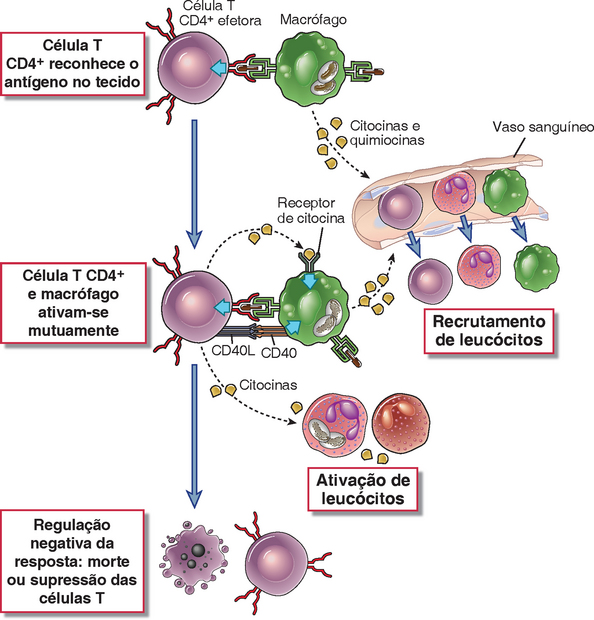
FIGURA 10-4 Sequência de eventos nas reações das células T CD4+ efetoras. A sequência de eventos nas respostas funcionais das células T CD4+ efetoras é mostrada. As células efetoras são recrutadas da circulação, ativadas por antígenos apresentados por macrófagos que têm micro-organismos fagocitados, e secretam citocinas que ampliam e controlam a reação. As células T usam o CD40L e as citocinas para ativar os fagócitos e as citocinas para recrutar mais leucócitos.
Com esse panorama, passamos a uma discussão sobre as funções dos três principais subgrupos das células efetoras T CD4+ na imunidade mediada por células.
Funções das Células TH1
A principal função das células TH1 é ativar os macrófagos para ingerir e destruir os micro-organismos (Fig. 10-5). Lembre-se de que os micro-organismos intracelulares fagocitados são estímulos poderosos para a geração de células TH1 (Cap. 9). Assim, as células efetoras TH1 se desenvolvem em resposta aos patógenos que essas células são projetadas para erradicar, um excelente exemplo da especialização da imunidade adaptativa. A mesma reação de ativação de macrófagos mediada por TH1 está envolvida na hipersensibilidade prejudicial do tipo tardio, que é um componente de muitas doenças inflamatórias, e na inflamação granulomatosa, que é típica da tuberculose e também é vista em alguns outros distúrbios infecciosos e inflamatórios. Essas reações patológicas serão descritas no Capítulo 18.
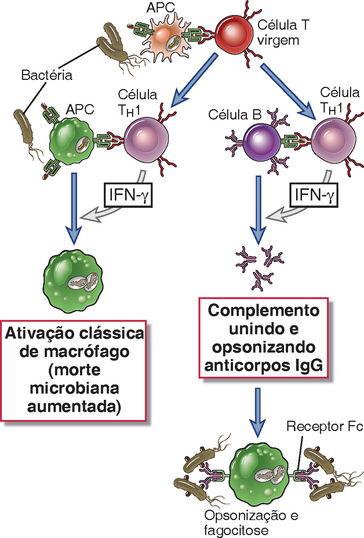
FIGURA 10-5 Funções das células TH1. As células T CD4+ que se diferenciam em células TH1 secretam IFN-γ, que atua nos macrófagos para aumentar a fagocitose e matar os micro-organismos nos fagolisossomos e nos linfócitos B a fim de estimular a produção de anticorpos IgG que opsonizam os micro-organismos para a fagocitose. As células também produzem TNF, que ativa os neutrófilos e promove a inflamação (não mostrado).
Antes de discutir a ativação dos macrófagos e como eles destroem os micro-organismos, descreveremos as propriedades do interferon-γ (IFN-γ), a citocina responsável pela maioria das funções especializadas das células TH1.
Citocinas Produzidas pelas Células TH1
A citocina de assinatura das células TH1 é o IFN-γ. As células TH1 também produzem TNF, algumas quimiocinas e outras citocinas.
Interferon-γ
O IFN-γ é a principal citocina de ativação de macrófagos e tem funções críticas na imunidade contra os micro-organismos intracelulares. O IFN-γ também é chamado de interferon imune ou tipo II. Embora tenha alguma atividade antiviral, ele não é uma citocina antiviral potente, e funciona principalmente como um ativador das células efetoras do sistema imunológico.
O IFN-γ é uma proteína homodimérica que pertence à família das citocinas tipo II (Cap. 7). Além das células TH1 CD4+, o IFN-γ também é produzido pelas células NK e pelas células T CD8+. As células NK secretam IFN-γ em resposta aos ligantes de ativação sobre a superfície de células infectadas ou estressadas (Cap. 2) ou em resposta à IL-12; nesse cenário, o IFN-γ funciona como um mediador da imunidade inata. Na imunidade adaptativa, as células T produzem IFN-γ em resposta ao reconhecimento de antígenos, e a produção é reforçada pela IL-12 e pela IL-18.
O receptor para o IFN-γ é composto por dois polipeptídeos homólogos estruturalmente que pertencem à família do receptor de citocina de tipo II, chamados FNγR1 e IFNγR2. O IFN-γ se liga e induz à dimerização de duas cadeias de receptores. Isso leva à ativação das cinases JAK1 e JAK2 associadas e, por último, à fosforilação e dimerização do STAT1, que estimula a transcrição de diversos genes (Cap. 7). Os genes induzidos pelo IFN-γ codificam muitas moléculas diferentes que medeiam as atividades biológicas dessa citocina, descritas a seguir.
As funções do IFN-γ são importantes na imunidade mediada pela célula contra os micro-organismos intracelulares (Fig. 10-5).
• O IFN-γ ativa os macrófagos a matarem os micro-organismos fagocitados, a marca dos macrófagos “ativados classicamente”. Nas reações imunológicas inatas, o IFN-γ é produzido pelas células NK e age nos macrófagos junto com os sinais do receptor semelhante a Toll (Toll-like receptors - TLR) entregues pelos micro-organismos (Cap. 4) para desencadear a ativação dos macrófagos. Na imunidade adaptativa mediada por células, o IFN-γ produzido pelas células TH1 funciona junto com o ligante CD40, também expresso pelas células T, para ativar os macrófagos. O IFN-γ ativa diversas vias de sinalização e fatores de transcrição, e o mais importante, os sinais STAT1, TLR e CD40 ativam o fator nuclear dos fatores de transcrição κB (NF-κB) e a proteína de ativação 1 (AP-1). Esses fatores de transcrição estimulam a expressão de diversas enzimas nos fagolisossomos dos macrófagos, incluindo a oxidase dos fagócitos, que induz a produção de espécies de oxigênio reativo (ROS); óxido nítrico sintase induzível (iNOS), que estimula a produção de óxido nítrico (NO); e enzimas lisossômicas. Essas substâncias destroem os micro-organismos ingeridos nas vesículas e são responsáveis pela função microbicida dos macrófagos ativados.
• O IFN-γ atua nas células B para promover a mudança a certas subclasses de IgG, nomeadamente para a IgG2a ou IgG2c (nos camundongos), e para inibir a mudança para isótipos dependentes de IL-4, como a IgE. As subclasses de IgG induzidas pelo IFN-γ se ligam aos receptores Fcγ nos fagócitos e ativam o complemento, e ambos os mecanismos promovem a fagocitose de micro-organismos opsonizados (Cap. 12). Assim, o IFN-γ induz as respostas dos anticorpos, que também participam na eliminação de micro-organismos mediada por fagócitos, em conjunto com os efeitos de ativação direta dos macrófagos dessa citocina. O mecanismo de mudança do isótipo e o papel das citocinas nesse processo serão descritos no Capítulo 11. Essa ação do IFN-γ nas células B é mais bem estabelecida nos camundongos que nos seres humanos.
• O IFN-γ promove a diferenciação de células T CD4+ para o subgrupo TH1 e inibe a diferenciação de células TH2 e TH17. Essas ações do IFN-γ servem para ampliar a resposta de TH1 e foram descritas no Capítulo 9.
• O IFN-γ estimula a expressão de diversas proteínas diferentes que contribuem para o aprimoramento da apresentação de antígenos associados à MHC e à iniciação e ampliação de respostas imunológicas dependentes da célula T (Fig. 6-9, Cap. 6). Essas proteínas incluem as moléculas MHC; muitas proteínas envolvidas no processamento de antígenos, incluindo o transportador associado ao processamento do antígeno (TAP); componentes do proteassoma; HLA-DM; e coestimuladores B7 nas APC.
As ações do IFN-γ juntas resultam no aumento da ingestão de micro-organismos e na destruição de patógenos ingeridos. Os indivíduos com raras mutações inativadas herdadas no receptor de IFN-γ e camundongos knockout com ausência de IFN-γ ou receptores de IFN-γ ou moléculas necessárias para a diferenciação de TH1 ou para a sinalização de IFN-γ (IL-12, T-bet, STAT1) são suscetíveis às infecções por micro-organismos intracelulares, como micobactérias, em razão da morte de micro-organismos mediada por macrófagos defeituosos.
Outras Citocinas TH1
Além do IFN-γ, as células TH1 produzem TNF e diversas quimiocinas, que contribuem para o recrutamento de leucócitos e aumento da inflamação. Surpreendente de alguma forma, as células TH1 também são fontes importantes de IL-10, que funciona principalmente para inibir as células dendríticas e os macrófagos e, portanto, para suprimir a ativação de TH1. Esse é um exemplo de circuito de feedback negativo em resposta às células T.
A Ativação Clássica do Macrófago Mediada por TH1 e a Morte de Micro-organismos Fagocitados
Nas respostas imunológicas mediadas por células contra os micro-organismos fagocitados, as células T reconhecem especificamente os antígenos microbianos, mas os fagócitos na verdade destroem os patógenos. Esse conceito fundamental foi levantado de estudos da imunidade mediada por células para a bactéria intracelular Listeria monocytogenes (Fig. 10-6). Foi mostrado nos anos de 1950, que os camundongos infectados com uma baixa dose de Listeria foram protegidos contra doses letais mais altas e desafiantes. A proteção poderia ser transferida para animais virgens com linfócitos (demonstrados posteriormente serem linfócitos T) de camundongos infectados, mas não com o soro. In vitro, as bactérias eram destruídas, não por células T de animais imunes, mas por macrófagos ativados, enfatizando o papel central dos macrófagos na execução da função efetora.
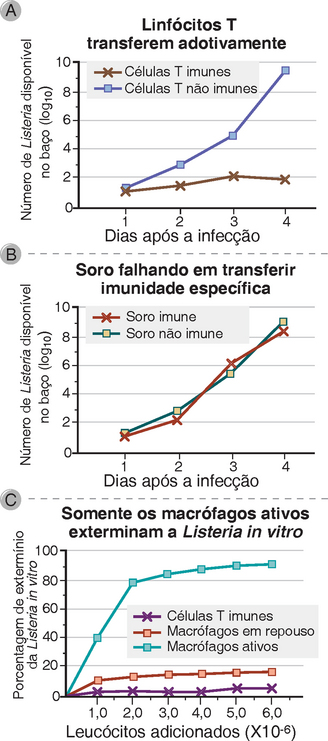
FIGURA 10-6 A imunidade mediada por células para Listeria monocytogenes. A imunidade para a L. monocytogenes é medida por meio da inibição pelo crescimento bacteriano no baço de animais inoculado com uma dose conhecida de bactérias viáveis. Essa imunidade pode ser transferida para os camundongos normais pelos linfócitos T (A), mas não por soro (B) dos camundongos singênicos previamente imunizados com doses baixas ou letais de L. monocytogenes. Em um ensaio in vitro de imunidade mediada por células, as bactérias são realmente mortas por macrófagos ativados e não por células (C).
Em qualquer sítio da infecção, como parte da resposta imunológica inata, os monócitos são recrutados do sangue para os tecidos por quimiocinas produzidas por macrófagos e outras células residentes no sítio (Cap. 4). Esses monócitos amadurecem em macrófagos teciduais e primeiro tentam fagocitar e destruir o patógeno. Se o micro-organismo evoluiu para resistir à eliminação pelos macrófagos, ele sobrevive dentro dos fagossomos. Nessas células infectadas, os peptídeos microbianos são processados e apresentados como peptídeos associados às moléculas MHC de classe II. Ao mesmo tempo, as células efetoras TH1 são geradas em uma resposta imunológica adaptativa nos tecidos linfoides secundários, por processos descritos no Capítulo 9. Essas células T são recrutadas para o sítio da infecção, onde reconhecem peptídeos antigênicos (os mesmos que iniciaram a resposta) apresentados pelos macrófagos que suportam os micro-organismos. Os macrófagos são expostos a sinais das células efetoras TH1, que os ativam para matar os micro-organismos ingeridos. A ativação consiste em alterações quantitativas na expressão de várias proteínas que conferem aos macrófagos ativados a capacidade de desempenhar algumas funções especializadas, como morte microbiana. Nas seções seguintes, descreveremos os sinais das células T que ativam os macrófagos nas reações imunológicas mediadas por células e as funções desses macrófagos.
As células TH1 CD4+ ativam os macrófagos com sinais mediados por contato entregues pelas interações CD40L-CD40 e pelo IFN-γ (Fig. 10-7). Quando as células TH1 são estimuladas pelo antígeno, as células expressam o CD40L em sua superfície e secretam o IFN-γ. As ações do IFN-γ nos macrófagos, descritas anteriormente, entram em sinergia com o ligante CD40, e juntas elas são potentes estímulos para a ativação de macrófagos. A importância da via CD40 na imunidade mediada pela célula é ilustrada pelos defeitos imunológicos nos seres humanos que herdaram mutações no CD40L (síndrome de hiper-IgM ligada ao X) e nos camundongos em que os genes para o CD40 ou para o CD40L são eliminados (Cap. 20). Todos esses distúrbios são caracterizados por deficiências graves na imunidade mediada por células para os micro-organismos intracelulares, e as crianças com a síndrome de hiper-IgM ligada ao X frequentemente sucumbem à infecção pelo patógeno intracelular Pneumocystis jiroveci. Como esperado, esses pacientes e os camundongos knockout também têm defeitos na produção de anticorpos dependentes de células T auxiliares. A necessidade de interações entre as moléculas CD40 das superfícies nos macrófagos e as CD40L nas células T assegura que os macrófagos que estão apresentando antígenos para as células T (ou seja, os macrófagos que estão abrigando micro-organismos intracelulares) também são os macrófagos mais eficientemente ativados pelas células T. O papel do IFN-γ como a citocina de maior ativação do macrófago foi discutido anteriormente. Os mesmos princípios são aplicáveis para a ativação dos linfócitos B dependentes da célula T – as células T auxiliares estimulam a proliferação e a diferenciação dos linfócitos B pelos sinais e as citocinas mediados pelo CD40 (Cap. 11).
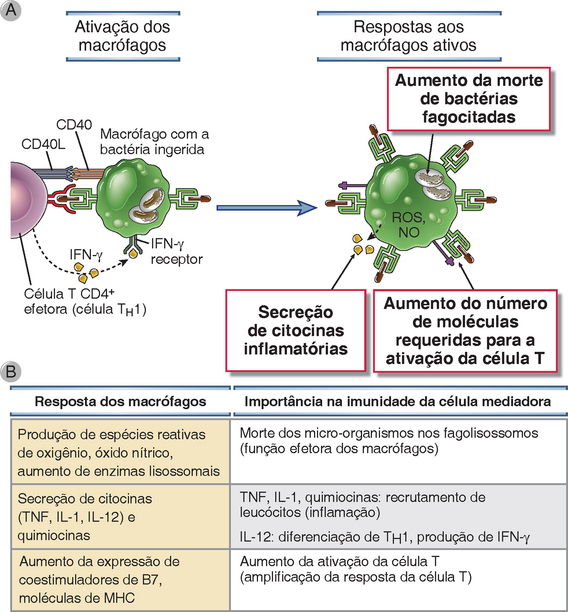
FIGURA 10-7 Ativação dos macrófagos pelas células TH1. A, Os macrófagos são ativados pelas interações CD40L-CD40 e pelo IFN-γ expresso pelas células TH1 e desempenha diversas funções que matam os micro-organismos, estimulam a inflamação e aumentam a capacidade de apresentação dos antígenos das células. B, As moléculas principais que medeiam as funções dos macrófagos são listadas. Os macrófagos também são ativados durante reações imunológicas inatas e executam as mesmas funções (Cap. 4).
Os macrófagos ativados matam os micro-organismos fagocitados, principalmente pelas ações das espécies reativas de oxigênio, óxido nítrico e enzimas lisossômicas. Todos esses potentes agentes microbicidas são produzidos dentro dos lisossomos dos macrófagos e matam os micro-organismos ingeridos depois que os fagossomos se fundem aos lisossomos (Cap. 4, Fig. 4-12). Essas substâncias tóxicas podem também ser liberadas dentro de tecidos adjacentes, onde eliminam os micro-organismos extracelulares e podem causar lesão ao tecido normal. Essa via de ativação dos macrófagos é chamada de clássica (Fig. 10-8) para distingui-la da ativação alternativa, descrita posteriormente.
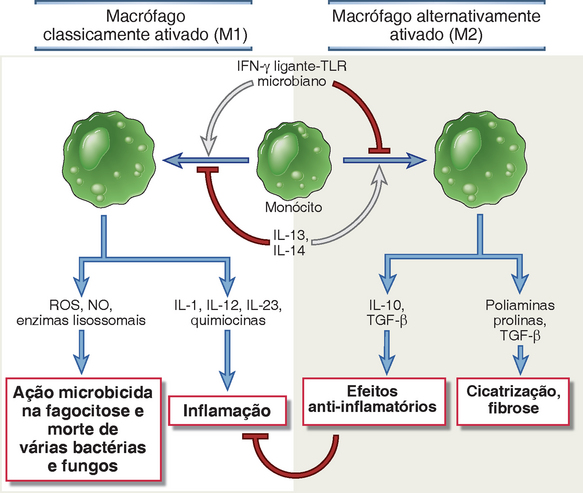
FIGURA 10-8 Ativação dos macrófagos alternativos e clássicos. Subconjuntos dos macrófagos ativados. Diferentes estímulos ativam os monócitos-macrófagos a se desenvolverem em populações funcionalmente distintas. Os macrófagos ativados classicamente são induzidos por produtos microbianos e citocinas, particularmente o IFN-γ, e são microbicidas e envolvidos na inflamação potencialmente prejudicial. Os macrófagos alternativamente ativados são induzidos pela IL-4 e pela IL-13 produzidas pelas células TH2 e outros leucócitos, e são importantes no reparo dos tecidos e na fibrose.
Os macrófagos ativados são envolvidos em várias outras reações de defesa do hospedeiro (Fig. 10-7). Eles estimulam a inflamação por meio da secreção de citocinas, principalmente de TNF, IL-1 e quimiocinas, e mediadores lipídicos de curta duração, como prostaglandinas, leucotrienos e fator ativador das plaquetas. A ação coletiva dessas citocinas derivadas dos macrófagos e mediadores lipídicos é recrutar mais leucócitos, o que melhora a capacidade de destruir os organismos infecciosos. Os macrófagos ativados ampliam as respostas imunológicas mediadas pelas células tornando as APC mais eficientes em razão dos níveis aumentados das moléculas envolvidas no processamento de antígenos e na expressão de superfície aumentada das moléculas MHC de classe II e coestimuladores, e por meio da produção de citocinas (como a IL-12), que estimula a diferenciação do linfócito T em células efetoras.
Algumas lesões teciduais podem normalmente acompanhar as reações imunológicas mediadas por células TH1 aos micro-organismos, porque os produtos microbicidas liberados pelos macrófagos e neutrófilos ativados são capazes de lesar o tecido normal e não discriminam entre micro-organismos e tecidos do hospedeiro. Entretanto, esse dano tecidual é normalmente limitado em extensão e duração e se resolve quando a infecção é debelada. Como mencionado anteriormente, a hipersensibilidade retardada é um exemplo de reação mediada por TH1 que pode provocar lesão significativa no tecido (Cap. 18).
Funções das Células TH2
As células TH2 estimulam as reações mediadas por IgE e eosinófilos que servem para erradicar infecções helmínticas (Fig. 10-9). Os helmintos são muito grandes para serem fagocitados por neutrófilos e macrófagos e podem ser muito mais resistentes às atividades microbicidas desses fagócitos do que a maioria das bactérias e dos vírus. Portanto, mecanismos especiais são necessários para a defesa contra infecções helmínticas. As células TH2 secretam IL-4, IL-5 e IL-13, que trabalham em conjunto para erradicar as infecções. Primeiro descreveremos as propriedades dessas citocinas e seu papel na defesa do hospedeiro.
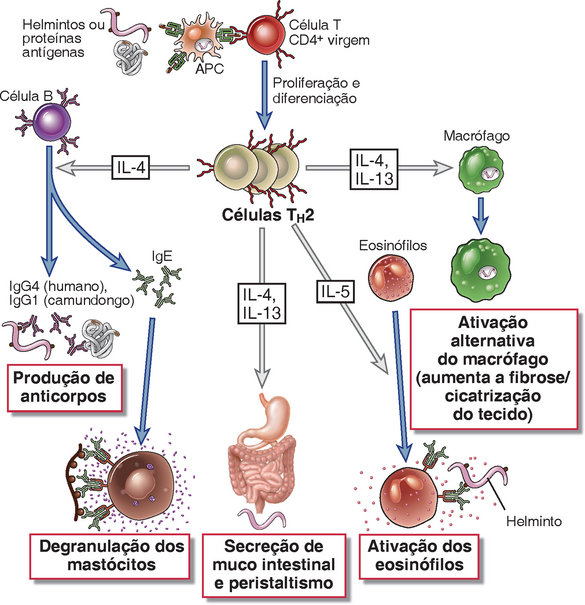
FIGURA 10-9 Funções das células TH2. As células T CD4+ que se diferenciam em células TH2 que secretam IL-4, IL-5 e IL-13. A IL-4 (e a IL-13) atua nas células B para estimular a produção de anticorpos que se ligam aos mastócitos, como o IgE. A IL-4 também é um crescimento autócrino e citocina de diferenciação para células TH2. A IL-5 ativa os eosinófilos, uma resposta que é importante para a defesa contra as infecções helmínticas. A IL-4 e a IL-13 estão envolvidas na imunidade à barreira, a induzir uma via alternativa de ativação de macrófagos, e a inibir a ativação clássica de macrófagos mediados por TH1.
Citocinas Produzidas pelas Células TH2
As funções das células TH2 são mediadas pela IL-4, que induz as respostas dos anticorpos IgE; pela IL-5, que ativa os eosinófilos; e pela IL-13, que tem diversas ações.
Interleucina 4
A IL-4 é o maior estímulo para a produção de anticorpos IgE e para o desenvolvimento de células TH2 de células T CD4+ auxiliares. A IL-4 é a citocina da assinatura do subgrupo TH2 e funciona tanto como uma citocina indutora como efetora dessas células.
A IL-4 é um membro das quatro famílias de citocina α-helicoidais. As principais fontes celulares da IL-4 são os linfócitos T CD4+ do subgrupo TH2 e mastócitos ativados. O receptor IL-4 das células linfoides consiste em uma cadeia α de ligação de citocinas, que é um membro da família de receptores de citocina do tipo I, associado à cadeia γc compartilhada por outros receptores de citocinas. Esse receptor de IL-4Rαγc sinaliza por meio da via JAK-STAT (JAK1, JAK3 e o STAT6) e de uma via que envolve o substrato da resposta à insulina (IRS) chamada IRS-2. A IL-4 e a IL-13 ativam a proteína STAT6, que induz a transcrição de genes responsáveis por muitas das ações dessas citocinas. A IL-4 também se liga ao receptor IL-13 (descrito a seguir).
A IL-4 tem ações importantes em diversos tipos celulares.
• A IL-4 estimula a mudança da classe da cadeia pesada Ig da célula B para o isótipo IgE. Os mecanismos da mudança de classe serão descritos no Capítulo 11. Os camundongos knockout sem IL-4 têm menos de 10% dos níveis normais de IgE. Os anticorpos IgE desempenham um papel na defesa mediada por eosinófilos contra infecções helmínticas (e alguns artrópodes). A IgE também é o principal mediador das reações de hipersensibilidade imediata (alérgicas), e a produção de IL-4 é importante para o desenvolvimento de alergias (Cap. 19). A IL-4 também melhora a mudança para o IgG4 (nos seres humanos, ou o homólogo IgG1 nos camundongos) e inibe a mudança para os isótipos IgG2a e IgG3 nos camundongos, ambos estimulados pelo IFN-γ. Essa é uma das diversas ações antagônicas recíprocas da IL-4 e do IFN-γ. A IL-13 também pode contribuir para a mudança ao isótipo IgE.
• A IL-4 estimula o desenvolvimento de células TH2 e funciona como um fator de crescimento autócrino para células diferenciadas TH2. Essa função da IL-4 foi descrita no Capítulo 9.
• A IL-4, junto com a IL-13, contribui para uma forma alternativa de ativação dos macrófagos que é diferente da resposta dos macrófagos ao IFN-γ e será descrita posteriormente. Na verdade, a IL-4 e a IL-13 suprimem a ativação clássica dos macrófagos mediada pelo IFN-γ e inibe, assim, a defesa contra micro-organismos intracelulares.
• A IL-4 (e a IL-13) estimula o peristaltismo do trato gastrointestinal, e a IL-13 aumenta a secreção do muco das vias aéreas e das células epiteliais intestinais. Ambas as ações contribuem para a eliminação de micro-organismos em superfícies epiteliais.
• A IL-4 e a IL-13 estimulam o agrupamento de leucócitos, principalmente de eosinófilos, com a promoção da expressão de moléculas de adesão no endotélio e a secreção de quimiocinas que se ligam aos receptores da quimiocina expressos nos eosinófilos.
Interleucina 13
A IL-13 é estrutural e funcionalmente semelhante à IL-4 e também desempenha um papel fundamental na defesa contra os helmintos (Cap. 15) e nas doenças alérgicas (Cap. 19). A IL-13 é membro da família das citocinas em α-hélicas, com homologia de sequência limitada, mas semelhança estrutural significativa com a IL-4. A IL-13 é produzida principalmente pelo subgrupo TH2, mas basófilos, eosinófilos e células T NK também podem produzir a citocina. O receptor funcional de IL-13 é um heterodímero da cadeia IL-4Rα e da cadeia IL-13Rα1. Esse complexo pode se ligar tanto a IL-4 como a IL-13 com alta afinidade, e é responsável pelo fato de a maioria dos efeitos biológicos da IL-13 ser compartilhada com a IL-4. O receptor é expresso em uma ampla variedade de células, incluindo células B, fagócitos mononucleares, células dendríticas, eosinófilos, basófilos, fibroblastos, células endoteliais e células epiteliais brônquicas. As células T não expressam o receptor de IL-13. A sinalização IL-13R é semelhante à sinalização IL-4R.
A IL-13 trabalha em conjunto com a IL-4 na produção de efeitos biológicos associados à inflamação alérgica, discutidos em detalhes no Capítulo 19, e na defesa contra os helmintos. Algumas das ações da IL-13 se sobrepõem às da IL-4, e outras são distintas. As funções da IL-13 com a IL-4 induzem à ativação dos macrófagos alternativos, que contribuem para reparar os tecidos e a fibrose. A IL-13 estimula a produção de muco pelas células epiteliais das vias aéreas, um componente importante de reações alérgicas como a asma. Conforme mencionando anteriormente, tanto a IL-13 como a IL-4 podem ativar as células B para mudar para IgE e para alguns isótipos de IgG e recrutar leucócitos. Ao contrário, a IL-4, e a IL-13 não estão envolvidas na diferenciação da TH2.
Interleucina 5
A IL-5 é um ativador de eosinófilos e serve como ligação principal entre a ativação das células T e a inflamação eosinofílica. É um homodímero de um polipeptídeo contendo um domínio helicoidal de quatro domínios em α hélice e é um membro da família de citocinas do tipo I. É produzido por células TH2 e por mastócitos ativados. O receptor IL-5 é um heterodímero composto de uma única cadeia α e uma cadeia β comum (βc), que também faz parte da IL-3 e dos receptores do fator estimulante da colônia de granulócitos-macrófagos (GM-CSF) (Fig. 7-23, Cap. 7). A maior via de sinalização induzida pela IL-5 envolve o JAK2 e o STAT3.
As principais ações da IL-5 são ativar eosinófilos maduros e estimular o crescimento e a diferenciação de eosinófilos. Os eosinófilos ativados são capazes de matar os helmintos. Os eosinófilos expressam receptores Fc específicos para IgE e alguns anticorpos IgG, e são, portanto, capazes de se ligar aos micro-organismos, como os helmintos, que são opsonizados por esses anticorpos. A IL-5 também estimula a produção de anticorpos IgA.
Os Papéis das Células TH2 na Defesa do Hospedeiro
A seguir descrevemos a função das células TH2 na defesa contra as infecções helmínticas pelos diversos mecanismos (Fig. 10-9).
• Reações mediadas por IgE e por eosinófilos. A IL-4 (e a IL-13) estimula a produção de anticorpos IgE específicos para helmintos, que os opsonizam e promovem a ligação dos eosinófilos. A IL-5 ativa os eosinófilos e essas células liberam o conteúdo de seus grânulos, incluindo as principais proteínas básicas e as principais proteínas catiônicas, capazes de destruir até mesmo os tegumentos duros dos helmintos (Caps. 15 e 19).
• Ativação dos mastócitos. Os mastócitos expressam receptores Fcε de alta afinidade e podem ser ativados por helmintos revestidos por IgE e outros antígenos que se ligam à IgE, resultando em desgranulação. O conteúdo dos grânulos dos mastócitos inclui as aminas vasoativas, e os mastócitos secretam citocinas como as TNF e as quimiocinas, e os mediadores lipídicos, todos os quais induzem à inflamação sítio que ajuda a destruir os parasitas. Os mediadores dos mastócitos também são responsáveis pelas anormalidades vasculares e pela inflamação nas reações alérgicas (Cap. 19).
• Imunidade à barreira. As citocinas produzidas pelas células TH2 são envolvidas no bloqueio da entrada e na promoção da expulsão de micro-organismos dos órgãos da mucosa. Por exemplo, a IL-13 estimula a produção de muco, e a IL-4 e a IL-13 podem estimular o peristaltismo no sistema gastrointestinal. Assim, as células TH2 desempenham um importante papel na defesa do hospedeiro nas barreiras com o ambiente externo, algumas vezes chamada de imunidade à barreira.
• Ativação alternativa dos macrófagos. A IL-4 e a IL-13 ativam os macrófagos para expressar enzimas que promovem a síntese do colágeno e a fibrose. A resposta dos macrófagos às citocinas TH2 foi chamada de ativação alternativa dos macrófagos (Fig. 9-8) para distingui-la da ativação induzida por IFN-γ, que foi caracterizada primeiro (e por isso a denominação “clássica”) e que resulta em potentes funções microbicidas. Os macrófagos ativados pelas citocinas TH2 contribuem para a remodelagem tecidual e para a fibrose na definição das infecções parasitárias crônicas e doenças alérgicas. Alternativamente, os macrófagos ativados também podem servir para iniciar o reparo após diversos tipos de lesões teciduais que podem não envolver agentes infecciosos ou respostas imunológicas; nessas situações, as citocinas de ativação, como a IL-4, podem ser produzidas por eosinófilos e outros tipos de células nos tecidos. Os macrófagos ativados alternativamente induzem a formação de tecido fibroso por meio dos fatores de crescimento secretados que estimulam proliferação de fibroblastos (fator de crescimento derivado das plaquetas), síntese do colágeno (fator de crescimento transformador-β [TGF-β]) e formação de novos vasos sanguíneos ou angiogênese (fator de crescimento dos fibroblastos). As citocinas TH2 suprimem a ativação dos macrófagos clássicos e interferem nas respostas imunológicas mediadas por TH1 protetores para infecções intracelulares (Cap. 15). A supressão da ativação dos macrófagos clássicos se deve, em parte, à IL-4 que estimula a produção de citocinas como a IL-10 e a TGF-β, que inibem o desenvolvimento e a função da TH1.
Funções das Células TH17
As células TH17 secretam citocinas que recrutam leucócitos, principalmente neutrófilos, para os sítios de infecção (Fig. 10-10). Como os neutrófilos são um grande mecanismo de defesa contra bactérias e fungos extracelulares, as células TH17 desempenham um papel importante na defesa contra essas infecções.
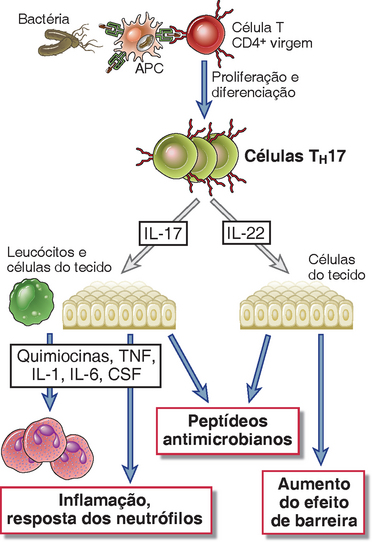
FIGURA 10-10 Funções das células TH17. As citocinas produzidas pelas células TH17 estimulam a produção sítio das quimiocinas e inflamação e produção dos peptídeos antimicrobianos (defensinas) e, também promovem as funções da barreira epitelial.
Citocinas Produzidas pelas Células TH17
As células TH17 produzem várias citocinas. A maioria das ações inflamatórias dessas células é mediada pela IL-17, mas outras citocinas produzidas por esse subgrupo também podem contribuir.
Interleucina 17
A IL-17 é uma citocina incomum porque nem ela nem seu receptor são homólogos a qualquer outro par conhecido de receptores de citocina. A família das IL-17 inclui seis proteínas relacionadas estruturalmente, das quais a IL-17A e a IL-17F são as mais semelhantes, e as atividades imunológicas parecem ser mediadas principalmente pela IL-17A. A IL-17A e a IL-17F são produzidas principalmente pelas células TH17, enquanto os outros membros da família são produzidos por diversos tipos de células. Os receptores IL-17 são multiméricos e expressos em uma ampla variedade de células. Sua estrutura e seus mecanismos de sinalização não são bem definidos.
A IL-17 é uma ligação importante entre a imunidade adaptativa mediada por células T e o sistema imunológico inato, especialmente o componente inflamatório das respostas inatas.
• A IL-17 induz às reações inflamatórias ricas em neutrófilos. Ela estimula a produção de quimiocinas e outras citocinas (como a TNF) que recrutam neutrófilos e, em menor grau, monócitos para o sítio da ativação de células T. Ela também aumenta a geração de neutrófilos, aumentando a produção de G-CSF e a expressão de seus receptores.
• A IL-17 estimula a produção de substâncias antimicrobianas, incluindo as defensinas, de numerosos tipos de células.
Outras Citocinas TH17
A IL-22 é um membro da família de citocinas IL-10. Ela é produzida pelas células T ativadas, particularmente pelas células TH17, e pelas células NK. As ações da IL-22 parecem contraditórias. Alguns estudos indicam que ela contribui para inflamação e lesão tecidual, mas a maior parte dos dados disponíveis sugere que ela é produzida nos tecidos epiteliais, especialmente da pele e do trato gastrointestinal, e serve para manter a integridade epitelial, principalmente promovendo a função de barreira dos epitélios e estimulando as reações de reparo.
A IL-21 é produzida por células T CD4+ ativadas, incluindo as células TH17, que tem uma grande variedade de efeitos nas células B, T e NK. O receptor da IL-21 pertence à família de receptores da citocina tipo I, e consiste em uma cadeia de ligação do ligante e a subunidade γc, ativando uma via de sinalização JAK-STAT em que o STAT3 fica especialmente proeminente. Uma função importante da IL-21 está nas respostas dos anticorpos, especialmente nas reações que ocorrem nos centros germinativos (Cap. 11). A IL-21 é necessária para a geração das células T auxiliares foliculares e também é produzida pelas células auxiliares foliculares e estimula as células B nos centros germinativos. A IL-21 também mostrou promover a diferenciação das células TH17, especialmente nos seres humanos, proporcionando uma via autócrina para ampliar as respostas TH17. Algumas das outras relações reportadas da IL-21 incluem o aumento da proliferação e da função efetora das células CD8+ T e das células NK.
Papéis das Células TH17 na Defesa do Hospedeiro
A principal função efetora das células TH17 é induzir a inflamação neutrofílica, que serve para destruir bactérias e fungos extracelulares (Fig. 10-10). A capacidade da IL-17 de recrutar neutrófilos é responsável pelo papel central das células TH17 nas reações imunológicas adaptativas em que a inflamação neutrofílica é proeminente. Os neutrófilos recrutados ingerem e matam os micro-organismos extracelulares, incluindo fungos e bactérias. A importância do papel das células TH17 é ilustrada pela doença herdada chamada de síndrome de hiper-IgE (ou síndrome de Job), que é caracterizada pelo aumento da suscetibilidade às infecções fúngicas e bacterianas cutâneas, e é provocada por mutações no fator de transcrição STAT3, que é essencial para o desenvolvimento das células TH17 (Cap. 9).
As células TH17 também são importantes na patogênese de muitas doenças inflamatórias, como psoríase, doença inflamatória intestinal, artrite reumatoide e esclerose múltipla. Os anticorpos que bloqueiam o desenvolvimento ou as funções das células TH17 estão nos ensaios clínicos para várias dessas doenças. As células TH1 e TH17 podem ambas estar presentes nas lesões dessas doenças, e sua contribuição relativa para o desenvolvimento e a propagação desses distúrbios é uma área de pesquisa ativa. As células TH17 também podem servir para manter a função epitelial normal do intestino e da pele, principalmente em virtude das ações da IL-22.
FUNÇÕES EFETORAS DOS LINFÓCITOS T CITOTÓXICOS CD8+
Os CTL CD8+ eliminam os micro-organismos intracelulares principalmente com a morte das células infectadas (Fig. 10-1B). O desenvolvimento de uma resposta dos CTL CD8+ à infecção continua pelas etapas semelhantes conforme aqueles descritos para as respostas às células T CD4+, incluindo o estímulo de células T CD8+ virgens nos órgãos linfoides mediadas por antígenos, expansão clonal, diferenciação e migração dos CTL diferenciados em tecidos. Esses eventos foram descritos no Capítulo 9. Além de direcionar a morte celular, as células T CD8+ secretam IFN-γ e contribuem, assim, com a ativação dos macrófagos na defesa do hospedeiro e nas reações de hipersensibilidade. Aqui discutiremos os mecanismos pelos quais os CTL diferenciados matam as células que abrigam os micro-organismos.
Mecanismos de Citotoxidade Mediada por CTL
A morte mediada por CTL envolve o reconhecimento específico das células-alvo e a entrega de proteínas que induzem à morte celular. Os CTL matam os alvos que expressam os antígenos associados à mesma classe I que desencadearam a proliferação e a diferenciação das células T CD8+ virgens das quais eles são derivados, e não matam células não infectadas adjacentes que não expressam esse antígeno. De fato, mesmo os próprios CTL não são lesados durante a morte dos alvos que expressam os antígenos. Essa especificidade da função efetora dos CTL assegura que células normais não sejam destruídas por CTL que estão reagindo contra células infectadas. A morte é altamente específica porque uma “sinapse imunológica” (Cap. 6) é formada no sítio de contato do CTL e no alvo expresso pelo antígeno, e as moléculas que realmente matam são aquelas secretadas na sinapse, e não podem ser difundidas por outras células vizinhas.
O processo de extermínio de alvos mediado por CTL consiste no reconhecimento de antígenos, na ativação dos CTL, na liberação do “tiro letal” que mata as células-alvo e na liberação dos CTL (Fig. 10-11). Cada uma dessas etapas é controlada por interações moleculares específicas.
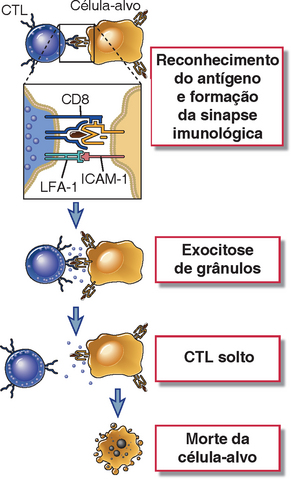
FIGURA 10-11 Etapas na lise mediada por CTL das células-alvo. Um CTL reconhece a célula-alvo expressa pelo antígeno e é ativado. A ativação resulta na liberação do conteúdo de grânulos do CTL na célula-alvo pela área de contato (sinapse imunológica). O conteúdo dos grânulos extermina o alvo. O CTL pode se soltar e matar as células-alvo. A formação de conjugados entre um CTL e seu alvo e a ativação do CTL também exige interações entre as moléculas acessórias (LFA-1, CD8) no CTL e seus ligantes específicos na célula-alvo; esses não são mostrados.
Reconhecimento do Antígeno e Ativação dos CTL
O CTL se liga e reage à célula-alvo usando receptor antigênico, coreceptor (CD8) e moléculas de adesão. Para serem eficientemente reconhecidas pelos CTL, as células-alvo devem expressar as moléculas MHC do tipo I complexadas para um peptídeo (o complexo que serve como ligante para o receptor da célula T [TCR] e o coreceptor CD8) e a molécula de adesão intercelular 1 (ICAM-1, o ligante principal para a integrina LFA-1). Os CTL e suas células-alvo foram conjugados (Fig. 10-12). Essa sinapse imunológica (Cap. 7) formada entre as duas células é caracterizada por um anel de justaposição entre o CTL e as membranas da célula-alvo, mediada pela ligação LFA-1-ICAM-1, e um espaço fechado ou espaço dentro do anel. Regiões distintas da membrana do CTL podem ser observadas por microscopia de imunofluorescência dentro do anel, incluindo uma área de sinalização, que inclui o TCR, proteína cinase C-θ e o Lck, e um domínio secretor, que aparece como uma lacuna em um lado da área de sinalização. Essa interação resulta na iniciação dos sinais bioquímicos que ativam o CTL, que são essencialmente os mesmos que os sinais envolvidos na ativação das células T auxiliares (Cap. 7). As citocinas e os coestimuladores fornecidos pelas células dendríticas, necessários para a diferenciação das células T CD8+ virgens em CTL, não são necessários para desencadear a função efetora dos CTL (ou seja, matar as células-alvo). Portanto, uma vez que as células T CD8+ específicas para um antígeno tenham se diferenciado em CTL completamente funcionais, elas podem matar qualquer célula nucleada que exibir aquele antígeno.
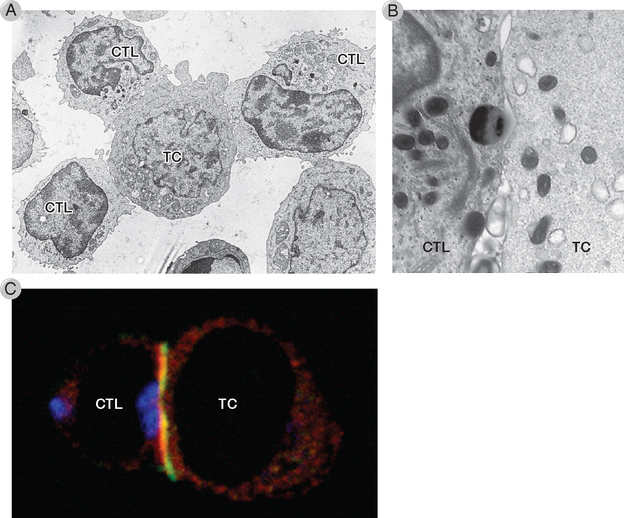
FIGURA 10-12 Formação dos conjugados entre os CTL e uma célula-alvo. A, Micrografia eletrônica dos três CTL de uma linha celular clonada específica para a molécula MHC humana HLA-A2 que se liga a uma célula-alvo (TC) que expressa HLA-A2 dentro de um minuto depois que os CTL e os alvos são misturados. Observe que no CTL, no canto superior esquerdo, os grânulos foram redistribuídos para a célula-alvo. B, Micrografia eletrônica do ponto de contato da membrana entre um CTL (esquerda) e a célula-alvo (direita). Os dois grânulos CTL estão próximos à sinapse. Diversas mitocôndrias também são visíveis. C, Micrografia de fluorescência confocal de uma sinapse imunológica entre um CTL (esquerda) e uma célula-alvo (direita) corada com anticorpos contra catepsinas em um grânulo secretor (azul), LFA-1 (verde), e a talina das proteínas citoesqueléticas (vermelha). A imagem demonstra a localização central do grânulo secretor e a localização periférica da molécula de adesão LFA-1 e a talina da proteína citoesquelética associada.
A, (Cortesia de Dr. P. Peters, Netherlands Cancer Institute, Amsterdã.) B, (Reproduzido do Stinchcombe JC, G Bossi, S Booth, e GM Griffiths. The immunological synapse of CTL contains a secretory domain and membrane bridges. Immunity 8:751-761, 2001, © Cell Press, com permissão da Elsevier). C, (Reproduzido de Stinchcombe JC, e GM Griffiths. The role of the secretory immunological synapse in killing by CD8+ CTL. Seminars in Immunology 15:301-305, © 2003 Elsevier Science Ltd., com permissão da Elsevier.)
Além do receptor das células T, os CTL CD8+ expressam receptores que também são expressos pelas células NK, que contribuem tanto para a regulação como para a ativação dos CTL. Alguns desses receptores pertencem à família de receptores que matam imunoglobulina (KIR), discutidos no Capítulo 4, e reconhecem as moléculas MHC de classe I nas células-alvo, mas não são específicos para um complexo específico peptídeo-MHC. Essa transdução de KIR de sinais inibidores pode servir para evitar que os CTL matem as células normais. Além disso, os CTL expressam o receptor NKG2D, descrito no Capítulo 4, que reconhece as moléculas MIC-A, MIC-B e ULBP, semelhantes às moléculas MHC do tipo I, expressas nas células infectadas ou neoplásicas. O NKG2D pode servir para liberar sinais que atuam junto com o reconhecimento do antígeno TCR a fim de aumentar a atividade destruidora.
Destruição das Células-alvo por CTL
Dentro de poucos minutos em que o receptor do antígeno de um CTL está reconhecendo seu antígeno em uma célula-alvo, a célula-alvo passa por mudanças que a induzem a morrer por apoptose. O extermínio da célula-alvo ocorre durante as próximas duas a seis horas e prossegue mesmo se o CTL se desprender. Assim, diz-se que o CTL libera um tiro letal na célula-alvo. O mecanismo principal de morte da célula-alvo mediada por CTL é a entrega das proteínas citotóxicas armazenadas dentro dos grânulos citoplasmáticos (também chamados de lisossomos secretores) para a célula-alvo, desencadeando, portanto, a apoptose da célula-alvo (Fig. 10-13). Conforme discutido anteriormente, o reconhecimento do alvo do CTL leva à ativação do CTL, uma consequência da reorganização do citoesqueleto, de tal forma que o centro de organização do microtúbulo do CTL se movimenta para a área do citoplasma próxima ao contato com a célula-alvo. Os grânulos citoplasmáticos do CTL são transportados ao longo de microtúbulos e são concentrados na região da sinapse, e a membrana dos grânulos se funde com a membrana plasmática no domínio secretório. A fusão das membranas resulta em exocitose do conteúdo dos grânulos do CTL para o espaço confinado dentro do anel sináptico, entre as membranas plasmáticas do CTL e da célula-alvo.
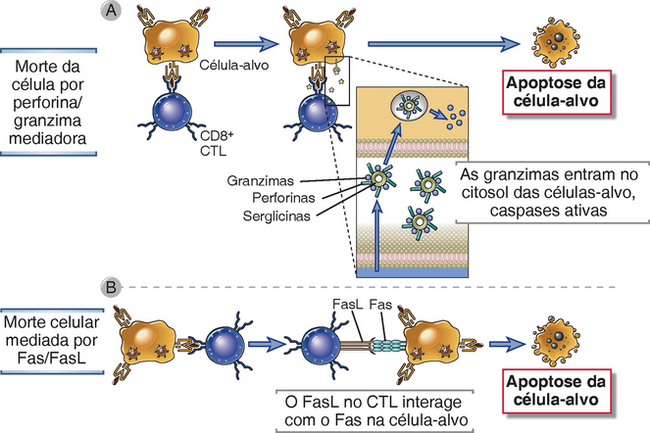
FIGURA 10-13 Mecanismos de morte mediada por CTL das células-alvo. Os CTL matam as células-alvo com dois mecanismos principais. A, Complexos de perforina e granzimas são liberados do CTL por exocitose dos grânulos e entrada nas células-alvo. As granzimas são entregues no citoplasma das células-alvo por um mecanismo dependente da perforina, e elas induzem a apoptose. B, A FasL é expressa nos CTL ativados, se junta ao Fas na superfície das células-alvo e induz a apoptose.
As proteínas citotóxicas nos grânulos dos CTL (e as células NK) incluem as granzimas e a perforina. As granzimas A, B e C são proteases serinas que clivam as proteínas depois dos resíduos de aspartato. A perforina é uma molécula que perturba a membrana homóloga à proteína complementar do C9. Os grânulos também contêm um proteoglicano sulfatado, o serglicina, que serve para montar um complexo que contém granzimas e perforina. A principal função da perforina é facilitar a entrega das granzimas para o citosol da célula-alvo. Como isso é realizado, ainda não está bem compreendido. A perforina pode polimerizar e formar poros aquosos na membrana da célula-alvo por meio dos quais as granzimas entram, mas não há prova de que isso seja crítico para a morte das células mediadas por CTL. De acordo com outro modelo atual, complexos de granzima B, perforina e serglicina são descarregados pelo CTL por sobre a célula-alvo e são internalizados para os endossomos por endocitose mediada por receptores. A perforina pode atuar sobre a membrana endossômica para facilitar a liberação das granzimas para dentro do citoplasma da célula-alvo. Uma vez no citoplasma, as granzimas clivam vários substratos, incluindo as caspases, e iniciam a morte apoptótica da célula. Por exemplo, a granzima B ativa a caspase-3, assim como o membro da família Bid, Bcl-2, que desencadeia a via mitocondrial da apoptose (Fig. 14-7, Cap. 14). Outra proteína encontrada nos grânulos de CTL humanos (e células NK), chamada granulisina, pode alterar a permeabilidade da célula-alvo e das membranas microbianas, mas sua importância na morte das células pelos CTL não é estabelecida.
Os CTL também usam um mecanismo de morte independente dos grânulos, que é mediado pelas interações das moléculas da membrana nos CTL e nas células-alvo. Sob ativação, os CTL expressam uma proteína da membrana, chamada ligante de Fas (FasL), que se liga ao receptor de morte Fas, expresso em muitos tipos celulares. Essa interação também resulta na ativação de caspases e apoptose de alvos que expressam o Fas (Fig. 14-7, Cap. 14). Os estudos com camundongos knockout que têm deficiência de perforina, granzima B, ou FasL indicam que as proteínas do grânulo são os principais mediadores da morte por CTL CD8+. Algumas células T CD4+ também são capazes de matar células-alvo (que, é claro, devem expressar peptídeos associados à MHC de classe II a serem reconhecidos pelas células CD4+). As células T CD4+ são deficientes em perforina e granzimas, e a FasL pode ser muito importante para sua atividade de morte.
Depois do golpe letal, o CTL é liberado de sua célula-alvo, que geralmente ocorre mesmo antes de a célula-alvo continuar a morrer. Os CTL em si não são lesados durante a morte da célula-alvo. A razão provável para isso é que o processo de exocitose do grânulo dirigido durante a morte mediada por CTL libera preferencialmente os conteúdos do grânulo para dentro da célula-alvo e para longe do CTL. Além disso, os grânulos dos CTL contêm uma enzima proteolítica chamada catepsina B, que é entregue para a superfície dos CTL na exocitose dos grânulos, onde degrada moléculas de perforina errantes que chegam à vizinhança da membrana dos CTL.
Papéis dos CTL CD8+ na Defesa do Hospedeiro
Em infecções por micro-organismos intracelulares, a atividade de morte dos CTL é importante para a erradicação do reservatório de infecção (Fig. 10-1B). Existem dois tipos de situações em que as células não podem destruir os micro-organismos que os infectam. Primeiro, alguns vírus vivem e se replicam nas células que são incapazes de destruir micro-organismos (tais como o vírus da hepatite nas células do fígado). Segundo, mesmo nos fagócitos, alguns micro-organismos escapam das vesículas e vivem no citoplasma, onde os mecanismos microbicidas dos fagócitos são ineficazes porque estão em grande parte restritos às vesículas (para proteger as células dos danos). Essas infecções podem ser eliminadas apenas por destruir as células infectadas, e nas respostas imunológicas adaptativas, os CTL CD8+ são o mecanismo principal para matar células infectadas. Além disso, as caspases ativadas nas células-alvo por granzimas e FasL clivam muitos substratos e ativam enzimas que degradam o DNA, mas elas não distinguem entre proteínas do hospedeiro e proteínas microbianas. Portanto, mediante a ativação de nucleases nas células-alvo, os CTL podem iniciar a destruição do DNA microbiano assim como do genoma da célula-alvo, eliminando, portanto, DNA potencialmente infeccioso. A expansão maciça das células T CD8+ que segue as infecções (Fig. 9-12, Cap. 9) fornece um grande conjunto de CTL para combater essas infecções. Os defeitos no desenvolvimento e na atividade dos CTL resultam no aumento da suscetibilidade às infecções virais e algumas bacterianas e à reativação de infecções virais latentes (tais como infecção pelo vírus Epstein-Barr), que são normalmente mantidos na verificação pelos CTL específicos do vírus.
A destruição das células infectadas por CTL é uma causa da lesão tecidual em algumas doenças. Por exemplo, na infecção pelos vírus da hepatite B e C, as células infectadas do fígado são mortas pela resposta do CTL ao hospedeiro (e às células NK) e não pelos vírus. Esses vírus não são citopáticos, mas o hospedeiro sente e reage contra o micro-organismo infeccioso e não é capaz de distinguir os micro-organismos que são intrinsecamente nocivos ou relativamente inofensivos (Cap. 18).
FUNÇÕES DE OUTROS SUBGRUPOS DE CÉLULAS T
A maioria das células T são as células CTL auxiliares CD4+ e CD8+. Além desses, existem populações menores de células T que têm características distintas e, provavelmente, têm funções especializadas na defesa do hospedeiro. As células mais definidas desses subgrupos são as células T γδ T e as células T NK. Ambos os subgrupos têm características comuns que os distinguem das células T CD4+ e CD8+.
• As células T γδ e as células T NK reconhecem uma grande variedade de antígenos, muitos dos quais não são peptídeos, e não são apresentados pelas moléculas MHC de classe I e II nas APC.
• Os receptores dos antígenos de muitas células T γδ e células NKT têm diversidade limitada, sugerindo que ambos os tipos de células podem ter evoluído para reconhecer um pequeno grupo de micro-organismos. Em razão dessa característica, diz-se que essas células T estão muitas vezes nos cruzamentos da imunidade adaptativa e inata.
• Ambos os tipos de células são abundantes nos tecidos epiteliais, como no trato gastrointestinal.
Células Tγδ
O receptor do antígeno dos linfócitos T CD4+ e CD8+ MHC-restrito é um heterodímero composto de cadeias α e β (Cap. 7). Há um segundo tipo de receptor distribuído de forma clonal composto por heterodímeros de cadeias γ e δ, que são homólogos às cadeias α e β dos TCR encontrados nos linfócitos T CD4+ e CD8+. As células T, que expressam o TCR γδ, representam uma linhagem distinta de mais numerosas células T expressando αβ. As porcentagens das células T γδ variam amplamente em diferentes tecidos e espécies, mas no geral, menos de 5% de todas as células T expressam essa forma de TCR. O heterodímero γδ associado ao CD3 e às proteínas ζ do mesmo modo que os heterodímeros TCR αβ fazem, e eventos típicos de sinalização induzidos por TCR das células T expressas por α β também são observados nas células T γδ T. Embora a diversidade potencial teórica da TCR γδ seja ainda maior do que a diversidade da TCR αβ, na realidade, apenas um número limitado de regiões γ e δ V são expressos em alguns subgrupos dessas células, e há pouca ou nenhuma diversidade juncional.
As diferentes populações de células T γδ podem desenvolver em momentos distintos, durante a ontogenia, contêm regiões V diferentes, residem nos diferentes tecidos e têm uma capacidade limitada para recircular entre esses tecidos. Nos camundongos, muitas células T da pele γδ se desenvolvem na vida neonatal e expressam uma TCR específica com essencialmente nenhuma variabilidade na região V, enquanto muitas das células T γδ na vagina, no útero e na língua aparecem mais tarde e expressam outra TCR com uma diferente região V. A diversidade limitada das TCR γδ em muitos tecidos sugere que os ligantes para esses receptores podem ser invariáveis e conservados. Uma característica intrigante das células T γδ T é sua abundância nos tecidos epiteliais de certas espécies. Por exemplo, mais de 50% dos linfócitos na mucosa do intestino delgado de camundongos e galinhas, chamada linfócitos intraepiteliais, são as células T γδ. Na pele do camundongo, a maioria das células T intraepidérmicas expressa o receptor γδ. As populações das células equivalentes não são tão abundantes nos seres humanos; apenas cerca de 10% das células T intraepiteliais do intestino humano expressam a TCR γδ. As células T γδ T nos órgãos linfoides expressam as TCR mais diversificadas do que as células epiteliais γδ.
As células T γδ não reconhecem antígenos dos peptídeos associados à MHC e não estão restritas à MHC. Alguns dos clones das células T γδ reconhecem pequenas moléculas fosforiladas, aminas alquilas, ou lipídios, que são comumente encontrados nas micobactérias e em outros micro-organismos e que podem ser apresentados pelas moléculas semelhantes às MHC não clássicas de classe I. Outras células T γδ T reconhecem antígenos de proteínas ou não proteínas que não exigem processamento de qualquer tipo particular de APC para sua apresentação. Muitas células T γδ são desencadeadas por proteínas de choque térmico microbianas. Uma hipótese de trabalho para a especificidade das células T γδ é que elas podem reconhecer antígenos que são frequentemente encontrados nos limites epiteliais entre o hospedeiro e o ambiente externo.
Uma série de atividades biológicas tem sido atribuída às células T γδ, incluindo a secreção de citocinas e a morte de células infectadas, mas a função dessas células permanece pouco compreendida. Foi postulado que esse subconjunto de células T pode iniciar respostas imunológicas aos micro-organismos nos epitélios, antes do agrupamento e da ativação de células T αβ específicas para o antígeno. No entanto, os camundongos com ausência de células T γδ, criados pelo rompimento planejado do gene TCR γ ou δ, têm pouca ou nenhuma imunodeficiência e apenas um aumento modesto na suscetibilidade às infecções por algumas bactérias intracelulares.
Células NKT
Uma pequena população de células T também expressa marcadores que são encontrados nas células NK, como o CD56; eles são chamados células NKT. As cadeias TCR α expressas por um subconjunto de células NKT têm diversidade limitada, e nos seres humanos, essas células são caracterizadas por uma região V codificada por um segmento de genes reorganizado Vα24-Jα18, com pouca ou nenhuma diversidade juncional, associada a uma das três cadeias β. Em razão dessa diversidade limitada, essas células também são chamadas células NKT invariantes (INKT). Outras células NKT existem e têm muitos receptores antígenos diversos. Todos os TCR das células NKT reconhecem os lipídios ligados às moléculas semelhantes às MHC de classe I. As células Tαβ que não expressam os marcadores NKT, mas reconhecem os antígenos lipídicos associados ao CD1 que também foram descritos, e essas células podem ser as células CD4+, CD8+, ou as células T CD4−CD8− αβ. As células NKT e outras células T específicas dos antígenos lipídicos são capazes de produzir rapidamente citocinas, como a IL-4 e o IFN-γ após a ativação, e eles podem ajudar as células B da zona marginal para produzir anticorpos contra antígenos lipídicos. As células NKT podem mediar às respostas imunológicas inatas protetoras contra alguns patógenos, como as bactérias (que têm paredes celulares ricas em lipídios), e as células NKT invariantes podem até regular respostas imunológicas adaptativas principalmente pelas citocinas secretoras. No entanto, os papéis dessas células na imunidade protetora ou na doença nos seres humanos não são claros.
• A imunidade mediada por células é a resposta imunológica adaptativa por micro-organismos dentro das células hospedeiras. Ela é mediada por linfócitos T e pode ser transferida de indivíduos imunizados para indivíduos inativos por meio de células T, e não por anticorpos.
• As células T efetoras diferenciadas são recrutadas preferencialmente para os sítios dos tecidos periféricos da infecção e de lesões teciduais, e as células que reconhecem os antígenos nos tecidos são mantidas. Esses eventos são mediados principalmente por moléculas de adesão e quimiocinas.
• Tanto as células T CD4+ e as células T CD8+ contribuem para a imunidade mediada por células, mas cada subgrupo tem funções efetoras únicas para a erradicação de infecções.
• Células TH1 CD4+ reconhecem os antígenos de micro-organismos que foram ingeridos pelos fagócitos e os ativam para matar os micro-organismos. A ativação dos macrófagos pelas células TH1 é mediada pelo IFN-γ e pelas interações CD40L-CD40. Os macrófagos ativados matam os micro-organismos fagocitados ingeridos nos fagolisossomos pelas ações de espécies reativas de oxigênio e de nitrogênio e enzimas (chamada ativação clássica dos macrófagos). Os macrófagos ativados também estimulam a inflamação e podem lesionar os tecidos.
• As células TH2 CD4+ reconhecem os antígenos produzidos por helmintos e outros micro-organismos, assim como os antígenos ambientais associados às alergias. A IL-4, secretada pelas células TH2 ativadas, promove a mudança do isótipo da célula B e a produção de IgE, que pode revestir os helmintos e mediar à desregulação e inflamação dos mastócitos. A IL-5 secretada por células TH2 ativa os eosinófilos para liberarem o conteúdo dos grânulos que destrói os helmintos, mas também pode lesionar os tecidos dos hospedeiros. A IL-4 e a IL-13, juntas, oferecem proteção nas barreiras epiteliais (imunidade à barreira) e induzem uma maneira alternativa de ativação dos macrófagos que gera macrófagos que medeiam o reparo dos tecidos e a fibrose.
• As células TH17 CD4+ estimulam as respostas inflamatórias ricas em neutrófilos que erradicam as bactérias extracelulares e os fungos. As células TH17 também podem ser importantes ao mediarem à lesão tecidual nas doenças autoimunes.
• Os CLT CD8+ matam as células que expressam peptídeos derivados dos antígenos citosólicos (p. ex., antígenos virais) que são apresentados em associação com as moléculas MHC de classe I. A morte por CTL é mediada principalmente pela exocitose dos grânulos, que libera granzimas e perforina. A perforina facilita a entrada de granzima no citoplasma das células-alvo, e as granzimas iniciam várias vias de apoptose. As células T CD8+ também secretam o IFN-γ e, portanto, podem participar na defesa contra os micro-organismos fagocitados e nas reações DTH.
• As células Tγδ e as células NKT são pequenas populações de linfócitos que expressam receptores de antígenos de diversidade limitada e reconhecem uma ampla variedade de antígenos, incluindo os peptídeos e pequenas moléculas (células γδ) e lipídios (células NKT). Algumas dessas células estão localizadas nos epitélios e acredita-se que respondam contra antígenos microbiais conservados. As funções dessas células não estão bem definidas.
Funções Efetoras das Células T CD4+
Littman DR, Rudensky AY. Th17 and regulatory T cells in mediating and restraining inflammation. Cell. 2010;140:845-858.
Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation. Immunity. 2008;28:454-467.
Spencer LA, Weller PF. Eosinophils and Th2 immunity: contemporary insights. Immunology and Cell Biology. 2010;88:244-249.
Wan YY, Flavell RA. How diverse—CD4 effector T cells and their functions. Journal of Molecular and Cell Biology. 2009;1:20-36.
Billiau A, Matthys P. Interferon-γ: a historical perspective. Cytokine and Growth Factor Reviews. 2009;20:97-113.
Gordon S, Martinez FO. Alternative activation of macrophages: mechanisms and functions. Immunity. 2010;32:593-604.
Martinez FO, Sica A, Mantovani A, Locati M. Macrophage activation and polarization. Frontiers in Bioscience. 2008;13:453-461.
Bossi G, Griffiths GM. CTL secretory lysosomes: biogenesis and secretion of a harmful organelle. Seminars in Immunology. 2005;17:87-94.
Catalfamo M, Henkart PA. Perforin and the granule exocytosis cytotoxicity pathway. Current Opinion in Immunology. 2003;15:522-527.
Lieberman J. The ABCs of granule-mediated cytotoxicity: new weapons in the arsenal. Nature Reviews Immunology. 2003;3:361-370.
Russell JH, Ley TJ. Lymphocyte-mediated cytotoxicity. Annual Review of Immunology. 2002;20:323-370.
Williams MA, Bevan MJ. Effector and memory CTL differentiation. Annual Review of Immunology. 2007;25:171-192.
Wong P, Pamer EG. CD8 T cell responses to infectious pathogens. Annual Review of Immunology. 2003;21:29-70.
Outras Populações de Células T
Bendelac A, Savage PB, Teyton L. The biology of NKT cells. Annual Review of Immunology. 2007;25:297-336.
Bonneville M, O’Brien RL, Born WK. γδ T cell effector functions: a blend of innate programming and acquired plasticity. Nature Reviews Immunology. 2010;10:467-478.
Godfrey DI, Stankovic S, Baxter AG. Raising the NKT cell family. Nature Immunology. 2010;11:197-206.