CAPÍTULO 11 Ativação da Célula B e Produção de Anticorpos
CARACTERÍSTICAS GERAIS DAS RESPOSTAS IMUNES HUMORAIS,
RECONHECIMENTO DE ANTÍGENOS E ATIVAÇÃO DA CÉLULA B INDUZIDA PELO ANTÍGENO,
RESPOSTAS DE ANTICORPOS DEPENDENTES DE CÉLULA T AUXILIAR AOS ANTÍGENOS PROTEICOS,
RESPOSTAS DE ANTICORPOS A ANTÍGENOS INDEPENDENTES DE CÉLULAS T,
AUTORREGULAÇÃO DOS ANTICORPOS: REGULAÇÃO DAS RESPOSTAS IMUNES HUMORAIS POR RECEPTORES Fc,
A imunidade humoral é mediada por anticorpos secretados por células da linhagem de linfócitos B. Dois tipos de antígenos microbianos podem induzir respostas robustas de anticorpos. Primeiro, os antígenos multivalentes de origem microbiana podem ativar as células B por meio do receptor de célula B (BCR), muitas vezes acompanhados de sinais fornecidos pelo envolvimento de receptores de reconhecimento de padrões em células B mediante reconhecimento de produtos microbianos, mas sem o auxílio de células T. Em segundo lugar, os antígenos proteicos microbianos podem ser apresentados por células B para as células T auxiliares (helper), resultando em respostas dependentes de T em que as células T auxiliares ativam células B. Em ambos os casos, os anticorpos são secretados e se ligam aos antígenos de bactérias extracelulares, vírus e outros micro-organismos e têm a função de neutralizar e eliminar esses patógenos. A eliminação de diferentes tipos de micro-organismos requer vários mecanismos efetores, mediados por diferentes isótipos de anticorpos. Em geral, os anticorpos produzidos com a ajuda de células T se ligam mais firmemente aos antígenos e desempenham funções mais diversificadas do que aqueles produzidos sem o auxílio de células T, e é por isso que anticorpos contra antígenos proteicos (os estimuladores de células T) são os mediadores mais eficazes da imunidade humoral. Este capítulo descreve os eventos moleculares e celulares da resposta imune humoral, particularmente os estímulos que induzem a proliferação e a diferenciação da célula B e como esses estímulos influenciam o tipo de anticorpo que é produzido. Os mecanismos pelos quais os anticorpos eliminam micro-organismos estarão descritos no Capítulo 12.
CARACTERÍSTICAS GERAIS DAS RESPOSTAS IMUNES HUMORAIS
Os primeiros estudos sobre a imunidade adaptativa foram dedicados à análise de anticorpos séricos produzidos em resposta a micro-organismos, toxinas e a outros antígenos. Grande parte do nosso conhecimento atual sobre as respostas imunes adaptativas e as interações celulares que ocorrem durante tais respostas se desenvolveu de estudos da produção de anticorpos. Começaremos com um resumo de algumas das principais características da ativação das células B e produção de anticorpos.
• A ativação de células B resulta em sua proliferação, levando à expansão clonal, seguida de diferenciação, culminando na geração de células B de memória e plasmócitos secretores de anticorpos (Fig. 11-1). Como discutido no Capítulo 8, linfócitos B maduros responsivos ao antígeno se desenvolvem de precursores na medula óssea antes do estímulo antigênico, e povoam os tecidos linfoides periféricos, que são os locais onde os linfócitos interagem com antígenos estranhos. As respostas imunes humorais são iniciadas pelo reconhecimento antigênico por linfócitos B específicos. O antígeno se liga à IgM e IgD de membrana em células B virgens (naïve) maduras possibilitando que elas sejam ativadas. A ativação leva à proliferação e à diferenciação de células específicas para o antígeno, gerando células B de memória e plasmócitos que secretam anticorpos. Uma única célula B pode, em uma semana, originar aproximadamente 5 mil células secretoras de anticorpos, que produzem mais de 1012 moléculas de anticorpo por dia. Essa enorme expansão é necessária para acompanhar o ritmo dos micro-organismos, que se dividem rapidamente. Algumas células B ativadas começam a produzir outros anticorpos diferentes de IgM e IgD; esse processo é chamado de mudança de isótipo (classe) da cadeia pesada. Conforme uma resposta imune humoral se desenvolve, as células B ativadas que produzem anticorpos que se ligam aos antígenos com grande afinidade progressivamente dominam a resposta; esse processo é chamado de maturação de afinidade.
• O tipo e a quantidade de anticorpos produzidos variam de acordo com o tipo de antígeno, o envolvimento de células T, o histórico prévio de exposição ao antígeno e o sítio anatômico onde ocorre a ativação. A influência desses fatores sobre a resposta imune humoral é resumida mais tarde e discutida ao longo do capítulo.
• As respostas de anticorpos contra antígenos proteicos necessitam que o antígeno seja expressamente reconhecido e internalizado pelas células B e que um fragmento de peptídeo da proteína internalizada seja apresentado aos linfócitos T CD4+ auxiliares que, por sua vez, ativarão essas células B. Por essa razão, as proteínas são classificadas como antígenos timo-dependentes ou T-dependentes. O termo linfócito T auxiliar surgiu da observação de que essas células estimulam, ou auxiliam, os linfócitos B a produzirem anticorpos. Um tipo especializado de células T auxiliares, chamados de célula T auxiliar folicular, facilita a formação de centros germinativos, que são estruturas especializadas em órgãos linfoides gerados durante respostas imunes humorais dependentes da célula T.
• As respostas de anticorpos a antígenos não proteicos multivalentes com determinantes (epítopo) que se repetem, como polissacarídeos e lipídeos, não necessitam de linfócitos T auxiliares específicos para o antígeno. Antígenos multivalentes (assim chamados porque cada molécula do antígeno contém vários epítopos idênticos) são, portanto, chamados de antígenos timo-independentes ou independentes de T. Essas respostas são induzidas em razão da intensa aglomeração do BCR pelos epítopos repetidos, e podem ser reforçadas pela ativação de receptores de reconhecimento de padrões em células B e células mieloides e pelas citocinas.
• Algumas das progênies das células B ativadas são plasmócitos secretores de anticorpos de vida longa que continuam a produzir anticorpos por meses ou anos, e outras são células de memória de vida longa. As respostas imunes humorais são iniciadas em órgãos linfoides periféricos, como o baço para antígenos transportados pelo sangue, os gânglios linfáticos para antígenos que entram pela pele e de outros epitélios, e os tecidos linfoides de mucosa para alguns antígenos inalados e ingeridos. Os anticorpos produzidos nesses locais entram na circulação ou são transportados para os lúmens das superfícies de mucosa onde exercem seus efeitos protetores onde quer que os antígenos estejam presentes. Nas respostas dependentes de células T, os plasmócitos ou seus precursores migram dos centros germinativos dos órgãos linfoides secundários, onde são produzidos, para a medula óssea, onde vivem por muitos anos. Esses plasmócitos de vida longa secretam anticorpos que fornecem proteção imediata sempre que um micro-organismo reconhecido por esses anticorpos infecta o indivíduo. Alguns descendentes de células B ativadas de uma maneira dependente de T podem diferenciar-se em células de memória, que montam respostas rápidas em encontros subsequentes com o antígeno. A diferenciação das células B ativadas em plasmócitos ou células de memória depende de sinais de receptores nas células B, incluindo o receptor de antígenos e receptores de citocinas-chave, que induzem a expressão de fatores de transcrição específicos que controlam as decisões de destino da célula.
• A mudança de isótipos de cadeia pesada e a maturação da afinidade são tipicamente vistos nas respostas imunes humorais dependentes de células T auxiliares a antígenos proteicos. A mudança de isótipos resulta principalmente da estimulação de células B por células T auxiliares. Nesse sentido, o ligante CD40 (CD40L), expresso na superfície de células T auxiliares ativadas, assim como a secreção de citocinas por esses linfócitos são os principais propulsores moleculares que induzem as células B a passar pelo processo de mudança de cadeia pesada da imunoglobulina (Ig). A maturação de afinidade também é dependente da ativação de células B pelo CD40L em células T; esse evento envolve, em primeiro lugar, a mutação somática de genes V rearranjados das Ig em células B ativadas e a posterior seleção de células B com uma elevada afinidade para o antígeno original. Enquanto mudança de isótipo pode ocorrer fora dos folículos linfoides, a mutação somática e a mudança de isótipo ocorrem principalmente nos centros germinativos.
• Respostas de anticorpos primários e secundários aos antígenos proteicos diferem quantitativamente e qualitativamente (Fig. 11-2). As respostas primárias resultam da ativação de células B virgens não estimuladas, enquanto as respostas secundárias se devem ao estímulo de clones de células B de memória expandidos. Assim, a resposta secundária se desenvolve mais rapidamente do que a primária, e quantidades maiores de anticorpos são produzidas na resposta secundária. A mudança de isótipo da cadeia pesada e a maturação da afinidade também aumentam com exposições repetidas a antígenos proteicos.
• Subgrupos distintos de células B respondem preferencialmente a diferentes tipos de antígenos (Fig. 11-3). Células B foliculares nos órgãos linfoides periféricos montam principalmente respostas de anticorpos a antígenos proteicos que necessitam da colaboração de células T auxiliares. As células B da zona marginal no baço e outros tecidos linfoides reconhecem antígenos multivalentes, como polissacarídeos transportados pelo sangue, e montam principalmente respostas de anticorpos independentes de células T. Células B-1 também medeiam em grande parte as respostas que são independentes de células T, mas em tecidos de mucosa e do peritônio.
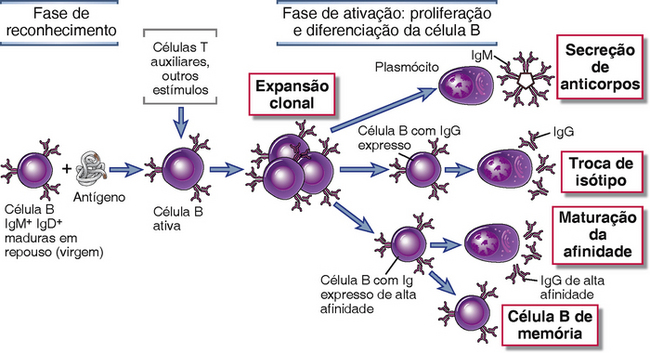
FIGURA 11-1 Fases da resposta imune humoral. A ativação de células B é iniciada pelo reconhecimento específico de antígenos por receptores Ig de superfície das células. Antígenos e outros estímulos, incluindo as células T auxiliares, estimulam a proliferação e diferenciação do clone de células B específicas. A população clonal expandida pode produzir isótipos IgM ou outros Ig (p. ex., IgG), pode sofrer maturação de afinidade, ou pode continuar como células de memória.
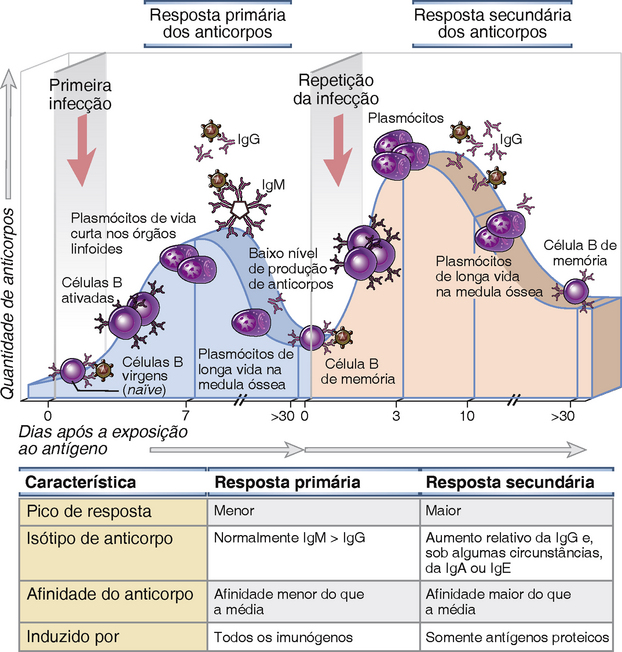
FIGURA 11-2 Respostas imunes humorais primárias e secundárias. Em uma resposta imune primária, as células B virgens são estimuladas pelo antígeno, tornam-se ativadas, e se diferenciam em células secretoras de anticorpos que produzem anticorpos específicos para o antígeno que as provocam. Alguns dos plasmócitos secretores de anticorpos migram e sobrevivem na medula óssea, onde continuam a produzir anticorpos por longos períodos. Células B de memória de vida longa também são geradas durante a resposta primária. Uma resposta imune secundária é provocada quando o mesmo antígeno estimula as células B de memória, levando a uma proliferação e diferenciação mais rápida, e a produção de quantidades maiores de anticorpos específicos do que os que são produzidos na resposta primária. As principais características da resposta imune primária e secundária estão resumidas na tabela. Essas características são típicas de respostas de anticorpos dependentes de células T auxiliares a antígenos proteicos.
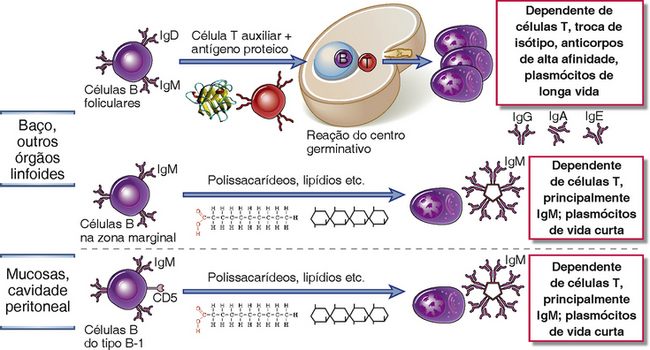
FIGURA 11-3 Subtipos distintos de células B medeiam diferentes tipos de respostas de anticorpos. As células B foliculares são células de recirculação que recebem o auxílio de células T quando respondem a antígenos proteicos e, assim, iniciam as respostas de anticorpos T-dependentes. Essas respostas podem levar à formação de centros germinativos, onde ocorrem a mudança de classe e a mutação somática do gene de anticorpos, resultando em respostas especializadas de alta afinidade de anticorpos. Respostas T-independentes a antígenos multivalentes como lipídeos, polissacarídeos e ácidos nucleicos são mediadas principalmente por células B da zona marginal do baço e células B-1 em sítios de mucosa. Essas distinções funcionais entre subtipos não são absolutas.
Nas seções seguintes, iremos inicialmente discutir a interação dos antígenos com as células B. Em seguida, discutiremos o papel das células T auxiliares nas respostas de células B a antígenos proteicos e os mecanismos de mudança de isótipo e maturação da afinidade. Concluiremos com uma discussão sobre as respostas de anticorpos independentes de célula T.
RECONHECIMENTO DE ANTÍGENOS E ATIVAÇÃO DA CÉLULA B INDUZIDA PELO ANTÍGENO
Para iniciar as respostas de anticorpos, os antígenos têm de ser capturados e transportados para as áreas de células B de órgãos linfoides. Os antígenos então iniciam o processo de ativação das células B, muitas vezes trabalhando em conjunto com outros sinais que são gerados durante a resposta imune natural desencadeada principalmente durante infecções ou por adjuvantes presentes em vacinas. Descreveremos a seguir esses eventos iniciais de ativação das células B.
Captura e Reconhecimento de Antígeno pelas Células B
Os linfócitos B maduros migram de um órgão linfoide secundário para outro em busca de antígeno. As células B virgens residem e circulam pelos folículos dos órgãos linfoides periféricos (baço, gânglios linfáticos e tecidos linfoides de mucosa) em busca de antígenos cognatos (Caps. 2 e 3). A maioria das células B entra nos folículos e são chamadas de células B foliculares ou células B recirculantes. A entrada nos folículos é guiada pela quimiocina CXCL13 secretada pelas células dendríticas foliculares e pelas células do estroma no folículo. A CXCL13 se liga ao receptor de quimiocina CXCR5 nas células B virgens recirculantes atraindo-as para dentro dos folículos. Como discutiremos mais adiante, o mesmo par de quimiocina-receptor também é importante durante as respostas imunes humorais, pois pode atrair um subtipo de células T ativadas para o folículo. As células B virgens foliculares sobrevivem por períodos limitados até encontrarem o antígeno (Cap. 2). A sobrevivência da célula B folicular depende de sinais bioquímicos deflagrados via BCR, assim como de estímulos recebidos da citocina pertencente à família do fator de necrose tumoral (TNF) chamada BAFF (fator de ativação da célula B da família TNF; também conhecido como BLyS, estimulador do linfócito B), a qual proporciona sinais de maturação e sobrevivência por meio do receptor de BAFF. O BAFF e um ligante relacionado, APRIL, podem ativar dois outros receptores, TACI e BCMA, que participam dos estágios mais avançados da ativação e diferenciação da célula B (e serão discutidos mais adiante). Essas citocinas são produzidas principalmente por células mieloides no folículo linfoide e na medula óssea.
O antígeno pode ser entregue para as células B virgens em órgãos linfoides em diferentes formas e por várias vias. Os antígenos que entram cruzando uma barreira epitelial, além dos antígenos na circulação, são capazes de ativar células B e são trazidos para zonas de células B por vários mecanismos (Fig. 11-4).
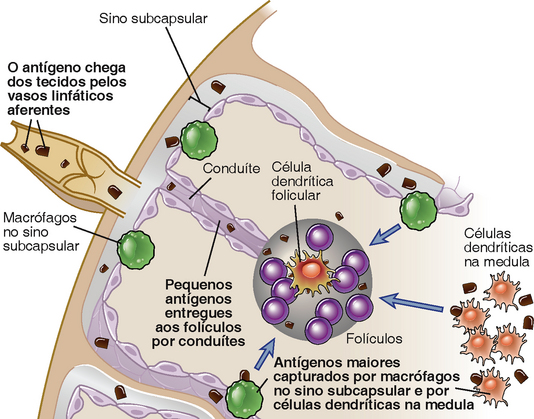
FIGURA 11-4 Vias de acesso do antígeno em células B foliculares. O antígeno chega até onde estão as células B nos folículos em grande parte pelos vasos linfáticos aferentes que drenam para o seio subcapsular do gânglio linfático. Pequenos antígenos podem atingir o folículo por meio de condutores. Antígenos maiores podem ser capturados por macrófagos do seio subcapsular e entregues ao folículo, ou podem acessar diretamente as células dendríticas na região medular que podem estar envolvidas no fornecimento de antígenos não apenas para a zona de células T, mas também para folículos contendo células B.
• A maioria dos antígenos presentes nos tecidos são transportados para os gânglios linfáticos pelos vasos linfáticos aferentes que os drenam para o seio subcapsular dos gânglios linfáticos. Antígenos solúveis, geralmente menores que 70 kD, podem alcançar a zona de células B pelos condutores que se estendem entre o seio subcapsular e o folículo, e interagir diretamente com células B específicas.
• Macrófagos do seio subcapsular capturam micro-organismos inteiros assim como complexos de antígeno-anticorpos e os entregam aos folículos, que ficam por baixo do seio.
• Muitos antígenos relativamente grandes que entram no gânglio linfático pelos vasos linfáticos aferentes não são nem capturados pelos macrófagos do seio subcapsular nem são transportados pelos condutores até o folículo em razão do seu tamanho. Esses antígenos podem ser capturados na região medular por células dendríticas residentes e transportados para os folículos, onde podem ativar as células B.
• Antígenos acoplados aos anticorpos (complexos imunes) que ativam o complemento podem se ligar a receptores do complemento (especialmente o receptor de complemento de tipo 2 ou CR2) nas células B da zona marginal, e essas células podem transferir os complexos imunes contendo antígenos para as células B foliculares.
• Os antígenos acoplados aos anticorpos (complexos imunes) também podem se ligar ao CR2 na superfície das células dendríticas foliculares e serem apresentados às células B antígeno-específicas.
• Patógenos presentes no sangue podem ser capturados por células dendríticas plasmocitoides no sangue e transportados para o baço, onde podem ser entregues para as células B da zona marginal.
• Antígenos polissacarídeos podem ser capturados por macrófagos na zona marginal dos folículos linfoides do baço e exibidos ou transferidos para células B nessa área.
Em todos esses casos, o antígeno que é apresentado às células B está geralmente na sua conformação nativa intacta e não é processado por células apresentando antígenos. Isso, naturalmente, é uma das importantes distinções entre as maneiras de reconhecimento de antígenos por linfócitos B e T (Cap. 6).
Ativação de Células B por Antígenos e Outros Sinais
A ativação dos linfócitos B específicos para o antígeno inicia-se pela ligação do antígeno às moléculas de Ig da membrana, as quais, em conjunto com as proteínas associadas Igα e Igβ, formam o complexo do receptor de antígenos de células B maduras. O receptor de antígeno de linfócitos B, descrito no Capítulo 7, tem duas funções fundamentais na ativação de células B. Primeira, a ligação do antígeno ao receptor fornece sinais bioquímicos para que as células B iniciem o processo de ativação (Cap. 7). Segunda, o receptor internaliza o antígeno ligado em vesículas endossômicas, e se o antígeno for uma proteína, ele é processado em peptídeos que podem ser apresentados na superfície das células B para reconhecimento pelas células T auxiliares. Essa função apresentadora de antígeno das células B será discutida mais adiante no contexto da ativação de células B dependentes de T.
Embora o reconhecimento de antígenos já possa dar início às respostas de células B, esse evento, por si só, é geralmente inadequado para estimular a proliferação e diferenciação significativa das células B. Para que respostas completas sejam induzidas, outros estímulos cooperam com os sinais deflagrados via BCR mediante reconhecimento do antígeno, incluindo proteínas do complemento, receptores de reconhecimento de padrões, e, no caso de antígenos de proteína, as células T auxiliares (discutidas mais adiante).
A ativação de células B é facilitada pelo coreceptor CR2/CD21 em células B, que reconhece fragmentos do complemento ligados covalentemente ao antígeno ou que fazem parte de complexos imunes contendo o antígeno (Fig. 11-5). A ativação do complemento está normalmente associada à presença de patógenos, que ativam esse sistema pelas vias alternativas (na ausência de anticorpos), da lectina, e, na presença de anticorpos, pela via clássica (Caps. 4 e 12). Em todas essas situações, são gerados fragmentos do complemento que se ligam aos micro-organismos. Um desses fragmentos, chamado de C3d, é reconhecido pelo receptor CR2 do complemento (também chamado CD21), que aumenta a força de sinalização do BCR e, portanto, funciona como um coreceptor de células B (Cap. 7). Alguns polissacarídeos não microbianos também ativam o complemento pela via alternativa ou da lectina, e essa é uma razão pela qual esses antígenos são capazes de induzir respostas de anticorpos sem o auxílio de células T.
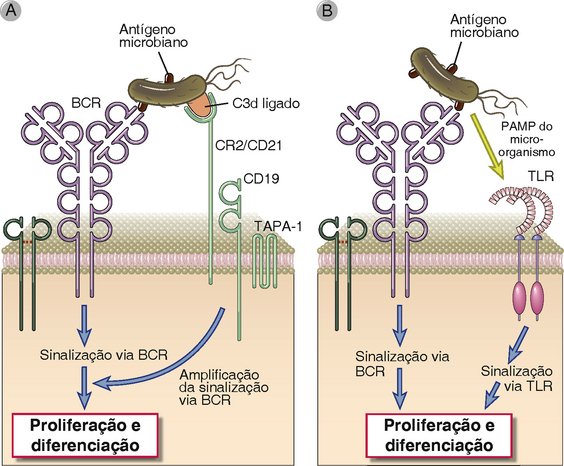
FIGURA 11-5 Papel do CR2 e TLR na ativação de células B. Em resposta imune aos micro-organismos, a ativação de células B por meio do BCR pode ser aumentada pelo antígeno revestido de complemento que pode, simultaneamente, fazer a ligação do BCR e do receptor 2 do complemento (CR2) (A), além de envolver a ativação simultânea de receptores semelhantes a Toll (TLR) em células B por moléculas (chamados de padrões moleculares associados a patógenos [PAMP]) derivadas do micro-organismo (B).
Produtos microbianos podem ser reconhecidos por receptores semelhantes a Toll nas células B, amplificando assim a ativação das células B (Fig. 11-5). As células B humanas expressam vários receptores semelhantes a Toll (Toll-like receptors – TLR), incluindo TLR5, que reconhece a flagelina bacteriana; TLR7 endossômicos, que reconhecem RNA de fita única; e TLR9, específico para DNA rico em CpG não metilado nos endossomos (Cap. 4). Células B murinas também expressam TLR4 na superfície da célula. Esses receptores de reconhecimento de padrões ativam as células B diretamente. Além disso, a ativação de células mieloides por meio de receptores de reconhecimento de padrões pode promover a ativação de células B indiretamente de duas maneiras. Células dendríticas ativadas pelos TLR contribuem significativamente para a ativação de células T auxiliares (Cap. 9). Células mieloides ativadas por TLR podem secretar APRIL e BAFF, citocinas que podem induzir respostas das células B independentes de célula T.
Respostas Funcionais das Células B a Antígenos
Eventos celulares distintos são induzidos pela ligação cruzada do complexo do BCR mediada por tipos diferentes de antígenos: antígenos multivalentes iniciam a proliferação e a diferenciação da célula B, e antígenos proteicos preparam as células B para interações subsequentes com células T auxiliares. A ligação cruzada do receptor de antígeno com alguns antígenos pode estimular várias mudanças importantes nas células B (Fig. 11-6). As células previamente em repouso entram no estágio G1 do ciclo celular, e isso é acompanhado pelo aumento no tamanho celular, do conteúdo de RNA citoplásmico e de organelas biossintéticas, como ribossomos. A sobrevivência das células B estimuladas é aumentada em decorrência do aumento na expressão de várias proteínas antiapoptóticas, especialmente Bcl-2 (Fig. 14-7, Cap. 14), e as células podem proliferar e secretar alguns anticorpos. A ativação de células B por antígenos resulta na expressão aumentada de moléculas do complexo principal de histocompatibilidade (MHC) de classe II e de coestimuladores, razão pela qual células B estimuladas pelo antígeno passam a ser ativadoras mais eficientes dos linfócitos T auxiliares que as células B virgens. A expressão de receptores para várias citocinas derivadas de células T também é aumentada, o que permite que linfócitos B estimulados por antígenos respondam às citocinas secretadas por células T auxiliares. A expressão de receptores de quimiocinas pode mudar, o que resulta no movimento das células B para fora dos folículos.
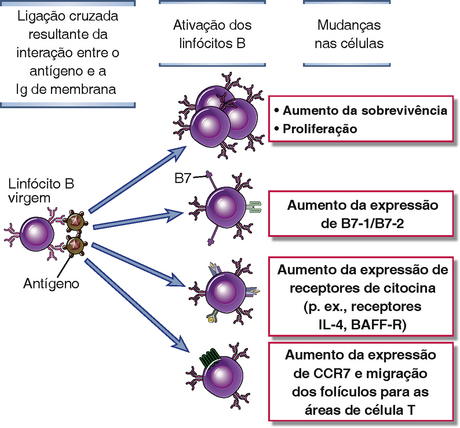
FIGURA 11-6 Respostas funcionais induzidas por ligação cruzada mediada por antígeno do complexo BCR. Ligações cruzadas induzidas por antígeno do receptor de antígeno de células B induzem várias respostas celulares, incluindo a proliferação; a expressão de moléculas de superfície de células novas, incluindo coestimuladores e receptores de citocinas; e migração alterada dentro do gânglio linfático das células como resultado da expressão de CCR7.
A importância da sinalização pelo complexo do BCR para as respostas subsequentes das células B pode variar com a natureza do antígeno. A maioria dos antígenos independentes de célula T, como polissacarídeos, exibe múltiplos epítopos idênticos em cada molécula ou na superfície de uma célula. Portanto, tais antígenos multivalentes promovem a ligação cruzada de muitos receptores antigênicos de células B de maneira eficaz e iniciam respostas, mesmo que não sejam reconhecidos pelos linfócitos T auxiliares. Por sua vez, muitos antígenos na forma de proteínas globulares que ocorrem na natureza têm apenas uma cópia de cada epítopo por molécula. Portanto, tais antígenos proteicos não conseguem fazer ligações cruzadas extensas com múltiplas moléculas Ig, tendo assim uma capacidade limitada de ativar o BCR. Esses antígenos, portanto, não induzem normalmente suficientes sinais que possam levar à proliferação e diferenciação de células B. Por outro lado, alguns antígenos proteicos podem ser exibidos como matrizes multivalentes nas superfícies de micro-organismos ou células, ou podem ser polivalentes, pois estão agregados. Os antígenos de proteína também são internalizados pelo BCR, processados e apresentados às células T auxiliares, que são, por sua vez, estimuladores potentes da proliferação e diferenciação de linfócitos B. Na verdade, nas respostas dependentes de célula T, uma função principal da Ig de membrana pode não ser sinalizar, mas ligar e internalizar o antígeno para subsequente apresentação às células T auxiliares, como será discutido adiante. Portanto, os BCR, ao se ligarem aos antígenos proteicos, devem preferencialmente favorecer a apresentação de antígenos e a migração de células B antígens-específicas para a zona de células T.
Após as células B específicas reconhecerem os antígenos, as etapas subsequentes nas respostas imunes humorais são muito diferentes nas respostas dependentes e independentes das células T. A seguir, descreveremos a ativação de células B por antígenos proteicos e células T auxiliares.
RESPOSTAS DE ANTICORPOS DEPENDENTES DE CÉLULA T AUXILIAR AOS ANTÍGENOS PROTEICOS
Respostas de anticorpos a antígenos proteicos requerem reconhecimento e processamento do antígeno pelas células B, seguidos da apresentação de um fragmento de peptídeo do antígeno às células T auxiliares, levando à cooperação entre linfócitos B e T antígeno-específicos. A função auxiliar de linfócitos T foi descoberta em experimentos realizados no final dos anos de 1960, que mostraram que as respostas de anticorpos necessitavam da presença de células da medula óssea (agora conhecidas por conter linfócitos B maduros) e de células derivadas do timo (que eram os linfócitos T). Experimentos posteriores mostraram que apenas as células da medula óssea produziam o anticorpo, mas a sua ativação necessitava das células do timo, que foram chamadas de células auxiliares. Esses estudos experimentais clássicos foram a primeira prova formal da importância das interações entre duas populações de células completamente diferentes do sistema imune. Muitos anos foram necessários para estabelecer que a maioria das células T auxiliares são linfócitos CD4+CD8− que reconhecem antígenos de peptídeo apresentados pelas moléculas MHC de classe II. Uma das conquistas importantes da imunologia foi a elucidação dos mecanismos de interações de células T-B e as ações de células T auxiliares nas respostas de anticorpos.
Sequência de Eventos nas Respostas de Anticorpos Dependentes de Células T
Antígenos proteicos são reconhecidos por linfócitos B e T específicos nos órgãos linfoides periféricos, e as populações celulares ativadas se reúnem nesses órgãos para iniciar as respostas imunes humorais (Fig. 11-7). A interação entre as células T auxiliares e os linfócitos B é iniciada pelo reconhecimento de antígenos proteicos, e a sequência de eventos que impulsiona a proliferação das células B e a diferenciação é a seguinte:
• O antígeno é captado pelas células dendríticas, que também foram ativadas por produtos microbianos e apresentadas às células T auxiliares virgens nas zonas de células T dos órgãos linfoides.
• As células T auxiliares são inicialmente ativadas pelas células dendríticas, apresentando peptídeos antigênicos acoplados às moléculas MHC de classe II e também expressando ligantes coestimuladores, como as moléculas B7 (Caps. 6 e 9).
• As células T auxiliares ativadas expressam CD40L e receptores de quimiocinas que promovem a sua migração para o folículo seguindo um gradiente desses quimioatraentes.
• As células B nos folículos linfoides são ativadas pelo antígeno, que pode estar na forma solúvel ou exibido por outras células.
• As células B processam e apresentam o antígeno, alteram o seu perfil de receptores de superfície para quimiocinas e migram em direção à zona de células T.
• Células T auxiliares ativadas e células B interagem no limite da zona de células T e folículo, em que as células B são ativadas pelo CD40L das células T auxiliares e por citocinas que as células T secretam.
• Pequenos focos de células B extrafoliculares se formam na medula do gânglio linfático ou entre a bainha linfoide periarteriolar da polpa vermelha do baço. As células B nesses focos passam por baixos níveis de mudanças de isótipo e por mutação somática, e geram plasmócitos de curta duração que secretam anticorpos.
• Algumas células T auxiliares ativadas são induzidas durante as interações B-T para se diferenciarem em células T auxiliares foliculares (células TFH).
• Células B ativadas e células TFH migram para o folículo, onde as células B são ativadas pelas células TFH. Centros germinativos são formados dentro dos folículos e são os locais de extensa proliferação de células B, mudança de isótipo, mutação somática, eventos de seleção que levam à maturação da afinidade, geração de células B de memória e indução de plasmócitos de longa vida que migram à medula óssea.
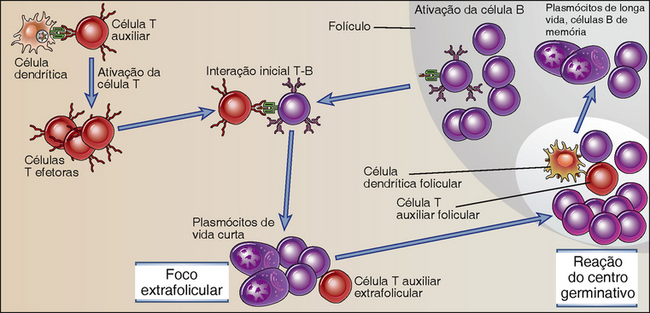
FIGURA 11-7 Sequência de eventos na resposta imune humoral aos antígenos proteicos dependente de células T. As respostas imunes são iniciadas pelo reconhecimento de antígenos por células B e células T auxiliares. Os linfócitos ativados migram em direção uns aos outros e interagem, resultando na proliferação e diferenciação de células B. A reestimulação de células B por células T auxiliares em sítios extrafoliculares leva à mudança de isótipo precoce e geração de plasmócitos de curta duração. Os últimos acontecimentos ocorrem nos centros germinativos e incluem mutação somática e a seleção de células de alta afinidade (maturação de afinidade), mudança de isótipo, geração de células B de memória e geração de plasmócitos de longa vida.
Nas seções seguintes, descreveremos cada uma dessas etapas em detalhes.
Ativação Inicial e Migração das Células T Auxiliares e Células B
A ativação de células B e T específicas por antígenos é essencial para sua interação funcional e as colocam em proximidade para aumentar a possibilidade de células T e B antígenos-específicas realizarem interações produtivas (Fig. 11-8). A frequência de células B virgens ou células T específicas para um epítopo de um antígeno é baixa, estimada em 1 a cada 105 podendo chegar a 1 em 106 linfócitos, e tanto as células B quanto as células T, ambas antígeno-específicas, devem estar ativadas para que elas possam interagir fisicamente umas com as outras possibilitando a produção de fortes respostas de anticorpos. As células T auxiliares que foram ativadas por antígenos e pelos coestimuladores proliferam e expressam o CD40L e secretam citocinas. Elas também sofrem uma redução na expressão do receptor de quimiocina CCR7 enquanto aumentam a expressão de CXCR5, e como resultado, as células T ativadas deixam a zona de células T e migram em direção ao folículo. Como mencionado anteriormente, CXCL13, o ligante para CXCR5, é secretado por células dendríticas foliculares e outras células do estroma folicular e contribui para a migração de células T CD4+ ativadas para o folículo.
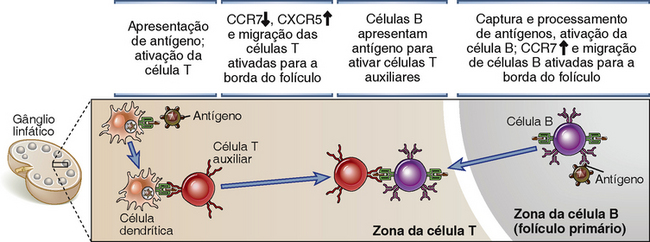
FIGURA 11-8 Migração de células B e células T auxiliares e interação T-B. As células T auxiliares ativadas por antígenos e as células B se movem em direção umas às outras em resposta a sinais de quimiocinas e fazem contato adjacente à borda dos folículos primários. Nesse local, a célula B apresenta antígeno para a célula T, e a célula B recebe sinais de ativação da célula T.
Embora os antígenos proteicos, sendo monovalentes, normalmente não forneçam sinais fortes o suficiente para induzir proliferação e diferenciação de células, eles podem ativar as células B e iniciar uma série de eventos. A ativação do BCR com esses antígenos resulta em uma expressão reduzida na superfície celular do receptor de quimiocina CXCR5 e no aumento da expressão de CCR7, que é normalmente expressa em células T. Como resultado, as células B ativadas migram para a zona de células T levadas por um gradiente de CCL19 e CCL21, ligantes para o CCR7. As células B ativadas por antígenos de proteína também podem expressar CD69, que bloqueiam a expressão na superfície de receptores de esfingosina 1-fosfato, garantindo a retenção de células B ativadas nos gânglios linfáticos (Cap. 3). Antígenos proteicos são endocitados pela célula B e apresentados em uma forma que podem ser reconhecidos pelas células T auxiliares, e isso possibilita a próxima etapa no processo de ativação de células B dependente de T.
Apresentação de Antígeno por Células B e o Efeito Hapteno-carregador
Os antígenos proteicos que são reconhecidos por receptores de antígeno de células B específicas são endocitados e direcionados para um compartimento vesicular para que sejam processados em peptídeos lineares que serão associados a às moléculas MHC de classe II (Fig. 11-9). Cada peptídeo é apresentado na superfície da célula B para uma célula T auxiliar previamente ativada na zona de células T, onde seu TCR reconheceu um peptídeo idêntico apresentado por uma célula dendrítica que havia encontrado o mesmo antígeno. Como o BCR reconhece um epítopo da proteína nativa com alta afinidade, as células B específicas se ligam e apresentam o antígeno de maneira muito mais eficiente (ou seja, em concentrações muito mais baixas) que outras células B não específicas para o antígeno. É por isso que as células B específicas para um antígeno respondem preferencialmente a esse antígeno, em comparação com outras células “espectadoras”. Portanto, um antígeno proteico que induz uma resposta de célula B dependente de célula T necessita de pelo menos dois epítopos ao ativar as células B específicas. Um epítopo de superfície na proteína nativa é reconhecido com alta especificidade por uma célula B, e, em razão da degradação dessa proteína, um epítopo peptídico linear é posteriormente acoplado a moléculas MHC de classe II, e é reconhecido pelas células T auxiliares. Os anticorpos que são subsequentemente secretados são geralmente específicos para determinantes conformacionais do antígeno. Como as Ig de membrana das células B são capazes de ligar epítopos conformacionais nos antígenos proteicos, a mesma Ig, quando secretada por plasmócitos derivados dessas células B, são igualmente capazes de reconhecer esses epítopos conformacionais. Essa característica do reconhecimento antigênico da célula B determina a especificidade fina da resposta do anticorpo e é independente do fato de que as células T auxiliares reconhecem apenas epítopos lineares de peptídeos processados. De fato, um único linfócito B específico para um epítopo natural pode ligar-se e endocitar uma proteína e apresentar vários peptídeos diferentes conjugados com moléculas do MHC de classe II a diferentes células T auxiliares, mas a resposta de anticorpo resultante permanece específica para a proteína natural.
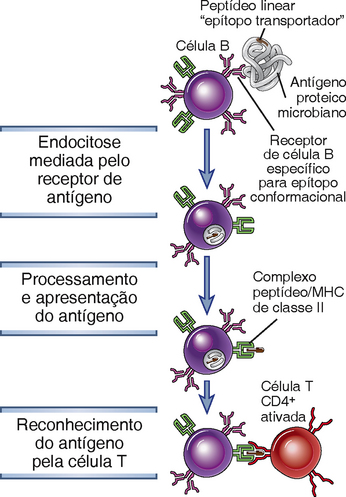
FIGURA 11-9 Apresentação de antígenos pelas células B para as células T auxiliares. Antígenos proteicos ligados à Ig de membrana são endocitados e processados, e fragmentos de peptídeos são apresentados em associação com moléculas MHC de classe II. As células T auxiliares que anteriormente eram ativadas por células dendríticas reconhecem os complexos MHC-peptídeo nas células B e, em seguida, estimulam respostas de células B. As células B ativadas também expressam coestimuladores (não mostrados) que melhoram as respostas das células T auxiliares. Em resposta ao hapteno-carregador, a proteína é conjugada a um hapteno (o epítopo de célula B) e é internalizada por uma célula B específica ao hapteno, que processa o antígeno e apresenta o peptídeo linear (o epítopo de célula T, também conhecido como o determinante de carregador) em moléculas MHC de classe II a uma célula T auxiliar ativada.
Os princípios delineados aqui para a colaboração de células T-B ajudam a explicar um fenômeno que é conhecido como efeito hapteno-carregador. A análise das respostas de anticorpos a conjugados de hapteno-carreadores estava entre as primeiras abordagens que demonstraram como a apresentação de antígenos pelos linfócitos B contribui para o desenvolvimento das respostas imunes humorais. Haptenos, como dinitrofenol, são pequenos compostos químicos que podem ser reconhecidos por anticorpos específicos, mas não são em si imunogênicos. Se, entretanto, os haptenos estiverem conjugados a proteínas que servem como carreadores, os conjugados (hapteno-carreador) são capazes de induzir respostas de anticorpos contra os haptenos. Existem três características importantes das respostas de anticorpos anti-hapteno a conjugados hapteno-proteína. Primeira, tais respostas requerem tanto células B específicas para o hapteno quanto células T auxiliares específicas para peptídeos da proteína (carreador). Segunda, para estimular uma resposta, as porções hapteno e carreador precisam estar fisicamente ligadas e não podem ser administradas separadamente. Terceira, a interação é restrita ao MHC de classe II, isto é, as células T auxiliares cooperam somente com os linfócitos B que expressam moléculas MHC de classe II que são idênticas às que estiveram envolvidas na ativação inicial de células T virgens pelas células dendríticas. Todas essas características da resposta de anticorpos aos conjugados hapteno-proteína podem ser explicadas pelas funções apresentadoras de antígenos dos linfócitos B. Células B específicas para o hapteno têm BCR que se ligam ao complexo por meio do reconhecimento do determinante no hapteno, endocitam o conjugado hapteno-carreador e apresentam peptídeos derivados da proteína carreadora para linfócitos T auxiliares específicos para o carreador (Fig. 11-9). Assim, os dois linfócitos que cooperam reconhecem epítopos diferentes do mesmo antígeno complexo. O hapteno é responsável pela captação eficiente do carreador pela célula B, o que explica porque o hapteno e o carreador devem estar fisicamente ligados. A necessidade da apresentação do antígeno associado ao MHC para a ativação da célula T explica a restrição das células T ao MHC durante interações T e B.
As características das respostas humorais induzidas pelos conjugados hapteno-carreador se aplicam a todos os antígenos proteicos nos quais um epítopo, geralmente um determinante conformacional natural, é reconhecido por células B (e é, portanto, análogo ao hapteno), e outro epítopo, sempre na forma de um peptídeo linear associado ao MHC de classe II, é reconhecido por células T auxiliares (e é análogo ao carreador que é a fonte do peptídeo). O efeito hapteno-carreador é a base para o desenvolvimento de vacinas conjugadas, assunto discutido mais adiante neste capítulo.
Função do CD40L: Interação ao CD40 e Ativação de Células B Dependentes de T
Na ativação, células T auxiliares expressam ligante do CD40 (CD40L), que se acopla ao seu receptor, chamado CD40, expresso em células B estimuladas por antígenos na interface T-B, e induz a subsequente proliferação e diferenciação inicialmente em focos extrafoliculares e mais tarde em centros germinativos (Fig. 11-10). O CD40 é um membro da superfamília do receptor de TNF. Seu ligante, o CD40L (CD 154), é uma proteína trimérica de membrana que é homóloga ao TNF. O CD40 é expresso constitutivamente nas células B e o CD40L é expresso na superfície das células T auxiliares após a ativação pelo antígeno e pelos coestimuladores. Quando essas células T auxiliares ativadas interagem fisicamente com células B apresentando antígenos, o CD40L reconhece CD40 na superfície das células B. A ligação do CD40L ao CD40 induz a alteração conformacional dos trímeros de CD40 pré-formados, o que possibilita o recrutamento de proteínas citosólicas chamadas TRAF (fatores associados ao receptor de TNF) que se associam ao domínio citoplasmático do CD40. Os TRAF recrutados para CD40 iniciam cascatas de sinalização, muitas das quais mediadas por enzimas, que levam à ativação e translocação nuclear de fatores de transcrição, incluindo NF-κB e AP-1, que em conjunto estimulam a proliferação das células B e o aumento da síntese e secreção de Ig. Vias semelhantes de sinalização são ativadas por receptores de TNF (Cap. 7). A indução desses fatores de transcrição induzidos via CD40 é crucial para a formação subsequente do centro germinativo e para a síntese da desaminase induzida pela ativação (AID), uma enzima que é crítica nos processos de mutação somática e mudança de isótipo, como será discutido a seguir. A ativação de células dendríticas e de macrófagos mediada por células T também envolve a interação de CD40L, em células T auxiliares ativadas, com CD40 expressos nesses fagócitos (Cap. 10). Assim, essa via de respostas celulares dependentes de contato é um mecanismo geral para a ativação de células-alvo por linfócitos T auxiliares, e não é exclusiva da produção de anticorpo.
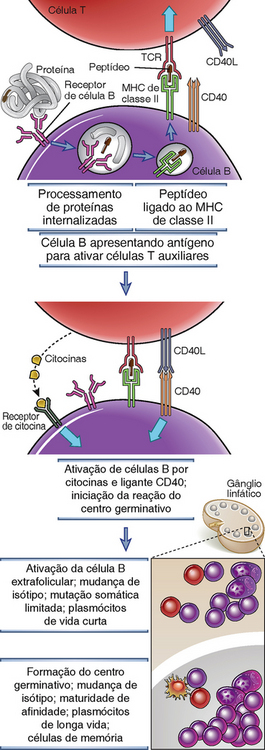
FIGURA 11-10 Mecanismos de ativação de células B mediadas por células T auxiliares. As células T auxiliares ativadas que migram para a zona de células B expressam CD40L e seus receptores de células T reconhecem complexos MHC de classe II-peptídeos em células B que tenham sido desencadeadas por antígeno e, por sua vez migraram para a interface entre as zonas de células T e B. O CD40L na célula T auxiliar ativada se liga ao CD40 em células B antígeno-ativadas e inicia a proliferação e diferenciação das células B. As citocinas, secretadas pelas células T, se ligam aos receptores de citocinas nas células B e também estimulam respostas de células B. Dois tipos de eventos de diferenciação podem ocorrer, a formação de focos extrafoliculares e a indução de uma reação de células B de centros germinativos.
Mutações no gene CD40L resultam em uma doença chamada de síndrome de hiper-IgM ligada ao X, que é caracterizada por defeitos na produção de diferentes classes de anticorpos (exceto IgM), mudança de isótipos, maturação de afinidade e geração de células B de memória em resposta a antígenos de proteína, além de deficiência na imunidade mediada por células (Cap. 20). Anormalidades semelhantes são vistas nos camundongos knockout para os genes CD40 ou CD40L. É interessante que um vírus de DNA chamado Epstein-Barr (EBV) infecte células B humanas e induza sua proliferação. Esse vírus pode levar à imortalização dessas células e ao desenvolvimento de linfomas. A cauda citoplasmática de uma proteína transformadora de EBV chamada LMP1 (proteína de membrana latente 1) se associa às mesmas moléculas TRAF que o domínio citoplasmático de CD40, e isso, aparentemente, desencadeia a proliferação das células B. Assim, o LMP1 do EBV é funcionalmente homólogo a uma molécula de sinalização fisiológica da célula B, e o EBV aparentemente aproveita uma via normal de ativação de linfócitos B para próprio benefício, que é o de promover a sobrevivência e proliferação das células que o vírus tenha infectado.
Além do CD40L nas células T auxiliares ativando células B, as células T auxiliares também secretam citocinas que contribuem para as respostas de células B. A principal função mediada pelas citocinas derivadas de células T na resposta imune humoral é a mudança de isótipo, descrita mais adiante. Várias citocinas também têm sido implicadas nas etapas iniciais da proliferação e diferenciação de células B, mas ainda não está claro se alguma é realmente essencial para essas respostas.
A interação inicial de células T auxiliares ativadas com células B específicas de antígenos na borda do folículo induz certo grau de proliferação e diferenciação de células B e leva à formação de um conjunto de células chamado de foco extrafolicular.
Ativação de Células B Extrafoliculares
Após a interação inicial de células B com células T auxiliares na interface entre o folículo e a zona de células T, a subsequente ativação de células B por células T auxiliares pode ocorrer em dois locais diferentes, um fora dos folículos e o outro dentro dos folículos, nos centros germinativos. A natureza da resposta mediada pelas células B difere nesses locais (Tabela 11-1). Focos extrafoliculares de ativação de células B dependentes de células T são gerados relativamente cedo em uma resposta imune. Centros germinativos, onde células T auxiliares foliculares especializadas (TFH) fazem com que as células B se submetam a inúmeras mudanças, aparecem alguns dias mais tarde.
TABELA 11-1 Respostas de Células B Extrafoliculares e do Centro Germinativo
| Característica | Folicular/Centro Germinativo | Extrafolicular |
|---|---|---|
| Localização | Folículos secundários | Cordões medulares dos gânglios linfáticos e nos limites entre a zona de células T e a polpa vermelha do baço |
| Sinais CD40 | Exigidos | Exigidos |
| Auxílio de células T especializadas | Células TFH em centros germinativos | Células auxiliares T extrafoliculares |
| Expressão de AID | Sim | Sim |
| Mudança de classe | Sim | Sim |
| Hipermutação somática | Alta taxa | Baixa taxa |
| Afinidade de anticorpos | Alta | Baixa |
| Células B terminalmente diferenciadas | Plasmócitos de vida longa e células de memória | Plasmócitos de vida curta (expectativa de vida de quase 3 dias) |
| Destino dos plasmócitos | Medula óssea ou MALT | A maioria morre por apoptose nos tecidos linfoides secundários onde foram produzidos |
| Fatores de transcrição de células B | Bcl-6 | Blimp-1 |
AID, deaminase citidina induzida por ativação; Bcl-6, linfoma 6 de célula B; Blimp-1, proteína 1 de maturação induzida por linfócito B; MALT, tecido linfoide associado à mucosa; TFH, célula T auxiliar folicular.
Dados de Vinusa CG, I Sanz, and MC Cook. Dysregulation of germinal centres in autoimmune disease. Nature Reviews Immunology 9:845-857, 2009.
Células B que são ativadas por células T auxiliares por meio de CD40L nos focos extrafoliculares podem sofrer certo grau de diferenciação em células plasmáticas e mudança de isótipo. Cada foco pode produzir 100 a 200 plasmócitos secretores de anticorpos. No baço, os focos extrafoliculares se desenvolvem nas porções externas das bainhas de linfócitos periarteriolares ricas em células T (PALS) ou entre a zona de células T e a polpa vermelha, e essas coleções de células também são chamadas de focos PALS. Focos semelhantes dependentes de célula T são observados nos cordões medulares dos gânglios linfáticos. A mudança de isótipo ocorre primeiro nesses focos extrafoliculares. Algumas hipermutações somáticas de genes Ig, que resultam no processo de maturação de afinidade, também ocorrem, mas em uma magnitude muito inferior à extensão de hipermutação somática vista nas respostas centradas nos centros germinativos que serão descritos depois. As células circulantes secretoras de anticorpos, chamadas de plasmablastos, e plasmócitos do tecido que são gerados em focos extrafoliculares são em sua maioria de curta duração, e essas células não adquirem a capacidade de migrar para locais distantes, como a medula óssea. A pequena quantidade de anticorpos produzida nesses focos pode contribuir para a formação de complexos imunes (contendo antígeno, anticorpo e talvez complemento) que são capturados por células dendríticas foliculares nos folículos linfoides. Especula-se que essa deposição de complexos imunes pode ser um prelúdio necessário para a liberação de quimiocinas pelas células dendríticas foliculares que atrai poucas (talvez uma ou duas) células B ativadas dos focos extrafoliculares para dentro dos folículos a fim de iniciar a reação do centro germinativo.
A Reação de Células B de Centro Germinativo e a Função das Células T Auxiliares Foliculares
Os eventos característicos de respostas de anticorpos dependentes de células T auxiliares, incluindo maturação da afinidade, mudança de isótipo, geração de células B de memória, e diferenciação de plasmócitos de vida longa, ocorrem principalmente nos centros germinativos dos folículos linfoides. Dentro de quatro a sete dias após a exposição a antígenos, algumas das células T auxiliares ativadas que migram ao encontro das células B ativadas são induzidas por essas células B a se diferenciarem em células T auxiliares foliculares (células TFH), que expressam altos níveis do receptor de quimiocina CXCR5 e são atraídas aos folículos linfoides pelo ligante de CXCR5, produzido somente nos folículos. Essas células são chamadas de células T auxiliares foliculares (TFH), pois são as principais células T CD4+ presentes nos folículos e têm papéis fundamentais na reação do centro germinativo. Ao mesmo tempo, algumas das células B ativadas migram de volta ao folículo e começam a proliferar rapidamente, formando a região central de coloração mais clara do folículo, chamada de centro germinativo (Figs. 11-11 e 11-12). Cada centro germinativo completamente formado contém células derivadas de apenas um ou poucos clones de células B específicas para o antígeno. Dentro do centro germinativo existe uma “zona escura” que é densamente povoada por células B em rápida proliferação. O tempo de divisão dessas células B do centro germinativo em proliferação, também chamadas de centroblastos, é estimado em 6 a 12 horas, de modo que em cinco dias, um único linfócito B pode originar uma prole de quase 5 mil células. A progênie das células B em proliferação no centro germinativo consiste em células menores, algumas vezes chamadas de centrócitos, que sofrem os processos de diferenciação e seleção na “zona clara”, descrita adiante. As células B nos centros germinativos expressam um repressor transcricional conhecido como Bcl-6 (para o gene 6 do linfoma de células B), cujo papel é descrito depois, quando consideramos a regulação transcricional do destino da célula B.
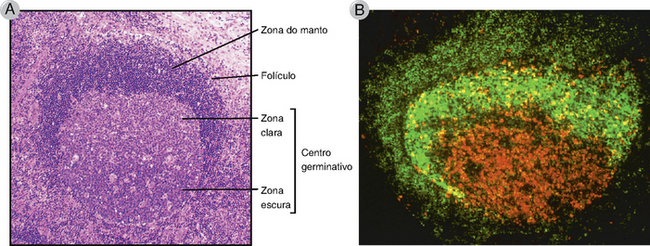
FIGURA 11-11 Centros germinativos em órgãos linfoides secundários. A, Histologia de um folículo secundário com um centro germinativo em um gânglio linfático. O centro germinativo está contido no folículo, e inclui uma zona basal escura e uma zona clara adjacentes. A zona do manto é o folículo mãe dentro do qual o centro germinativo se formou. B, Componentes celulares de um centro germinativo. Um folículo secundário foi corado com um anticorpo anti-CD23 (verde), que marca (identificado por fluorescência) as células foliculares dendríticas na zona clara e marca pouco as células B virgens na zona do manto. O anti-Ki67 (vermelho), que detecta as células de divisão, marca blastos de células B em mitose ativos na zona escura.
A, (Cortesia de Dr. James Gulizia, Departament of Pathology, Brigham and Women’s Hospital, Boston, Massachusetts.) B, (Modificado de Liu YJ, GD Johnson, J Gordon, and IC MacLennan. Germinal centres in T-cell–dependent antibody responses. Immunology Today 13:17-21, Copyright 1992, com permissão da Elsevier.)
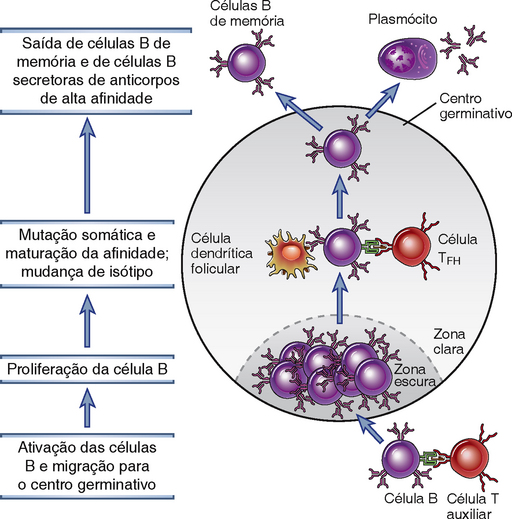
FIGURA 11-12 A reação do centro germinativo em um gânglio linfático. As células B que foram ativadas por células T auxiliares na borda de um folículo primário migram para o folículo e proliferam, formando a zona escura do centro germinal. Células B presentes nos centros germinativos sofrem extensas mudanças de isótipo. A hipermutação somática de genes V da Ig ocorre nessas células B, e elas migram para a zona clara, onde encontram células dendríticas foliculares exibindo antígeno e células TFH. As células B com maior afinidade aos receptores Ig são selecionadas positivamente (sobrevivência), e elas se diferenciam em células B secretoras de anticorpos ou de memória. As células secretoras de anticorpos saem e residem na medula óssea como plasmócitos de longa vida, e as células B de memória entram no conjunto de células em recirculação.
Além do receptor de quimiocina CXCR5, células TFH são caracterizadas pela expressão de ICOS (coestimulador induzível), da citocina IL-21 e do fator de transcrição Bcl-6. Células TFH têm um fenótipo que as distingue de TH1, TH2, TH17, e das células Treg descritas nos Capítulos 9 e 10. É possível que as células TFH possam se desenvolver de células T CD4+ virgens ou de subtipos de células T polarizadas que retêm plasticidade de desenvolvimento. A citocina característica secretada pelas células TFH é a IL-21. É necessária para o desenvolvimento do centro germinativo e também contribui para a geração de plasmócitos na reação do centro germinativo. Além da IL-21, as células TFH secretam outras citocinas, incluindo IFN-γ e IL-4 (mas em níveis menores que as células TH1 e TH2 diferenciadas, respectivamente), e todas têm funções importantes na mudança de isótipo.
Os mecanismos que impulsionam o desenvolvimento de células TFH a partir de células CD4+, e os mecanismos pelos quais as células TFH ativam as células B não são totalmente compreendidos. Várias moléculas das células B e células T auxiliares são conhecidas por executarem um papel fundamental nesses processos (Fig. 11-13). O coestimulador ICOS, que está relacionado ao CD28 e é expresso nas células TFH, é essencial para a reação do centro germinativo. A interação do ICOS com o ligante ICOS nas células B promove a diferenciação de células T em células TFH. As interações entre as células B e células T auxiliares são mediadas por integrinas e por membros da família SLAM de coestimuladores. Uma molécula de sinalização que se associa a essas proteínas da família SLAM em células TFH é chamada de SAP, e a sinalização via SAP ativa reguladores transcricionais, particularmente Bcl-6, que são necessários para o desenvolvimento de células TFH. Mutação no gene SAP é responsável pelo desenvolvimento de uma doença em humanos conhecida como síndrome linfoproliferativa ligada a X, que está associada a defeitos na produção de anticorpos e nas respostas citotóxicas de células T (Cap. 20). A IL-21 secretada por células TFH pode facilitar os eventos de seleção de células B no centro germinativo e a diferenciação de células B ativadas em plasmablastos. Essas células T auxiliares podem secretar outras citocinas que podem ser características de células TH1, TH2, e TH17, e essas citocinas podem contribuir para a mudança de isótipo. A formação de centros germinativos é também dependente das interações CD40L-CD40. Essas podem ser críticas para a proliferação de células B, necessárias para a expansão de células B nos centros germinativos, e também para a mudança de isótipo e maturação de afinidade. Portanto, a formação de centros germinativos é prejudicada nos humanos e nos camundongos com defeitos genéticos no desenvolvimento ou na ativação da célula T ou com mutações de CD40 ou do seu ligante (Cap. 20).
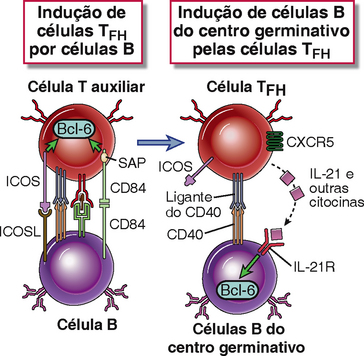
FIGURA 11-13 Eventos moleculares na geração e função de células T auxiliares foliculares. Células B ativadas expressam ICOSL e ativam as células T auxiliares. O acoplamento de ICOS ao seu ligante (ICOSL) e a ativação homotípica de proteínas da família SLAM nas células T resultam na diferenciação dessas em células T auxiliares foliculares (TFH). A proteína associada a SLAM (SAP) é uma molécula de sinalização necessária para a diferenciação das células TFH. Células TFH expressam o fator de transcrição Bcl-6, secretam IL-21 e outras citocinas que são capazes de ativar as células B na reação do centro germinativo.
A arquitetura dos folículos linfoides e a reação dos centros germinativos dentro dos folículos dependem da presença de células dendríticas foliculares (FDC). As FDC são encontradas apenas nos folículos linfoides e expressam receptores de complemento (CR1, CR2 e CR3) e receptores de Fc. Essas moléculas estão envolvidas na captura e retenção de antígenos para a seleção das células B dos centros germinativos, como descrito mais adiante. Os FDC não expressam moléculas MHC de classe II e não são derivados de células progenitoras da medula óssea. Apesar de seu nome, essas células são distintas das células dendríticas expressando MHC de classe II que capturam os antígenos em tecidos e os transportam para os órgãos linfoides, onde apresentam peptídeos aos linfócitos T. Os longos processos citoplasmáticos das FDC formam uma rede ao redor da qual os centros germinativos são formados. As células B em proliferação se acumulam na zona escura, identificável histologicamente no centro germinativo, que tem poucas FDC. As células B em proliferação, que são blastos (grandes), dão origem a células B menores que não proliferam mais e que migram para a zona clara adjacente à zona escura. Nessa região, essas células B menores entram em íntimo contato com os processos citoplasmáticos abundantes das FDC, que também formam contatos íntimos com células TFH. É nesse microambiente que ocorrem os eventos de seleção subsequentes (Fig. 11-12). A área do folículo que contém apenas células B virgens circunda o centro germinativo e é chamada de zona do manto.
Mudança de Isótipo (Classe) da Cadeia Pesada
Em resposta à ligação ao CD40 e às citocinas, parte da progênie das células B ativadas que expressa IgM e IgD sofre o processo de mudança de isótipo (classe) da cadeia pesada, levando à produção de anticorpos com cadeias pesadas de diferentes classes, tais como γ, α e ε (Fig. 11-14). A mudança de isótipo é observada em células B nos focos extrafoliculares, induzida por células T auxiliares extrafoliculares, e, principalmente, nos centros germinativos, nesse caso impulsionada por células TFH. A capacidade das células B de produzir diferentes isótipos de anticorpos proporciona uma plasticidade marcante nas respostas imunes humorais, pois são gerados anticorpos que desempenham funções efetoras diferentes e estão envolvidos na defesa contra diferentes tipos de agentes infecciosos.
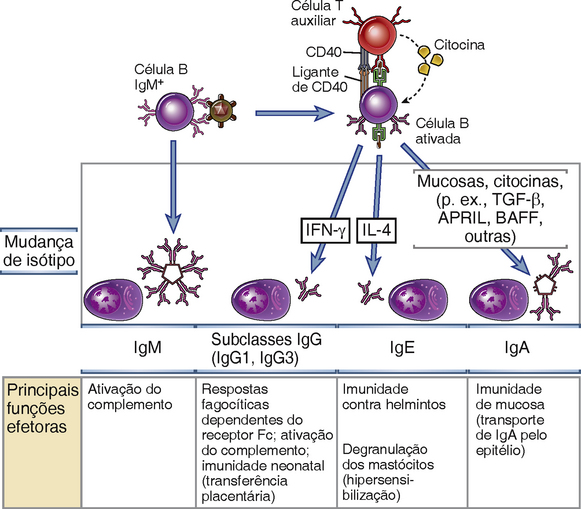
FIGURA 11-14 Mudança de isótipo de cadeia pesada Ig. As células B ativadas por sinais oriundos das células T auxiliares (CD40L, citocinas) sofrem mudanças de isótipos de cadeias pesadas, permitindo a produção de diferentes isótipos de Ig que medeiam funções efetoras distintas. Exemplos de mudanças de isótipos são mostrados. O papel do IFN-γ em dirigir a mudança de isótipos específicos foi estabelecido apenas em roedores.
A mudança de isótipo em resposta a diferentes tipos de micro-organismos é regulada pelas citocinas produzidas pelas células T auxiliares que são ativadas na presença desses patógenos. Por exemplo, a principal resposta imune humoral protetora contra bactérias com cápsulas ricas em polissacarídeo consiste em anticorpos IgM, os quais se ligam às bactérias, ativam o sistema complemento e induzem a fagocitose das bactérias opsonizadas. Antígenos polissacarídicos, que não desencadeiam auxílio das células T, estimulam principalmente anticorpos IgM, com pouca ou nenhuma mudança de isótipo para algumas subclasses de IgG. A resposta a muitos vírus e bactérias envolve a produção de anticorpos IgG, os quais bloqueiam a entrada dos micro-organismos nas células do hospedeiro e também promovem a fagocitose pelos macrófagos. Vírus e muitas bactérias ativam as células T auxiliares do subtipo TH1, que produzem a citocina IFN-γ. Em camundongos, o IFN-γ é o principal indutor de mudança de cadeia pesada da Ig em célula B para as subclasses IgG que são opsonizantes e fixadores de complemento; mas ainda não está claro quais citocinas desempenham esse papel em seres humanos. A resposta de anticorpos para muitos helmintos é principalmente IgE, que participa na eliminação desses parasitas mediada por eosinófilos e mastócitos (Caps. 12 e 15); anticorpos IgE também medeiam reações de hipersensibilidade imediata (alérgicas) (Cap. 19). Os helmintos ativam o subtipo TH2 a partir das células T auxiliares, a qual produz IL4, a citocina que induz a mudança de classe para IgE. Na reação de centro germinativo, essas citocinas podem ser produzidas por células efetoras clássicas TH1 e TH2 (que tendem a migrar para locais periféricos de infecção e inflamação), mas também por células TFH que retém a capacidade de produzir citocinas TH1 ou TH2. Além disso, células B em diferentes sítios anatômicos mudam para isótipos diferentes. Especificamente, células B em tecidos de mucosa mudam para IgA, que é a classe de anticorpo transportada com mais eficiência pelos epitélios nas secreções mucosas, onde ela defende contra micro-organismos que tentam entrar através dos epitélios da mucosa (Cap. 13). A mudança para IgA é estimulada pelo fator de β crescimento transformante (TGF-β), produzido por muitos tipos de células, incluindo células T auxiliares, presentes na mucosa e em outros tecidos. As citocinas da família TNF, BAFF e APRIL também estimulam a mudança para IgA. Como essas citocinas são produzidas por células mieloides, elas podem estimular a produção de IgA na ausência da ajuda de células T. Alguns indivíduos que herdam alelos mutantes do gene TACI, que codifica um receptor para essas citocinas, têm uma deficiência seletiva de produção de IgA (Cap. 20).
Os sinais bioqímicos deflagrados via CD40 trabalham em conjunto com sinais induzidos pelas citocinas para induzir a mudança de isótipo. O engajamento do CD40 induz a enzima chamada deaminase induzida pela ativação (AID), que, como veremos adiante, é crucial tanto para a mudança de isótipo quanto para a mutação somática. A necessidade de sinalização via CD40 e da indução de AID para promover a mudança de isótipo nas células B está bem documentada nos achados obtidos em camundongos e humanos com deficiência do CD40, do seu ligante ou de AID. Em todos esses casos, a resposta de anticorpos a antígenos proteicos é predominantemente de anticorpos IgM, e a mudança para outros isótipos é limitada. As citocinas, como descrito posteriormente, identificam os loci de cadeia pesada Ig específicos que irão participar no processo de mudança.
O mecanismo molecular da mudança de isótipo é um processo chamado de recombinação de troca, em que o éxon VDJ rearranjado que codifica um domínio V de cadeia pesada Ig recombina-se com o gene que codifica a região C localizado posteriormente, e o DNA que se interpõe entre eles é eliminado. Uma visão geral do processo é mostrada na Figura 11-15. Esses eventos de recombinação do DNA envolvem sequências nucleotídicas chamadas regiões de troca, que estão localizadas nos íntrons entre os segmentos J e C nas extremidades 5′ de todos os lócus CH, outros além do gene δ (que, em humanos, tem algumas sequências repetidas ricas em GC que podem funcionar, com menor eficiência, como região de troca). As regiões de mudança têm 1-10 kilobases de extensão, contêm inúmeras repetições em tandem de sequências de DNA ricas em GC, e são encontradas sempre a 5′ de cada gene que codifica a região constante (C) da cadeia pesada dos diferentes isótipos. A 5′ de cada região de troca há um pequeno éxon chamado de éxon I (para o iniciador da transcrição) precedido por um promotor chamado de região I. Os sinais de citocinas e CD40 induzem a transcrição de uma região I particular de leitura do promotor pelo éxon I, região de troca, e éxons CH adjacentes. Essas transcrições são conhecidas como transcrições de linhagem germinal. Elas não codificam proteínas específicas, mas são necessárias para que a mudança do isótipo aconteça. Transcrições germinativas são encontradas tanto no lócus μ quanto no lócus da cadeia pesada para a qual a célula B será induzida a mudar. Em cada região que participa da troca, a transcrição do RNA, mantendo a configuração germinativa, facilita as quebras de DNA de fita dupla, como descrito posteriormente. A quebra de DNA na região de troca do isótipo anterior, IgM (μ), é unida à quebra feita na região de troca do isótipo selecionado. Como resultado, o éxon VDJ rearranjado que está imediatamente antes da região de troca μ na célula B produtora de IgM se recombina com a nova região C a qual se pretende trocar com atividade transcricional. As citocinas determinam qual região CH irá sofrer a transcrição de linha germinal. Por exemplo, a IL-4 induz a transcrição mantendo a configuração germinal do lócus Iε-Sε-Cε (Fig. 11-15). Isso leva primeiro à produção de transcrições ε germinativas em uma célula B expressando IgM e, em seguida, à recombinação da região de troca Sμ com a região de troca Sε. O DNA intercalante é perdido, e o éxon VDJ é, portanto, trazido para perto do Cε. O resultado é a produção de IgE com a mesma região V que a da IgM original produzida por essa célula B.
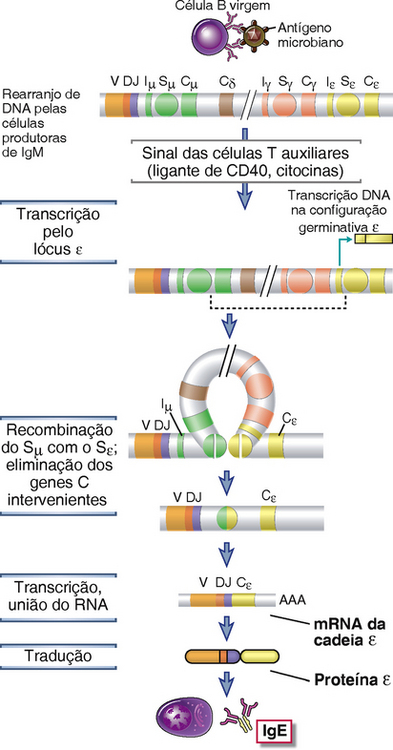
FIGURA 11-15 Mecanismos de mudanças de isótipos de cadeia pesada. Na ausência de sinais de célula T auxiliar, as células B produzem IgM. Quando as células B ativadas por antígeno encontram sinais das células T auxiliares (CD40L e, neste exemplo, IL-4), as células B sofrem mudanças para outros isótipos Ig (neste exemplo, IgE). Esses estímulos iniciam uma transcrição do RNA na configuração germinativa do lócus Iε-Sε-Cε. Os genes proximais ao CH são eliminados em um círculo de DNA, levando à recombinação do éxon VDJ com o gene Cε. Regiões de mudança estão indicadas por círculos designados Sμ ou Sγ. Embora não seja mostrada uma região de mudança para o gene δ, em humanos, uma região semelhante à mudança acima do gene δ é funcional. Iμ e Iε representam o sítio de iniciação para a transcrição na configuração germinativa. (Note que há múltiplos genes Cγ localizados entre Cδ e Cε, mas não são mostrados.)
A enzima-chave necessária para a mudança de isótipo (e mutação somática, como descrito mais tarde) é a deaminase induzida pela ativação (AID). Em humanos e em camundongos deficientes nessa enzima são observados defeitos profundos na mudança de isótipos e maturação de afinidade. A expressão da AID é ativada principalmente por sinais via CD40. A enzima deamina a citocina na fita simples de DNA, convertendo resíduos de citocina (C) em resíduos de uracil (U) (Fig. 11-16). Regiões de troca são ricas em bases G e C, e os transcritos das regiões de troca tendem a formar híbridos estáveis de DNA-RNA envolvendo a parte da fita do DNA codificante (de cima), liberando assim o filamento de baixo ou filamento não molde, que forma um loop de DNA de fita única aberto denominado loop R. O loop R é o local onde um grande número de resíduos de C na sequência do DNA modificada são convertidos a resíduos de U pela AID. Uma enzima chamada uracil N-glicosilase remove os resíduos U, deixando sítios abásicos. A endonuclease ApeI, e provavelmente outras endonucleases, cliva esses sítios abásicos, gerando um corte em cada posição. Alguns cortes são gerados no filamento superior, bem como de uma forma dependentes de AID, mas é menos claro como isso acontece. Cortes em ambos os filamentos contribuem para quebras bifilamentares tanto na região Sμ quanto no lócus de mudança posterior que está envolvido em um evento de mudança de isótipo específico. A existência de quebras bifilamentares em duas regiões de troca resulta na deleção do DNA localizado entre elas e na união das duas regiões de troca quebradas, usando a maquinaria envolvida no reparo da quebra bifilamentar pela junção de extremidades não homólogas. Essa maquinaria também é usada para reparar quebras bifilamentares durante a recombinação V(D)J (Cap. 8).
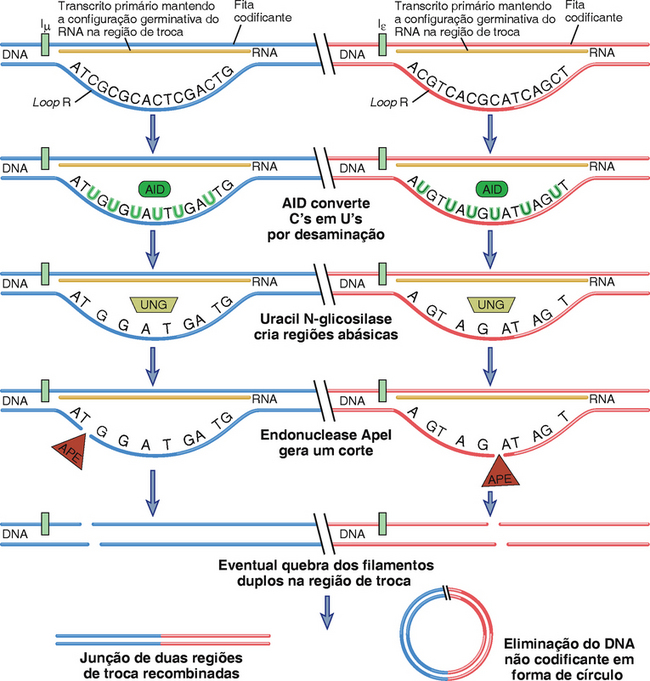
FIGURA 11-16 Mecanismo pelo qual a transcrição de AID e do transcrito na configuração germinativa colaboram para gerar quebras de filamentos duplos em regiões de troca. Duas regiões diferentes de troca, para μ e ε, são mostradas. Os transcritos primários na configuração germinativa formam híbridos DNA-RNA na região de troca, liberando a fita não moldada como um loop R de DNA unifilamentar. Esse é um modelo particularmente bom para a AID, pois essa enzima desamina os resíduos C gerando resíduos U no DNA unifilamentar. A uracil N-glicosilase (UNG) remove os resíduos U gerando regiões abásicas que podem ser locais de corte após a ação da endonuclease ApeI. Dois cortes aproximadamente opostos contribuem para uma quebra de cadeia dupla. O mecanismo de geração do corte na fita molde é bem menos compreendido. Quebras de fita dupla são feitas em cada região que será alvo da troca, e essas são recombinadas, enquanto o DNA interveniente é removido como um círculo.
Maturação de Afinidade: Mutação Somática em Genes Ig e Seleção de Células B de Alta Afinidade
A maturação da afinidade é o processo que leva ao aumento da afinidade dos anticorpos para um antígeno à medida que a resposta humoral dependente de célula T progride, e é o resultado da mutação somática de genes Ig seguida pela sobrevivência seletiva das células B produtoras dos anticorpos de maior afinidade. O processo de maturação de afinidade gera anticorpos com a capacidade aumentada de se ligar a antígenos e, desse modo, ligam, neutralizam e eliminam micro-organismos com mais eficiência (Fig. 11-17). Células T auxiliares e interações CD40-CD40L são necessárias para que a mutação somática seja iniciada, e como resultado, a maturação de afinidade é observada somente nas respostas de anticorpos a antígenos proteicos dependentes de células T. Certo grau de mutação somática ocorre nas células B em focos extrafoliculares, mas a maior parte desse fenômeno ocorre nos centros germinativos. Como discutido anteriormente, a necessidade do CD40 reflete a capacidade desse receptor de induzir a AID, além de induzir extensa proliferação em células B.
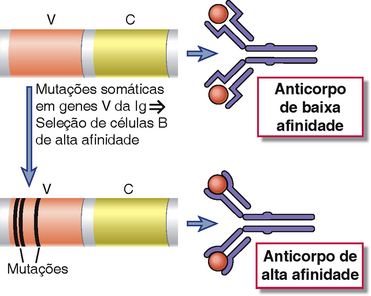
FIGURA 11-17 Visão geral da maturação de afinidade. No início da resposta imune, anticorpos de baixa afinidade são produzidos. Durante a reação do centro germinativo, a mutação somática de genes V da Ig e a seleção de células B mutantes com receptores de alta afinidade resultam na produção de anticorpos com alta afinidade para o antígeno.
Nas células B em proliferação na zona escura do centro germinativo, os genes Ig V sofrem mutações pontuais em uma taxa extremamente elevada. Essa taxa é estimada em 1 a cada 103 pares de base do gene V por divisão celular, o que é cerca de mil vezes maior do que a taxa de mutação espontânea em outros genes de mamíferos. (Por essa razão, a mutação nos genes V das Ig também é chamada de hipermutação.) Os genes V de cadeias pesadas e leves expressos em cada célula B contêm um total de cerca de 700 nucleotídeos; isso implica que as mutações se acumulam nas regiões V expressas a uma taxa média de quase uma por divisão celular. As mutações do gene V da Ig continuam a ocorrer na progênie de células B individuais. Como resultado, qualquer clone de células B pode acumular mais e mais mutações durante sua vida no centro germinativo. Estima-se que, como consequência das mutações somáticas, as sequências de nucleotídeos dos anticorpos IgG derivados de um clone de células B podem divergir em torno de 5% da sequência original da linhagem germinativa. Isso geralmente se traduz em até 10 substituições de aminoácidos. Várias características dessas mutações são dignas de nota. Primeiro, as mutações são concentradas nas regiões V, em sua maioria nas regiões de determinação da complementaridade ao antígeno (Fig. 11-18). Segundo, existem muito mais mutações nos anticorpos IgG do que nos anticorpos IgM. Terceiro, a presença de mutações se correlaciona com o aumento na afinidade dos anticorpos para o antígeno que induziu a resposta.
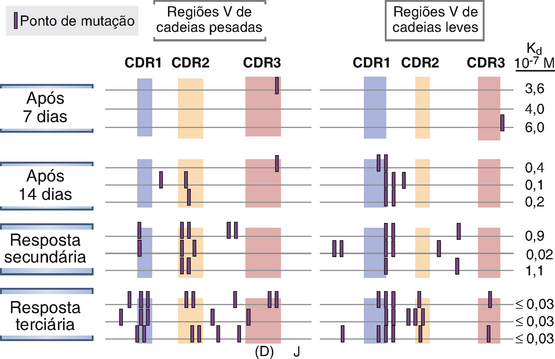
FIGURA 11-18 Mutações somáticas nos genes V da Ig. Hibridomas foram produzidos a partir de células do baço de camundongos imunizados 7 ou 14 dias antes com um hapteno, oxazolina, acoplado a uma proteína, e as células do baço foram obtidas após a imunização secundária e terciária com o mesmo antígeno. Hibridomas produzindo anticorpos monoclonais específicos para oxazolina foram isolados, e as sequências de nucleotídeos dos genes V codificando os domínios variados das cadeias pesadas e leves de Ig foram determinados. As mutações em genes V aumentam com o tempo após a imunização com vacinas repetidas, e estão agrupadas nas regiões determinantes de complementaridade (CDR). A localização do CDR3 nas cadeias pesadas é aproximada. As afinidades dos anticorpos produzidos também tendem a aumentar com mais mutações, como indicado pelos menores valores das constantes de dissociação (Kd) para ligação do hapteno.
(Modificado de Berek C, and C Milstein. Mutation drift and repertoire shift in maturation of the immune response. Immunological Reviews 96:23-41, 1987, Blackwell Publishing.)
Os mecanismos que estão por trás da mutação somática nos genes Ig são parcialmente compreendidos. Está claro que o éxon VDJ rearranjado da Ig se torna altamente suscetível a mutações, sugerindo uma sensibilidade acentuada dessa região não apenas aos fatores de ligação ao DNA que identificam as regiões V rearranjadas como também à mutação. A enzima AID, discutida anteriormente no contexto da mudança de isótipo, desempenha um papel essencial na maturação de afinidade. Sua atividade de desaminase do DNA converte resíduos C em resíduos U em pontos suscetíveis de mutação. As U podem ser trocadas por T quando ocorre a replicação do DNA, gerando, assim, um tipo comum de mutação de C para T, ou a U pode ser excisada pela uracil N-glicosilase, e o sítio abásico que é gerado é reparado por um processo de reparo propenso a erro, gerando, assim, todos os tipos de substituições em cada sítio de desaminação da N-citidina induzida pela AID. Esses processos de reparo que são sujeitos a erros de reparação estendem as mutações a resíduos além dos resíduos C que são direcionados pela AID.
A estimulação repetida por antígenos proteicos dependentes de célula T leva a números crescentes de mutações nos genes Ig de células B presentes no centro germinativo que são específicas para o antígeno. Algumas dessas mutações provavelmente são úteis porque irão gerar anticorpos de alta afinidade. Entretanto, muitas das mutações podem resultar em um declínio ou mesmo na perda de ligação ao antígeno. Portanto, o próximo e crucial passo no processo da maturação da afinidade é a seleção das células B de maior afinidade.
As células B que se ligam a esses antígenos nos centros germinativos com alta afinidade são positivamente selecionadas (Fig. 11-19). A resposta inicial ao antígeno resulta na produção de anticorpos, alguns dos quais formam complexos com antígeno residual e podem ativar o complemento. As FDC expressam receptores para as porções Fc dos anticorpos e para produtos da ativação do complemento, incluindo C3b e C3d. Esses receptores ligam e exibem antígenos que estão complexados com anticorpos e produtos do complemento. O antígeno também pode ser exibido na forma livre no centro germinativo. Enquanto isso, as células B do centro germinativo que sofreram mutação somática migram para a zona clara do centro germinativo, rica em FDC. Nas células B dos centros germinativos, a IL-21 secretada por células TFH induz a expressão de proteínas que induzem a apoptose e reduz a expressão de proteínas que impedem a apoptose. Portanto, essas células B morrem por apoptose a menos que sejam resgatadas pelo reconhecimento do antígeno. Células B com receptores de alta afinidade para o antígeno são mais capazes de ligar o antígeno quando estão presentes em baixas concentrações, e essas células B sobrevivem preferencialmente por causa de vários mecanismos. Primeiro, o reconhecimento de antígeno por si só induz a expressão de proteínas antiapoptóticas da família Bcl-2. Em segundo lugar, as células B de alta afinidade irão preferencialmente fazer endocitose e apresentar o antígeno e interagir de maneira estável com os números limitados de células TFH no centro germinal. Essas células T auxiliares podem usar o CD40L para promover a sobrevivência das células B com as quais elas interagem. Em terceiro, algumas células TFH expressam ligantes Fas, que podem reconhecer o receptor de morte Fas em células B do centro germinativo e deflagrar um sinal de apoptose. Células B de alta afinidade, que são mais eficazes em reconhecer e responder ao antígeno, podem ativar inibidores endógenos de Fas quando seus BCR reconhecerem o antígeno e, portanto, estarem protegidos da morte, enquanto as células B de baixa afinidade são mortas.
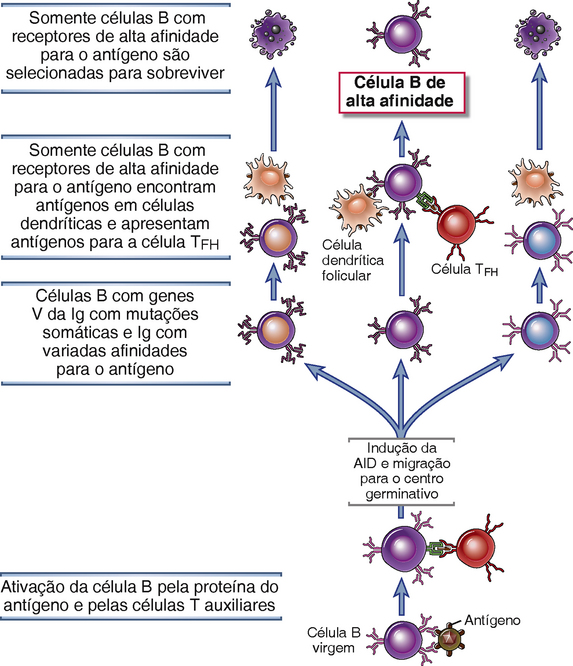
FIGURA 11-19 Seleção de células B em centros germinativos. A mutação somática de genes da região V em células B de centros germinativos geram anticorpos com afinidades diferentes para o antígeno. Posteriormente, a ligação das células B aos antígenos exibidos nas células dendríticas foliculares é necessária para resgatar as células B da morte celular programada. As células B também podem apresentar antígenos para células TFH dos centros germinativos, que podem promover a sobrevivência de células B. As células B com maior afinidade para o antígeno terão uma vantagem seletiva para a sobrevivência conforme a quantidade de antígeno disponível diminui durante uma resposta imune. Isso leva a um aumento médio na afinidade de anticorpos para o antígeno conforme a resposta imune humoral avança.
À medida que mais anticorpos são produzidos, mais antígenos são eliminados e menos ficam disponíveis nos centros germinativos. Logo, as células B que serão capazes de se ligar especificamente a esse antígeno e serem resgatadas da morte precisam expressar receptores antigênicos com afinidade cada vez maior pelo antígeno. Em decorrência disso, à medida que a resposta de anticorpos a um antígeno progride, as células B selecionadas nos centros germinativos produzem Ig de afinidade crescente pelo antígeno. Esse processo de seleção resulta na maturação da afinidade da resposta de anticorpos. Como a mutação somática também gera muitas células B que não expressam receptores de alta afinidade pelo antígeno e não podem, portanto, ser selecionadas para sobreviver, os centros germinativos são sítios de intensa apoptose.
A mutação somática ocorre na zona basal escura dos centros germinativos em células B chamadas de centroblastos, que contêm AID nuclear, e essas células que sofreram mutações pontuais nas regiões V da Ig podem repetidamente circular entre a zona basal escura e a zona apical clara, onde se diferenciam em células morfologicamente distintas chamadas centrócitos. Por fim, os centrócitos de alta afinidade podem ser selecionados na zona clara por antígeno, com a ajuda de células TFH, e podem sofrer mudanças isótipas adicionais. As células selecionadas, então, se diferenciam em células B de memória ou em plasmócitos secretores de anticorpos de alta afinidade que saem dos centros germinativos.
Dada a extraordinária taxa de mutação nos centros germinativos, não é surpreendente que as neoplasias malignas de origem linfoides em humanos se desenvolvam mais frequentemente de células B nesse local, porque as quebras de DNA associadas à mutação e mudança de isótipo criam um cenário propício para as translocações cromossômicas de vários oncogenes para o loci de gene Ig, produzindo tumores de células B (linfomas). Os centros germinativos também assumem um papel importante na patogênese da autoimunidade porque os mecanismos de tolerância das células T podem ser subvertidos se a mutação somática dirigir um clone de células B no centro germinativo para se tornar fortemente autorreativa. Na verdade, sabe-se que a desregulação da seleção de célula B nos centros germinativos contribui para a produção de autoanticorpos.
Diferenciação da Célula B em Plasmócitos Secretores de Anticorpos
Parte da progênie das células B que proliferaram em resposta ao antígeno e com o auxílio da célula T se diferencia em plasmócitos secretores de anticorpos. Os plasmócitos são células B completamente diferenciadas, morfologicamente distintas, comprometidas com produção abundante de anticorpos (Cap. 2). Plasmócitos são gerados após a ativação das células B por meio de sinais oriundos do BCR, CD40, TLR assim como de outros receptores, incluindo os receptores de citocinas. Existem dois tipos de plasmócitos. Os plasmócitos de vida curta são gerados durante respostas independentes de célula T ou no início de uma resposta dependente de célula T em focos de células B extrafoliculares, descritos anteriormente. Essas células são encontradas geralmente nos órgãos linfoides secundários e em tecidos não linfoides periféricos. Plasmócitos de vida longa são gerados nos centros germinativos em respostas a antígenos proteicos dependentes de células T. Sinais do receptor de antígeno de células B e IL-21 colaboram na geração de plasmócitos. Plasmócitos (e seus precursores, os plasmablastos, que podem ser encontrados na circulação) gerados nos centros germinativos adquirem a habilidade de se alojar na medula óssea, onde são mantidos por citocinas da família BAFF que se ligam a um receptor de membrana dos plasmócitos chamado de BCMA, permitindo assim que os plasmócitos sobrevivam por longos períodos, muitas vezes, durante todo o tempo de vida do hospedeiro. Tipicamente, duas a três semanas após a imunização com um antígeno T-dependente, a medula óssea se torna um importante sítio de produção de anticorpos. Os plasmócitos na medula óssea podem continuar a secretar anticorpos por meses ou mesmo anos após o antígeno ter sido eliminado. Esses anticorpos podem proporcionar proteção imediata se o antígeno for encontrado mais tarde. Estima-se que quase a metade dos anticorpos no sangue de um adulto sadio é produzida por plasmócitos de vida longa e é específica para antígenos que foram encontrados no passado. Os anticorpos secretados entram na circulação e nas secreções mucosas, mas os plasmócitos maduros, quando chegam a medula óssea, não circulam novamente.
A diferenciação das células B ativadas em plasmócitos secretores de anticorpos envolve grandes alterações estruturais, especialmente de componentes do retículo endoplasmático e da via de excreção com aumento da produção de Ig, além de uma mudança nas cadeias pesadas Ig da forma membrana para a forma secretada. Embora um plasmócito seja derivado de uma célula B, ele sofre uma transformação notável, uma vez que se diferencia de uma célula B ativada para o estágio de plasmablasto. Mais notavelmente, a célula aumenta drasticamente, e a relação do citoplasma para o núcleo também passa por um aumento impressionante. O retículo endoplasmático torna-se proeminente, e a célula é transformada em uma célula secretora que tem pouca ou nenhuma semelhança com uma célula B. Os fatores de transcrição que regulam o desenvolvimento de células plasmáticas serão descritos mais tarde.
As mudanças na produção de Ig da forma de membrana (característica das células B) à forma secretada (em plasmócitos) é o resultado de mudanças no terminal carboxila na cadeia pesada de Ig (Fig. 11-20). Por exemplo, na membrana μ, Cμ4 é seguido por um espaçador curto, 26 resíduos transmembrana hidrofóbicos e uma cauda citoplásmica de três aminoácidos (lisina, valina e lisina). Por sua vez, na IgM secretada, o domínio Cμ4 é seguido por uma peça da cauda contendo aminoácidos polares. Essa transição de Ig de membrana para secretada é realizada pelo processamento do RNA mensageiro (RNAm) da cadeia pesada. O transcrito primário do RNA em todas as células B produtoras de IgM contém o bloco VDJ rearranjado, os quatro éxons Cμ que codificam os domínios da região constante (C), e os dois éxons que codificam os domínios transmembrana e citoplasmático. O processamento alternativo desse transcrito, que é regulado pela clivagem do RNA e pela escolha dos sítios de poliadenilação, determina se os éxons transmembrana e citoplasmático estarão incluídos no RNAm maduro ou não. Caso esses últimos éxons sejam mantidos nos RNAm, a cadeia μ produzida conterá os aminoácidos necessários para construir os segmentos transmembrana e citoplasmático e, portanto, ficará ancorada na bicamada lipídica da membrana plasmática. Se, por sua vez, o segmento transmembrana tiver sido excluído da cadeia μ, a extremidade carboxiterminal consistirá em cerca de 20 aminoácidos constituindo a peça da cauda. Como essa proteína não possui um trecho de aminoácidos hidrofóbicos ou uma cauda citoplasmática carregada positivamente, essa isoforma não pode permanecer ancorada na membrana do retículo endoplasmático, fazendo com que a proteína fique inicialmente no espaço luminal da via secretora, e é secretada. Assim, cada célula B pode sintetizar ambas as formas, Ig de membrana e secretada. A maior parte do RNAm da cadeia pesada Ig em um plasmócito é clivada no local de poliadenilação posterior, por isso a maior parte desse RNAm é da forma secretora. Todos os genes CH contêm éxons de membrana semelhantes, e todas as cadeias pesadas podem potencialmente ser expressas na forma ligada à membrana e na forma secretada. Entretanto, a forma secretora da cadeia pesada δ raramente é sintetizada, de modo que a IgD em geral só está presente como proteína ligada à membrana.
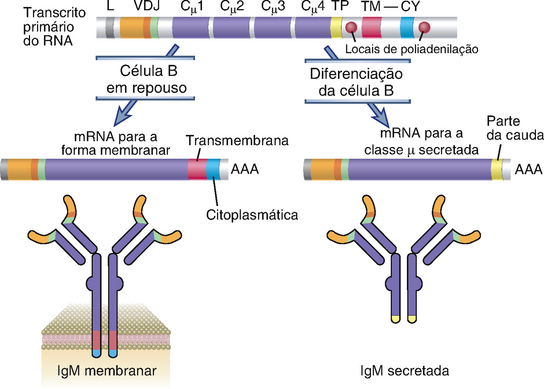
FIGURA 11-20 Produção de cadeias μ de membrana e secretadas em linfócitos B. Processamento alternativo do transcrito primário do RNA pode resultar na formação de um mRNA capaz de codificar a forma membranar da Ig ou a forma secretada da cadeia pesada μ. A diferenciação das células B resulta em uma fração crescente de proteína μ produzida como forma secretada. TP, TM e CY se referem às regiões da cauda, da transmembrana e dos segmentos citoplásmicos, respectivamente. Cμ1, Cμ2, Cμ3 e Cμ4 são quatro éxons do gene Cμ.
Geração de Células B de Memória e Respostas Imunes Humorais Secundárias
Algumas das células B ativadas pelo antígeno que emergem dos centros germinativos adquirem a capacidade de sobreviver por longos períodos, aparentemente sem necessitar do contínuo estímulo antigênico. Essas são as células de memória, capazes de montar respostas rápidas à introdução subsequente do antígeno. Como as células de memória são geradas principalmente nos centros germinativos, são vistas nas respostas imunes dependentes de células T e, geralmente, surgem em paralelo com as células T auxiliares de memória. Células B de memória expressam altos níveis da proteína antiapoptótica Bcl-2, que contribui para a longa vida útil dessas células. Algumas células B de memória podem permanecer no órgão linfoide em que foram produzidas, enquanto outras deixam os centros germinativos e recirculam entre o sangue e os órgãos linfoides. Quando comparada às células B virgens, as células de memória exibem tipicamente receptores antigênicos com maior afinidade (resultado da mutação somática) e de diferentes classes (consequência da troca de cadeia pesada). A produção de grandes quantidades de anticorpos de alta afinidade com isótipos mudados é tremendamente acelerada após a segunda exposição aos antígenos, e isso pode ser atribuído à ativação das células de memória nos centros germinativos.
Muitas das características das respostas secundárias de anticorpos a antígenos proteicos, e suas diferenças com relação às repostas primárias (Fig. 11-2), refletem as diferenças entre as respostas de células B de memória e células virgens, respectivamente. Como a geração de células B de memória é melhorada na presença de células T auxiliares, as respostas secundárias também são mais bem observadas após exposição a antígenos de proteína dependentes de células T. Assim, a mudança de classe de cadeia pesada, que é típica das respostas secundárias, é estimulada pelas células T auxiliares. A maturação de afinidade, que aumenta com estímulos antigênicos repetidos, também é consequência da ativação da célula B induzida pela célula T auxiliar e da mutação somática. Anticorpos de alta afinidade são necessários para neutralizar muitos micro-organismos e/ou suas toxinas, e células B de memória montam respostas rápidas, de maior extensão e afinidade às infecções repetidas. Portanto, vacinas eficazes contra esses micro-organismos devem induzir a maturação da afinidade e a formação de células B de memória, e esses eventos ocorrerão somente se as vacinas forem capazes de ativar as células T auxiliares. Esse conceito tem sido aplicado ao projeto de vacinas para algumas infecções bacterianas em que o antígeno-alvo é um polissacarídeo capsular, incapaz de estimular células T. Nesses casos, o polissacarídeo é covalentemente ligado a uma proteína estranha para formar o equivalente a um conjugado hapteno-carregador, que ativa as células T auxiliares. Tais vacinas, que são chamadas de vacinas conjugadas, induzem anticorpos de alta afinidade e memória mais prontamente do que vacinas de polissacarídeos sem proteínas ligadas. Essas vacinas têm-se revelado particularmente eficazes na indução de imunidade protetora em lactentes e crianças, que são menos capazes de fazer respostas fortes independentes de células T a polissacarídeos do que os adultos.
Função dos Reguladores Transcricionais na Determinação do Destino das Células B Ativadas
O destino da diferenciação de células B é regulado pela indução e ativação de fatores de transcrição diferentes. Está claro até agora que as células B ativadas podem seguir vários destinos. Podem se desenvolver em plasmócitos de curta ou longa duração, que secretam grandes quantidades de anticorpos, ou em células de memória de longa duração, que não secretam anticorpos; mas sobrevivem por períodos prolongados e respondem rapidamente à estimulação antigênica. No Capítulo 9, discutimos o conceito que o destino das células T é determinado em grande parte pela expressão de vários ativadores e repressores transcricionais. O mesmo princípio geral aplica-se ao destino das células B ativadas.
Em células B do centro germinativo, os sinais deflagrados por CD40 e pelo receptor para IL-21 induzem a expressão de um repressor transcricional chamado de Bcl-6. O Bcl-6 antagoniza outro repressor chamado Blimp-1, que é necessário para o desenvolvimento de plasmócitos (veja adiante) e, portanto, impede que as células do centro germinativo se diferenciem em plasmócitos durante a proliferação maciça, que é característica da reação do centro germinativo. As células B em focos extrafoliculares expressam baixos níveis de Bcl-6 e mais facilmente se transformam em plasmócitos de vida curta. O Bcl-6 e outros reguladores transcricionais ajudam a orquestrar a entrada rápida das células B do centro germinativo no ciclo celular. Também tornam as células B do centro germinativo sensíveis à apoptose, aumentando os níveis de fatores pró-apoptóticos e reduzindo os níveis de proteínas antiapoptóticas.
Duas etapas principais que permitem a transformação das células B em plasmócito são a perda da expressão de um fator de transcrição, Pax-5, que é necessário para desenvolvimento e manutenção de uma célula B madura (Cap. 8), e a repressão de Bcl-6. Durante a diferenciação dos plasmócitos, um ativador transcricional chamado IRF4 e um repressor transcricional chamado Blimp-1 são induzidos. Juntos, o IRF4 e o Blimp-1 induzem a expressão e recombinação de XBP-1, um fator de transcrição que desempenha um papel crítico na resposta de proteína desnaturada. O XBP-1 pode proteger os plasmócitos em desenvolvimento das consequências prejudiciais das proteínas desnaturadas (que são produzidas como um efeito colateral do aumento maciço na síntese de proteínas), ou pode contribuir para a maturação dos plasmócitos e amplificar a síntese de Ig vistas nessas células.
Como essa decisão é tomada para definir se determinada célula B do centro germinativo irá se tornar uma célula B de memória ou um plasmócito de longa duração não é totalmente clara. De fato, fatores de transcrição que delineiam o desenvolvimento de células B de memória continuam sendo identificados. Parece, no entanto, que algumas das células B estimuladas por antígeno que expressam níveis baixos de IRF4 se tornam células de memória funcionalmente inativas (repouso), autorrenováveis e de vida longa. Enquanto células B que expressam altos níveis de IRF4 se diferenciam em plasmócitos (níveis mais baixos de IRF4 são insuficientes para levar uma célula B ativada em direção à diferenciação de plasmócitos e, portanto, pode ser permissiva à geração de células B de memória).
RESPOSTAS DE ANTICORPOS A ANTÍGENOS INDEPENDENTES DE CÉLULAS T
Muitos antígenos não proteicos, como polissacarídeos e lipídeos, estimulam a produção de anticorpos na ausência de células T auxiliares, e esses antígenos e as respostas que eles desencadeiam são denominados timo-independentes ou T-independentes (TI). Essas respostas de anticorpos diferem em vários aspectos das respostas dependentes da célula T a antígenos proteicos (Tabela 11-2). Os anticorpos que são produzidos na ausência do auxílio da célula T geralmente são de baixa afinidade e consistem principalmente em IgM com mudança de isótipo limitada a alguns subtipos de IgG e também a IgA.
TABELA 11-2 Propriedades dos Antígenos Timo-dependentes e Timo-independentes
| Antígeno Timo-dependente | Antígeno Timo-independente | |
|---|---|---|
| Natureza química | Proteínas | Antígenos poliméricos, especialmente polissacarídeos; também glicolipídeos, ácidos nucleicos |
| Características da Resposta de Anticorpos | ||
| Mudança de isótipo | Sim; IgG, IgE e IgA | Pouca ou nenhuma; talvez algum IgG e IgA |
| Maturação de afinidade | Sim | Não |
| Resposta secundária (células B de memória) | Sim | Somente visto com alguns antígenos (p. ex., polissacarídeos) |
Natureza das Células B que Respondem aos Antígenos Independentes de T
Células B da zona marginal e do subtipo B-1 são especialmente importantes para as respostas de anticorpos contra antígenos TI. Enquanto as respostas aos antígenos de proteína dependente de células T são em grande parte mediadas por células B foliculares, outros subtipos de células B podem ser os respondedores primários aos antígenos TI (Fig. 11-3). Células B da zona marginal são uma população distinta de células B que respondem principalmente aos polissacarídeos. Após a ativação, essas células se diferenciam em plasmócitos de vida curta que produzem principalmente IgM. Em seres humanos essas células também são chamadas de células de memória IgM. As células B-1 representam outra linhagem de células B que respondem prontamente aos antígenos TI, principalmente no peritônio e nas mucosas.
As respostas TI podem ser iniciadas no baço, na medula óssea, na cavidade peritoneal e nos sítios mucosos. Os macrófagos localizados nas zonas marginais que circundam os folículos linfoides no baço são particularmente eficientes na captura de polissacarídeos quando esses antígenos são injetados por via intravenosa. Os antígenos TI podem persistir por longos períodos nas superfícies dos macrófagos da zona marginal, onde são reconhecidos por células B específicas.
Mecanismos de Respostas de Anticorpos Independentes de T
Os antígenos TI mais importantes são polissacarídeos, glicolipídeos e ácidos nucleicos, que induzem a produção de um anticorpo específico em animais com deficiência em células T. Esses antígenos não podem ser processados e apresentados em associação de moléculas MHC e, portanto, não podem ser reconhecidos por células T CD4+ auxiliares. A maioria dos antígenos TI é multivalente, sendo compostos por epítopos antigênicos idênticos e repetidos. Tais antígenos multivalentes podem induzir o máximo de ligações cruzadas do complexo BCR em células B específicas, levando à ativação sem a necessidade do auxílio da célula T de mesma origem. Além disso, muitos polissacarídeos ativam o sistema complemento pela via alternativa, gerando C3d, que se liga ao antígeno e é reconhecido por CR2, aumentando a ativação da célula B (Fig. 11-5 e Cap. 7). Antígenos proteicos encontrados em alta concentração na membrana microbiana podem ser funcionalmente multivalentes e funcionar de maneira independente da célula T, bem como de maneira dependente de células T. Como mencionado anteriormente, as respostas TI também podem ser facilitadas por sinais adicionais derivados de produtos microbianos que ativam TLR em células B.
Embora as respostas TI normalmente apresentem pouca mudança de isótipo, alguns antígenos não proteicos T-independentes induzem isótipos de Ig além da IgM. No homem, a classe de anticorpo dominante induzida em resposta ao polissacarídeo capsular pneumocócico é a IgG2. Em camundongos geneticamente manipulados para não expressar o CD40, a produção de IgE e de muitas subclasses de IgG é praticamente indetectável no soro, mas os níveis de IgG3 (que lembram a IgG2 humana) e IgA no soro estão apenas reduzidos a cerca de metade dos seus níveis normais. As citocinas produzidas por células T não podem estimular a mudança de isótipos nas respostas TI. Conforme descrito anteriormente, na ausência de células T, BAFF e APRIL produzidos pelas células de origem mieloide, como células dendríticas e macrófagos, podem induzir a síntese de AID em células B ativadas por antígeno por um receptor da família dos receptores BAFF chamado de TACI. Isso pode ser ainda amplificado pela ativação dessas células B via TLR. Além disso, citocinas como TGF-β, que ajudam a mediar a mudança de IgM para IgA, são secretadas por muitas células não linfoides nos sítios de mucosa e podem contribuir para a geração de anticorpos IgA dirigidos contra antígenos não proteicos.
Funções Mediadas pelos Anticorpos Independentes de T
O significado prático dos antígenos TI é que muitos polissacarídeos da parede celular das bactérias pertencem a essa categoria, e a imunidade humoral é o principal mecanismo de defesa do hospedeiro contra infecções por essas bactérias encapsuladas. Por essa razão, indivíduos com deficiências congênitas ou adquiridas da imunidade humoral são especialmente suscetíveis a infecções potencialmente letais com bactérias encapsuladas, como pneumococos, meningococos e Haemophilus. Além disso, os antígenos TI contribuem para a geração de anticorpos naturais, que estão presentes na circulação de indivíduos normais e são aparentemente produzidos sem exposição a patógenos. A maioria dos anticorpos naturais é dirigida contra icarboidratos e são de baixa afinidade; postula-se que eles sejam produzidos por células B peritoneais do tipo B1, estimuladas por bactérias que colonizam o trato gastrointestinal, e por células B da zona marginal no baço. Os anticorpos contra os glicolipídeos A e B, que são os antígenos dos grupos sanguíneos, são exemplos desses anticorpos naturais (Cap. 16).
Apesar da sua incapacidade de ativar especificamente células T auxiliares, muitas vacinas de polissacarídeos, como vacina pneumocócica, induzem imunidade protetora de longa duração. Respostas secundárias rápidas e amplas, típicas de memória (mas sem muita mudança de isótipo ou maturação da afinidade), ocorrem na segunda exposição a esses antígenos de carboidratos. O fenômeno da memória da IgM foi claramente demonstrado no camundongo, e, tanto nos camundongos quanto em humanos adultos, células B de memória IgM podem ser identificadas pela expressão de marcadores específicos de superfície celular. Em humanos, essas células semelhantes a células de memória expressam altos níveis de CD27, IgM e IgD e também são chamadas de células B de zona marginal.
AUTORREGULAÇÃO DOS ANTICORPOS: REGULAÇÃO DAS RESPOSTAS IMUNES HUMORAIS POR RECEPTORES Fc
Anticorpos secretados freiam a ativação de células B ao formar complexos de antígenos-anticorpos que simultaneamente se ligam a receptores de antígenos e a receptores Fcγ inibidores em células B específicas para antígenos (Fig. 11-21). Essa é a explicação para um fenômeno chamado autorregulação (feedback) de anticorpos, que se refere à regulação negativa da produção de anticorpos por anticorpos IgG secretados. Os anticorpos IgG inibem a ativação da célula B por meio da formação de complexos com o antígeno, e esses complexos se ligam, por intermédio do antígeno, a um receptor de célula B e, por meio da porção Fc da IgG, ao receptor chamado receptor II de Fcγ (FcγRIIB ou CD32). (A biologia dos receptores Fc é discutida no Cap. 12.) Conforme discutido no Capítulo 7, a cauda citoplasmática de FcγRIIB contém um motivo de seis aminoácidos (isoleucina-x-tirosina-x-x-leucina) compartilhado com outros receptores no sistema imune, que medeiam sinais negativos, incluindo receptores inibidores em células NK. Por analogia aos ITAM, esse motivo de inibição é chamado de um motivo de inibição com base no imunorreceptor contendo tirosina (ITIM). Quando o receptor Fcγ das células B é ocupado, o ITIM da cauda citosólica do receptor é fosforilado nos resíduos de tirosina, e isso forma um sítio de ancoragem para uma enzima chamada inositol 5-fosfatase, ou SHIP (inositol fosfatase contendo domínio SH2). O SHIP recrutado hidrolisa um fosfato do lipídeo sinalizador chamado fosfatildilinositol trifosfato (PIP3), inativando essa molécula. Por esse mecanismo, a ocupação do FcγRIIB induz uma parada na resposta da célula B ao antígeno. Os complexos antígeno-anticorpo interagem simultaneamente com o receptor antigênico (pelo antígeno) e com o FcγRIIB (pelo anticorpo), e isso traz as fosfatases às proximidades dos receptores de antígeno, bloqueando assim a sinalização. Além de células B, o FcγRIIB liga e envia sinais inibitórios para outras células mieloides, incluindo macrófagos e células dendríticas, e talvez também para plasmócitos.
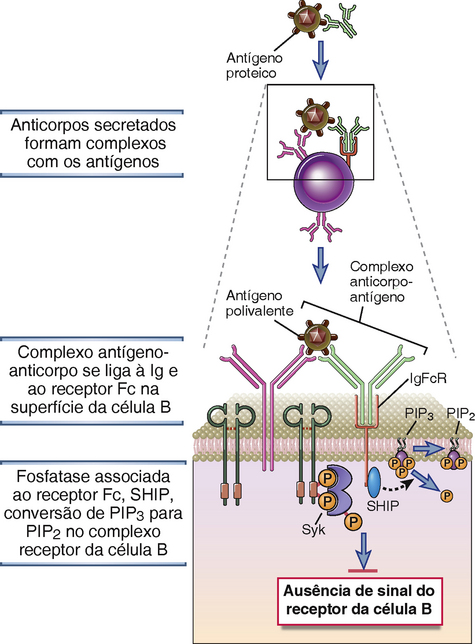
FIGURA 11-21 Regulação da ativação de células B por FcγRIIB. Complexos de antígeno-anticorpos podem simultaneamente se ligar à Ig de membrana (pelo antígeno) e ao receptor FcγRIIB pela porção Fc do anticorpo. Como consequência dessa ligação simultânea dos receptores, a fosfatase associada à cauda citoplasmática do FcγRIIB inibe a sinalização pelo complexo BCR e bloqueia a ativação de células B.
A autoinibição (feedback) de anticorpos mediada pelo receptor de Fc é um mecanismo fisiológico de controle nas respostas imunes humorais porque é desencadeada por anticorpos secretados e bloqueia a produção adicional de anticorpos. Relatamos anteriormente neste capítulo que os anticorpos também podem amplificar a produção de anticorpos, ativando o complemento e gerando C3d. Não está claro sob quais circunstâncias os anticorpos secretados proporcionam amplificação mediada por complemento ou inibição mediada por receptor de Fc. Um cenário provável é que no início das respostas imunes humorais, os anticorpos IgM (que ativam o complemento, mas não se ligam ao receptor Fcγ) estão envolvidos na amplificação, enquanto a produção crescente de IgG leva à inibição por feedback.
A importância da inibição mediada por FcγRIIB é demonstrada pela produção descontrolada de anticorpos vista em camundongos nos quais o gene que codifica esse receptor foi nocauteado. Um polimorfismo no gene FcγRIIB foi relacionado com a suscetibilidade à doença autoimune lúpus eritematoso sistêmico (LES) em humanos.
As células B expressam outro receptor inibidor, chamado CD22. O CD22 é uma lectina de ligação ao ácido siálico; seu ligante natural não é conhecido, e não sabemos exatamente como ele está envolvido em controlar as respostas fisiológicas de células B. No entanto, camundongos deficientes em CD22 mostram uma ativação de células B muito maior. A cauda citoplasmática dessa molécula contém resíduos de tirosina ITIM que, quando fosforilado pela cinase Lyn da família Src, se liga ao domínio SH2 da tirosina fosfatase SHP-1. O SHP-1 remove fosfatos dos resíduos de tirosina de várias enzimas e proteínas adaptadoras envolvidas na sinalização via BCR, e assim anulam a ativação de células B. Uma cepa de camundongo chamada motheaten, que desenvolve autoimunidade grave com ativação descontrolada da célula B e produção de autoanticorpos, tem uma mutação que ocorre naturalmente em SHP-1. Deficiência de SHP-1, bem como da proteína de Lyn em células B leva a uma quebra de tolerância periférica de células B o que leva ao desenvolvimento da autoimunidade.
• Nas respostas imunes humorais, os linfócitos B são ativados pelo antígeno e secretam anticorpos que agem para eliminá-lo. Tanto antígenos proteicos quanto antígenos não proteicos podem estimular as respostas de anticorpos. As respostas da célula B a antígenos proteicos necessitam da contribuição de células T CD4+ auxiliares específicas para o antígeno.
• As respostas das células B dependentes da célula T auxiliar a antígenos proteicos necessitam da ativação inicial das células T virgens nas zonas de células T, e das células B nos folículos linfoides dos órgãos linfoides. Os linfócitos ativados migram na direção uns dos outros e interagem nas bordas dos folículos, onde as células B apresentam antígeno às células T auxiliares.
• Células T auxiliares ativadas expressam CD40L, que se acopla ao CD40 nas células B, e as células T secretam as citocinas que se ligam aos receptores citocina nas células B. A combinação de sinais deflagrados via CD40 e via citocina estimula a proliferação e a diferenciação de células B.
• A estimulação das células B ativadas em locais extrafoliculares por células T auxiliares leva à formação de focos extrafoliculares onde algumas mudanças de isótipos ocorrem e plasmócitos de vida curta são gerados.
• Algumas células T auxiliares ativadas se diferenciam em células TFH especializadas, que expressam altos níveis de ICOS e CXCR5 e secretam IL-21. Células TFH e células B ativadas migram para o folículo, e as células TFH ativam essas células B específicas para iniciarem a formação de centros germinativos. Os eventos tardios nas respostas de anticorpos dependentes da célula T, incluindo extensa mudança de isótipo, mutação somática, maturação da afinidade e a geração de células B de memória, além da indução de plasmócitos de vida longa, ocorrem dentro dos centros germinativos.
• Sinais derivados da célula T auxiliar, incluindo CD40L e citocinas, induzem a mudança de isótipo nas células B por um processo de recombinação de troca, levando à escolha de vários isótipos de Ig. A mudança de isótipo requer a indução da AID, uma citidina desaminase que converte a citocina em uracil no DNA unifilamentar, e diferentes citocinas permitem que a AID tenha acesso a diferentes loci de cadeia pesada situados mais à 3′ do VDJ rearranjado.
• A maturação de afinidade ocorre em centros germinativos e leva ao aumento da afinidade de anticorpos durante o curso de uma resposta humoral de células B dependente de células T. A maturação de afinidade é o resultado da mutação somática dos genes de cadeias leves e pesadas da Ig, induzida por AID, seguida pela sobrevivência seletiva das células B, que produzem os anticorpos de alta afinidade e se ligam a antígenos exibidos por FDC no centro germinativo. As células TFH também participam da seleção de células B de alta afinidade.
• Uma parte da progênie das células B do centro germinativo se diferencia em plasmócitos secretores de anticorpos que migram para a medula óssea. A outra parte da descendência se transforma em células B de memória, que vivem por longos períodos, recirculam entre os gânglios linfáticos e o baço, e respondem rapidamente a exposições subsequentes ao antígeno com a diferenciação em células secretoras de anticorpos de alta afinidade. A diferenciação das células B ativadas em plasmócitos ou células de memória é controlada pela expressão de vários fatores de transcrição.
• Antígenos TI são geralmente antígenos não proteicos que induzem respostas imunes humorais sem o envolvimento de células T auxiliares. Muitos antígenos TI, incluindo polissacarídeos, glicolipídeos de membrana e ácidos nucleicos, são multivalentes, podem fazer múltiplas ligações cruzadas de moléculas da membrana de Ig em uma célula B, e ativar o complemento, permitindo assim a ativação das células B sem o auxílio de células T. A ativação de TLR em células B por produtos microbianos facilita a ativação de células B T-independentes. Os antígenos TI estimulam a resposta imune, mas com limite de mudança de classe de cadeia pesada, maturação de afinidade, ou geração de células B de memória, porque esses eventos são em grande parte dependentes das células T auxiliares, que não são ativadas por antígenos não proteicos. No entanto, algumas mudanças de isótipos T-independentes podem ser induzidas pela estimulação de TLR por micro-organismos, os quais podem levar à produção de citocinas da família TNF que ativam as células B a expressar AID.
• Autorregulação (feedback) de anticorpos é um mecanismo pelo qual as respostas imunes humorais são reguladas negativamente quando uma quantidade suficiente de anticorpos foi produzida e complexos antígeno-anticorpo solúveis estão presentes. A Ig de membrana e o receptor para porções Fc de IgG na célula B, chamado FcγRIIB, são reunidos por complexos antígeno-anticorpo. Isso ativa uma cascata de sinalização inibidora ao longo da cauda citoplasmática de FcγRIIB, que termina a ativação da célula B.
Subtipos de Células B e Ativação de Células B
Goodnow CC, Vinuesa CG, Randall KL, Mackay F, Brink R. Control systems and decision making for antibody production. Nature Immunology. 2010;11:681-688.
Hardy RR. B-1 B cell development. Journal of Immunology. 2006;176:2749-2754.
Harwood NE, Batista FD. New insights into the early molecular events underlying B cell activation. Immunity. 2008;28:609-619.
Martin F, Chan AC. B cell immunobiology in disease: evolving concept from the clinic. Annual Review of Immunology. 2006;24:467-496.
A Reação de Células B do Centro Germinativo e a Função das Células T Auxiliares Foliculares
Crotty S. Follicular helper CD4 T cells. Annual Review of Immunology. 29, 2011.
Crotty S, Johnston RJ, Schoenberger SP. Effectors and memories: Bcl-6 and Blimp-1 in T and B lymphocyte differentiation. Nature Immunology. 2010;11:114-120.
King C. New insights into the differentiation and function of T follicular helper cells. Nature Reviews Immunology. 2009;9:757-766.
McHeyzer-Williams LJ, McHeyzer-Williams MG. Antigen- specific memory B cell development. Annual Review of Immunology. 2005;23:487-513.
Radbruch A, Muehlinghaus G, Luger EO, Inamine A, Smith KG, Dörner T, Hiepe F. Competence and competition: the challenge of becoming a long-lived plasma cell. Nature Reviews Immunology. 2006;6:741-750.
Vinuesa CG, Sanz I, Cook MC. Dysregulation of germinal centres in autoimmune disease. Nature Reviews Immunology. 2009;9:845-857.
AID, Mudança de Classe e Mutação Somática
Cerutti A. The regulation of IgA class switching. Nature Reviews Immunology. 2008;8:421-434.
Delker RK, Fugmann S, Papavasiliou FN. A coming-of-age story: activation-induced cytidine deaminase turns 10. Nature Immunology. 2009;10:1147-1153.
Liu M, Schatz DG. Balancing AID and DNA repair during somatic hypermutation. Trends in Immunology. 2009;30:173-181.
Neuberger MS. Antibody diversification by somatic mutation: from Burnet onwards. Immunology and Cell Biology. 2008;86:124-132.
Peled JU, Kuang FL, Iglesias-Ussel MD, Roa S, Kalis SL, Goodman MF, Scharff MD. The biochemistry of somatic hypermutation. Annual Review of Immunology. 2008;26:481-511.
Stavnezer J, Guikema JE, Schrader CE. Mechanism and regulation of class switch recombination. Annual Review of Immunology. 2008;26:261-292.