CAPÍTULO 13 Imunidade Regional: Respostas Imunes Especializadas em Tecidos Epiteliais e Imunoprivilegiados
A maior parte do que foi discutido até agora a respeito do sistema imune inato e adaptativo neste livro cobriu características e mecanismos das respostas imunes em qualquer localização anatômica do corpo de mamíferos. No entanto, o sistema imune desenvolveu propriedades especializadas em diferentes partes do corpo, especialmente em superfícies epiteliais. Essas características são essenciais para a proteção contra os tipos de desafios microbianos que são mais frequentemente encontrados nesses locais e também asseguram a tolerância a organismos comensais não patogênicos que vivem no epitélio e no lúmen dos órgãos mucosos (Tabela 13-1). O conjunto dos componentes do sistema imune que serve a funções especializadas em uma localização anatômica particular é denominado sistema imune regional. A maior parte deste capítulo é dedicada à discussão desse sistema imune especializado. Finalizamos com uma consideração acerca de alguns tecidos que normalmente não sustentam respostas imunes e são conhecidos como imunoprivilegiados.
CARACTERÍSTICAS GERAIS DA IMUNIDADE NAS BARREIRAS EPITELIAIS
Os sistemas imunes regionais incluem o sistema imune mucoso, que protege as barreiras mucosas gastrointestinais, broncopulmonares e genitourinárias, e o sistema imune cutâneo (pele). O sistema imune gastrointestinal é o maior e mais complexo. Por duas simples comparações, incluindo o número de linfócitos localizados no tecido e a quantidade de anticorpos produzidos nesse local, o sistema imune gastrointestinal diminui todas as outras partes do sistema imune combinadas. Estima-se que a mucosa intestinal humana contenha aproximadamente 50 × 109 linfócitos (Tabela 13-2). O fato de tantos recursos do sistema imune serem dedicados ao intestino reflete a grande área de superfície da mucosa intestinal, a qual foi desenvolvida para maximizar a função absortiva primária do tecido, mas também deve resistir à invasão de trilhões de bactérias no lúmen. A pele também é um tecido de barreira com uma vasta área de superfície que deve estar protegida contra micro-organismos ambientais que possuem pronto acesso ao revestimento externo. O número total de linfócitos na pele é estimado em aproximadamente 20 × 109, cerca de duas vezes o número total de linfócitos circulantes (Tabela 13-2). As diferentes características físicas da mucosa (macia, úmida e quente) e da pele (firme, seca e fria) favorecem a colonização e a invasão por diferentes tipos de micro-organismos. Dessa forma, não é surpreendente que o sistema imune seja especializado de diferentes maneiras nesses dois tipos de tecidos.
TABELA 13-2 Número de Linfócitos em Diferentes Tecidos
| Baço | 72 × 109 |
| Medula óssea | 50 × 109 |
| Sangue | 10 × 109 |
| Pele | 20 × 109 |
| Trato gastrointestinal | 50 × 109 |
Dados de Clark RA, B Chong, N Mirchandani, NK Brinster, K Yamanaka, RK Dowkiert, and TS Kupper. The vast majority of CLA+ T cells are resident in normal skin. Journal of Immunology 176:4431-4439, 2006; Ganusov AA and De Boer RJ. Do most lymphocytes in humans really reside in the gut? Trends in Immunology 28:514-518, 2007.
Os principais sistemas imunes regionais compartilham uma organização anatômica básica, na qual existe uma barreira epitelial mais externa que apresenta funções essenciais de prevenir a invasão microbiana; tecido conjuntivo subjacente contendo células de diversos tipos, distribuídas de forma difusa, que são importantes para as respostas imunes inatas e adaptativas contra micro-organismos locais; e linfonodos drenantes mais distantes, onde as respostas imunes adaptativas aos micro-organismos invasores são iniciadas e amplificadas. A barreira epitelial pode possuir várias camadas de espessura, como na pele, ou uma única camada revestindo a membrana basal, como nos intestinos. A camada de tecido conjuntivo subjacente, como a derme na pele ou a lâmina própria no intestino, contém numerosos linfócitos, células dendríticas (DC), macrófagos e mastócitos espalhados que medeiam respostas imunes inatas e mecanismos efetores das respostas imunes adaptativas. Os tecidos mucosos também possuem tecidos linfoides secundários não encapsulados, mas organizados, imediatamente abaixo da barreira epitelial, que incluem linfócitos B e T, DC e macrófagos. Esses conjuntos de células imunes, frequentemente denominados tecido linfoide associado à mucosa (MALT), são os locais onde as respostas imunes adaptativas especializadas para a mucosa em particular são iniciadas. Respostas imunes adaptativas nos sistemas imunes regionais também são induzidas nos linfonodos drenantes que estão localizados externamente ao tecido de barreira. Na pele e nos tecidos mucosos, os antígenos externos à barreira epitelial são capturados por células especializadas para dentro do epitélio e levadas para os linfonodos drenantes ou para o MALT. Notadamente, os linfócitos efetores que são gerados nos linfonodos drenantes ou no MALT de um sistema imune regional em particular (p. ex., pele, intestino delgado) penetrarão na circulação e retornarão preferencialmente para o tecido conjuntivo subepitelial do mesmo órgão (p. ex., derme e lâmina própria).
Cada sistema imune regional é definido, em parte, por uma singularidade anatômica dos tecidos daquela região, incluindo tecidos linfoides secundários. Por exemplo, a amostragem de antígenos no intestino e seu transporte para tecidos linfoides secundários dependem dos tipos celulares e das rotas de drenagem linfática que são fundamentalmente diferentes daquelas que ocorrem na pele ou em órgãos internos. Além disso, as estruturas do MALT em diferentes regiões do intestino e de outros órgãos mucosos possuem características distintas.
Cada sistema imune regional contém tipos celulares especializados e moléculas que podem não ser abundantes em outros locais. Os tipos celulares que são restritos a um ou mais sistemas imunes regionais, mas que não estão presentes em todo o sistema imune, incluem subpopulações de DC (p. ex., células Langerhans na pele), células transportadoras de antígenos (p. ex., células M no intestino), linfócitos T (p. ex., células T γδ no epitélio) e subpopulações de linfócitos B (p. ex., células B e plasmócitos em tecidos mucosos que produzem IgA). A localização de subpopulações de linfócitos em diferentes tecidos é, em parte, decorrente dos mecanismos de localização tecido-específicos que direcionam essas subpopulações da circulação sanguínea para órgãos linfoides secundários em particular ou tecido periféricos, o que será discutido em detalhes posteriormente neste capítulo.
Os sistemas imunes regionais possuem funções reguladoras importantes que servem para impedir respostas indesejadas a micro-organismos não patogênicos e a substâncias estranhas que estão presentes nas diferentes barreiras. O exemplo mais claro é o sistema imune associado ao intestino, que deve suprimir respostas a bactérias comensais que colonizam a mucosa intestinal, bem como substâncias estranhas dos alimentos, mas devem responder a bactérias patogênicas menos frequentes. A supressão de respostas imunes a organismos não patogênicos e a substâncias estranhas inofensivas também é importante em outros locais do corpo, incluindo pele, pulmão e trato genitourinário, que não são estéreis e estão constantemente expostos ao ambiente.
Com essa introdução, discutiremos agora os detalhes dessas várias caraterísticas em diferentes sistemas imunes regionais, começando com o maior.
IMUNIDADE NO SISTEMA GASTROINTESTINAL
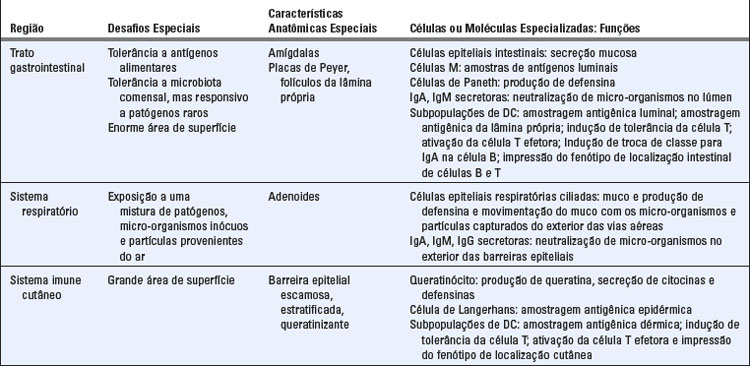
O sistema gastrointestinal, como outros tecidos mucosos, é composto de uma estrutura tubular revestida por uma camada de células epiteliais contínuas, assentada sobre a membrana basal e que serve como uma barreira física ao ambiente externo. Adjacente ao epitélio há uma camada de tecido conjuntivo frouxo, denominada lâmina própria do intestino, que contém vasos sanguíneos, vasos linfáticos e tecidos linfoides associados à mucosa (Fig. 13-1). A submucosa é uma camada de tecido conjuntivo denso que conecta a mucosa a camadas de musculatura lisa.
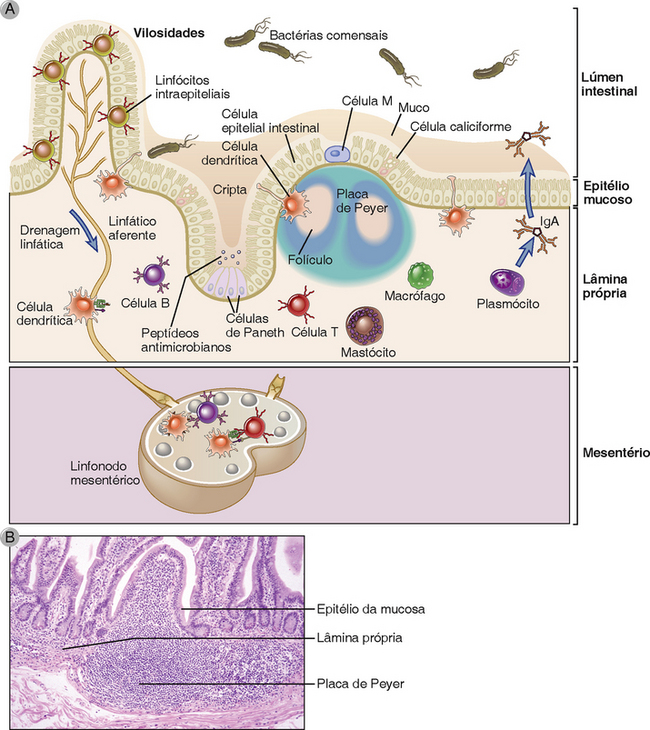
FIGURA 13-1 O sistema imune gastrointestinal. A, Esquema ilustrativo dos componentes celulares do sistema imune de mucosas no intestino. B, Fotomicrografia do tecido linfoide de mucosa no intestino humano. Agregados semelhantes de tecido linfoide são encontrados por todo o trato gastrointestinal.
Da perspectiva dos imunologistas, o trato gastrointestinal possui duas propriedades notáveis. Primeira, a mucosa combinada do intestino delgado e do intestino grosso possui uma área de superfície total de mais de 200 m2 (o tamanho de uma quadra de tênis), constituída, em sua maior parte, de vilosidades e microvilosidades do intestino delgado. Segunda, o lúmen do intestino é repleto de micro-organismos, muitos dos quais são ingeridos juntamente com o alimento e a maior parte desses está em crescimento contínuo na superfície da mucosa de indivíduos saudáveis como comensais. Estima-se que mais de 500 diferentes espécies de bactérias, quantidade aproximada de 1014 células, vivem no intestino de mamíferos. Isso é dez vezes mais que o número total de células do corpo, o que leva muitos microbiologistas a sugerir que nós, humanos, somos apenas 10% “humanos” e 90% bacterianos! Evoluímos dependendo desses comensais para diversas funções, incluindo a degradação de componentes de nossa dieta que nossas próprias células não conseguem digerir. Embora os organismos comensais sejam benéficos quando estão contidos do lado externo da barreira mucosa intestinal, eles são potencialmente letais se atravessarem a barreira mucosa e entrarem na circulação ou se cruzarem a parede intestinal, especialmente em indivíduos imunocomprometidos. A enorme área de superfície e a alta densidade de comensais da mucosa no intestino representam, dessa forma, um perigo potencial constante contra o qual se deve proteger. Além disso, os organismos patogênicos não comensais podem, a qualquer momento, fazer parte de uma mistura diversa de organismos que constituem a microbiota intestinal se forem ingeridos com água ou alimento contaminados. Esses organismos patogênicos, incluindo bactérias, vírus, protozoários e parasitas helmintos, podem causar doença significativa, muitas vezes sem invadir o revestimento epitelial e mesmo que representem uma pequena fração dos micro-organismos no lúmen. Para que a saúde seja mantida, o sistema imune das mucosas deve ser capaz de reconhecer e eliminar esses patógenos numericamente raros na presença de números superiores de micro-organismos não patogênicos. Esses desafios foram gerados pela evolução de um conjunto complexo de estratégias de reconhecimento e de mecanismos efetores dos sistemas imunes inato e adaptativo, os quais serão descritos agora. Alguns desses entendemos bem e outros permanecem caracterizados de maneira incompleta. Muitas das características do sistema imune gastrointestinal são partilhadas por outros tecidos mucosos, e assinalaremos características comuns da imunidade de mucosas. Infelizmente, as infecções intestinais por organismos patogênicos frequentemente não são controladas pela imunidade de mucosa e são responsáveis por milhões de mortes a cada ano em todo o mundo.
Imunidade Inata no Trato Gastrointestinal
As células epiteliais intestinais que revestem os intestinos delgado e grosso são parte integral do sistema imune inato gastrointestinal, envolvido nas respostas a patógenos, na tolerância a organismos comensais e na amostragem de antígenos para apresentação ao sistema imune adaptativo no intestino. Existem vários tipos de células epiteliais intestinais, todas derivadas de um precursor em comum encontrado nas criptas das glândulas intestinais. Dentre essas, estão as células caliciformes secretoras de muco que residem no ápice das vilosidades intestinais; as células epiteliais absortivas secretoras de citocinas; as células M, que fazem a apresentação de antígenos, encontradas na cúpula de estruturas especializadas sobrepostas aos tecidos linfoides; e as células de Paneth, secretoras de peptídeos antibacterianos, encontradas na base das criptas. Todos estes tipos celulares contribuem de diferentes maneiras para a função de barreira da mucosa, que será discutida posteriormente.
A proteção da imunidade inata no intestino é parcialmente mediada por barreiras físicas e químicas não específicas, proporcionadas pelas células epiteliais mucosas e suas secreções de muco. As células epiteliais intestinais adjacentes são mantidas unidas por proteínas que formam as junções de oclusão (tight junctions), incluindo as zônulas occludens 1 e claudinas, bloqueando o movimento das bactérias e dos padrões moleculares associados a patógenos (PAMP) entre as células para a lâmina própria. Além disso, as células epiteliais mucosas produzem substâncias antimicrobianas, e diversos tipos celulares localizados na mucosa, incluindo células epiteliais, DC e macrófagos, são capazes de montar respostas anti-inflamatórias e antivirais. A maior parte dessas respostas é induzida pelo receptor de reconhecimento de padrão, com envolvimento de PAMP, os quais foram discutidos no Capítulo 4. De forma interessante, alguns receptores da imunidade inata que promovem inflamação em outras partes do corpo possuem ações anti-inflamatórias no intestino. Nesta seção, descreveremos características da imunidade inata que são exclusivas do intestino.
Diversas proteínas diferentes extensamente glicosiladas, denominadas mucinas, formam uma barreira física viscosa que impede o contato entre micro-organismos e as células do trato gastrointestinal. As mucinas possuem vários diferentes oligossacarídeos ligados a O e incluem glicoproteínas de superfície celular e secretadas. As mucinas secretadas, incluindo MUC2, MUC5 e MUC6, formam um gel hidratado de 300 a 700 μm de espessura, que pode impedir o contato de micro-organismos com células epiteliais de revestimento e serve também como matriz para exposição de substâncias antimicrobianas produzidas pelas células epiteliais. Algumas mucinas atuam como moléculas chamariz, que podem se desprender de células epiteliais e se ligar a proteínas adesinas que as bactérias patogênicas utilizam para se ligar às membranas celulares do hospedeiro. Além do muco secretado, a superfície apical das células epiteliais gastrointestinais é coberta com proteínas mucinas ligadas à membrana, incluindo MUC1, MUC3A/b, MUC12, MUC13 e MUC17. Essas mucinas ligadas à membrana combinam-se com vários glicolipídeos para formar uma camada macrolecular densa na superfície de células epiteliais, chamada de glicocálice, que varia de 30 a 500 nm de espessura em diferentes localizações do intestino. O glicocálice, como secretor de muco, funciona como uma barreira física para prevenir o contato microbiano.
Uma propriedade marcante da barreira mucosa do intestino é sua rápida renovação e resposta a vários sinais imunológicos e ambientais, o que possibilita rápidos aumentos na função da barreira mucosa. As mucinas são constitutivamente produzidas tanto pela superfície de células epiteliais do trato gastrointestinal quanto pelas glândulas submucosas e são repostas por moléculas recém-sintetizadas a cada 6 a 12 horas. Várias diferenças ambientais e de estímulos imunológicos podem induzir enormes aumentos da produção de mucinas. Esses estímulos incluem as citocinas (IL-1, IL-4, IL-6, IL-9, IL-13, fator de necrose tumoral [TNF] e interferons do tipo 1), produtos de neutrófilos (como a elastase) e proteínas de adesão microbianas. Esses estímulos não apenas aumentam a expressão gênica de mucina, mas também alteram a glicosilação das mucinas devido às alterações induzidas na expressão de enzimas glicosiltransferases. Acredita-se que as alterações na quantidade e na glicosilação das mucinas aumentem a função da barreira contra os patógenos.
As defensinas produzidas por células epiteliais intestinais proporcionam uma proteção imune inata contra bactérias luminais, e os defeitos na sua produção estão associados a invasão de bactérias e doença inflamatória intestinal. As defensinas são peptídeos produzidos por vários tipos celulares no corpo que exercem efeitos tóxicos letais sobre micro-organismos por se inserirem em seu interior e provocarem a perda da integridade de suas membranas fosfolipídicas externas (Cap. 4). No intestino delgado, as principais defensinas são as α-defensinas, incluindo a defensina humana 5 (HD5) e HD6, produzidas constitutivamente como proteínas precursoras inativas pelas células de Paneth localizadas na base das criptas entre as microvilosidades. Os peptídeos HD5 e HD6 ativados são gerados por clivagem proteolítica mediada por tripsina, também produzida pelas células de Paneth. No cólon, β-defensinas são produzidas por células epiteliais absortivas nas criptas intestinais, algumas constitutivamente e outras em resposta a IL-1 ou a bactérias invasoras. Além disso, os grânulos dos neutrófilos são ricos em α-defensinas, as quais provavelmente contribuem para suas funções antimicrobianas nos locais de infecção na parede do intestino delgado. Diversos estudos identificaram defeitos na produção de defensinas por células epiteliais nas regiões do intestino afetadas pela doença de Crohn, uma doença inflamatória crônica que pode envolver todo o trato gastrointestinal. Devido à existência de um risco hereditário significativo de desenvolvimento da doença de Crohn, é possível que defeitos na produção de defensinas determinados geneticamente sejam um fator predisponente para a doença, e a expressão reduzida dos genes da defensina foi associada a um subgrupo da doença de Crohn.
Receptores semelhantes a Toll (Toll-like receptors - TLR) e receptores citoplasmáticos semelhantes a Nod (NLR) expressos pelas células epiteliais intestinais promovem respostas imunes a patógenos invasores, mas também são regulados para limitar as respostas inflamatórias a bactérias comensais. No Capítulo 4, definimos TLR e NLR como receptores celulares que reconhecem PAMP produzidos por micro-organismos e geram sinais que promovem respostas inflamatórias e antivirais pelas células. A maior parte das bactérias do lúmen não é patogênica, se elas permanecerem no exterior da barreira epitelial, ainda que possam expressar o mesmo conjunto de PAMP que é expresso por bactérias patogênicas, como os lipopolissacarídeos, proteoglicanos, DNA CpG e flagelina. Como as respostas inflamatórias que envolvem as células epiteliais intestinais podem prejudicar a função de barreira e levar à invasão bacteriana e à inflamação patológica, não é surpresa que os mecanismos de controle rigorosos estejam envolvidos para limitar as respostas pró-inflamatórias induzidas por TLR a bactérias comensais. As células epiteliais intestinais expressam uma grande variedade de TLR, incluindo TLR 2, 4, 5, 6, 7 e 9, com diferentes receptores expressos em diferentes regiões do intestino. A ligação de alguns TLR resulta na fosforilação e reorganização da zona occludens 1 e resistência aumentada das junções de oclusão entre as células, e a sinalização dos TLR também aumenta a motilidade e a proliferação das células epiteliais intestinais. Essas respostas funcionais à sinalização dos TLR aumentam a função de barreira, mas não a inflamação. As respostas aos TLR no intestino também parecem ser reguladas pelos níveis de expressão ou expressão compartimentalizada somente em determinados locais (Fig. 13-2). Por exemplo, TLR5, que reconhece flagelinas bacterianas, é expresso exclusivamente na superfície basolateral de células epiteliais intestinais, onde estará acessível apenas à bactéria que houver invadido através da barreira. De forma similar, os receptores da família NLR para flagelinas (p. ex., NAIP e IPAF-1) são expressos no citoplasma das células epiteliais intestinais e somente ativarão respostas inflamatórias quando bactérias patogênicas ou seus produtos alcançarem o citosol. Também há evidências de que os reguladores da sinalização de TLR no interior das células epiteliais intestinais mantenham um limiar mais alto para a ativação de respostas inflamatórias em comparação a células epiteliais e DC em outros tecidos (Fig. 13-2).
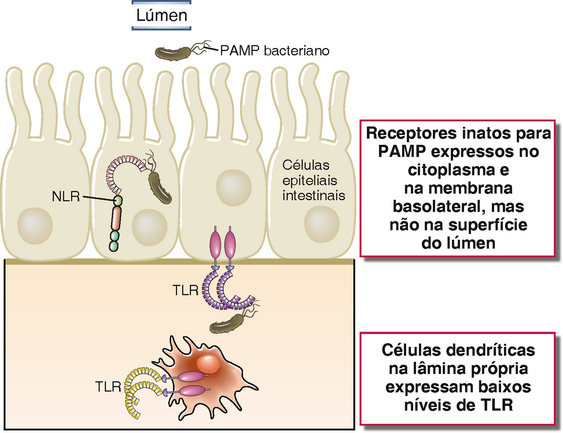
FIGURA 13-2 Mecanismo de regulação das respostas imunes inatas na mucosa intestinal. A expressão e a função do receptor de reconhecimento de padrão nas células epiteliais intestinais e nas DC da lâmina própria minimizam as respostas inflamatórias a bactérias comensais no lúmen, mas promovem respostas aos micro-organismos que cruzam a barreira e entram na lâmina própria. Superior, Receptores de reconhecimento de padrão que reconhecem a flagelina bacteriana ficam compartimentalizados no citosol (NLR) ou na membrana basal (TLR5) das células epiteliais intestinais, mas não na membrana apical/lúmen. Inferior, TLR4, que reconhece lipopolissacarídeos bacterianos, é expresso em baixos níveis nas células epiteliais intestinais e nas DC da lâmina própria. A sinalização do TLR não induz expressão de genes inflamatórios nas DC da lâmina própria devido ao efeito mais dominante dos reguladores intracelulares de transdução de sinal de TLR, como TOLLIP e IRAK-M, em comparação às DC de outros tecidos.
Em indivíduos sadios, as DC e os macrófagos da lâmina própria no intestino inibem a inflamação e servem para manter a homeostase. De um modo geral, os macrófagos intestinais possuem um fenótipo singular que os capacita para a fagocitose e morte dos micro-organismos, mas, ao mesmo tempo, secretam citocinas anti-inflamatórias, como a IL-10. Esse fenótipo é aparentemente induzido no ambiente da mucosa local pelo fator de transformação do crescimento-β (TGF-β). A expressão de TLR4 em macrófagos e em DC na lâmina própria é mais baixa que em outros tecidos, e a expressão de genes inflamatórios nessas células frequentemente é inibida por produtos microbianos. Esse pode ser um mecanismo desenvolvido para impedir os danos decorrentes da inflamação em resposta a bactérias comensais e a produtos bacterianos que podem atravessar a barreira epitelial.
Imunidade Adaptativa no Trato Gastrointestinal
O sistema imune adaptativo no trato gastrointestinal possui características distintas das funções imunes adaptativas em outros sistemas orgânicos.
• A principal forma de imunidade adaptativa no intestino é a imunidade humoral dirigida a micro-organismos no lúmen, o que evita que comensais e patógenos colonizem e invadam através da barreira epitelial mucosa. Essa função é mediada pelos anticorpos IgA diméricos que são secretados para o lúmen ou, no caso de bebês lactentes, pela IgA secretada no colostro e no leite materno e ingerido pelo bebê. Também estão presentes quantidades significativas de anticorpos IgG e IgM no lúmen e elas contribuem para a imunidade humoral neste local.
• A resposta imune protetora mediada por células dominante consiste em células efetoras TH17.
• O sistema imune adaptativo no intestino deve suprimir continuamente as respostas imunes potenciais a antígenos alimentares e a antígenos provenientes dos micro-organismos comensais para evitar reações inflamatórias que poderiam comprometer a barreira mucosa. Em nenhum outro local do corpo existe um comprometimento do sistema imune extenso como esse para manter a tolerância a antígenos estranhos. O principal mecanismo para controlar as respostas no intestino é a ativação de células T reguladoras (Treg), e algumas subpopulações de Treg são mais abundantes nos tecidos linfoides associados à mucosa (MALT) do que em outros órgãos linfoides.
Agora, discutiremos características especiais da imunidade adaptativa no sistema gastrointestinal, incluindo organização anatômica, amostragem de antígenos, localização e diferenciação de linfócitos e distribuição de anticorpos para o lúmen.
Anatomia Funcional do Sistema Imune Adaptativo no Trato Gastrointestinal
Nesta seção, discutiremos a organização anatômica das células no interior do intestino e a relação dessa organização com a maneira pela qual as respostas imunes adaptativas são iniciadas, realizadas e reguladas. Em geral, a anatomia funcional do sistema imune adaptativo no intestino evoluiu para lidar efetivamente com as condições que enfatizamos anteriormente de abundantes micro-organismos comensais e raros patógenos do lado de fora da barreira epitelial da enorme área de superfície.
As respostas imunes adaptativas no intestino são iniciadas em conjuntos discretamente organizados de linfócitos e de células apresentadoras de antígenos intimamente associados ao revestimento epitelial mucoso do intestino e em linfonodos mesentéricos (Fig. 13-1). Os linfócitos virgens (naïve) são expostos a antígenos nestes locais e diferenciados em células efetoras. Esses tecidos linfoides associados ao intestino adjacentes ao epitélio mucoso são, algumas vezes, denominados GALT, que é a versão gastrointestinal da MALT, embora os termos sejam com frequência utilizados alternadamente. Até 30% dos linfócitos do corpo são encontrados no GALT. As estruturas do GALT mais proeminentes são as placas de Peyer, encontradas principalmente no íleo distal, e em agregados menores de folículos linfoides ou em folículos isolados no apêndice e no cólon. As placas de Peyer possuem uma estrutura de folículos linfoides, com centros germinativos contendo linfócitos B, células T auxiliares (helper) foliculares, células dendríticas foliculares (FDC) e macrófagos. Os centros germinativos nos folículos são circundados por células B foliculares virgens que expressam IgM e IgD. Uma região chamada de cúpula está localizada entre os folículos e o epitélio e contém linfócitos B e T, DC e macrófagos. Entre os folículos, existem áreas parafoliculares ricas em células T, similares aos linfonodos, mas globalmente a proporção entre células B e células T no GALT é aproximadamente cinco vezes maior que nos linfonodos. Também de modo diferente dos linfonodos, as estruturas do GALT não são encapsuladas, e nessas estruturas existem rotas de distribuição de antígenos que são independentes dos linfáticos. O desenvolvimento de agregados de folículos, como as placas de Peyer, e de folículos isolados na lâmina própria do intestino necessita da presença de células indutoras de tecidos linfoides, as quais expressam o fator de transcrição RORγT e produzem a citocina linfotoxina-β (LTβ).
A principal via de distribuição de antígenos do lúmen para o GALT ocorre através de células especializadas no interior do epitélio intestinal, denominadas células micropregas (M) (Fig. 13-3). As células M estão localizadas em regiões do epitélio intestinal chamadas epitélio da cúpula ou associado a folículo, o qual recobre a parte superior das placas de Peyer e de outras estruturas do GALT. Embora as células M e as células epiteliais mais numerosas com função absortiva provavelmente se originem de um precursor epitelial em comum, as células M se distinguem por um tênue glicocálice, por suas microvilosidades relativamente curtas e irregulares (conhecidas como micropregas) e pelas grandes fenestrações em suas membranas, características essas que aumentam a captura de antígenos para o lúmen intestinal. A principal função das células M é o transporte transcelular de várias substâncias do lúmen do intestino através da barreira epitelial para as células apresentadoras de antígeno subjacentes. As células M apreendem o conteúdo luminal eficientemente e de diversas formas, incluindo fagocitose de maneira similar a macrófagos e endocitose de vesículas cobertas por clatrinas ou de fase líquida. Estas vias são capazes de capturar bactérias inteiras, vírus e produtos microbianos solúveis. De maneira diferente de macrófagos ou DC, células M não se empenham em processamentos extensos de substâncias que elas captam, mas sim movem partículas e moléculas por meio de vesículas endocíticas através do citosol e as distribuem por exocitose da membrana basolateral para as DC nas regiões de cúpula de estruturas do GALT subjacentes. Embora as células M exerçam um papel importante na imunidade protetora contra micro-organismos luminais, alguns micro-organismos evoluíram de forma a tirar vantagens das células M como uma rota de invasão através da barreira mucosa. O melhor exemplo descrito é o da Salmonella typhimurium, similar ao patógeno humano S. typhi que causa febre tifoide. As células M expressam lectinas específicas que permitem que essas bactérias se liguem especificamente e sejam internalizadas. As bactérias são citotóxicas para as células M, levando à formação de lacunas no epitélio que promovem a invasão de mais organismos. As lectinas das células M também podem promover a infecção por certos vírus entéricos.
FIGURA 13-3 Células M no intestino delgado. As células M são células epiteliais intestinais especializadas, encontradas no epitélio do intestino delgado sobrepostas às placas de Peyer e aos folículos linfoides da lâmina própria (A). Diferentemente das células epiteliais vizinhas com bordas de microvilosidades altas e funções primariamente absortivas, as células M apresentam vilosidades mais baixas (B) e se encarregam de transportar os micro-organismos ou moléculas intactas através da barreira mucosa para os tecidos linfoides associados ao intestino, onde são entregues às DCs (C).
(Eletromicrografia de Corr SC, CC Gahan e C Hill. M-cells: origin, morphology and role in mucosal immunity and microbial pathogenesis, FEMS Immunology and Medical Microbiology 52:2-12, 2008.)
Os antígenos microbianos no lúmen do intestino podem ser capturados pelas DC da lâmina própria que estendem processos citoplasmáticos entre as células epiteliais intestinais e por meio da captura de antígenos opsonizados por IgG dependente dos receptores Fc por células epiteliais (Fig. 13-4). As DC apresentadoras de antígenos são numerosas em certas regiões do intestino, especialmente no íleo terminal, onde elas estendem dendritos através das junções entre as células epiteliais adjacentes, aparentemente sem o rompimento das junções de oclusão. Essas DC apresentadoras de antígenos pertencem a uma subpopulação de DC de mucosa que promove respostas das células T efetoras, o que será discutido posteriormente neste capítulo. Ao contrário das células M, essas DC são capazes de processar e apresentar antígenos proteicos para as células T no interior do GALT. Antígenos no lúmen opsonizados por anticorpos podem ser transportados para o GALT por vias mediadas por receptores Fc. Há evidências provenientes de estudos em camundongos de que antígenos opsonizados por IgG, como as flagelinas bacterianas, podem ser transportados através do epitélio intestinal por receptores Fcγ neonatais (FcRn, Cap. 12) e passados para as DC no GALT, levando a respostas de células T aos antígenos.
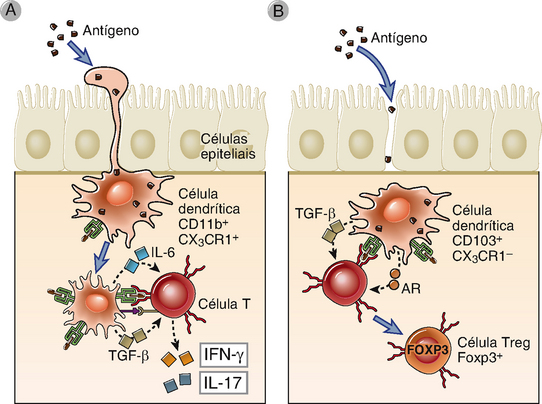
FIGURA 13-4 DC na mucosa intestinal. Existem diversas subpopulações diferentes de DC constitutivamente presentes na mucosa intestinal que são definidas por suas moléculas de superfície e função. A figura mostra duas subpopulações que também estão presentes em outros tecidos mucosos. A, As DC apresentadoras de antígenos estendem processos dendríticos entre as células epiteliais intestinais em direção ao lúmen para colher antígenos e, então, migrar para os linfonodos mesentéricos, onde iniciam a ativação e a diferenciação das células T efetoras pró-inflamatórias. Essas DC expressam a cadeia de integrina CD11b e o receptor de quimiocina CX3CR1. B, Outras DC presentes na lâmina própria que expressam a integrina CD103 apresentam antígenos a células T virgens e induzem sua diferenciação para células T reguladoras, em parte por secretar TGF-β e ácido retinoico (AR). A função reguladora dessas DC depende de fatores secretados pelas células epiteliais intestinais.
Os linfonodos mesentéricos coletam antígenos trazidos pela linfa dos intestinos grosso e delgado e são os locais de diferenciação de linfócitos efetores e reguladores que retornam para a lâmina própria. Existem 100 a 150 desses linfonodos localizados entre as camadas membranosas do mesentério. Os linfonodos mesentéricos possuem algumas funções iguais às do GALT, incluindo diferenciação de células B para plasmócitos secretores de IgA dimérica e desenvolvimento de células T efetoras e de células T reguladoras. As células que se diferenciam nos linfonodos mesentéricos em resposta à invasão da parede do intestino por patógenos ou comensais frequentemente residem na lâmina própria. Discutiremos a impressão das propriedades de localização dos linfócitos ativados nos linfonodos mesentéricos posteriormente.
Tonsilas palatinas e linguais são estruturas linfoides não encapsuladas, localizadas abaixo da mucosa epitelial escamosa estratificada na orofaringe e na base da língua, respectivamente, e são os sítios das respostas imunes a micro-organismos na cavidade oral. Essas tonsilas, juntamente com as tonsilas nasofaríngeas, formam um anel de tecidos linfoides conhecido como anel de Waldeyer. A massa de tecido tonsilar é composta por folículos linfoides, geralmente com proeminentes centros germinativos. Existem múltiplas invaginações estreitas e profundas do epitélio escamoso superficial, chamadas criptas, que crescem para o tecido folicular. Apesar de essas tonsilas serem frequentemente consideradas parte do GALT, elas são distintas, pois são separadas da cavidade oral rica em micro-organismos por múltiplas camadas de células epiteliais escamosas, em vez de uma camada simples de células epiteliais do intestino. O mecanismo de apresentação antigênica de micro-organismos da cavidade oral não está bem descrito; as criptas são os possíveis locais onde isso ocorre. No entanto, tonsilas linguais e palatinas respondem a infecções da mucosa epitelial por meio de respostas de anticorpos, principalmente IgA, significativamente aumentadas e vigorosas. As infecções típicas que estão associadas ao aumento das tonsilas, normalmente em crianças, são causadas por estreptococos e pelo vírus Epstein-Barr.
Os linfócitos efetores que são gerados no GALT e nos linfonodos mesentéricos são marcados com integrinas seletivas e com receptores de quimiocinas próprios do intestino e circulam pelo sangue, retornando para a lâmina própria do intestino (Fig. 13-5). As células B secretoras de IgA e as células T efetoras adquirem o fenótipo de sua localização no intestino. Dessa forma, o braço efetor do sistema imune gastrointestinal depende de um grande número de células secretoras de anticorpos e de células T que recirculam para a lâmina própria e respondem rapidamente a patógenos. A integrina mais importante de localização intestinal para os linfócitos B e T é a α4β7, que se liga à proteína MadCAM-1, expressa nas células endoteliais venulares pós-capilares na lâmina própria do intestino. A localização intestinal também requer o receptor de quimiocinas CCR9 nos linfócitos B e T e seu ligante de quimiocina CCL25, que é produzido por células epiteliais. A expressão combinada de MadCAM-1 e de CCL25 é restrita ao intestino. A localização de células produtoras de IgA para o cólon também requer a expressão de CCR-10 e a quimiocina CCL28, mas esta não é uma via específica do intestino porque o CCL28 é expresso por células epiteliais em outros tecidos de mucosas, como os tratos pulmonar e genitourinário. O bloqueio feito por anticorpos monoclonais específicos para a cadeia α4 de α4β7 tem sido utilizado para tratar pacientes com doenças inflamatórias intestinais com base no conhecimento de que as células T efetoras usam essa integrina para entrar no tecido intestinal nessas doenças. (Discutiremos as doenças inflamatórias intestinais posteriormente neste capítulo.)
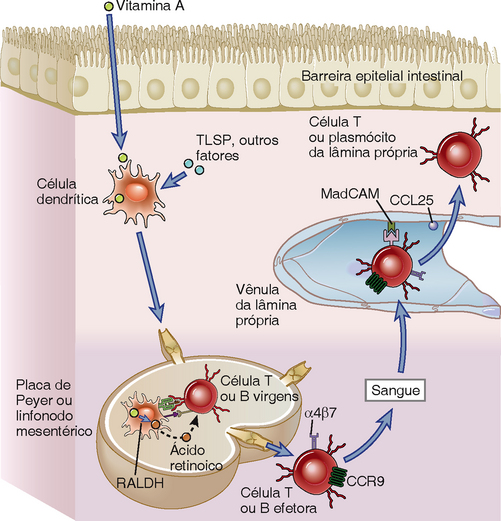
FIGURA 13-5 Propriedades de localização dos linfócitos intestinais. As propriedades de localização intestinal de linfócitos efetores são impressas nos tecidos linfoides, onde eles sofrem diferenciação de precursores virgens. As DC nos tecidos linfoides associados ao intestino, incluindo as placas de Peyer e os linfonodos mesentéricos, são induzidas por linfopoietina (TSLP) tímica estromal e outros fatores para expressar desidrogenase retinaldeído (RALDH), que converte a vitamina A dietética em ácido retinoico. Quando as células T ou B virgens são ativadas por antígenos no GALT, elas são expostas ao ácido retinoico produzido pelas DC e isso induz a expressão do receptor de quimiocina CCR9 e da integrina α4β7 nos plasmócitos e nas células T efetoras, que se originaram de linfócitos virgens. Os linfócitos efetores entram na circulação e retornam para a lâmina própria intestinal porque a quimiocina CCL25 (o ligante para CCR9) e a molécula de adesão MadCAM (o ligante para α4β7) estão dispostas sobre as células endoteliais venulares da lâmina própria.
O fenótipo de localização intestinal das células produtoras de IgA e das células T efetoras é impresso pelas DC e pela ação do ácido retinoico durante os processos de ativação das células T (Fig. 13-5). Além de promover a diferenciação das células T virgens em células T efetoras e a diferenciação de células B virgens em células secretoras de anticorpos IgA, discutidas posteriormente neste capítulo, as DC no GALT e nos linfonodos mesentéricos também proporcionam sinais que levam à expressão de α4β7 e de CCR9 nessas células efetoras. A indução dessas moléculas de localização depende da secreção do ácido retinoico por DC, embora os mecanismos ainda não estejam bem compreendidos. A indução seletiva de células de localização intestinal nos tecidos linfoides intestinais é explicada pelo fato de esses tecidos linfoides estarem expostos à vitamina A proveniente da dieta e de DC no GALT e linfonodos mesentéricos expressarem desidrogenase retiniana (RALDH), a enzima necessária para a síntese de ácido retinoico da vitamina A, uma vez que as DC de outros tecidos não podem expressá-la. Além disso, as células epiteliais intestinais também expressam RALDH e podem sintetizar ácido retinoico. Em consistência com essas propriedades do sistema imune humoral intestinal, sabe-se que a vacinação oral não apenas favorece a expansão de células B produtoras de IgA, comparada com a imunização intradérmica, mas as vacinas orais também induzem níveis mais altos de α4β7 nas células B.
A lâmina própria contém linfócitos efetores, DC e macrófagos distribuídos de forma difusa e é o local da fase efetora de respostas imunes adaptativas gastrointestinais. Como discutido anteriormente, os linfócitos efetores gerados nas placas de Peyer, em outras estruturas do GALT e nos linfonodos mesentéricos retornam para a lâmina própria. Neste local, as células T podem responder aos patógenos invasores e as células B podem secretar anticorpos que são transportados para o lúmen e neutralizam patógenos antes que eles invadam.
Imunidade Humoral no Trato Gastrointestinal
A imunidade humoral no intestino é dominada pela produção de IgA secretada no GALT e pelo transporte dos anticorpos através do epitélio mucoso para o lúmen. Pequenas, embora significativas, quantidades de IgG e IgM também são secretadas para o lúmen intestinal. Dentro do lúmen, anticorpos IgA, IgG e IgM ligam-se a micro-organismos e toxinas e os neutralizam impedindo sua ligação a receptores de células do hospedeiro. Essa forma de imunidade humoral é, algumas vezes, chamada de imunidade secretora e é particularmente desenvolvida em mamíferos. As respostas de anticorpos aos antígenos adquiridos pela ingestão são característicamente dominadas por IgA, e a imunidade secretora é o mecanismo de proteção induzido por vacinas orais, como a vacina antipólio. Diversas propriedades singulares do ambiente intestinal resultam no desenvolvimento seletivo de células secretoras de IgA que permanecem no trato gastrointestinal ou, se entrarem na circulação, retornam para a lâmina própria do intestino. O resultado é que as células secretoras de IgA acumulam-se de modo eficiente nas regiões próximas ao epitélio que ficará repleto de IgA secretada e a transportará para o lúmen.
IgA é produzida em maior quantidade do que qualquer outro isotipo de anticorpo. Estima-se que um adulto normal de 70 kg secrete aproximadamente 2 g de IgA por dia, o que corresponde a 60% a 70% do total de anticorpos produzidos. Essa enorme produção de IgA ocorre devido ao grande número de plasmócitos produtores de IgA no GALT, que são, por algumas estimativas, da ordem de 1010 células por metro de intestino (Fig. 13-6). Como a síntese de IgA ocorre principalmente em tecidos linfoides de mucosa e o transporte para o lúmen da mucosa é eficiente, esse isotipo constitui menos de um quarto de anticorpos no plasma e é o menor componente da imunidade humoral sistêmica, se comparado com IgG e IgM.
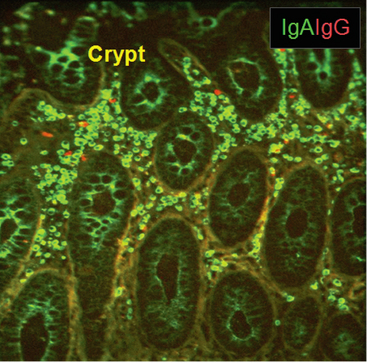
FIGURA 13-6 Plasmócitos secretores de IgA no intestino. A abundância de plasmócitos produtores de IgA (verde) na mucosa do cólon, comparados com as células secretoras de IgG (vermelho), é mostrada por coloração de imunofluorescência. A IgA que está sendo secretada pode ser observada em verde no citoplasma das células epiteliais da cripta.
(De Brandtzaeg P. The mucosal immune system and its integration with the mammary glands. The Journal of Pediatrics 156 (Suppl 1): S8-S16, 2010.)
A dominância da produção de IgA pelos plasmócitos intestinais deve-se, em parte, à indução seletiva da troca de classe para o isotipo de IgA nas células B no GALT e nos linfonodos mesentéricos. A troca de classes para IgA no intestino pode ocorrer por mecanismos dependentes de T e independentes de T (Fig. 13-7). Em ambos os casos, as moléculas que direcionam essa troca de classe para IgA incluem tanto citocinas solúveis quanto proteínas de membrana de outros tipos celulares que se ligam a receptores de sinalização nas células B (Cap. 11). O TGF-β é necessário para a troca de classe para isotipos de IgA no intestino bem como em outros compartimentos da mucosa, e essa citocina é produzida por células epiteliais intestinais e por DC no GALT. Além disso, as DC do GALT expressam a integrina αvβ8, que é necessária para a ativação de TGF-β. Várias moléculas que promovem a troca de classes para IgA são expressas por células epiteliais intestinais ou DC do GALT em resposta à sinalização de TLR, e as bactérias comensais no lúmen intestinal produzem ligantes que aderem aos TLR relevantes. Por exemplo, a troca de classes para IgA e IgG independente de T requer a ligação da citocina APRIL, da família do TNF, ao receptor TACI nas células B, e células epiteliais intestinais produzem APRIL em resposta aos ligantes TLR produzidos por bactérias comensais. As células epiteliais intestinais também produzem a linfopoietina estromal tímica (TSLP) em resposta a sinais de TLR, e a TSLP estimula a produção adicional de APRIL por DC do GALT. Os ligantes de TLR produzidos por bactérias comensais no intestino também aumentam a expressão de óxido nítrico sintase indutível em DC, levando à produção de óxido nítrico. Acredita-se que o óxido nítrico promova a troca de classe para IgA, tanto dependente de T quanto independente de T, em parte porque o óxido nítrico aumenta a sinalização de TGF-β em células B e também a síntese de APRIL por DC do GALT. Finalmente, a produção de IgA pelas células B intestinais é, pelo menos parcialmente, dependente do metabólitos de vitamina A, o ácido retinoico all-trans (tretinoína), o qual é produzido por células epiteliais intestinais e por DC do GALT, embora os mecanismos pelos quais o ácido retinoico promove a produção de IgA ainda não sejam conhecidos. O ácido retinoico também é importante para a localização residente das células B do intestino, como foi discutido. Existe uma abundância de muitas dessas moléculas no interior do GALT e dos linfonodos mesentéricos, em comparação com os tecidos linfoides não mucosos como o baço e linfonodos drenantes da pele, devido em muito à propensão de células B no GALT fazerem a troca de classes para a produção de IgA.
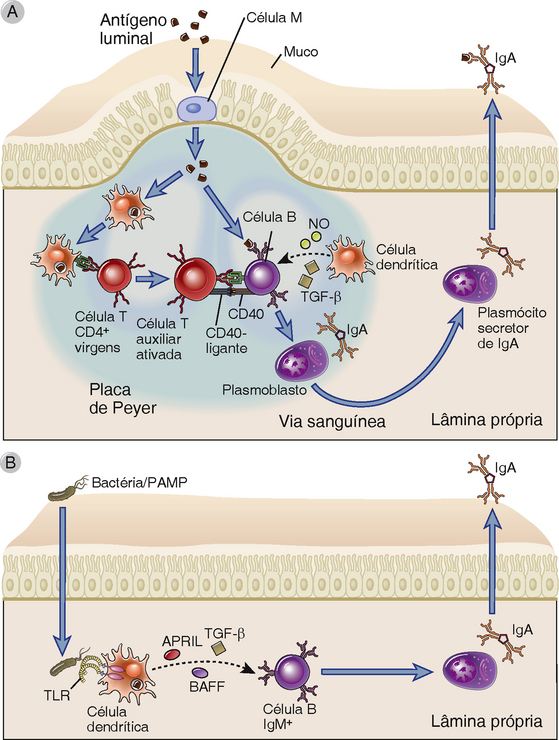
FIGURA 13-7 Troca de classe para IgA no intestino. A troca de classe para IgA no intestino ocorre tanto por mecanismos dependentes de T quanto por mecanismos independentes de T. A, Na troca de classe para IgA independente de T, as DC no ápice subepitelial das placas de Peyer capturam os antígenos bacterianos enviados pela células M e migram para a zona interfolicular, onde apresentam os antígenos para as células T CD4+. As células T ativadas diferenciam-se em células T auxiliares e se engendram em interações cognatas com as células B IgM+IgD+ apresentadoras de antígenos que também possuem antígeno bacteriano englobado e processado. A troca de classe para IgA na célula B é estimulada por meio da ligação de CD40L da célula T ao CD40 da célula B, juntamente com a ação do TGF-β. A troca de classe para IgA pode ser aumentada pela produção de NO pelas DC, com regulação positiva do receptor para TGF-β nas células B. Essa via dependente de célula T produz anticorpos IgA de alta afinidade que são, preferencialmente, direcionados a patógenos e toxinas. B, A troca de classe para IgA independente de T envolve a ativação das células B IgM+IgD+, incluindo células B B-1, pelas células dendríticas. As DC ativadas pelo ligante de TLR secretam fatores que induzem a troca de classe para IgA, incluindo BAFF, APRIL e TGF-β. As DC também produzem IL-6 e ácido retinoico. Essa via independente de célula T produz anticorpos IgA de afinidade relativamente baixa às bactérias intestinais. Os mecanismos moleculares da troca de classes estão descritos no Capítulo 11.
A predominância da produção de IgA pelos plasmócitos intestinais é aumentada pelas propriedades seletivas de localização intestinal das células produtoras de IgA que se originam no GALT e nos linfonodos mesentéricos (Fig. 13-5). Algumas das IgAs que são transportadas através do epitélio intestinal podem ser produzidas por plasmócitos que se diferenciaram e permaneceram nos folículos subjacentes ao GALT. No entanto, os plasmócitos secretores de IgA estão amplamente dispersos na lâmina própria do trato gastrointestinal, não apenas nos folículos linfoides. Como discutido, as células B ativadas que sofrem uma troca de classe de isotipo para células produtoras de IgA no GALT e nos linfonodos mesentéricos podem entrar na circulação sistêmica e, então, retornar seletivamente para a lâmina própria intestinal, onde podem permanecer como plasmócitos.
A IgA secretada é transportada através das células epiteliais para o interior do lúmen intestinal por um receptor Fc específico para IgM/IgA, denominado receptor poli-Ig (Fig. 13-8). A IgA produzida por plasmócitos na lâmina própria encontra-se sob a forma de um dímero que é mantido unido pela cadeia J produzida coordenadamente, a qual fica covalentemente ligada por pontes dissulfeto a regiões Fc da cadeia pesada α de duas moléculas de IgA. Os plasmócitos da mucosa produzem cadeias J em abundância, mais até do que plasmócitos de tecidos não mucosos, e a IgA sérica geralmente é um monômero que não possui a cadeia J. Da lâmina própria, a IgA deve ser transportada através do epitélio para o lúmen por um processo conhecido como transcitose, e essa função é mediada pelo receptor poli-Ig. Esse receptor é sintetizado por células epiteliais mucosas e expresso em suas superfícies basal e lateral. Ele é uma glicoproteína integral de membrana com cinco domínios extracelulares homólogos aos domínios de Ig e é, portanto, um membro da superfamília das Ig. A cadeia J da IgA dimérica secretada e da IgM pentamérica contém um domínio necessário para a ligação do receptor poli-Ig, e dessa forma a IgA dimérica (e a IgM multimérica) liga-se ao receptor poli-Ig nas células epiteliais mucosas (Fig. 13-8). Esse complexo é endocitado para o interior da célula epitelial e transportado ativamente em vesículas até a superfície luminal. Aqui, o receptor poli-Ig é proteoliticamente clivado, seus domínios transmembranas e citoplasmáticos permanecem ligados à célula epitelial, e o domínio extracelular do receptor, que carrega a molécula de IgA, é liberado para o lúmen intestinal. O componente solúvel do receptor associado à IgA é chamado de componente secretor. A IgM produzida pelos plasmócitos da lâmina própria também é um polímero (pentâmero) associado não covalentemente à cadeia J, e o receptor poli-Ig também transporta a IgM para as secreções intestinais. É por essa razão que esse receptor é chamado de receptor poli-Ig. Acredita-se que o componente secretor ligado proteja a IgA e a IgM poliméricas da proteólise por enzimas presentes no lúmen intestinal, e esses anticorpos são, assim, capazes de cumprir suas funções de neutralização de micro-organismos e de toxinas no lúmen. O receptor poli-Ig também é responsável pela secreção de IgA na bile, no leite, no escarro, na saliva e no suor.
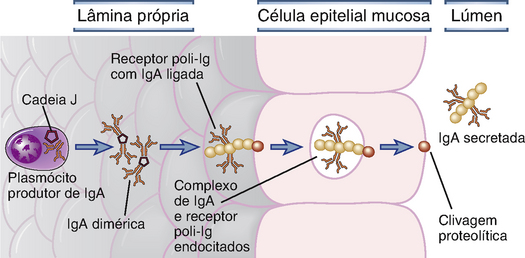
FIGURA 13-8 Transporte de IgA através das células epiteliais. A IgA é produzida pelos plasmócitos na lâmina própria do tecido mucoso e liga-se ao receptor poli-Ig na base de uma célula epitelial. O complexo é transportado através da célula epitelial e a IgA ligada é liberada no lúmen por clivagem proteolítica. O processo de transporte através da célula, da superfície basolateral até a superfície luminal, nesse caso, é denominado transcitose.
A IgG está presente nas secreções intestinais em concentrações iguais às da IgM mas inferiores às da IgA. Em algumas secreções mucosas (p. ex., reto, trato genitourinário e vias aéreas), as concentrações de IgG são altas e, frequentemente, excedem as de IgA. O transporte de IgG para as secreções mucosas deve-se a outro receptor de transcitose, o receptor Fc neonatal (FcRn), o qual já foi discutido nos Capítulos 5 e 12. Em contraste com o receptor poli-Ig, que transporta a IgA unidirecionalmente (do lado basal para o lado apical/luminal), o FcRn pode mediar o transporte bidirecional de IgG. Dessa forma, o transporte de IgG mediado por FcRn contribui para a imunidade humoral contra patógenos do lúmen intestinal e também pode contribuir para a captura de micro-organismos recobertos por anticorpos e outros antígenos do lúmen para o GALT.
A IgA produzida nos tecidos linfoides na glândula mamária é secretada para o colostro e para o leite da mama madura através de transcistose mediada por receptor poli-Ig e medeia a imunidade de mucosa passiva de lactentes. A glândula mamária lactante humana contém um grande número de plasmócitos secretores de IgA, e o epitélio da glândula mamária pode armazenar grandes quantidades de IgA secretora. Os plasmócitos na mama se originam de vários tecidos linfoides associados à mucosa. Eles residem na mama porque a maior parte dos plasmoblastos expressa CCR10, independentemente de qual tecido linfoide os gerou, e os tecidos mamários expressam CCL28, a quimiocina que se liga a CCR10. Portanto, durante a amamentação, a criança ingere uma quantidade significativa de IgA materna, a qual proporciona ampla proteção polimicrobiana no intestino da criança. Quantidades moderadas de IgG e de IgM também são secretadas no leite materno e contribuem para a imunidade passiva do lactente. Muitos estudos epidemiológicos mostraram que a amamentação reduz significativamente o risco de doenças diarreicas e sepse, especialmente em países em desenvolvimento, e isso se correlaciona com a presença de IgA secretora no leite da glândula mamária específico para espécies enterotóxicas de bactérias, incluindo Escherichia coli e Campylobacter.
Imunidade Mediada por Células T no Trato Gastrointestinal
As células T exercem um papel importante na proteção contra patógenos microbianos no sistema gastrointestinal e na regulação das respostas a antígenos alimentares e de comensais. Além disso, as células T contribuem para doenças inflamatórias no trato gastrointestinal. Como em outras partes do corpo, a imunidade por células T no intestino envolve diferentes subpopulações de células T e é influenciada de várias maneiras pelas DC apresentadoras de antígeno, as quais também pertencem a diferentes subpopulações. Nesta seção, discutiremos importantes características das funções das células T e das DC nos intestinos.
As células T são encontradas no interior da camada epitelial do intestino, disseminadas por toda a lâmina própria e submucosa, e no interior das placas de Peyer e em outros conjuntos organizados de folículos. Em humanos, a maior parte das células T intraepiteliais é composta de células CD8+. Em camundongos, aproximadamente 50% dos linfócitos intraepiteliais expressam a forma γδ de TCR, de maneira similar aos linfócitos intraepidérmicos da pele. Em humanos, apenas 10% dos linfócitos intraepiteliais são células γδ, mas essa proporção ainda é mais alta que as proporções de células γδ encontradas entre as células T de outros tecidos. Os linfócitos intraepiteliais que expressam ambos os TCR, αβ e γδ, apresentam uma diversidade limitada de receptores de antígenos. Esses achados sustentam a ideia de que linfócitos intraepiteliais de mucosa possuem uma variação de especificidade limitada e distinta da maior parte das células T e de que esse repertório restrito pode ter evoluído para reconhecer micro-organismos que são comumente encontrados na superfície epitelial. As células T da lâmina própria são, em sua maioria, CD4+, e a maior parte possui o fenótipo de células T efetoras ativadas ou de memória, sendo a última com fenótipo de memória efetora (Cap. 9). Deve-se lembrar que essas células T efetoras e de memória da lâmina própria são geradas de precursores virgens no GALT e nos linfonodos mesentéricos, entram na circulação e preferencialmente retornam para a lâmina própria (Fig. 13-5). As células T no interior das placas de Peyer e em outros folículos adjacentes ao epitélio intestinal incluem células T auxiliares CD4+ e células T reguladoras.
As DC são abundantes no sistema imune gastrointestinal e podem ser amplamente divididas em duas subpopulações funcionais, as quais participam da estimulação das respostas protetoras das células T efetoras ou da indução das respostas das células T reguladoras que suprimem a imunidade aos antígenos ingeridos e aos organismos comensais (Fig. 13-4). Essas subpopulações, que também estão presentes em outros tecidos mucosos além do intestino, algumas vezes são chamadas de DC efetoras e DC reguladoras. Elas podem ser diferenciadas por sua expressão distinta de integrinas e de receptores de quimiocinas: as DC efetoras são CD11b+CX3CR1+ e as DC reguladoras são CD103+CX3CR1−. As DC efetoras são as DC captadoras de antígenos, discutidas anteriormente neste capítulo, que projetam dentritos entre as células epiteliais e colhem amostras do conteúdo luminal. Elas podem interagir com as células T (e B) virgens no GALT ou podem migrar através da drenagem linfática para os linfonodos mesentéricos, onde apresentam os antígenos proteicos processados para células T virgens e induzem a diferenciação dessas células T em células efetoras produtoras de IFN-γ ou de IL-17. As DC reguladoras, que não fazem amostragem diretamente do conteúdo luminal, induzem a diferenciação das células T virgens em células T reguladoras FoxP3+. Acredita-se que as DC reguladoras sejam condicionadas pelas células epiteliais mucosas a secretar TGF-β e ácido retinoico no momento da apresentação de antígenos às células T virgens; essas moléculas favorecem a diferenciação da Treg. A heterogeneidade das DC no intestino, bem como em outros tecidos, é, na verdade, mais complexa do que o que foi discutido, com cinco a dez subpopulações diferentes identificadas por padrões de expressão de múltiplas moléculas de superfície. A relevância funcional dessas subpopulações ainda permanece incompletamente entendida.
No trato gastrointestinal, as diferentes subpopulações de células T CD4+ efetoras são induzidas e protegem contra diferentes espécies microbianas. Nos Capítulos 9 e 10, introduzimos o conceito de que subpopulações de células T auxiliares que secretam diferentes citocinas são especializadas em tipos particulares de respostas microbianas. Esse conceito fundamental é altamente relevante para o sistema imune de mucosas. A microbiota bacteriana comensal do lúmen intestinal exerce profunda influência sobre o fenótipo de células T durante a homeostasia.
• Células TH17. Estudos em camundongos mostraram que certas classes de bactérias, ou, em alguns casos, espécies individuais de bactérias, podem mudar o padrão dominante de produção de citocinas por células T. Por exemplo, a lâmina própria do intestino delgado em camundongos saudáveis é particularmente rica em células produtoras de IL-17, ao passo que no cólon não, e a presença de células TH17 depende da colonização do intestino por um determinado filo de bactérias (bactérias filamentosas segmentadas) no período pós-natal. Essa presença regular de células TH17 é necessária para a proteção contra espécies patogênicas de bactérias (p. ex., Citrobacter rodentium). Outro exemplo de alterações induzidas pela microbiota bacteriana nos fenótipos de células T no intestino é o fato de que linhagens de Bacteroides fragilis colonizantes do intestino que expressam ou não polissacarídeo A induzem, respectivamente, células T reguladoras produtoras de IL-10 ou de IL-17. As células TH17 parecem exercer um papel especial na manutenção da função da barreira epitelial mucosa devido às ações das duas citocinas características que elas produzem, IL-17 e IL-22. Os receptores de ambas as citocinas são expressos nas células epiteliais intestinais e ambas induzem a expressão de proteínas importantes para essa função de barreira, como as mucinas e as β-defensinas, que protegem as células epiteliais contra os danos induzidos por micro-organismos. Os mecanismos pelos quais ocorrem essas alterações induzidas por micro-organismos nas respostas da célula T não são bem compreendidos, mas provavelmente envolvem sinais induzidos pelos micro-organismos tanto nas células epiteliais intestinais quanto nas DC. Esses sinais alteram o fenótipo e o perfil de secreção de citocinas pelas DC, o que, por sua vez, influencia a diferenciação da subpopulação de células T quando as DC apresentam o antígeno às células T virgens específicas para o antígeno microbiano.
• Células TH2. As infecções por helmintos intestinais induzem fortes respostas TH2, as quais são efetivas na eliminação dos vermes porque as citocinas TH2 IL-4 e IL-13 cooperam no aumento das secreções líquidas e mucosas e induzem contração da musculatura lisa e motilidade intestinal. Esse tipo de defesa do hospedeiro é denominado imunidade de barreira, uma vez que ela se faz ativa nas barreiras epiteliais (Cap. 10).
Regulação da Imunidade no Trato Gastrointestinal por Células T Reguladoras e Citocinas
As células T reguladoras são abundantes no GALT e evitam as reações inflamatórias contra os micro-organismos comensais. Estima-se que haja pelo menos o dobro de Treg FoxP3+ entre as células CD4+ na lâmina própria como em outros tecidos linfoides periféricos. Muitas dessas Treg são provavelmente induzidas no intestino em resposta aos antígenos encontrados localmente e, portanto, pertencem à categoria de Treg adaptativa (Cap. 14). Os fatores que contribuem para a geração dessas Treg incluem DC CD103+, produção local de ácido retinoico (que promove a expressão de FoxP3) e produção local de TGF-β (que também promove a expressão de FoxP3 e inibe a geração de células TH1 e TH2). Como será discutido no Capítulo 14, acredita-se que as Treg suprimam as respostas imunes por diversos mecanismos. Desses, o mecanismo dominante no intestino parece ser a produção da citocina imunossupressora IL-10, como será discutido posteriormente.
Diversas citocinas, incluindo TGF-β, IL-10 e IL-2, parecem exercer papéis cruciais na manutenção da homeostasia do sistema imune no intestino, e deficiências nessas citocinas ou em seus receptores resultam em inflamação intestinal patológica. Muito do que se sabe sobre a regulação mediada por citocina no intestino é proveniente de estudos em camundongos geneticamente deficientes para os genes de citocinas ou de seus receptores. A principal característica do fenótipo murino com deficiências produzidas por engenharia genética em TGF-β, IL-10, receptor de IL-10, IL-2 e seu receptor é a inflamação descontrolada no intestino. Mutações nos genes para IL-10 ou seu receptor também estão associadas à doença inflamatória intestinal grave em crianças, confirmando a importância da IL-10 na prevenção de inflamação intestinal patológica em humanos. A inflamação descontrolada intestinal que se observa na ausência dessas citocinas ou de seus receptores é mais provavelmente causada por respostas imunes inatas e adaptativas à microbiota intestinal comensal, uma vez que a inflamação não ocorre em camundongos criados em condições livres de patógenos. As fontes celulares de citocinas e as células-alvo relevantes que expressam receptores essenciais para a prevenção da inflamação intestinal não estão completamente elucidadas. Os modelos murinos nos quais as citocinas, os receptores de citocinas e a sinalização desses receptores de citocinas são geneticamente deletados somente em tipos celulares específicos têm sido utilizados para resolver questões acerca da importância dos tipos celulares. No caso da regulação da inflamação intestinal dependente de TGF-β e de IL-10, há evidências que indicam que Treg e macrófagos são fontes importantes dessas citocinas. Por exemplo, a deleção seletiva do gene IL-10 em células FoxP3+ induz rapidamente uma colite severa, mas não há outras manifestações de doença inflamatória, o que é compatível com o papel essencial da Treg produtora de IL-10 na manutenção da homeostasia no trato gastrointestinal. As células-alvo que expressam receptores para, e são reguladas por, TGF-β e Il-10 provavelmente incluem DC, células T efetoras, células efetoras da imunidade inata, como macrófagos, e células epiteliais. Camundongos deficientes em IL-2 ou em seu receptor têm, como consequência desse defeito, a doença inflamatória intestinal no desenvolvimento das funções de Treg, as quais necessitam de IL-2 (Cap. 14).
Tolerância Oral e Vacinas Orais
Tolerância oral é a tolerância imune adaptativa sistêmica aos antígenos que são ingeridos ou administrados oralmente de outra forma e é um potencial via de tratamento de doenças nas quais ocorrem respostas imunes indesejadas, como a autoimunidade. A tolerância oral foi mais claramente demonstrada em modelos experimentais com roedores. Camundongos alimentados com altas doses de um antígeno proteico podem apresentar, subsequentemente, prejuízo nas respostas humorais e mediadas por célula T ao mesmo antígeno administrado por outras vias, como através da pele. Um fenômeno semelhante pode ser demonstrado quando os antígenos são administrados por via intranasal para a mucosa respiratória, e o termo mais geralmente utilizado tolerância de mucosa descreve a tolerância induzida pela administração antigênia oral ou nasal. Especula-se que o papel fisiológico da tolerância oral seja a prevenção de respostas imunes potencialmente perigosas às proteínas provenientes da dieta ou das bactérias comensais. Os mecanismos subjacentes da tolerância oral não estão bem compreendidos, mas provavelmente incluem os mesmos mecanismos da tolerância periférica, discutida no Capítulo 14, como a anergia, deleção e supressão mediadas por Treg. A propensão do sistema imune no intestino para suprimir as respostas imunes locais a antígenos no lúmen intestinal poderia se manifestar em outras partes do corpo devido à circulação de Treg para outros tecidos e à deleção ou anergia de células T efetoras, as quais não ficam mais disponíveis para responder a antígenos em outros locais. As tentativas de tratar doenças autoimunes ou alergias pela administração oral ou nasal de autoantígenos ou alérgenos importantes não têm sido até agora bem-sucedidas.
A administração oral de antígeno no cenário da estimulação da imunidade inata pode levar a respostas imunes adaptativas produtivas, como na utilização de vacinas virais orais para induzir respostas protetoras de anticorpos aos vírus. Essas vacinas são vacinas de vírus vivos atenuados que podem infectar as DC no intestino e estimular fortes respostas inatas que, então, promovem a ativação de células T e B.
Doenças Relacionadas às Respostas Imunes no Intestino
Dada a abundância de células imunes e sua constante atividade na mucosa intestinal, não é surpreendente que haja muitas doenças intestinais relacionadas às respostas imunes anormais. Essas doenças geralmente são causadas por respostas desreguladas a organismos comensais ou a antígenos alimentares. Discutiremos agora exemplos selecionados dessas doenças; elas se encontram descritas de modo mais completo em livros médicos.
A doença inflamatória intestinal é um grupo heterogêneo de distúrbios caracterizados por inflamação remitente crônica do intestino delgado ou grosso, provavelmente devido a respostas mal reguladas às bactérias comensais. Os dois principais tipos de doença inflamatória intestinal são a doença de Crohn, que pode afetar toda a espessura do tecido da parede intestinal em qualquer parte do trato gastrointestinal, mas envolve mais frequentemente o íleo terminal, e a colite ulcerativa, que é restrita à mucosa colônica. Os sintomas incluem dor abdominal, vômitos, diarreia e perda de peso. O tratamento inclui diversos fármacos anti-inflamatórios, como a sulfassalazina, corticosteroides, antagonistas de TNF e antimetabólitos. Apesar de a etiologia da doença de Crohn e da colite ulcerativa ser pouco conhecida, diversos tipos de evidências sugerem que esses distúrbios sejam um resultado dos defeitos na regulação das respostas imunes a organismos comensais no intestino de indivíduos geneticamente suscetíveis. Inúmeras anormalidades imunológicas podem contribuir para o desenvolvimento da doença intestinal.
• Defeitos na imunidade inata aos comensais do intestino. Foi discutida a possibilidade de que a doença intestinal inflamatória é resultado de defeitos na imunidade inata de dois tipos. Primeiro, pode haver expressão defeituosa de moléculas, como as defensinas, levando à invasão bacteriana comensal aumentada ao longo do epitélio intestinal. Segundo, pode haver regulação negativa inadequada das respostas imunes inatas aos organismos comensais. Polimorfismos no gene que codifica o sensor citoplasmático da imunidade inata NOD2 estão associados a um subgrupo da doença de Crohn e podem levar a anormalidades desses dois tipos na imunidade inata.
• Respostas anormais de TH17 e TH1. Análises das respostas da célula T em modelos animais e em pacientes com doença inflamatória intestinal indicam que existe uma resposta de TH17 ativa nas partes alteradas do intestino. Além disso, estudos de genes associados ao risco para o desenvolvimento de doença inflamatória intestinal indicam que polimorfismos do gene do receptor da IL-23 estão associados ao risco alterado, o que também é consistente com um papel para as respostas de TH17, porque a IL-23 é necessária para a manutenção e diferenciação de TH17. A doença de Crohn também é caracterizada por inflamação granulomatosa orientada por células TH1 produtoras de IFN-γ (Cap. 18). Esses achados são a base para os ensaios clínicos nos quais os pacientes com doença inflamatória intestinal são tratados com um anticorpo monoclonal que se liga a um polipeptídeo (p40) compartilhado por IL-23 e IL-12. A IL-23 é requerida para as respostas imunes mediadas por TH17, como mencionado, e a IL-12 é requerida para as respostas TH1.
• Função defeituosa das células T reguladoras. É possível que a doença inflamatória intestinal possa ser causada por supressão inadequada mediada por Treg das respostas imunes a organismos comensais. A evidência que sustenta essa hipótese provém de modelos murinos, nos quais a ausência de Treg leva à doença inflamatória intestinal. De fato, um dos primeiros experimentos demonstrando a existência de Treg foi o desenvolvimento de inflamação gastrointestinal em camundongos imunodeficientes que receberam células T CD4+CD25− virgens, que agora se sabe que contêm precursores de células T efetoras, mas não de Treg CD4+CD25+. Camundongos deficientes em Treg devido à deleção dos genes de IL-2 ou do receptor de IL-2, como já mencionado, ou deficientes no gene de FoxP3, também desenvolvem doença inflamatória intestinal. Em humanos, as mutações em FoxP3 resultam em falha do desenvolvimento de Treg e causam a doença conhecida como enteropatia, poliendocrinopatia, desregulação ligada ao X (IPEX), que inclui grave inflamação intestinal, bem como autoimunidade em muitos outros tecidos. Apesar de todas essas informações serem consistentes com a necessidade de Treg para manter a homeostasia, como discutido, não se sabe se os defeitos em Treg são a base da maioria dos casos de doença inflamatória intestinal em humanos.
• Polimorfismos dos genes que estão associados à macroautofagia e a resposta de proteína não dobrada ao estresse do retículo endoplasmático são fatores de risco para a doença inflamatória intestinal. Evidências experimentais sugerem que a conexão entre doença inflamatória intestinal, variantes de respostas de proteínas não dobradas e genes de autofagia relacionam-se à diminuição da secreção de enzimas antimicrobianas e defensinas pelas células de Paneth. A macroautofagia é um processo pelo qual as células sequestram organelas citoplasmáticas dentro de autofagossomos que, então, se fundem com lisossomos, promovendo a destruição das organelas. Variações genéticas dos genes de autofagia (incluindo ATG16L1 e LBKK2) que estão associadas à doença de Crohn prejudicam a autofagia nas células de Paneth e, por razões não esclarecidas, isso reduz a secreção de lisozimas e de defensinas para o lúmen intestinal. O estresse do retículo endoplasmático ocorre quando proteínas mal dobradas se acumulam nesse compartimento celular. Isso leva à ativação de uma série de proteínas, incluindo o fator de transcrição XBP-1, que atua no bloqueio da tradução proteica e também aumenta a expressão de chaperonas que promovem a adequada dobra de proteínas. As células de Paneth, como outras células secretoras, dependem da resposta de proteína não dobrada para manter a função secretora de proteínas.
A doença celíaca (enteropatia sensível ao glúten ou espru não tropical) é uma doença inflamatória da mucosa do intestino delgado causada por respostas imunes contra proteínas do glúten ingeridas e presentes no trigo. A doença celíaca é caracterizada por inflamação crônica da mucosa do intestino delgado, levando a atrofia das vilosidades, má absorção e várias deficiências nutricionais, o que leva a manifestações extraintestinais. A doença é tratada por restrição dietética a alimentos livres de glúten. Os pacientes produzem anticorpos IgA e IgG específicos para o glúten, bem como autoanticorpos IgA e IgG específicos para a transglutaminase 2A, uma enzima que modifica a proteína gliadina do glúten. Acredita-se que esses autoanticorpos surjam quando células B específicas para transglutaminase endocitam a transglutaminase do hospedeiro covalentemente associada à gliadina e, então, apresentam os peptídeos de gliadina para as células T auxiliares, que, por sua vez, auxiliam a resposta de anticorpos antitransglutaminase. Não se sabe se esses anticorpos contribuem para o desenvolvimento da doença, mas constituem um marcador diagnóstico sensível para a doença. Existe forte evidência de que as respostas de célula T CD4+ à gliadina estejam envolvidas na patogenia da doença. Células T específicas para os peptídeos da gliadina são encontradas em pacientes celíacos, e o processo inflamatório no intestino inclui células T e suas citocinas. Os peptídeos da gliadina ligam-se a dois alelos de CHP classe II encontrados na maior parte dos pacientes, denominados HLA-DQ2 e HLA-DQ8, e há um risco relativo alto para o desenvolvimento da doença entre pessoas com esses dois alelos. A associação de doenças autoimunes e alelos do CHP será mais bem discutida no Capítulo 14. Além das respostas da célula T CD4+, o linfócito T citotóxico (CTL) CD8+ que mata células epiteliais intestinais também pode contribuir para a doença celíaca, embora isso não ocorra pelo reconhecimento de peptídeos de gliadina. Em vez disso, a gliadina estimula as células epiteliais a secretar IL-15, que induz a expressão do receptor de ativação NKG2D nos CTL, e a gliadina induz a expressão de ligantes para NKG2A (MICA, MICB) nas células epiteliais intestinais. O resultado final é uma redução do limiar necessário para que o CTL mate as células epiteliais, embora ainda não esteja claro qual é, de fato, a fonte de peptídeos reconhecidos pelo CTL.
As alergias alimentares são causadas por respostas de TH2 a muitas proteínas alimentares diferentes, e quando da ingestão dessas proteínas, provocam respostas inflamatórias agudas localizadas no intestino e sistêmicas. As alergias resultam das respostas de IgE dependente de TH2 a antígenos ambientais (alérgenos), que podem ser proteínas ou compostos químicos que modificam (haptenos) as próprias proteínas. No caso das alergias alimentares, os antígenos ambientais são ingeridos, e esse é outro exemplo de falha da tolerância imune adaptativa a antígenos alimentares. Os anticorpos antialérgeno ligam-se aos receptores Fc nos mastócitos, e a exposição subsequente ao alérgeno produzirá ligação cruzada de receptores Fc, ativação de mastócitos e a liberação de potentes aminas pró-inflamatórias, mediadores lipídicos e citocinas. Existem abundantes mastócitos na lâmina própria do intestino. Dessa forma, a reingestão de um alérgeno alimentar por uma pessoa que montou previamente uma resposta de TH2 e de IgE ao alérgeno produzirá ativação do mastócito, com suas consequências patológicas. As citocinas produzidas pelas células TH2 também estimulam diretamente o peristaltismo e podem desencadear sintomas de alergias alimentares, mesmo sem a participação de IgE. Essas reações podem produzir sintomas gastrointestinais como náusea, vômitos, diarreia e dor abdominal, mas o alérgeno pode ser absorvido na corrente sanguínea e, por fim, ativar mastócitos em muitos tecidos diferentes, produzindo manifestações sistêmicas. Discutiremos mais detalhadamente as reações alérgicas no Capítulo 19.
As respostas imunes prolongadas aos micro-organismos gastrointestinais podem levar ao surgimento de tumores no trato gastrointestinal. O melhor exemplo documentado desse fenômeno são os linfomas de MALT no estômago de pessoas com infecção por Helicobacter pylori. Esses linfomas são tumores que surgem de células B malignamente transformadas nos folículos linfoides da lâmina própria gástrica. Acredita-se que o H. pylori inicie uma reação inflamatória que promove o desenvolvimento e crescimento de tumores pelas células B intrínsecas de eventos oncogênicos. Notadamente, se os linfomas de MALT gástrico forem diagnosticados antes de se disseminarem para além das paredes do estômago, os pacientes podem ser curados da infecção por H. pylori pelo tratamento com antibiótico.
IMUNIDADE EM OUTROS TECIDOS MUCOSOS
Da mesma forma que a mucosa gastrointestinal, as mucosas do sistema respiratório, do sistema genitourinário e da conjuntiva devem manter uma barreira contra a invasão de diversos micro-organismos no ambiente e equilibrar as respostas protetoras efetivas aos micro-organismos invasores e a supressão de respostas a numerosos organismos comensais. Muitas das características que descrevemos para a imunidade gastrointestinal são válidas para a imunidade de mucosa nessas diferentes localizações. Essas características comuns incluem barreiras epiteliais secretoras de muco relativamente impermeável e de defensina; conjunto de tecidos linfoides localizados imediatamente abaixo do epitélio; constante amostragem de antígenos localizados do lado externo das barreiras realizada pelas células imunes do lado interno da barreira; constante integração de sinais pró-inflamatórios e reguladores gerados pela ligação de produtos bacterianos aos TLR epiteliais e às DC; forte confiança na imunidade humoral mediada por IgA secretora para impedir a invasão microbiana; e a presença de populações de DC efetoras e reguladoras, que estimulam tipos particulares de respostas da célula T efetora e reguladora. Além dessas características comuns, cada tecido de mucosa diferente possui características singulares que refletem as funções e a anatomia distintas dos órgãos dos quais fazem parte e a variação distinta de antígenos e micro-organismos ambientais que estão presentes em cada local. Discutiremos, agora, algumas das principais características da imunidade de mucosas nesses órgãos, focando principalmente o sistema respiratório.
Imunidade de Mucosa no Sistema Respiratório
A mucosa do sistema respiratório reveste as passagens nasais, a nasofaringe, a traqueia e a árvore brônquica. Os alvéolos, as terminações das vias aéreas brônquicas em forma de fundo de saco e revestidas por epitélio, também podem ser considerados parte da mucosa. A inalação do ar expõe a mucosa respiratória a uma ampla variedade de substâncias estranhas, incluindo organismos infecciosos provenientes do ar, pólens de plantas, partículas de pó e vários outros antígenos ambientais. A microbiota das vias aéreas é bem menos densa e menos diversa do que a observada no intestino, e as vias aéreas inferiores e os alvéolos são geralmente estéreis. Apesar disso, houve desenvolvimento de mecanismos similares no sistema imune da mucosa respiratória para a obtenção de um fino equilíbrio entre ativação imune para proteger contra patógenos e regulação imune para evitar respostas desnecessárias ou exacerbadas que possam prejudicar as funções fisiológicas. As falhas do sistema imune no controle das infecções broncopulmonares e as respostas imunes ou inflamatórias excessivas a infecções são as causas principais de morbidade e mortalidade no mundo todo.
Imunidade Inata no Sistema Respiratório
O epitélio colunar ciliado, pseudoestratificado, que reveste a maior parte da mucosa respiratória, incluindo passagens nasais, nasofaringe e árvore brônquica, realiza funções similares de barreira física e química do epitélio intestinal, em virtude das junções de oclusão entre as células e da secreção de muco, defensinas e catelicidinas. O muco das vias aéreas captura substâncias estranhas, inclusive micro-organismos, e os cílios movimentam o muco e os micro-organismos capturados para cima e para fora dos pulmões. A importância do muco e dos cílios na proteção decorrente da imunidade inata no pulmão é ilustrada pelo grande aumento da frequência de infecções pulmonares sérias em pessoas com função ciliar diminuída, como fumantes intensos, ou produção prejudicada de muco, como em pacientes com fibrose cística.
As respostas inatas nos alvéolos atendem as funções antimicrobianas, mas são extremamente controladas para evitar inflamação, o que poderia prejudicar a troca gasosa. Os alvélos, normalmente, são estéreis, mas são suscetíveis à infecção disseminada decorrente de broncopneumonia, e as células do revestimento alveolar podem ser diretamente infectadas por vírus. As proteínas surfactantes A (SP-A) e D (SP-D), que são secretadas nos espaços alveolares, são membros da família das colectinas (Cap. 4) e ligam-se aos PAMP de carboidratos da superfície de muitos patógenos. Esses surfactantes estão envolvidos na neutralização viral e na eliminação de micro-organismos provenientes dos espaços aéreos, mas também suprimem respostas inflamatórias e alérgicas no pulmão. Por exemplo, a SP-A inibe a sinalização de TLR2 e de TLR4 e a expressão de citocinas inflamatórias nos macrófagos alveolares, e a SP-A também se liga ao TLR4 e inibe a ligação de lipopolissacarídeo. A SP-A e a SP-D reduzem a atividade fagocitária dos macrófagos alveolares.
Os macrófagos alveolares representam a maioria das células livres no interior dos espaços alveolares. Essas células são funcionalmente distintas dos macrófagos da maior parte dos outros tecidos nos quais mantêm um fenótipo anti-inflamatório. Eles expressam IL-10, óxido nítrico e TGF-β e são fracamente fagocitários, se comparados com os macrófagos residentes de outros tecidos, como baço e fígado. Os macrófagos alveolares inibem as respostas da célula T, bem como a função de apresentação antigênica das DC CD103+ das vias aéreas.
Imunidade Adaptativa no Sistema Respiratório
A imunidade humoral protetora nas vias aéreas é dominada por IgA secretora, como em outros tecidos mucosos, embora a quantidade de IgA secretada seja bem inferior à do trato gastrointestinal. A IgG secretora exerce um papel importante nas vias aéreas superiores. Os locais anatômicos da ativação das células B virgens, da diferenciação e da troca de classe para o isótipo IgA podem variar, mas incluem amígdalas e adenoides na nasofaringe e linfonodos no mediastino e adjacentes aos brônquios nos pulmões. Existem relativamente poucos folículos linfoides agregados ou isolados na lâmina própria das vias aéreas inferiores, quando comparada com o intestino, e provavelmente menos iniciação das respostas imunes humorais nesses locais. O retorno dos plasmócitos secretores de IgA para o tecido aéreo nas proximidades do epitélio da mucosa respiratória depende da quimiocina CCL28, secretada pelo epitélio respiratório, e de seu receptor CCR10, nos plasmócitos. A IgA e a IgG são transportadas para o lúmen das vias aéreas pelo mesmo receptor poli-Ig e pelo mecanismo de FcRn de transporte transcelular observado no intestino. As respostas de IgE aos antígenos aéreos ocorrem com frequência e estão envolvidas nas doenças alérgicas do sistema respiratório, incluindo febre do feno e asma. A IgE desempenha suas funções efetoras inflamatórias quando ligada aos mastócitos, os quais são abundantes nas vias aéreas.
As respostas da célula T no pulmão são iniciadas pela amostragem antigênica das vias aéreas pelas DCs e por sua apresentação para as células T virgens nos linfonodos peribrônquicos e mediastinais. Uma rede de DCs está presente na mucosa das vias aéreas, e essas DCs podem ser subdivididas em subpopulações com base nos marcadores de superfície e localização. As DC CD103+CD11b− estendem seus dendritos entre as células epiteliais brônquicas até o lúmen da via aérea. Essas DC fazem apresentação dos antígenos aéreos, migram para os linfonodos drenantes, apresentam os antígenos processados para as células T virgens e têm a propensão de orientar a diferenciação dessas células T para a subpopulação TH2. As células TH2 retornam para a mucosa brônquica, onde podem ser reativadas por alérgenos apresentados pelas DC da lâmina própria. Essa via é considerada central para o desenvolvimento da asma alérgica (Cap. 19). Outras DC são encontradas na lâmina própria abaixo das células epiteliais, e essas células são principalmente CD103−CD11b+.
Imunidade de Mucosa no Sistema Genitourinário
A defesa imune inata contra invasão e infecção microbianas na mucosa genitourinária recai principalmente sobre o revestimento epitelial, assim como em outras barreiras mucosas. O epitélio escamoso estratificado reveste a mucosa vaginal e a uretra terminal masculina, e uma única camada de epitélio colunar secretor de muco reveste o trato genital feminino superior. O epitélio vaginal contém células de Langerhans, e uma variedade de DC e macrófagos foi descrita abaixo do epitélio na vagina, endocérvice e uretra. Também existem células B e T residentes na mucosa genital. Diferenças no fenótipo das DCs e dos macrófagos na mucosa genital feminina em relação às do trato gastrointestinal podem ser a base para a maior suscetibilidade à infecção de HIV. Há pouca especialização regional do sistema imune adaptativo na mucosa genitourinária, na qual há ausência de importantes tecidos linfoides associados à mucosa. Diferentemente de outras mucosas, nas quais a IgA é o isótipo de anticorpo dominante, a maior parte dos anticorpos nas secreções genitais é constituída de IgG, e cerca de metade disso é produzida pelos plasmócitos na mucosa do trato genital; o restante provém da circulação.
O SISTEMA IMUNE CUTÂNEO
A pele inclui duas camadas principais, a epiderme mais externa, composta principalmente de células epiteliais e separada por uma fina membrana basal, e a derme subjacente, composta de tecido conjuntivo e de estruturas anexas especializadas, tais como os folículos pilosos e as glândulas sudoríparas. No interior de ambas as camadas, uma variedade de diferentes tipos celulares e seus produtos, que compõem o sistema imune cutâneo (Fig. 13-9), proporciona barreira física e ativa as funções de defesa imunológica contra micro-organismos. A pele de um adulto possui cerca de 2 m2 de área e é a segunda maior barreira do corpo contra micro-organismos ambientais e outros materiais estranhos. Apesar disso, dada a sua localização mais externa, a pele normalmente é colonizada por muitos micro-organismos e é frequentemente rompida por traumas e queimaduras. Dessa forma, a pele é a porta de entrada comum para uma ampla variedade de micro-organismos e outras substâncias estranhas e é o local de muitas respostas imunes.
FIGURA 13-9 Componentes celulares do sistema imune cutâneo. Os componentes principais do sistema imune cutâneo mostrados no diagrama esquemático incluem queratinócitos, células de Langerhans e linfócitos intraepiteliais, todos localizados na epiderme; e linfócitos T, DC e macrófagos, localizados na derme.
Respostas Imunes Inatas e Adaptativas na Pele
A epiderme fornece uma barreira física para a invasão microbiana. A epiderme consiste em múltiplas camadas de epitélio escamoso e estratificado, feito quase inteiramente de células epiteliais especializadas denominadas queratinócitos. Os queratinócitos da camada basal, ancorados sobre a membrana basal, estão em contínua proliferação, e as células maduras de sua progênie são deslocadas para o alto e se diferenciam para formar as diversas camadas. Na camada do topo, denominada estrato córneo, as células sofrem morte programada, formando, assim, uma barreira de permeabilidade rica em queratina e lipídeos, que é importante para a proteção contra micro-organismos, bem como contra perigosos agentes físicos e químicos.
Além do seu papel na formação de uma barreira física, os queratinócitos respondem a patógenos e lesões pela produção de peptídeos antimicrobianos, que matam micro-organismos, e diversas citocinas, que promovem e regulam as respostas imunes. Os peptídeos antimicrobianos, que os queratinócitos produzem, incluem defensinas, S100 e catelicidinas (Cap. 4). As citocinas produzidas pelos queratinócitos incluem TNF, IL-1, IL-6 e IL-18, que promovem inflamação; GM-CSF, que induz diferenciação e ativação das DC na epiderme, discutidas posteriormente; e IL-10, que controla as respostas imunes. Os queratinócitos produzem as quimiocinas CCL17, CCL20 e CCL27, que participam do recrutamento de linfócitos que expressam CC4, CCR6 e CCR27. A expressão induzida de defensinas, citocinas e quimiocinas pelos queratinócitos depende dos receptores da imunidade inata, incluindo TLR e NLR. Os queratinócitos expressam a maioria dos TLR e NLRP3, o qual forma o inflamassoma processador de IL-1 (Cap. 4). Os queratinócitos na pele normal sintetizam constitutivamente pró-IL-1 e pró-IL-18. Estímulos como a radiação UV ativam o inflamassoma para processar essas pró-citocinas para suas formas ativas, o que explica a resposta inflamatória à queimadura solar. Quando as vias de transdução de sinal ligadas a respostas inflamatórias, como as vias NF-κB e STAT3, estão geneticamente ativadas apenas em queratinócitos, os camundongos desenvolvem doenças cutâneas inflamatórias, mostrando o potencial dessas células para atuar como componente central das respostas imunes cutâneas.
Diversas populações de DC estão normalmente presentes na pele e contribuem para as respostas imunes inatas e para o início das respostas da célula T a micro-organismos e antígenos ambientais que entram no corpo através da pele. Na epiderme, as DC mais abundantes são as células de Langerhans, que expressam um receptor de lectina do tipo C chamado langerina (CD207) e possuem numerosos grânulos de Birbeck no citoplasma (Fig. 6-4, Cap. 6). Os dendritos das células de Langerhans formam uma densa malha entre os queratinócitos da epiderme. Na derme, existem DC CD103+ que expressam langerina relativamente esparsas, que são uma linhagem distinta das células de Langerhans, e DC langerina-negativas, como as DC plasmocitoides. Cada uma dessas populações de células dendríticas expressa receptores de reconhecimento de padrões para PAMPs, expressos nos micro-organismos, e para padrões moleculares associados a dano (DAMP), expressos nas células danificadas, e as DC respondem secretando citocinas inflamatórias.
As DC cutâneas capturam proteínas estranhas, transportam-nas para os linfonodos drenantes e apresentam os peptídeos processados dessas proteínas para as células T ou passam os antígenos proteicos para outras DC residentes dos linfonodos. Quando as células de Langerhans encontram micro-organismos, elas são ativadas pelo encontro com os receptores semelhantes a Toll (Cap. 6). As células perdem sua adesividade à epiderme, entram nos vasos linfáticos, passam a expressar o receptor de quimiocina CCR7 e migram para as zonas de células T dos linfonodos drenantes em resposta às quimiocinas produzidas nesse local. As células de Langerhans também maturam e tornam-se eficientes células apresentadoras de antígenos. O que ainda não está claro é a contribuição relativa de diferentes subpopulações de DC na pele para o início da resposta da célula T. Os modelos murinos desenvolvidos com DC que expressam langerinas podem ser seletivamente eliminados, e sob as condições adequadas, os camundongos não possuem células de Langerhans, mas possuem DC dérmicas. Utilizando esses modelos, os pesquisadores mostraram que algumas respostas de célula T a proteínas próprias quimicamente modificadas, um modelo para hipersensibilidade de contato, ocorrem na ausência das células de Langerhans. Além disso, as respostas da célula T a certos vírus, incluindo o herpesvírus, dependem das DC CD103+ langerina+, mas não das células de Langerhans. As células de Langerhans parecem ser necessárias para as respostas de TH2 que causam a dermatite atópica (hipersensibilidade de contato e dermatite atópica serão discutidas posteriormente). O papel das diferentes populações de DC cutâneas poderia variar com a dose e o tipo do antígeno e, provavelmente, diferirá entre camundongos e humanos.
A pele normal humana contém muitas células T, 95% das quais possuem um fenótipo de memória. A pele humana contém cerca de 1 milhão de células T/cm2, o que representa cerca de 2 × 1010 células T totais na pele. Aproximadamente 98% dessas células T estão presentes na derme e 2% são linfócitos intraepidérmicos. Os linfócitos T dérmicos (tanto células CD4+ como CD8+) estão predominantemente em uma localização perivascular e geralmente expressam marcadores fenotípicos característicos de células ativadas ou de memória. Não está claro se essas células residem permanentemente no interior da derme ou se estão apenas em trânsito entre os capilares sanguíneos e linfáticos como parte da recirculação das células T de memória. As células T CD4+ de cada subpopulação principal, TH1, TH2, TH17 e Treg, são encontradas na pele. As células TH1 e TH17 são importantes para a defesa de micro-organismos, contra micro-organismos intra e extracelulares, respectivamente, como em outros tecidos. As duas citocinas de assinatura TH17, IL-17 e IL-22 são conhecidas por induzir a expressão de defensinas nos queratinócitos. As células T intraepidérmicas, a maior parte das quais é células CD8+, podem expressar um conjunto mais restrito de receptores antigênicos que os linfócitos T da maioria dos tecidos extracutâneos. Em camundongos (e em algumas outras espécies), muitos linfócitos intraepidérmicos são células T que expressam o receptor de célula T para antígeno do tipo γδ.
Na pele, as células T expressam moléculas de localização residente que direciona sua migração para fora dos microvasos dérmicos (Fig. 13-10). A migração das células T efetoras ou de memória para a pele depende da expressão do antígeno de linfócito cutâneo (CLA) pelas células T, o qual é um carboidrato ligante de E-selectina e presente em metade das diversas glicoproteínas da membrana plasmática da célula endotelial. Além disso, a expressão pela célula T de CCR4 e CCR10, que se ligam às quimiocinas CCL17 e CCL27, respectivamente, também é necessária para o tráfego da célula T à pele. As propriedades de localização cutânea das células T são impressas durante a ativação nos linfonodos drenantes da pele, por um processo análogo ao da impressão das propriedades de localização intestinal das células T nos linfonodos mesentéricos, discutido anteriormente. Quando as células T virgens reconhecem os antígenos apresentados pelas DC nos linfonodos drenantes da pele, elas recebem sinais dessas DC que não somente induzem sua proliferação e diferenciação em células efetoras, mas também induzem a expressão de moléculas de localização cutânea CLA, CCR4 e CCR10. De forma interessante, a luz solar e a vitamina D parecem exercer um papel importante na migração das células T para a pele, análogo ao papel da vitamina A e seu metabólito, ácido retinoico, na migração de linfócitos para o intestino. Os raios UVB na luz solar agem sobre o 7-desidrocolesterol produzido na camada basal da epiderme e convertem-no em pré-vitamina D3. As DC da derme expressam vitamina D3-hidroxilases que convertem a pré-vitamina D3 em sua forma ativa, 1,25(OH)2D3. Quando as DC apresentam antígenos às células T, o 1,25(OH)2D3 ativo é liberado, entra nas células T, transloca-se para o núcleo e ativa a transcrição de CCR10. O 1,25(OH)2D3 produzido nas DC da derme podem ser transportados na forma livre ou migrar no interior das DCs para os linfonodos drenantes da pele. No linfonodo, o 1,25(OH)2D3 induz a expressão de CCR10 nas células T virgens ativadas pelas DC apresentadoras de antígenos. A IL-12 proveniente das DC participa na indução de CLA. CCR4 também é regulado positivamente e a integrina de localização intestinal α4β7 é regulada negativamente, ambas por sinais desconhecidos, durante a ativação da célula T nos linfonodos drenantes da pele. Assim, as células T virgens ativadas nesses linfonodos serão diferenciadas em células T efetoras que retornarão, preferencialmente, para a pele. O 1,25(OH)2D3 também pode atuar localmente no interior da derme sobre as células T efetoras e de memória, regulando positivamente CCR10 e promovendo a migração de células T para a epiderme, porque o ligante de CCR10, CCL27, é feito pelos queratinócitos.
FIGURA 13-10 Propriedades de localização dos linfócitos na pele. As propriedades de localização cutânea de linfócitos efetores são impressas nos linfonodos drenantes da pele, onde essas células sofreram diferenciação de precursores virgens. O precursor de vitamina D, 7-desidrocolesterol, produzido na camada basal da epiderme é convertido em 1,25(OH)2D3 (vitamina D ativa) por ações sequenciais dos raios ultravioleta na luz solar (UVB) e hidroxilases das células dendríticas da derme. Durante a ativação das células T virgens pelas células dendríticas nos linfonodos drenantes, 1,25(OH)2D3 induz a expressão de CCR10, IL-12 induz a expressão do antígeno de linfócito cutâneo (CLA) ligante de E-selectina, e outros sinais induzem a expressão de CCR4. As células T efetoras diferenciadas entram na circulação, e as moléculas de localização que elas expressam agora direcionam a migração para fora das vênulas na pele devido à expressão de E-selectina no endotélio das vênulas e à produção de CCL27 e CCL17 (os ligantes de CCR10 e de CCR4) na pele.
Doenças Relacionadas às Respostas Imunes na Pele
Existem muitas doenças inflamatórias diferentes que são causadas por respostas imunes desreguladas e inadequadamente direcionadas na pele. Discutiremos dois exemplos selecionados dessas doenças. Além dessas doenças inflamatórias, existem vários linfomas malignos que afetam primariamente a pele. A maior parte deles deriva das células T residentes na pele.
Psoríase, um distúrbio inflamatório crônico da pele, caracterizado por placas descamantes avermelhadas, é causada por respostas imunes inatas e mediadas pela célula T, disparadas por diversos estímulos ambientais. As DC são centrais na patogênese, e a redução do número de DC cutâneas pelo tratamento com o composto químico absorvente de luz ultravioleta A (UVA), psoraleno, acrescido de luz ultravioleta (terapia PUVA), reduz as manifestações da doença. Há evidência de que a psoríase seja iniciada quando o trauma ou infecção induzem a produção da catelicidina LL-37 pelos queratinócitos, que formam complexos com o DNA do hospedeiro e, então, ativam as DC plasmocitoides na pele através do TLR9. As DC plasmocitoides ativadas produzem IFN-α abundantemente e a pele psoriática possui uma forte assinatura de interferon do tipo I (i. e., a expressão de muitos genes induzíveis por interferon). Um dos efeitos do IFN-α é a ativação de outras DCs que são induzidas a migrar para os linfonodos, ativar as células T auxiliares de especificidade antigênica desconhecida e induzir sua diferenciação em células T efetoras de localização cutânea. Essas células T circulam para a derme e ainda promovem uma cascata inflamatória e proliferação persistente dos queratinócitos. As células TH1 e TH17 têm sido implicadas nessa fase da doença. Várias terapias que foram aprovadas ou estão em testes clínicos têm como alvo a migração da célula T e as citocinas que direcionam a diferenciação para TH1 e TH17 (IL-12, IL-23) ou são produzidas por essas células T (IL-17, IL-22, TNF). Uma questão central não resolvida acerca dessa doença é a identificação dos antígenos reconhecidos pelas células T.
A dermatite atópica é uma doença inflamatória crônica da pele caracterizada por erupções pruriginosas, nas quais a IgE específica a antígenos ambientais e as células que expressam receptores Fc de alta afinidade para IgE (Fc RI) exercem um papel central. A ligação cruzada do FcεRI nos mastócitos mediada pelo antígeno é importante em muitas doenças alérgicas, como será discutido em detalhes no Capítulo 19, e os mastócitos estão implicados na patogênese da dermatite atópica. Além disso, o FcεRI é expresso nas DC cutâneas, incluindo células de Langerhans e DC plasmocitoides, e a ativação das DC também exerce um papel central na dermatite atópica, como na psoríase. No entanto, acredita-se que, na dermatite atópica, a resposta das DC à sinalização de TLR seja influenciada pela sinalização do FcεRI e pela citocina estromal tímica linfopoietina (TSLP), produzida por queratinócitos, levando a uma resposta inicial TH2. A base da cascata inflamatória da dermatite atópica pode ser a sensibilidade geneticamente determinada aos antígenos ambientais, talvez por causa da função prejudicada de barreira epitelial.
TECIDOS IMUNOPRIVILEGIADOS
As respostas imunes e a inflamação associada em certas partes do corpo, incluindo cérebro, olhos, testículos, placenta e feto, correm alto risco de disfunção orgânica letal ou falha reprodutiva. Esses tecidos, desenvolvidos para estar protegidos, em graus variados, das respostas imunes, são denominados sítios imunoprivilegiados. O imunologista Sir Peter Medawar, homenageado com o prêmio Nobel, cunhou o termo imunoprivilégio nos anos 1940 para descrever a falta de respostas imunes a tecidos transplantados no cérebro ou na câmara anterior do olho de animais experimentais. Os antígenos estranhos que poderiam provocar uma resposta imune na maior parte dos tecidos são frequentemente tolerados nesses sítios imunoprivilegiados. Os mecanismos subjacentes ao imunoprivilégio variam entre esses tecidos e não estão completamente elucidados. Alguns dos mecanismos são similares aos mecanismos de regulação no intestino e pele discutidos anteriormente neste capítulo e aos mecanismos de autotolerância discutidos no Capítulo 14. Nesta seção do capítulo, discutiremos algumas das características que distinguem o imunoprivilégio nos diferentes tecidos.
Imunoprivilégio no Olho, Cérebro e Testículos
O Olho
A visão, que é essencial para a sobrevivência da maior parte dos mamíferos, pode ser facilmente prejudicada por uma inflamação no interior do olho. Os mecanismos desenvolvidos que minimizam a probabilidade de respostas imunes e inflamação no olho foram inteiramente descritos, em sua maior parte, na câmara anterior, um espaço preenchido por líquido entre a córnea transparente à frente e a íris e o cristalino atrás. A inflamação dessa câmara poderia levar à opacificação da córnea transparente e do cristalino, com perda da visão. Ao menos algumas das propriedades do imunoprivilégio estudadas na câmara anterior também se aplicam a outros sítios oculares, como a cavidade vítrea e o espaço sub-retinal. As características anatômicas da câmara anterior que contribuem para o imunoprivilégio incluem as junções de oclusão e a resistência a vazamentos dos vasos sanguíneos nos tecidos adjacentes à câmara anterior (a tão conhecida barreira hemato-ocular), a natureza avascular da córnea e a ausência de linfáticos drenando a câmara anterior, o que limita o acesso do sistema imune adaptativo a antígenos no olho. Existem vários fatores solúveis com propriedades imunossupressoras/anti-inflamatórias no humor aquoso que preenche a câmara anterior, incluindo neuropeptídeos (hormônio estimulador de α-melanócitos, peptídeo vasointestinal, somatostatina), TGF-β e indolamina 2,3-dioxigenase. As células que revestem a câmara anterior, incluindo o epitélio da íris e o endotélio, expressam constitutivamente Fas-ligante e PD-L1, que podem, respectivamente, induzir morte ou inativação das células T.
O desvio imunológico associado à câmara anterior é um fenômeno no qual a introdução de um antígeno proteico estranho na porção anterior do olho induz ativamente tolerância sistêmica àquele antígeno. Esse fenômeno presumivelmente reduz a chance de respostas imunes adaptativas serem montadas para antígenos estranhos que podem estar localizados no olho. A tolerância é detectável como uma resposta inflamatória, de anticorpos ou de célula T, diminuída para o mesmo antígeno, quando esta é introduzida em locais extraoculares, comparada com a resposta em indivíduos que receberam o antígeno por via intraocular. O desvio imunológico associado à câmara anterior pode ser mediado por Treg. Estudos em camundongos mostram que o antígeno introduzido na câmara anterior é transportado por macrófagos ou DC, através do sangue, para o baço e apresentado por células B esplênicas a células T virgens, induzindo a geração de células T reguladoras específicas para o antígeno.
Em contraste com a tolerância induzida a antígenos estranhos introduzidos na câmara anterior, os autoantígenos do olho ficam isolados do sistema imune e a tolerância sistêmica a esses antígenos não é induzida. Essa falta de tolerância torna-se um problema somente quando um trauma ocular expõe os antígenos do olho ao sistema imune. Um exemplo impressionante disso é a oftalmia simpática, na qual o trauma a um olho provoca a liberação dos antígenos do olho, levando à doença autoimune em ambos os olhos, o lesionado e o intacto. Presumivelmente, embora os autoantígenos no olho normal estejam inacessíveis ao sistema imune extraocular para induzir tolerância, as células efetoras imunes ativadas e os anticorpos que são gerados na periferia quando um olho sofre dano ganham acesso ao olho normal e causam lesão no mesmo.
O Cérebro
A inflamação no cérebro pode levar a perturbação funcional e morte de neurônios, com consequências desastrosas. As características anatômicas do cérebro que prejudicam o início de uma imunidade adaptativa ao antígeno incluem ausência de drenagem linfática funcional e escassez de DC. A distribuição de células imunes e de mediadores inflamatórios para o cérebro é prejudicada pela natureza das junções de oclusão entre as células endoteliais microvasculares cerebrais (a tão conhecida barreira hematoencefálica). Alguns dos mecanismos que ocorrem nos olhos também podem se aplicar ao cérebro, incluindo a ação de neuropeptídeos. O cérebro é rico em macrófagos residentes, chamados de micróglia, os quais se tornam ativados em resposta a dano tecidual ou infecções no cérebro. O limiar para sua ativação, no entanto, pode ser mais alto que aquele exigido por macrófagos de outros tecidos. Um mecanismo opcional para a manutenção desse limiar alto é a sinalização inibidora realizada pelo receptor CD200, expresso pela micróglia. O ligante para esse receptor, CD200, é altamente expresso nos neurônios cerebrais e em outros tipos celulares.
Ao contrário das suposições comuns previamente baseadas em experimentos clássicos, há evidências de que a vigilância imunológica contra micro-organismos não ocorra no sistema nervoso central. Por exemplo, a frequência de algumas infecções oportunistas dentro do cérebro aumenta em pacientes imunossuprimidos. Pacientes tratados com certos anticorpos monoclonais que bloqueiam a adesão de linfócitos e de monócitos às células endoteliais apresentam risco significativamente aumentado, embora ainda pequeno, de ativação do vírus JC latente, levando a uma doença do sistema nervoso central uniformemente letal, chamada leucoencefalopatia multifocal progressiva. Os achados sugerem que o tráfego da célula T ou do monócito para o cérebro é necessário para manter os vírus latentes em constante controle e argumentam que o cérebro não é estritamente um sítio de imunoprivilégio.
Os Testículos
O imunoprivilégio nos testículos serve para limitar a inflamação que pode prejudicar a fertilidade masculina. Muitos autoantígenos nos testículos adultos são expressos, pela primeira vez, no momento da puberdade, bem depois do desenvolvimento de um sistema imune competente, o que pode incluir células T e B precursoras específicas para antígenos testiculares. Dessa forma, o imunoprivilégio nos testículos também pode servir para prevenir autoimunidade. Os testículos, como o olho e o cérebro, possuem uma barreira hematotecidual com junções de oclusão endoteliais especializadas que limitam a liberação de células e de moléculas para os locais de espermatogênese. O meio hormonal dos testículos, que é rico em andrógenos, possui uma influência anti-inflamatória sobre macrófagos. TGF-β é produzido por células de Leydig, de Sertoli e peritubulares e, provavelmente, contribui para a supressão imune local.
Imunoprivilégio em Fetos de Mamíferos
O feto de mamíferos expressa genes herdados paternamente que são alogênicos aos da mãe, mas os fetos não são rejeitados pelas mães. Em essência, o feto é um alotransplante de ocorrência natural, mas que é protegido da rejeição ao transplante. É claro que a mãe é exposta aos antígenos fetais durante a gestação, porque os anticorpos maternos contra as moléculas de CHP paternas são facilmente detectáveis. Obviamente, houve uma pressão seletiva muito forte que levou à evolução de mecanismos que protegem o feto do sistema imune materno, ainda que esses mecanismos permaneçam muito mal compreendidos. Provavelmente, muitas características de barreira e de diferentes moléculas especiais da placenta contribuem para isso, juntamente com a imunossupressão local.
Diversas observações experimentais indicam que a localização anatômica do feto é um fator essencial na ausência de rejeição. Por exemplo, animais gestantes são capazes de reconhecer e rejeitar alotransplantes singênicos ao feto colocado em locais extrauterinos, sem comprometimento da sobrevivência fetal. Blastocistos fetais completamente alogênicos que não possuem genes maternos podem sobreviver com sucesso em uma mãe gestante ou pseudogestante. Assim, nem os genes específicos maternos nem os paternos são necessários para a sobrevivência do feto. A hiperimunização da mãe com células que possuem antígenos paternos não compromete a placenta e o crescimento fetal.
A falha na rejeição ao feto recebeu atenção, com o foco na região de contato físico entre a mãe e o feto. Os tecidos fetais da placenta que estão em contato mais íntimo com a mãe são compostos de trofoblastos vasculares, que se infiltram difusamente no revestimento uterino (decídua), com o objetivo de ancorar a placenta à mãe.
Uma simples explicação para a sobrevivência fetal é que as células do trofoblasto não conseguem expressar as moléculas de CHP paternas. Moléculas de classe II não foram detectadas nos trofoblastos. Nos camundongos, os trofoblastos de implantação, mas não os trofoblastos vasculares, expressam moléculas do CHP classe I paternas. Em humanos, a situação pode ser mais complexa, uma vez que células de trofoblasto expressam apenas uma molécula não polimórfica de classe IB, denominada HLA-G. Essa molécula pode estar envolvida na proteção da célula trofoblástica da lise mediada por células NK maternas. Uma subpopulação de células NK especializadas, chamadas células NK uterinas, é o tipo principal de linfócito presente nos sítios de implantação, e a produção de IFN-γ por essas células é essencial para o desenvolvimento decidual. A maneira pela qual as células NK uterinas são estimuladas e o seu papel nas respostas maternas aos aloantígenos fetais não são conhecidos. Mesmo se as células de trofoblasto expressarem moléculas do CHP clássico, elas podem não apresentar moléculas coestimulatórias e não conseguem atuar como células apresentadoras de antígenos.
A decídua uterina pode ser um local onde as respostas imunes ficam funcionalmente inibidas. Essa ideia é sustentada pela observação de que a decídua murina é altamente suscetível à infecção por Listeria monocytogenes e não consegue suportar uma resposta de hipersensibilidade do tipo tardia. A base do imunoprivilégio claramente não é uma simples barreira anatômica, porque o sangue materno se encontra em extenso contato com o trofoblasto. Mais ainda, é provável que a barreira seja criada por inibição funcional. O cultivo de células decíduas inibe diretamente as funções dos macrófagos e das células T, talvez pela produção de citocinas inibitórias, como o TGF-β. Algumas dessas células decíduas inibitórias podem ser células T reguladoras residentes, embora haja evidências limitadas disso. Alguns estudos sugerem que as citocinas TH2 sejam produzidas na interface materno-fetal e sejam responsáveis pela supressão localizada das respostas TH1 aos antígenos fetais. No entanto, essa ideia não é sustentada pelos achados de que camundongos geneticamente deficientes para IL-4 e IL-10 apresentam gestações normais. Existe expansão da Treg sistêmica e decídua em mães durante a gestação, e o feto contém abundantes células T reguladoras.
As respostas imunes ao feto podem ser reguladas por concentrações locais de triptofano e seus metabólitos na decídua. A enzima indolamina 2,3-dioxigenase (IDO) cataboliza o triptofano, e o fármaco inibidor de IDO 1-metiltriptofano induz aborto em camundongos de uma maneira dependente da célula T. Essas observações levam à hipótese de que as respostas da célula T ao feto são normalmente bloqueadas porque as concentrações de triptofano na decídua são mantidas baixas ou as concentrações dos metabólitos tóxicos são altas.
Diversos outros mecanismos também podem arrefecer a resposta imune materna ao feto, incluindo expressão de Fas-L pelas células trofoblásticas fetais que promovem a apoptose de linfócitos maternos ativados que expressam Fas, geração de DC tolerogênicas em resposta à galectina-1 expressa na decídua, e prejuízo na migração das DC do útero para os linfonodos.
O trofoblasto e a decídua também podem ser resistentes ao dano mediado por complemento. Nos camundongos, esses tecidos expressam um inibidor de C3 e de C4 chamado Crry. Embriões deficientes em Crry morrem antes do nascimento e há evidências de ativação do complemento nas células trofoblásticas. Portanto, esse inibidor pode bloquear os aloanticorpos maternos e o dano mediado por complemento. No entanto, Crry ou moléculas equivalentes não foram encontradas em humanos.
• Os sistemas imunes regionais são coleções especializadas de células e tecidos imunes inatos e adaptativos em localizações anatômicas particulares, os quais desempenham funções protetoras e reguladoras que são singulares nesses locais. Os principais sistemas imunes regionais estão no trato gastrointestinal e na pele, que, juntos, protegem contra a invasão microbiana através de uma enorme área de superfície de exposição ao ambiente.
• O sistema imune gastrointestinal deve lidar com a presença de trilhões de bactérias comensais no lúmen intestinal por meio da prevenção de sua invasão e tolerância de sua presença no lúmen, enquanto também precisa identificar e responder a organismos patogênicos numericamente raros.
• A imunidade inata no sistema gastrointestinal é parcialmente mediada pelas células do revestimento epitelial mucoso, que dificulta a invasão microbiana pelas junções de oclusão intercelulares, pela secreção de muco, o qual impede a adesão microbiana às células de revestimento, e pela produção de moléculas antimicrobianas, como as defensinas. As células efetoras da imunidade inata na lâmina própria incluem macrófagos, DC e mastócitos. Os linfócitos intraepiteliais, incluindo células T γδ, também proporcionam defesa inata contra os micro-organismos geralmente encontrados na barreira epitelial intestinal. Características anatômicas especializadas da imunidade adaptativa no trato intestinal incluem conjuntos de tecidos linfoides imediatamente abaixo do revestimento epitelial, que compreendem os tecidos linfoides associados ao intestino (GALT), incluindo as amígdalas orofaríngeas, as placas de Peyer no íleo e um conjunto semelhante no cólon. As células M no revestimento epitelial coletam amostras de antígenos no lúmen e as transportam para as células apresentadoras de antígeno no GALT. As DC da lâmina própria estendem processos através das células de revestimento epitelial intestinal para colher amostras de antígenos no lúmen. Também existem linfócitos efetores difusos na lâmina própria do intestino e nos linfonodos mesentéricos, onde muitas das respostas imunes adaptativas na parede do intestino são iniciadas.
• Os linfócitos B e T efetores que se diferenciam de células T virgens no GALT ou nos linfonodos mesentéricos entram na circulação e seletivamente migram de volta para a lâmina própria intestinal. Essa localização específica do tecido ocorre devido a sinais que as células T virgens recebem das DC no GALT e nos linfonodos mesentéricos, incluindo ácido retinoico derivado da vitamina A dietética, que induz a expressão de receptores de quimiocinas e moléculas de adesão nas células efetoras diferenciadas, o que favorece o retorno para o intestino.
• A imunidade humoral no trato gastrointestinal é dominada pela secreção de IgA no lúmen, onde os anticorpos neutralizam potencialmente os patógenos invasores. As células B no GALT e nos linfonodos mesentéricos diferenciam-se em plasmócitos secretores de IgA sob a influência de TGF-β, BAFF e outras citocinas, através de mecanismos dependentes e independentes de T, e os plasmócitos migram para a lâmina própria, abaixo da barreira epitelial, e secretam IgA. A IgA dimerizada é transportada através do epitélio pelo receptor poli-Ig e liberada no lúmen. A IgA também é secretada no leite materno e medeia a imunidade passiva no intestino de bebês lactentes.
• As células TH17 exercem um papel dominante na imunidade mediada por célula T no trato intestinal, em parte porque a IL-17 e a IL-22, que elas secretam, aumentam a função de barreira epitelial. As células TH2 são importantes na defesa contra parasitas intestinais. Alterações na microbiota bacteriana podem influenciar o equilíbrio entre as respostas das diferentes subpopulações de células T auxiliares, seja no intestino ou sistemicamente por todo o sistema imune adaptativo.
• As respostas imunes aos organismos comensais e antígenos alimentares no lúmen do trato intestinal são minimizadas por uma variedade de mecanismos, incluindo expressão seletiva de receptores de reconhecimento de padrões no citoplasma e nas superfícies basolaterais das células de revestimento epitelial e apresentação de antígenos microbianos luminais pelas DC, as quais são especializadas em induzir Treg que, por sua vez, suprime as respostas imunes adaptativas. Diversas citocinas são essenciais para manter a homeostasia imunológica na parede intestinal, incluindo TGF-β, IL-10 e IL-12. A tolerância sistêmica a alguns antígenos pode ser induzida ao se administrar os antígenos na alimentação dos camundongos, um fenômeno conhecido como tolerância oral.
• Diversas doenças intestinais estão relacionadas a respostas imunes anormais, incluindo as doenças inflamatórias intestinais (doença de Crohn e colite ulcerativa), nas quais as respostas imunes inatas e adaptativas à microbiota intestinal normal não são adequadamente reguladas, e a doença celíaca, na qual ocorrem respostas humorais e mediadas por células ao glúten proveniente do trigo dietético.
• A imunidade de mucosa no sistema respiratório realiza a defesa contra patógenos de origem aérea e é a causa das doenças alérgicas das vias aéreas, como a asma. A imunidade inata na árvore brônquica depende do revestimento epitelial ciliado, que secreta muco e defensinas e movimenta o muco com os micro-organismos capturados para fora dos pulmões. As proteínas surfactantes e os macrófagos alveolares cumprem funções antimicrobianas e anti-inflamatórias. Como nos intestinos, os mecanismos reguladores, incluindo Treg e citocinas imunossupressoras, são importantes para a prevenção de respostas prejudiciais a organismos não patogênicos ou outros antígenos inalados.
• O sistema imune cutâneo realiza a defesa contra a invasão microbiana através da pele e suprime respostas contra numerosos organismos comensais. A camada epitelial escamosa queratinizada mais externa das multicamadas, chamada de epiderme, realiza funções de defesa imune inata, proporcionando uma barreira física à invasão microbiana. Os queratinócitos secretam defensina e citocinas inflamatórias em resposta a vários PAMP e DAMP. A derme contém uma população mista de mastócitos, macrófagos e DC, que respondem a micro-organismos e injúria e medeiam as respostas inflamatórias.
• As DC são abundantes na pele e medeiam as respostas imunes inatas. Essas DC também transportam antígenos microbianos e ambientais, que entram através da pele para os linfonodos drenantes, onde iniciam as respostas de célula T. As células de Langerhans são o principal tipo de DC na epiderme e há diversas subpopulações de DC dérmicas diferentes. As DC derivadas da pele fornecem sinais, incluindo a vitamina D, para as células T virgens que elas ativam nos linfonodos drenantes, induzindo a produção de quimiocinas e moléculas de adesão que favorecem a localização de retorno das células T efetoras na pele.
• Uma fração significativa das células T do corpo está presente na pele. A maior parte dessas células é formada de células T efetoras ou de memória CD4+ ou CD8+ e se encontra na derme. As células TH1, TH2 e TH17 são importantes para a defesa contra diferentes tipos de patógenos invasores da pele, e as células TH1 e TH17 também contribuem para dermatoses inflamatórias, como a psoríase.
• Os locais imunoprivilegiados, que são tecidos onde as respostas imunes não são prontamente iniciadas, incluem o cérebro, a câmara anterior do olho e os testículos. Os mecanismos de privilégio imunológico incluem as junções de oclusão das células endoteliais dos vasos sanguíneos desses locais, a produção local de citocinas imunossupressoras e a expressão de moléculas de superfície celular que inativam ou matam os linfócitos.
• Os mamíferos desenvolveram mecanismos que evitam a rejeição imunológica materna do feto em desenvolvimento, o qual invariavelmente expressa antígenos paternos que são alogeneicos para a mãe. Esses mecanismos parecem atuar localmente na interface materno-fetal da placenta, uma vez que não ocorre tolerância sistêmica materna aos aloantígenos paternos. Os possíveis mecanismos incluem ausência de expressão de CHP nos trofoblastos fetais, expressão de citocinas imunossupressoras, ações da Treg, e depleção de triptofano mediada pela indolamina 2,3-dioxigenase local, necessária para o crescimento do linfócito.
Brandtzaeg P. Mucosal immunity: induction, dissemination, and effector functions. Scandinavian Journal of Immunology. 2009;70:505-515.
Doss M, White MR, Tecle T, Hartshorn KL. Human defensins and LL-37 in mucosal immunity. Journal of Leukocyte Biology. 2010;87:79-92.
Dubin PJ, Kolls JK. Th17 cytokines and mucosal immunity. Immunological Reviews. 2008;226:160-171.
Sistema Imune Gastrointestinal, Geral
Duerkop BA, Vaishnava S, Hooper LV. Immune responses to the microbiota at the intestinal mucosal surface. Immunity. 2009;31:368-376.
Eberl G, Lochner M. The development of intestinal lymphoid tissues at the interface of self and microbiota. Mucosal Immunology. 2009;2:478-485.
Garrett WS, Gordon JI, Glimcher LH. Homeostasis and inflammation in the intestine. Cell. 2010;140:859-870.
Hooper LV, Macpherson AJ. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nature Reviews Immunology. 2010;10:159-169.
Respostas Imunes Inatas no Sistema Imune Gastrointestinal
Abreu MT. Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal function. Nature Reviews Immunology. 2010;10:131-144.
Corr SC, Gahan CC, Hill C. M-cells: origin, morphology and role in mucosal immunity and microbial pathogenesis. FEMS Immunology and Medical Microbiology. 2008;52:2-12.
Dommett R, Zilbauer M, George JT, Bajaj-Elliott M. Innate immune defence in the human gastrointestinal tract. Molecular Immunology. 2005;42:903-912.
Células Apresentadoras de Antígenos e Respostas da Célula T no Sistema Imune Gastrointestinal
Barnes MJ, Powrie F. Regulatory T cells reinforce intestinal homeostasis. Immunity. 2009;31:401-411.
Johansson-Lindbom B, Agace WW. Generation of gut-homing T cells and their localization to the small intestinal mucosa. Immunological Reviews. 2007;215:226-242.
Maynard CL, Weaver CT. Intestinal effector T cells in health and disease. Immunity. 2009;31:389-400.
Rescigno M, Di Sabatino A. Dendritic cells in intestinal homeostasis and disease. The Journal of Clinical Investigation. 2009;119:2441-2450.
Varol C, Zigmond E, Jung S. Securing the immune tightrope: mononuclear phagocytes in the intestinal lamina propria. Nature Reviews Immunology. 2010;10:415-426.
Produção de Anticorpos no Sistema Imune Gastrointestinal
Cerutti A, Rescigno M. The biology of intestinal immunoglobulin A responses. Immunity. 2008;28:740-750.
Fagarasan S, Kawamoto S, Kanagawa O, Suzuki K. Adaptive immune regulation in the gut: T cell–dependent and T cell–independent IgA synthesis. Annual Review of Immunology. 2010;28:243-273.
Macpherson AJ, McCoy KD, Johansen FE, Brandtzaeg P. The immune geography of IgA induction and function. Mucosal Immunology. 2008;1:11-22.
Mora JR, von Andrian UH. Differentiation and homing of IgA-secreting cells. Mucosal Immunology. 2008;1:96-109.
Doenças do Sistema Imune Gastrointestinal
Jabri B, Sollid LM. Tissue-mediated control of immunopathology in coeliac disease. Nature Reviews Immunology. 2009;9:858-870.
Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annual Review of Immunology. 2010;28:573-621.
Sistema Imune de Mucosa Respiratória
Holt PG, Strickland DH, Wikstrom ME, Jahnsen FL. Regulation of immunological homeostasis in the respiratory tract. Nature Reviews Immunology. 2008;8:142-152.
Lambrecht BN, Hammad H. Biology of lung dendritic cells at the origin of asthma. Immunity. 2009;31:412-424.
Wissinger E, Goulding J, Hussell T. Immune homeostasis in the respiratory tract and its impact on heterologous infection. Seminars in Immunology. 2009;21:147-155.
Clark RA. Skin-resident T cells: the ups and downs of on site immunity. Journal of Investigative Dermatology. 2010;130:362-370.
Kupper TS, Fuhlbrigge RC. Immune surveillance in the skin: mechanisms and clinical consequences. Nature Reviews Immunology. 2004;4:211-222.
Metz M, Maurer M. Innate immunity and allergy in the skin. Current Opinion in Immunology. 2009;21:687-693.
Nestle FO, Di Meglio P, Qin JZ, Nickoloff BJ. Skin immune sentinels in health and disease. Nature Reviews Immunology. 2009;9:679-691.
Romani N, Clausen BE, Stoitzner P. Langerhans cells and more: langerin-expressing dendritic cell subsets in the skin. Immunological Reviews. 2010;234:120-141.
Outros Sistemas Imunes Especializados
Erlebacher A. Why isn’t the fetus rejected? Current Opinion in Immunology. 2001;13:590-593.
Streilein JW. Ocular immune privilege: the eye takes a dim but practical view of immunity and inflammation. Journal of Leukocyte Biology. 2003;74:179-185.
Trowsdale J, Betz AG. Mother’s little helpers: mechanisms of maternal-fetal tolerance. Nature Immunology. 2006;7:241-246.
von Rango U. Fetal tolerance in human pregnancy—a crucial balance between acceptance and limitation of trophoblast invasion. Immunology Letters. 2008;115:21-32.