CAPÍTULO 17 Imunidade Tumoral
O câncer é um importante problema de saúde em todo o mundo e uma das causas mais relevantes de morbidade e mortalidade em crianças e adultos. Os cânceres surgem da proliferação e disseminação descontroladas de clones de células malignamente transformadas. A letalidade de tumores malignos é determinada, em grande parte, por sua atividade proliferativa desregulada, pela resistência das células tumorais à morte apoptótica e pela capacidade das células tumorais de invadir os tecidos do hospedeiro e metastatizar para locais distantes. A possibilidade de que cânceres possam ser erradicados por respostas imunológicas específicas foi o ímpeto para uma grande quantidade de trabalhos no campo da imunologia tumoral. O conceito de vigilância imunológica, proposto por Macfarlane Burnet na década de 1950, afirma que uma função fisiológica do sistema imunológico é reconhecer e destruir clones de células transformadas antes que eles se transformem em tumores e destruam os tumores depois de já formados. A existência da vigilância imunológica foi demonstrada pela maior incidência de alguns tipos de tumores em humanos e em animais experimentais imunocomprometidos. Embora a importância geral da vigilância imunológica tenha sido controversa, está claro agora que os sistemas imunológicos natural e adaptativo de fato reagem contra muitos tumores, e o aproveitamento dessas reações para destruir tumores de forma específica continua sendo um importante objetivo dos imunologistas. Neste capítulo, descrevemos os tipos de antígenos que são expressos por tumores malignos, como o sistema imunológico reconhece e responde a esses antígenos, como os tumores evadem o sistema imunológico do hospedeiro, e as aplicações de abordagens imunológicas para o tratamento do câncer.
ASPECTOS GERAIS DA IMUNIDADE TUMORAL
Várias características dos antígenos tumorais e das respostas imunológicas aos tumores são fundamentais para a compreensão da imunidade tumoral e para o desenvolvimento de estratégias de imunoterapia contra o câncer.
• Tumores estimulam respostas imunológicas específicas, adaptativas. Observações clínicas e experimentos com animais comprovaram que, apesar de as células tumorais serem derivadas de células do hospedeiro, os tumores provocam respostas imunológicas. Estudos histopatológicos mostram que muitos tumores são circundados por infiltrados de células mononucleares compostos de linfócitos T, células assassinas naturais (natural killer – NK) e macrófagos, e que linfócitos e macrófagos ativados encontram-se presentes nos linfonodos, drenando os locais de crescimento tumoral (Fig. 17-1). A presença de linfócitos infiltrados em alguns tipos de melanomas e carcinomas do cólon e no câncer de mama indica um melhor prognóstico. A primeira demonstração experimental de que tumores são capazes de induzir respostas imunológicas protetoras veio de estudos de tumores transplantados realizados na década de 1950 (Fig. 17-2). Um sarcoma pode ser induzido em um camundongo isogênico pincelando-se sua pele com o carcinógeno químico metilcolantreno (MCA). Se o tumor induzido por MCA for excisado e transplantado em outro camundongo singênico, o tumor cresce. Em contrapartida, se o tumor for transplantado de volta para o hospedeiro original, o camundongo rejeita o tumor. O mesmo camundongo que havia se tornado imune ao seu tumor não é capaz de rejeitar tumores induzidos por MCA em outros camundongos. Além disso, as células T do animal portador do tumor podem transferir a imunidade protetora contra o tumor para outro animal livre de tumores. Assim, respostas imunológicas contra tumores apresentam as características que definem a imunidade adquirida, a saber, especificidade e memória, e são a função mais importante dos linfócitos. Como previsto destes experimentos de transplantes, a resposta mais eficaz contra tumores parece ser mediada principalmente pelos linfócitos T.
• As respostas imunológicas frequentemente falham na prevenção do crescimento de tumores. Pode haver diversas razões para a imunidade antitumoral não conseguir erradicar as células transformadas. Primeiro, as células tumorais derivam de células do hospedeiro e se parecem com as células normais em muitos aspectos. Portanto, a maioria dos tumores tende a ser fracamente imunogênica. Tumores que provocam respostas imunológicas fortes incluem aqueles induzidos por vírus oncogênicos, nos quais as proteínas virais são antígenos estranhos, e tumores induzidos em animais por carcinógenos potentes (como o metilcolantreno), que frequentemente causam mutações em genes celulares normais. Muitos tumores espontâneos provocam imunidade fraca ou mesmo indetectável, e estudos desses tumores levaram a um considerável ceticismo quanto ao conceito de vigilância imunológica. Atualmente é evidente que a importância da vigilância imunológica e da imunidade tumoral varia conforme o tipo de tumor. Segundo, o crescimento e disseminação rápidos do tumor podem superar a capacidade do sistema imunológico de controlar eficazmente um tumor, o que exige que todas as células malignas sejam eliminadas. Terceiro, muitos tumores têm mecanismos especializados para evadir as respostas imunológicas do hospedeiro. Retornaremos a esses mecanismos mais adiante no capítulo.
• O sistema imunológico pode ser ativado por estímulos externos para destruir células tumorais e erradicar tumores eficazmente. Como veremos no final do capítulo, essa descoberta impulsionou novos caminhos na imunoterapia tumoral, na qual a potencialização das respostas antitumorais do hospedeiro é o objetivo do tratamento.
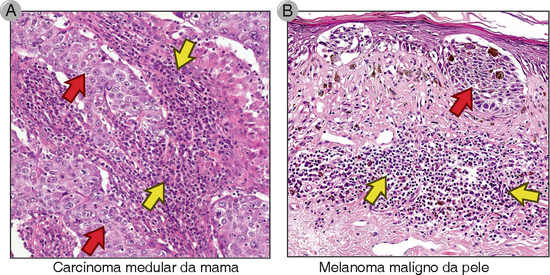
FIGURA 17-1 Inflamação linfocítica associada a certos tumores. A, Carcinoma medular da mama. B, Melanoma maligno. As setas vermelhas indicam células malignas. As setas amarelas indicam infiltrados inflamatórios ricos em linfócitos.
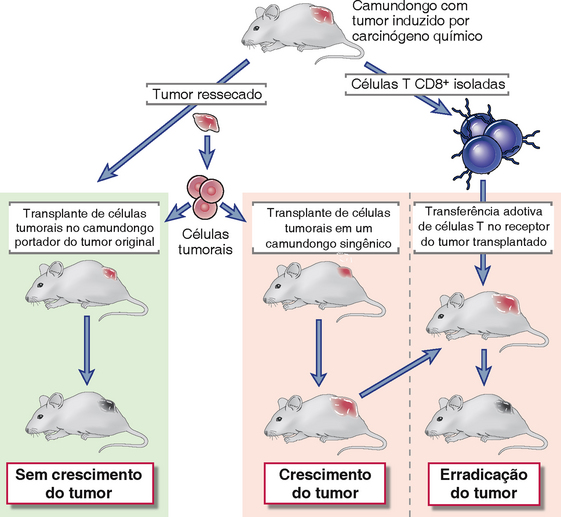
FIGURA 17-2 Demonstração experimental de imunidade tumoral. Camundongos curados cirurgicamente de um tumor induzido por carcinógeno químico (MCA) rejeitam transplantes subsequentes do mesmo tumor, enquanto o tumor transplantado cresce em camundongos singênicos normais. O tumor também é rejeitado em camundongos normais que recebem transferência adotiva de linfócitos T do animal portador do tumor original.
A existência de imunidade antitumoral específica implica que tumores devem expressar antígenos que são reconhecidos como estranhos pelo hospedeiro. A natureza e a significância destes antígenos são descritos a seguir.
ANTÍGENOS TUMORAIS
Uma diversidade de antígenos tumorais que podem ser reconhecidos por linfócitos T e B foi identificada em cânceres humanos e animais. Em situação experimental, como sarcomas em camundongos induzidos por MCA, é possível demonstrar com frequência que esses antígenos provocam respostas imunológicas adaptativas e são os alvos dessas respostas. Antígenos tumorais também foram identificados em humanos, mas os métodos usados neste caso geralmente não são adequados para provar que tais antígenos podem provocar imunidade protetora contra tumores. Ainda assim, é importante identificar antígenos tumorais em humanos, pois eles podem ser usados como componentes de vacinas tumorais, e anticorpos e células T efetoras produzidos contra esses antígenos podem ser utilizados para imunoterapia.
A primeira classificação de antígenos tumorais baseou-se nos seus padrões de expressão. Antígenos expressos em células tumorais, mas não em células normais, são chamados de antígenos específicos de tumores; alguns desses antígenos são exclusivos a um único tumor, enquanto outros são compartilhados por tumores do mesmo tipo. Antígenos tumorais que também são expressos em células normais são chamados de antígenos associados a tumores; na maioria dos casos, esses antígenos são constituintes celulares normais cuja expressão é aberrante ou desregulada em tumores. A classificação moderna de antígenos tumorais é baseada na estrutura molecular e fonte de antígenos expressos por células tumorais que estimulam respostas de células T ou de anticorpos em seus hospedeiros.
Identificação de Antígenos Tumorais
A identificação de muitos antígenos expressos por tumores humanos que ocorrem naturalmente representa um grande avanço no campo da imunologia tumoral. Diversas abordagens bioquímicas e de genética molecular foram usadas para identificar estes antígenos. Para antígenos tumorais reconhecidos por linfócitos T CD8+ citotóxicos (CTL), investigadores estabeleceram linhagens clonadas de CTL reativas a tumores de pacientes de câncer e as usaram como sondas na identificação específica dos antígenos peptídeos relevantes ou os genes codificando os peptídeos. Por exemplo, muitas linhagens clonadas de CTL específicas para melanomas foram geradas de células T de pacientes. Melanomas, que são tumores malignos de melanócitos, são frequentemente tumores de fácil acesso, capazes de serem ressecados cirurgicamente, e que podem crescer em culturas de tecido. As células T podem ser isoladas do sangue periférico, de linfonodos que drenam o tumor, ou diretamente de tecido tumoral removido de pacientes. Estas células T podem ser estimuladas a crescer in vitro por meio de cocultura com as células tumorais, e clones individuais podem ser isolados. Como as células T e o tumor são do mesmo indivíduo, a restrição das células T pelo complexo principal de histocompatibilidade (MHC) condiz com os alelos do MHC expressos pelo tumor. Estes clones de CTL antígeno tumoral-específicos foram usados para detectar respostas a peptídeos derivados de tumores ou respostas a proteínas produzidas por bibliotecas de DNA complementar (cDNA) do tumor (Fig. 17-3). Estas abordagens de início foram usadas para identificar antígenos de melanoma humano que estimulavam respostas CTL em pacientes com melanoma. Os mesmos métodos foram usados para identificar antígenos que são reconhecidos por células auxiliares (helper) CD4+, quando as sondas são clones de células T auxiliares derivadas de células T CD4+ de pacientes.
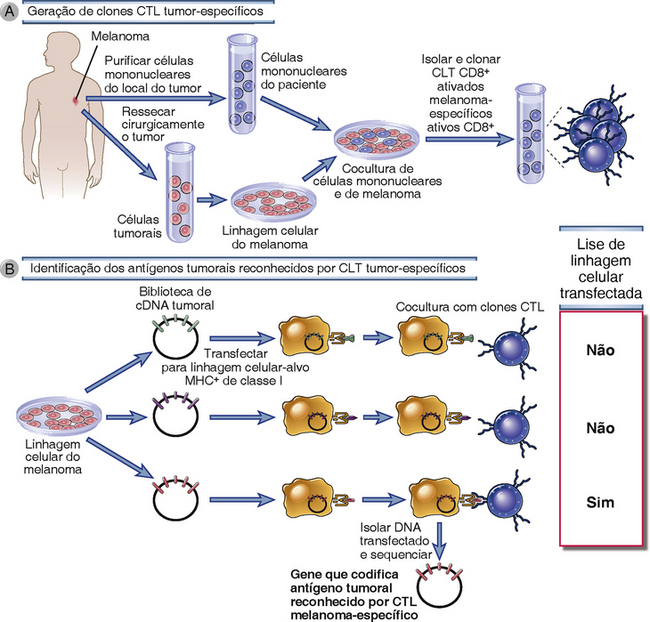
FIGURA 17-3 Linhagens de CTL clonadas específicas para tumores humanos são usados para identificar antígenos tumorais específicos. A, Células T CD8+ isoladas do sangue, linfonodos, ou tumores de pacientes com melanoma são propagadas em cultura pela estimulação com linhagens celulares de melanoma derivadas do tumor do paciente. Células T individuais destas culturas são expandidas em linhagens clonais de CTL. B, DNA de bibliotecas de genes de melanoma é transfectado para células-alvo que expressam MHC de classe I. Genes que sensibilizam as células-alvo para lise pelos clones CTL melanoma-específicos são analisados para identificar os antígenos proteicos do melanoma reconhecidos pelos CTL do paciente.
Um método de sucesso para a identificação de antígenos tumorais que estimularam respostas imunológicas humorais em pacientes com tumor é chamado de análise sorológica da expressão de cDNA recombinante (SEREX). Neste método, bibliotecas de expressão de cDNA derivadas do RNA do tumor de um paciente são transfectadas em uma linhagem celular, e análises são realizadas para detectar a ligação das imunoglobulinas do soro do paciente de câncer para as células transfectadas. Deste modo, as sequências de genes para as proteínas alvo são obtidas, e as proteínas codificadas que estimularam respostas de anticorpos no paciente são identificadas.
Na seção a seguir, descrevemos as principais categorias de antígenos tumorais (Tabela 17-1). Incluiremos antígenos tumorais conhecidos por induzir respostas imunológicas em humanos com cânceres assim como antígenos associados a tumores que podem não induzir respostas imunológicas naturalmente no hospedeiro, mas são alvos potenciais para imunoterapia ou são marcadores úteis para o diagnóstico clínico e para a observação de pacientes.
TABELA 17-1 Antígenos Tumorais
| Tipo de Antígeno | Exemplos de Antígenos Tumorais Humanos |
|---|---|
| Produtos de oncogenes mutados, genes supressores de tumor |
Produtos oncogênicos: mutações de Ras (quase 10% de carcinomas humanos), produto de p210 de rearranjos Bcr/Abl (CML) Produtos de genes supressores de tumor: p 53 mutado (presente em quase 50% de tumores humanos) |
| Produtos de oncogenes não mutados mas superexpressados | HER2/Neu (carcinomas de mama e outros) |
| Formas mutadas de genes celulares não envolvidos em tumorigênese | Diversas proteínas mutadas em melanomas reconhecidas por CTL |
| Produtos de genes que são silenciosos na maioria dos tecidos normais | Antígenos de câncer/testículo expressos em melanomas e em muitos carcinomas; normalmente expressos principalmente nos testículos e na placenta |
| Proteínas normais superexpressadas em células tumorais | Tirosinase, gp100, MART em melanomas (normalmente expressos em melanócitos) |
| Produtos de vírus oncogênicos | |
| Antígenos oncofetais | Antígeno carcinoembriônico em muitos tumores, também expressos no fígado e em outros tecidos durante inflamação α-Fetoproteína |
| Glicolipídios e glicoproteínas | GM2, GD2 em melanomas |
| Antígenos de diferenciação normalmente presentes em tecido de origem | Antígeno específico de próstata em carcinomas de próstata CD20 em linfomas de célula B |
CML, leucemia mieloide crônica; CTL, linfócito T citotóxico; EBNA, antígeno nuclear Epstein-Barr; EBV, Epstein-Barr vírus; MART, antígeno de melanoma reconhecido por células T.
Produtos de Genes Mutados
Oncogenes e genes supressores de tumor mutados produzem proteínas que diferem de proteínas celulares normais e são, portanto, reconhecidos como antígenos tumorais. Muitos tumores expressam genes cujos produtos são necessários para a transformação maligna ou para a manutenção do fenótipo maligno. Com frequência, esses genes são produzidos por mutações pontuais, deleções, translocações cromossômicas ou inserções de genes virais envolvendo proto-oncogenes celulares ou genes supressores de tumor. Os produtos destes oncogenes e genes supressores de tumor alterados são sintetizados no citoplasma das células tumorais e podem entrar na via de processamento de antígeno classe I. Além disso, estas proteínas podem entrar na rota de processamento de antígeno classe II em células apresentadoras de antígenos (APC) que fagocitaram células tumorais mortas. Como esses genes alterados não se encontram presentes nas células normais, os peptídeos deles derivados não podem induzir a autotolerância e podem estimular as respostas de células T no hospedeiro. Alguns pacientes com câncer possuem células T CD4+ e CD8+ que podem reagir aos produtos de oncogenes mutados, como as proteínas Ras e Bcr-Abl e genes supressores de tumor mutado, como o p53. Além disso, em animais, a imunização com proteínas Ras ou p53 mutadas ativa os CTL e as respostas de rejeição contra os tumores que expressam esses mutantes. No entanto, tais proteínas não parecem ser alvos importantes de CTL específicos para tumor na maior parte dos pacientes com tumores diversos.
Antígenos tumorais podem ser produzidos por genes mutados aleatoriamente cujos produtos não estão relacionados ao fenótipo maligno. Os antígenos tumorais que foram identificados por meio do transplante em animais com tumores induzidos por carcinógenos, denominados antígenos de transplante específicos de tumor, são mutantes de diversas proteínas celulares do hospedeiro. Estudos com sarcomas de roedores induzidos quimicamente, como os ilustrados na Figura 17-2, comprovaram que diferentes tumores de roedores, todos induzidos pelo mesmo carcinógeno, expressam diferentes antígenos de transplante. Os antígenos tumorais identificados nesses experimentos são peptídeos derivados de proteínas próprias mutadas, apresentados na forma de complexos de peptídeos e moléculas do MHC classe I, capazes de estimular os CTL. Esses antígenos são muito diversificados porque os carcinógenos que induzem o tumor podem mutar ao acaso praticamente qualquer gene do hospedeiro, e a via apresentadora de antígenos do MHC classe I pode apresentar peptídeos de qualquer proteína citosólica mutada de qualquer tumor. As proteínas celulares mutadas são encontradas com maior frequência em tumores animais induzidos por carcinógenos químicos ou por radiação do que em cânceres humanos espontâneos, provavelmente porque os carcinógenos químicos e a radiação mutam muitos genes celulares. No entanto, devido à instabilidade genômica intrínseca de muitos cânceres, uma grande variedade de genes pode ser mutada em células tumorais. Mesmo que estas mutações não contribuam para o fenótipo maligno, elas podem codificar proteínas anormais que são reconhecidas pelo sistema imunológico.
Proteínas Celulares não Mutadas Anormalmente Expressadas
Os antígenos tumorais que ativam respostas imunológicas podem ser proteínas celulares normais que são expressas anormalmente em células tumorais. Muitos desses antígenos foram identificados em tumores humanos, como em melanomas, pela clonagem molecular de antígenos reconhecidos pelas células T e anticorpos de pacientes portadores de tumor (Fig. 17-3). Uma das revelações que surgiu desses estudos foi que alguns antígenos tumorais são proteínas normais que são produzidas em níveis baixos nas células normais e superexpressas nas células tumorais (Tabela 17-1). Um desses antígenos é a tirosinase, uma enzima envolvida na biossíntese de melanina, expressa apenas em melanócitos normais e em melanomas. Tanto os clones de CTL CD8+ restritos ao MCH classe I quanto os clones de células T auxiliares CTL CD4+ restritos ao MHC classe II dos pacientes com melanoma reconhecem peptídeos derivados da tirosinase. À primeira vista, é surpreendente que esses pacientes sejam capazes de responder a um antígeno próprio normal. A explicação provável é que a tirosinase é geralmente produzida em quantidades tão pequenas e em tão poucas células que não chega a ser reconhecida pelo sistema imunológico, não sendo capaz de provocar tolerância. Portanto, a maior quantidade produzida pelas células de melanoma é capaz de ativar respostas imunológicas. A descoberta de respostas de células T específicas para a tirosinase em pacientes aumenta a possibilidade de que vacinas de tirosinase possam estimular tais respostas contra melanomas; ensaios clínicos com essas vacinas estão em andamento.
Antígenos de câncer/testículo são proteínas expressas nos gametas e trofoblastos e em muitos tipos de cânceres, mas não em tecidos somáticos normais. Os primeiros antígenos de câncer/testículo foram identificados por genes clonados de melanoma humano, que codificam antígenos de proteínas celulares reconhecidos pelos clones de CTL específicos para melanomas derivados de pacientes portadores desses tumores. Estes antígenos foram denominados proteínas MAGE, e subsequentemente se descobriu que são expressos em outros tumores além de melanomas, incluindo carcinomas de bexiga, mama, pele, pulmão e próstata, e em alguns sarcomas, assim como em testículos normais. Subsequentemente à identificação dos genes MAGE, foram identificadas várias outras famílias de genes não relacionados que codificam antígenos de melanoma reconhecidos pelos clones de CTL derivados de pacientes com melanoma. Como as proteínas MAGE, esses outros antígenos de melanoma encontram-se silenciados na maioria dos tecidos normais, exceto nos testículos ou trofoblastos na placenta, mas são expressos em uma diversidade de tumores malignos. Atualmente há mais de 40 diferentes famílias de antígenos de câncer/testículo já identificadas. Cerca da metade é codificada por genes no cromossomo X; o resto é codificado por genes distribuídos por todo o genoma. Embora tenha sido demonstrado que alguns antígenos de câncer/testículo regulam a transcrição ou tradução de outros genes, as funções da maioria destas proteínas são desconhecidas. Em geral, eles não são necessários para o fenótipo maligno das células, e suas sequências são idênticas aos genes correspondentes em células normais; isto é, eles não são mutados. Diversos antígenos de câncer/testículo ligados ao X estão atualmente sendo usados em experiências de vacinas tumorais.
Antígenos de Vírus Oncogênicos
Os produtos de vírus oncogênicos funcionam como antígenos tumorais e provocam respostas específicas de células T que podem servir para erradicar os tumores. Os vírus de DNA estão envolvidos no desenvolvimento de uma diversidade de tumores em humanos e em animais experimentais. Exemplos em humanos incluem o vírus Epstein-Barr (EBV), que está associado a linfomas de células B e carcinoma nasofaríngeo, e o papilomavírus humano (HPV), que está associado ao carcinoma cervical. Os papovavírus, que incluem o poliomavírus e o vírus símio 40 (SV40), e os adenovírus induzem tumores malignos em roedores recém-nascidos ou em adultos imunodeficientes. Na maior parte desses tumores induzidos por vírus de DNA, antígenos protéicos codificados pelo vírus são encontrados no núcleo, no citoplasma ou na membrana plasmática das células tumorais. Essas proteínas endogenamente sintetizadas podem ser processadas, e complexos de peptídeos virais processados por moléculas do MHC classe I podem ser expressos na superfície da célula tumoral. Uma vez que os peptídeos virais são antígenos estranhos, os tumores induzidos pelos vírus de DNA estão entre os tumores mais imunogênicos conhecidos.
A capacidade da imunidade adquirida de prevenir o crescimento de tumores induzidos por vírus de DNA foi confirmada por muitas observações. Por exemplo, linfomas associados ao EBV e cânceres de pele e cervicais associados ao HPV surgem com maior frequência em indivíduos imunossuprimidos, como os receptores de aloenxertos que recebem terapia imunossupressora e os pacientes com síndrome da imunodeficiência adquirida (AIDS), do que em indivíduos normais. Experimentos de transplante de tumores do tipo ilustrado na Figura 17-2 demonstraram que animais podem ser imunizados especificamente contra tumores induzidos por vírus de DNA, desenvolvendo rejeição contra os transplantes desses tumores. Diferentes dos antígenos tumorais induzidos por MCA, que são produtos de genes celulares mutados aleatoriamente, os antígenos tumorais codificados por vírus não são exclusivos para cada tumor, e sim compartilhados por todos os tumores induzidos pelo mesmo tipo de vírus. Assim, um sistema imunológico competente pode desempenhar um papel na vigilância contra tumores induzidos por vírus em razão da sua capacidade de reconhecer e destruir as células infectadas pelos vírus. De fato, o conceito de vigilância imunológica contra tumores é mais bem estabelecido para tumores induzidos por vírus de DNA do que para qualquer outro tipo de tumor.
A compreensão de que respostas imunológicas contra vírus protegem indivíduos de cânceres induzidos por vírus levou ao desenvolvimento de vacinas contra vírus oncogênicos. Por exemplo, uma vacina contra o HPV que tem o potencial de reduzir a incidência de câncer cervical em mulheres está sendo usada atualmente. A vacina é composta de proteínas capsídeas de HPV recombinantes das cepas oncogênicas mais comuns de HPV, que formam partículas semelhantes a vírus livres do genoma viral. A vacinação contra o vírus hepatite B também está reduzindo a incidência de câncer de fígado. Neste caso, o vírus não é oncogênico, mas provavelmente promove o desenvolvimento de câncer de fígado induzindo inflamação crônica, que é um fator de risco para o desenvolvimento de câncer (discutido mais adiante no capítulo).
Os vírus de RNA (retrovírus) tumorais são importantes causas de tumores em animais. Produtos de oncogenes retrovirais teoricamente possuem as mesmas propriedades antigênicas que aqueles de oncogenes celulares mutados, e respostas humorais e celulares contra esses produtos de genes retrovirais em células tumorais podem ser observadas experimentalmente. O único retrovírus humano bem definido que se sabe ser capaz de causar tumores é o vírus linfotrófico da célula T humana tipo 1 (HTLV-1), agente etiológico da leucemia/linfoma de células T em adultos (ATL), um tumor maligno de células TCD4+. Apesar de terem sido demonstradas respostas imunológicas específicas para antígenos codificados por HTLV-1 em indivíduos infectados pelo vírus, não está claro se elas desempenham algum papel na imunidade protetora contra o desenvolvimento de tumores. Além disso, com frequência pacientes com ATL são profundamente imunossuprimidos, provavelmente porque o vírus infecta as células T CD4+ e induz anormalidades funcionais nessas células.
Antígenos Oncofetais
Antígenos oncofetais são proteínas expressas em altos níveis nas células cancerosas e em fetos de desenvolvimento normal, mas não em tecidos de adultos. Acredita-se que os genes codificadores dessas proteínas são silenciados durante o desenvolvimento, sendo reativados em transformações malignas. Antígenos oncofetais foram identificados por meio de anticorpos produzidos em outras espécies, e sua principal importância é fornecer marcadores que auxiliam no diagnóstico de tumores. À medida que as técnicas para detecção desses antígenos foram sendo aprimoradas, ficou claro que sua expressão em adultos não está limitada a tumores. Em diversas condições inflamatórias as proteínas são aumentadas em tecidos e na circulação, e são encontradas em pequenas quantidades mesmo em tecidos normais. Não há evidências de que os antígenos oncofetais sejam importantes indutores ou alvos de imunidade antitumoral. Os dois antígenos oncofetais mais extensamente caracterizados são os antígenos carcino embrionário (CEA) e a α-fetoproteína (AFP).
O CEA (CD66) é uma proteína integral de membrana altamente glicosilada, pertencente à superfamília das imunoglobulinas (Ig) e funciona como uma molécula de adesão intercelular. Uma expressão elevada de CEA é normalmente restrita a células do intestino, pâncreas e fígado durante os primeiros 6 meses de gestação, e uma expressão reduzida é observada em adultos normais na mucosa colônica e na mama durante a lactação. A expressão de CEA é aumentada em muitos carcinomas de cólon, pâncreas, estômago e mama, e os níveis séricos apresentam-se elevados nesses pacientes. O nível sérico de CEA é utilizado para monitorar a persistência ou a recorrência de tumores após o tratamento. A utilidade do CEA como marcador diagnóstico para o câncer é limitada pelo fato de o CEA sérico ser também elevado em quadros de doenças não neoplásicas, como condições inflamatórias crônicas intestinais ou hepáticas.
A AFP é uma glicoproteína circulante normalmente sintetizada e secretada no desenvolvimento fetal pelo saco vitelino e pelo fígado. As concentrações séricas no feto podem chegar a 2 ou 3 mg/mL, mas na vida adulta a proteína é substituída pela albumina, e somente níveis reduzidos estão presentes no plasma. Níveis séricos de AFP podem estar significativamente elevados em pacientes com carcinoma hepatocelular, tumores de células germinativas e, ocasionalmente, cânceres gástricos e pancreáticos. Um nível sérico elevado de AFP é um indicador útil de tumores hepáticos ou de células germinativas avançados, ou da recorrência desses tumores após o tratamento. Além disso, a detecção de AFP em cortes histológicos por técnicas imunoistoquímicas pode auxiliar na identificação patológica de células tumorais. O valor diagnóstico da AFP como um marcador tumoral é limitado pelo fato de que elevados níveis séricos também são encontrados em doenças não neoplásicas, como a cirrose hepática.
Antígenos Glicolipídicos e Glicoproteicos Alterados
A maioria dos tumores humanos e experimentais expressa níveis mais altos do que o normal ou formas anormais de glicoproteínas e glicolipídeos de superfície, que podem ser marcadores diagnósticos e alvos para terapia. Essas moléculas alteradas incluem gangliosídeos, antígenos de tipos sanguíneos e mucinas. Alguns aspectos do fenótipo maligno dos tumores, incluindo a invasão de tecidos e o comportamento metastático, podem refletir propriedades de superfícies celulares alteradas, resultantes da síntese de glicoproteínas e glicolipídeos anormais. Diversos anticorpos capazes de reconhecer os agrupamentos de carboidratos ou os núcleos peptídicos dessas moléculas foram produzidos em animais. Ainda que a maioria dos epítopos reconhecidos por esses anticorpos não seja expressa especificamente em tumores, eles estão presentes em níveis mais altos nas células cancerosas do que nas células normais. Essa classe de antígenos associados a tumores é alvo da terapia com anticorpos específicos contra o câncer.
Gangliosídeos, incluindo GM2, GD2, e GD3, são glicolipídios expressos em altos níveis em neuroblastomas, melanomas e muitos sarcomas. Por causa da expressão seletiva a tumor destas moléculas, elas são um alvo atraente para terapias específicas contra tumores, como terapia de anticorpos. Ensaios clínicos com anticorpos antigangliosídio e imunização com vacinas de gangliosídeos estão em andamento em pacientes de melanoma. As mucinas são glicoproteínas de alto peso molecular, que contêm numerosas cadeias laterais de carboidratos ligadas ao O em um núcleo polipeptídico. Os tumores apresentam frequentemente uma expressão desregulada das enzimas que sintetizam essas cadeias laterais de carboidratos, o que leva ao surgimento de epítopos específicos de tumor nas cadeias laterais ou nos núcleos peptídicos anormalmente expostos. Várias mucinas têm sido o foco de estudos diagnósticos e terapêuticos, incluindo CA-125 e CA-19-9, expressas em carcinomas de ovário, e MUC-1, expressa em carcinomas de mama. Diferentemente de muitas mucinas, a MUC-1 é uma proteína integral de membrana, expressa normalmente apenas na superfície apical do epitélio ductal da mama, região relativamente isolada do sistema imunológico. Em carcinomas ductais de mama, no entanto, a molécula é expressa em uma forma não polarizada, contendo novos epitopos de carboidratos e peptídeos específicos de tumor, detectáveis por anticorpos monoclonais de camundongos. Os epitopos peptídicos induzem respostas dos anticorpos e das células T em pacientes com câncer, e esforços estão sendo feitos para desenvolver vacinas contendo formas imunogênicas de epitopos MUC-1.
Antígenos de Diferenciação Tecido-específicos
Tumores podem expressar moléculas que estão presentes somente nas células normais de origem e não em células de outros tecidos. Esses antígenos são chamados de antígenos de diferenciação porque são específicos para linhagens ou estágios particulares de diferenciação de diversos tipos de células. São importantes como alvos potenciais para a imunoterapia e para a identificação do tecido de origem dos tumores. Por exemplo, vários antígenos de melanoma, alvos dos CTL em pacientes, são antígenos de diferenciação de melanócitos, como a tirosinase, já mencionada. Os linfomas podem ser diagnosticados como tumores derivados de células B pela detecção de marcadores de superfície característicos dessa linhagem, como o CD10 (anteriormente denominado antígeno de leucemia linfoblástica aguda comum, ou CALLA) e o CD20. Anticorpos contras estas moléculas também são usados para imunoterapia tumoral; a imunoterapia de maior sucesso para linfomas não Hodgkin de células B é um anticorpo anti-CD20 (rituximab). Os determinantes idiotípicos da Ig de superfície de uma população clonal de células B são marcadores para os clones de células B, porque todas as demais células B expressam idiótipos diferentes. Portanto, o idiótipo da Ig é um antígeno tumoral altamente específico para linfomas e leucemias de células B. Esses antígenos de diferenciação são moléculas próprias normais, e, portanto, não costumam induzir respostas imunológicas fortes em hospedeiros portadores de tumor.
RESPOSTAS IMUNOLÓGICAS CONTRA TUMORES
Foi demonstrado que os mecanismos efetores tanto da imunidade natural como da imunidade adquirida destroem células tumorais. O desafio para os imunologistas de tumores é determinar quais desses mecanismos podem contribuir para respostas imunológicas que possam proteger contra tumores e aprimorar esses mecanismos efetores por meio de estratégias que sejam específicas para tumores. Nesta seção, revisamos as evidências da destruição tumoral por diversos mecanismos imunológicos efetores e discutimos quais teriam provavelmente maior relevância para os tumores humanos.
Respostas Imunológicas Naturais a Tumores
Algumas das primeiras pesquisas sobre as funções das células efetoras do sistema imunológico natural, incluindo as células NK e os macrófagos, focalizaram a capacidade destas células de destruir células tumorais cultivadas.
Células NK
As células NK destroem muitos tipos de células tumorais, especialmente aquelas que têm expressão de moléculas do MHC classe I reduzida e expressam ligantes para receptores ativadores das células NK. As células NK podem destruir in vitro células infectadas por vírus e certas linhagens de células tumorais, particularmente as de tumores hematopoiéticos. As células NK também respondem na ausência de moléculas do MHC classe I porque o reconhecimento dessas moléculas fornece sinais inibitórios para as células NK (Cap. 4, Fig. 4-6). Como veremos mais adiante, alguns tumores perdem a expressão de moléculas do MHC classe I, talvez como resultado da seleção contra as células que expressam MHC classe I feita pelos CTLs. Essa perda das moléculas do MHC classe I torna os tumores alvos particularmente bons para células NK. Alguns tumores também expressam MIC-A, MIC-B e ULB, os quais são ligantes para o receptor ativador NKG2D nas células NK. Além disso, as células NK podem ser direcionadas para as células tumorais revestidas por anticorpos IgG pelos receptores Fc (FcγRIII ou CD16). A capacidade tumoricida das células NK é aumentada pelas citocinas, incluindo interferon-γ (IL-γ), IL-15, e IL-12, e os efeitos antitumorais dessas citocinas são parcialmente atribuídos à estimulação da atividade das células NK. Células NK ativadas por IL-2, chamadas de células assassinas ativadas por linfocina (LAK), são obtidas pela cultura de células do sangue periférico ou linfócitos que infiltram tumores de pacientes com altas doses de IL-2. Estas células são assassinas de tumores mais potentes do que células NK inativadas. O uso de células LAK em imunoterapia adotiva para tumores é discutido mais adiante.
O papel das células NK na imunidade tumoral in vivo não está claro. Em alguns estudos, camundongos com deficiência de células T não apresentam alta incidência de tumores espontâneos, e isso é atribuído à presença de quantidades normais de células NK exercendo uma função de vigilância imunológica. Alguns pacientes com deficiência de células NK e incidência elevada de linfomas associados ao EBV foram descritos.
Macrófagos
Macrófagos são capazes de inibir e de promover o crescimento e disseminação de cânceres, dependendo do seu estado de ativação. Macrófagos M1 ativados classicamente, discutidos no Capítulo 10, apresentam diversas funções antitumorais. Estas células podem matar muitas células tumorais mais eficazmente do que matam células normais. A maneira como os macrófagos são ativados pelos tumores não é conhecida. Possíveis mecanismos incluem o reconhecimento direto de alguns antígenos da superfície de células tumorais e a ativação dos macrófagos pelo IFN-γ produzido pelas células T específicas para tumor. Os macrófagos M1 podem destruir células tumorais por meio de vários mecanismos, provavelmente os mesmos usados na destruição macrofágica de organismos infecciosos. Esses mecanismos incluem a liberação de enzimas lisossômicas, de espécies reativas de oxigênio e de óxido nítrico. Macrófagos M1 também produzem a citocina fator de necrose tumoral (TNF), caracterizada pela primeira vez, conforme seu nome sugere, como um agente capaz de destruir tumores. Sabemos agora que ela age principalmente pela indução de trombose em vasos sanguíneos do tumor. Em contrapartida, macrófagos M2 podem contribuir para a progressão do tumor. Estas células secretam fator de crescimento endotelial vascular (VEGF), fator de transformação do crescimento-β (TGF-β), e outros fatores solúveis que promovem a angiogênese tumoral. A função destas células e de outros componentes da resposta do hospedeiro no aumento do crescimento do tumor é discutida no final do capítulo.
Respostas Imunológicas Adquiridas a Tumores
Tumores desencadeiam a resposta mediada por células T e a resposta humoral. As células T são os principais mediadores de imunidade antitumoral, e este entendimento levou a esforços consideráveis para melhorar as respostas de células T na imunoterapia de cânceres.
Linfócitos T
O principal mecanismo de imunidade tumoral adaptativa é a destruição das células tumorais por CTL CD8+. A capacidade dos CTL de fornecer imunidade antitumoral eficaz in vivo é observada mais claramente em animais experimentais, usando-se tumores induzidos por carcinógenos e por vírus de DNA. Conforme discutido anteriormente, os CTL podem desempenhar uma função de vigilância pelo reconhecimento e morte de células potencialmente malignas que expressam peptídeos derivados de antígenos tumorais e apresentados em associação com moléculas MHC classe I. O papel da vigilância imunológica na prevenção de tumores comuns, não induzidos por vírus, ainda é controverso porque a frequência destes tumores em pessoas com deficiência de células T não é claramente maior do que a frequência em indivíduos imunocompetentes. Contudo, CTL específicos a tumores podem ser isolados de animais e humanos com tumores estabelecidos, e há evidência de que o prognóstico de alguns tipos de tumores humanos é melhor quando há mais CTL presentes. Além disso, células mononucleares derivadas dos infiltrados inflamatórios de tumores sólidos em humanos, chamadas linfócitos infiltradores de tumor (TIL), contêm CTL capazes de destruir o tumor do qual foram derivados.
As respostas de células T CD8+ específicas contra antígenos tumorais podem exigir apresentação cruzada dos antígenos tumorais por células dendríticas. A maioria das células tumorais não deriva de APC e, portanto, não expressa os coestimuladores necessários para dar início às respostas de células T nem as moléculas do MHC classe II necessárias para estimular as células T auxiliares que promovem a diferenciação das células T CD8+. Uma explicação provável para como são iniciadas as respostas de células T aos tumores é que células tumorais ou seus antígenos são ingeridos por APC hospedeiras, particularmente as células dendríticas, e antígenos tumorais são processados dentro das APC. Peptídeos derivados destes antígenos são então apresentados ligados a moléculas do MHC de classe I para reconhecimento por células T CD8+. As APC expressam coestimuladores capazes de fornecer os sinais necessários para a diferenciação de células T CD8+ em CTLs antitumorais, e as APC expressam moléculas do MHC de classe II que podem apresentar antígenos tumorais internalizados, bem como ativar células T CD4+ auxiliares (Fig. 17-4). Esse processo de apresentação cruzada, ou cross-priming, foi descrito em capítulos anteriores (Cap. 6, Fig. 6-20). Uma vez que os CTL efetores são gerados, eles são capazes de reconhecer e destruir as células tumorais sem que seja necessário haver coestimulação. Uma aplicação prática do conceito de cross-priming é cultivar células dendríticas de um paciente com câncer, incubar as APC com células ou antígenos tumorais daquele paciente, e usar essas APC pulsadas por antígenos como vacinas para estimular respostas antitumorais de células T.
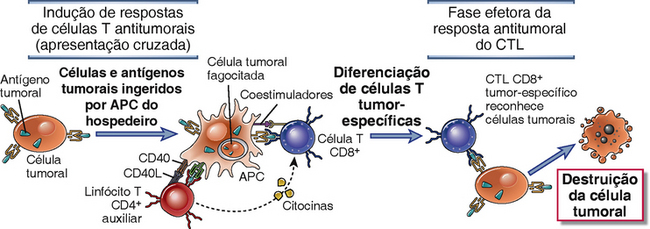
FIGURA 17-4 Indução de respostas de células T a tumores. Respostas de células T CD8+ a tumores podem ser induzidas por cross-priming (apresentação cruzada), onde as células tumorais ou antígenos tumorais são capturados, processados e apresentados a células T por células apresentadoras de antígenos (APC) profissionais. Em alguns casos, coestimuladores B7 expressos pelas APC fornecem os sinais secundários para a diferenciação de células T CD8+. As APC também podem estimular células T CD4+ auxiliares, que fornecem os sinais secundários para o desenvolvimento de CTL. CTL diferenciados matam células tumorais sem a necessidade de coestimulação ou ajuda de células T. (As funções da apresentação cruzada e de células T CD4+ auxiliares em respostas CTL são discutidas nos Caps. 6 e 9.)
A importância das células T CD4+ auxiliares na imunidade tumoral é menos clara. As células CD4+ podem exercer um papel nas respostas imunológicas antitumorais, fornecendo citocinas para o desenvolvimento eficaz dos CTL (Cap. 9). Além disso, células T auxiliares específicas para antígenos tumorais podem secretar citocinas, como o TNF e o IFN-γ, que podem aumentar a expressão do MHC classe I pelas células tumorais e a sensibilidade à lise por CTL. O IFN-γ também pode ativar a destruição das células tumorais por macrófagos. A importância do IFN-γ na imunidade tumoral é demonstrada por achados de incidência tumoral elevada em camundongos knockout desprovidos dessa citocina, do receptor de IFN-γ, ou de componentes da cascata de sinalização do receptor de IFN-γ.
Anticorpos
Hospedeiros portadores de tumor podem produzir anticorpos contra diversos antígenos tumorais. Por exemplo, pacientes com linfomas associados ao EBV possuem anticorpos séricos contra antígenos codificados por EBV expressos na superfície das células do linfoma. Os anticorpos podem destruir as células tumorais por meio da ativação do complemento ou da citotoxicidade dependente de anticorpos mediada por células, na qual os macrófagos portadores de receptor Fc ou células NK medeiam a destruição. No entanto, a capacidade dos anticorpos de eliminar células tumorais foi extensamente demonstrada in vitro e há poucas evidências de respostas imunológicas humorais efetivas contra tumores. É provável que alguns anticorpos terapêuticos antitumorais eficazes que são administrados passivamente a pacientes funcionem através de citotoxicidade mediada por células dependente de anticorpos, como será discutido adiante.
EVASÃO DE RESPOSTAS IMUNOLÓGICAS PELOS TUMORES
Muitos cânceres desenvolvem mecanismos que permitem que eles evitem respostas imunológicas antitumorais. Estes mecanismos podem ser divididos naqueles que são intrínsecos às células tumorais e aqueles que são mediados por outras células (Fig. 17-5). Um dos principais focos da imunologia de tumores é compreender os mecanismos de evasão dos tumores, com esperança de que as intervenções para a prevenção da evasão imunológica aumentem a imunogenicidade dos tumores e maximizem as respostas do hospedeiro. A evidência experimental em modelos murinos indica que as respostas imunes às células tumorais conferem pressões seletivas que resultam na sobrevivência e propagação de células tumorais variantes com imunogenicidade reduzida, um processo que foi chamado de edição do tumor. Por exemplo, quando tumores são induzidos por tratamento carcinógeno em camundongos imunodeficientes ou imunocompetentes, e os tumores em seguida são transplantados para novos camundongos imunocompetentes, os tumores que foram derivados dos camundongos imunodeficientes são mais frequentemente rejeitados pelo sistema imunológico do animal receptor do que os tumores derivados dos camundongos imunocompetentes. Este resultado indica que os tumores que se desenvolvem no contexto de um sistema imune normal se tornam menos imunogênicos com o tempo, o que é consistente com a seleção de células variantes menos imunogênicas. Considera-se que a edição do tumor é subjacente ao aparecimento de tumores que “escapam” da vigilância imunológica. Discutiremos agora os mecanismos tumorais intrínsecos e extrínsecos subjacentes à edição e à evasão.
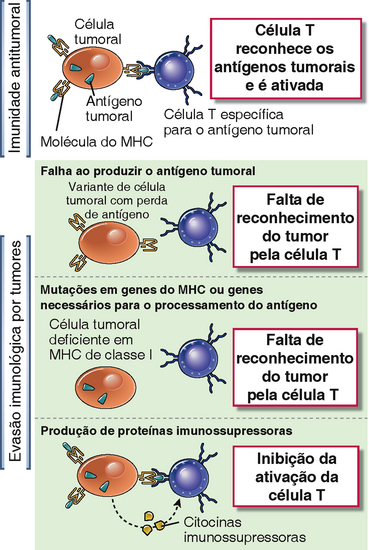
FIGURA 17-5 Mecanismos pelos quais os tumores escapam de defesas imunológicas. A imunidade antitumoral se desenvolve quando células T reconhecem antígenos tumorais e são ativadas. Células tumorais podem escapar de respostas imunológicas perdendo a expressão de antígenos ou de moléculas do MHC ou pela produção de citocinas imunossupressoras.
Mecanismos Intrínsecos de Evasão Imunológica por Células Tumorais
Várias propriedades de células tumorais permitem que elas escapem das defesas do hospedeiro.
• Tumores podem perder a expressão de antígenos que provocam respostas imunológicas. Tais “variantes de perda de antígenos” são comuns em tumores de crescimento rápido e podem ser induzidas prontamente em linhagens de células tumorais pela cultura com anticorpos específicos para tumor ou CTL. Dadas a alta taxa de mitose das células tumorais e a sua instabilidade genética, mutações ou deleções em genes codificadores de antígenos tumorais são comuns. Se esses antígenos não forem necessários para o crescimento dos tumores ou para a manutenção do fenótipo transformado, as células tumorais antígeno-negativas têm uma vantagem de crescimento no hospedeiro. Análises de tumores transplantados em série, de um animal para outro, mostraram que a perda de antígenos reconhecidos por CTL específicos para tumor se correlaciona com crescimento e o potencial metastático aumentados. Além de antígenos tumor-específicos, a expressão de MHC de classe I pode estar infrarregulada nas células tumorais, de modo que elas não podem ser reconhecidas pelos CTL. Diversos tumores apresentam síntese diminuída de moléculas do MHC de classe I, β2-microglobulina ou componentes da maquinaria de processamento de antígenos, incluindo o transportador associado ao processamento de antígenos e algumas subunidades do proteossoma. Estes mecanismos são, presumivelmente, adaptações dos tumores que surgem em resposta às pressões de seleção da imunidade do hospedeiro, e podem permitir que as células tumorais escapem respostas imunológicas mediadas por células T. Entretanto, não há uma correlação distinta entre o nível de expressão de MHC em uma variada gama de células tumorais experimentais ou humanas e o crescimento in vivo destas células.
• Antígenos tumorais podem estar inacessíveis ao sistema imunológico. Os antígenos de superfície celular em tumores podem estar escondidos do sistema imunológico por moléculas do glicocálice, como mucopolissacarídeos contendo ácido siálico. Esse processo é chamado de mascaramento antigênico e pode ser uma consequência do fato de que células tumorais frequentemente expressam mais dessas moléculas do glicocálice do que o fazem as células normais.
• Tumores podem não induzir respostas fortes das células T efetoras porque a maioria das células tumorais não expressa coestimuladores ou moléculas do MHC de classe II. Os coestimuladores são necessários para dar início às respostas das células T, e as moléculas classe II são necessárias para a ativação das células T auxiliares, que, em algumas situações, estimulam a diferenciação dos CTL. Portanto, a indução de respostas de células T específicas para tumor com frequência requer apresentação cruzada por células dendríticas, que expressam coestimuladores e moléculas classe II. Se essas APC não capturarem e apresentarem antígenos tumorais adequadamente, ativando as células T auxiliares (helper), os CTL específicos para as células tumorais podem não se desenvolver. Células tumorais transfectadas com genes codificadores dos coestimuladores B7-1 (CD80) e B7-2 (CD86) são capazes de provocar fortes respostas imunológicas mediadas por células. Previsivelmente, CTL induzidos por tumores transfectados com B7 são eficientes contra o tumor de origem (B7-negativo) também, pois a fase efetora da destruição mediada por CTL não requer coestimulação (Fig. 17-4). Como veremos adiante, esses resultados experimentais estão sendo estendidos para as situações clínicas, como a imunoterapia de tumores.
• Tumores podem engajar moléculas que inibem respostas imunológicas. Há boas evidências experimentais que as respostas das células T contra alguns tumores são inibidas pelo envolvimento de CTLA-4 ou PD-1, duas das vias inibitórias mais bem definidas em células T (Cap. 14). Uma possível razão para este papel do CTLA-4 é que antígenos tumorais são apresentados por APC na ausência de imunidade natural forte e, portanto com baixos níveis de coestimuladores B7. Estes baixos níveis podem ser o suficiente para engajar o receptor CTLA-4 de alta afinidade. O PD-L1, uma proteína da família B7 que se liga ao receptor inibitório de células T PD-1 (Cap. 14), é expresso em muitos tumores humanos, e estudos com animais indicam que respostas antitumorais de células T são comprometidas pela expressão de PD-L1. O PD-L1 em APCs também pode estar envolvido na inibição da ativação de células T tumor-específicas. Como discutiremos mais adiante, experimentos clínicos sobre o bloqueio das vias do CTLA-4 e PD-L1/PD-1 para aumentar a imunidade tumoral estão em andamento Alguns tumores expressam ligantes de Fas (FasL) que reconhecem o receptor de morte celular Fas nos leucócitos que tentam atacar o tumor; o acoplamento do FasL com o Fas pode resultar na morte apoptótica dos leucócitos. A importância desse mecanismo de escape tumoral não está comprovada porque FasL foi detectado apenas em alguns tumores espontâneos, e nem sempre é protetor quando expresso em tumores por transfecção de genes.
• Produtos secretados de células tumorais podem suprimir respostas imunológicas antitumorais. Um exemplo de produto tumoral imunossupressor é o TGF-β, que é secretado em grandes quantidades por muitos tumores e inibe a proliferação e as funções efetoras dos linfócitos e macrófagos (Cap. 10).
Supressão Celular Extrínseca de Imunidade Antitumoral
Diversas populações celulares que suprimem a imunidade antitumoral foram descritas em pacientes e animais portadores de tumores.
• Macrófagos associados a tumores podem promover o crescimento tumoral e a invasividade pela alteração do microambiente tecidual e pela supressão das respostas de células T. Estes macrófagos têm um fenótipo M2, como discutimos brevemente no início desse capítulo, e eles secretam mediadores, como IL-10, prostaglandina E2 e arginase, que danificam a ativação T e funções efetoras de células T. Macrófagos associados a tumores também secretam fatores que promovem a angiogênese, como TGF-β e VEGF, que aumentam o crescimento tumoral.
• As células T reguladoras podem suprimir respostas das células T aos tumores. Evidência de sistemas-modelo em camundongos e de pacientes com câncer indica que os números de células T reguladoras são aumentados nos indivíduos que apresentam tumores, e estas células podem ser encontradas nos infiltrados celulares em certos tumores. A depleção de células T reguladoras em camundongos afetados por tumores aumenta a imunidade antitumoral e reduz o crescimento tumoral.
• Células supressoras derivadas de mieloides (MDSC) são precursores mieloides recrutados da medula óssea e se acumulam em tecidos linfoides, sangue, ou tumores de animais portadores de tumor e pacientes de câncer e suprimem respostas antitumorais naturais e de células T. As MDSC são um grupo heterogêneo de tipos celulares, incluindo precursores de células dendríticas, monócitos e neutrófilos. Elas compartilham alguns marcadores de superfície comuns, incluindo Ly6C ou Ly6G e CD11b em camundongos e CD33, CD11b, e CD15 em humanos. O recrutamento de MDSC da medula óssea para os linofonodos e outros tecidos é induzido por vários mediadores pró-inflamatórios produzidos por tumores. Estes mediadores, que incluem a prostaglandina E2, IL-6, VEGF, e fragmento C5a do complemento, não são específicos a tumores, e na verdade, as MDSC se acumulam em locais de inflamação crônica não relacionados a tumores. As MDSC suprimem respostas imunológicas naturais pela secreção de IL-10, que inibe várias funções inflamatórias de macrófagos. As MDSCs suprimem respostas de células T por meio de uma variedade de mecanismos. Elas expressam a arginase e a sintase de óxido nítrico induzível, que trabalham juntas na geração de espécies reativas de oxigênio, como o peroxinitrito, que inibem a ativação de células T. As MDSC também produzem indolamina 2,3-dioxigenase, que cataboliza o triptofano necessário para a proliferação de células T. As MDSCs impedem respostas antitumorais de células T indiretamente pela indução do desenvolvimento de linfócitos T reguladores (Tregs) e pela alteração da diferenciação de células T auxiliares em células TH2.
Outras células hospedeiras e mecanismos que podem inibir a imunidade antitumoral são descritos mais adiante.
IMUNOTERAPIA PARA TUMORES
O potencial do tratamento de pacientes com câncer mediante abordagens imunológicas pareceu promissor para imunologistas e biólogos do câncer durante muitos anos. A principal razão para o interesse em uma abordagem imunológica é que a maioria das terapias atuais contra o câncer se baseia em medicamentos que destroem as células que se dividem ou bloqueiam a divisão celular, e esses tratamentos têm efeitos graves nas células normais em proliferação. Como consequência, o tratamento contra cânceres causa morbidade e mortalidade significativas. Respostas imunológicas a tumores podem ser específicas para antígenos tumorais e não irão causar danos à maior parte das células normais. Assim, a imunoterapia tem o potencial de ser o tratamento mais específico para tumores que pode ser elaborado. Avanços em nossa compreensão do sistema imunológico e na definição de antígenos em células tumorais têm motivado muitas novas estratégias. A imunoterapia de tumores visa potencializar a fraca resposta imunológica aos tumores (imunidade ativa), ou administrar anticorpos ou células T específicos para tumor, uma forma de imunidade passiva. Nesta seção, descrevemos algumas das formas de imunoterapia que foram tentadas no passado ou que estão sendo pesquisadas atualmente.
Estimulação das Respostas Imunológicas Ativas do Hospedeiro aos Tumores
As primeiras tentativas de reforçar a imunidade contra tumores se basearam na estimulação imunológica inespecífica. Mais recentemente, vacinas compostas de células tumorais mortas, antígenos tumorais ou células dendríticas incubadas com antígeno tumorais foram administradas em pacientes, e estratégias para aumentar as respostas imunológicas aos tumores estão sendo desenvolvidas.
Vacinação com Antígenos Tumorais
A imunização de indivíduos portadores de tumor com antígenos tumorais pode resultar em respostas imunológicas aumentadas contra o tumor (Tabela 17-2 e Fig. 17-6). A identificação de peptídeos reconhecidos por CTL específicos para tumor e a clonagem de genes que codificam antígenos específicos de tumor reconhecidos pelos CTL têm fornecido muitos candidatos a vacinas tumorais; diversos exemplos já foram mencionados nesse capítulo. Uma das primeiras tentativas de vacina, a imunização com antígenos tumorais purificados e adjuvantes, ainda está sendo experimentada. Mais recentemente, vacinas terapêuticas com células dendríticas têm sido usadas para imunizar pacientes com câncer contra seus próprios tumores. Nesta abordagem, células dendríticas de pacientes, purificadas, são incubadas com antígenos tumorais ou transfectadas com genes codificando estes antígenos e depois injetadas de volta no paciente. Por exemplo, uma vacina com base celular foi aprovada para tratar câncer de próstata avançado. Esta vacina é composta de um preparado de leucócitos do sangue periférico de um paciente enriquecido com células dendríticas, exposto a uma proteína de fusão recombinante consistindo em fator estimulador de colônias de granulócitos-macrófagos (GM-CSF) e o antígeno fosfatase ácida prostática associado a tumores. Uma abordagem alternativa em experimentos clínicos é o uso de vacinas de DNA compostas de plasmídeos de vetores virais codificando antígenos tumorais. As vacinas com base celular e de DNA podem ser as melhores formas de induzir respostas CTL porque os antígenos codificados são sintetizados no citoplasma e entram na via de apresentação de antígenos do MHC de classe I. Para antígenos que são exclusivos a tumores individuais, como os antígenos produzidos por mutações pontuais randômicas em genes celulares, estes métodos de vacinação são impraticáveis porque necessitariam identificar os antígenos de cada tumor. Por sua vez, antígenos tumorais compartilhados por muitos tumores, como MAGE, tirosinase e antígenos gp 100 em melanomas, e proteínas Ras e p53 mutadas em diversos tumores, são imunógenos potencialmente úteis para todos os pacientes com certos tipos de cânceres. Uma limitação de se tratar tumores já estabelecidos com vacinas é a de que tais vacinas precisam ser terapêuticas, e não apenas preventivas, e com frequência é difícil induzir uma resposta imunológica forte o suficiente para erradicar todas as células de tumores em crescimento.
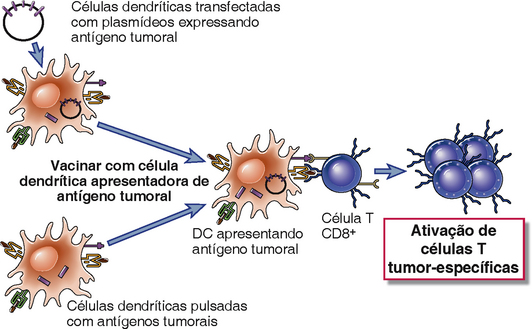
FIGURA 17-6 Vacinas tumorais. Dois tipos de vacinas tumorais que demonstraram eficácia em experimentos clínicos e em modelos animais são ilustrados. Células dendríticas análogas são preparadas das células sanguíneas periféricas do próprio paciente. As células dendríticas são pulsadas com proteína recombinante ou transfectadas com um construto genético que expressam a proteína. O construto também pode expressar moléculas coestimuladoras (não mostrado).
O desenvolvimento de tumores induzidos por vírus pode ser bloqueado pela imunização preventiva com antígenos virais ou com vírus vivos atenuados. Conforme mencionamos anteriormente, as vacinas recém-desenvolvidas para HPV prometem reduzir a incidência de tumores induzidos pelo HPV, incluindo carcinoma do colo do útero. Essa abordagem tem sido extremamente bem-sucedida na redução da incidência de tumores hematológicos malignos induzidos pelo vírus da leucemia felina em gatos e na prevenção do linfoma induzido por herpesvírus em galinhas, denominado doença de Marek.
Aumento da Imunidade do Hospedeiro contra Tumores por meio de Citocinas e Coestimuladores
A imunidade contra tumores mediada por células pode ser aumentada pela expressão de citocinas e coestimuladores em células tumorais e pelo tratamento de indivíduos portadores de tumor com citocinas que estimulam a proliferação e diferenciação de linfócitos T e células NK. Como discutido anteriormente neste capítulo, as células tumorais podem induzir respostas imunológicas fracas porque são desprovidas de coestimuladores e geralmente não expressam moléculas do MHC de classe II, não ativando, portanto, as células T auxiliares. Duas abordagens potenciais para reforçar as respostas imunológicas do hospedeiro ao tumor são fornecer artificialmente a coestimulação para as células T específicas para tumores e fornecer citocinas que possam potencializar a ativação das células T específicas de tumor, particularmente a dos CTL CD8+ (Fig. 17-7). Muitas citocinas também têm o potencial de induzir respostas inflamatórias inespecíficas, que por si só podem ter atividade antitumoral.
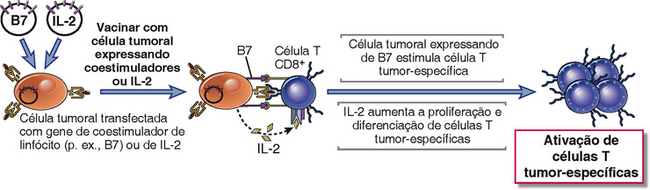
FIGURA 17-7 Melhora de imunogenicidade de células tumorais por transfecção de genes de coestimuladores e de citocinas. Células tumorais que não estimulam células T adequadamente quando transplantadas em um animal não serão rejeitadas e crescerão como tumores. A vacinação com células tumorais transfectadas com genes codificando coestimuladores ou citocinas, como IL-2, pode levar à melhor ativação de células T. Esta abordagem do uso de células tumorais transfectadas funcionou em modelos murinos, mas experimentos clínicos ainda não tiveram sucesso.
A eficácia de potencializar a coestimulação das células T para imunoterapia antitumoral foi demonstrada em experimentos com animais, nos quais células tumorais foram transfectadas com genes que codificam moléculas coestimulatórias B7 e usadas para vacinar os animais. Essas células tumorais que expressam B7 induzem a imunidade protetora contra células tumorais não modificadas injetadas em locais distantes. Tais sucessos com modelos experimentais de tumor resultaram em tentativas terapêuticas, nas quais uma amostra de tumor de um paciente é propagada in vitro, transfectada com genes de coestimuladores, irradiada e reintroduzida no paciente. Tais abordagens podem ter sucesso mesmo se os antígenos imunogênicos expressos no tumor não forem conhecidos.
É possível utilizar citocinas para potencializar respostas imunológicas adaptativas e naturais contra tumores. Em experimentos com camundongos, a injeção de células tumorais vivas transfectadas com genes de citocinas (p. ex., IL-2, GM-CSF) causou a rejeição de tumores estabelecidos. Esta abordagem foi tentada sem sucesso em pacientes com câncer.
As citocinas podem, também, ser administradas sistemicamente no tratamento de diversos tumores humanos (Tabela 17-3). A maior experiência clínica é com altas doses de IL-2, que estimula a produção de outras citocinas pelas células T, tais como TNF e IFN-γ, e essas citocinas agem no endotélio vascular e em outros tipos de células. A IL-2 tem sido eficaz na indução de respostas de regressão tumoral mensuráveis em cerca de 10% dos pacientes com melanomas e carcinomas avançados de células renais e é atualmente uma terapia aprovada para estes cânceres. O IFN-α foi aprovado para o tratamento de melanoma maligno, em combinação com quimioterapia, e tumores carcinoides. Ele também é usado para tratar certos linfomas e leucemias. Os mecanismos dos efeitos antineoplásticos do IFN-α provavelmente incluem a inibição da proliferação de células tumorais, atividade citotóxica aumentada de células NK, e expressão aumentada de MHC de classe I em células tumorais, que as torna mais suscetíveis à morte por CTL (Cap. 10). Outras citocinas, como TNF e IFN-γ, são agentes antitumorais eficazes em modelos animais, mas seu uso em pacientes é limitado por graves efeitos colaterais tóxicos. Fatores de crescimento hematopoiéticos, incluindo GM-CSF e G-CSF são usados em protocolos de tratamentos de câncer para encurtar os períodos de neutropenia e trombocitopenia após a quimioterapia ou transplante autólogo de medula óssea.
Bloqueamento das Vias Inibitórias para Promover Imunidade Tumoral
Outra estratégia imunoterapêutica se baseia na ideia anteriormente discutida de que células tumorais aproveitam várias vias normais de regulação ou tolerância imunológica para se evadirem da resposta imunológica do hospedeiro. Uma série de estudos em camundongos e humanos foi direcionada para o receptor inibidor a B7, chamado CTLA-4, que normalmente funciona para desligar respostas contra antígenos próprios (Cap. 14). A terapia combinada com uma vacina tumoral e um anticorpo que bloqueia CTLA-4 induz uma forte resposta antitumoral de células T que destrói o tumor. O anticorpo anti-CTLA-4 foi usado com algum sucesso em experimentos clínicos com pacientes com tumores avançados. Uma complicação comum deste tratamento foi o desenvolvimento de reações autoimunes, o que é previsível pelo conhecimento do papel do CTLA-4 na manutenção da autotolerância. Conforme discutimos anteriormente, respostas de células T contra tumores também podem ser inibidas pela via PD-L1/PD-1. O bloqueio de anticorpos PD-1 é eficaz no aumento da morte de tumores em camundongos por células T, e estão sendo realizados experimentos clínicos com humanos usando esta abordagem. A depleção de células T reguladoras também pode aumentar a imunidade antitumoral, e esta abordagem está sendo testada em modelos animais.
Estimulação Inespecífica do Sistema Imunológico
Respostas imunológicas a tumores podem ser estimuladas pela administração local de substâncias inflamatórias ou por tratamento sistêmico com agentes que funcionam como ativadores policlonais de linfócitos. A estimulação imunológica inespecífica de pacientes com tumores por meio da injeção de substâncias inflamatórias, como o bacilo de Calmette-Guérin (BCG), nos locais de crescimento tumoral, vem sendo tentada há muitos anos. As micobactérias BCG ativam macrófagos e, desta forma, promovem a morte mediada por macrófagos das células tumorais. Além disso, as bactérias funcionam como adjuvantes e podem estimular respostas de células T contra os antígenos tumorais. A BCG intravesicular é usada atualmente para o tratamento do câncer de bexiga. As terapias com citocinas, discutidas anteriormente, representam outro método de intensificar as respostas imunológicas de maneira inespecífica.
Imunoterapia Passiva para Tumores com Células T e Anticorpos
A imunoterapia passiva consiste na transferência de efetores imunológicos, incluindo células T e anticorpos específicos para tumor, em pacientes. A imunoterapia passiva contra tumores é rápida, mas não leva a uma imunidade duradoura. Alguns anticorpos antitumorais já foram aprovados para o tratamento de certos cânceres. Várias outras abordagens de imunoterapia passiva estão sendo tentadas, com sucesso variável.
Terapia Celular Adotiva
Imunoterapia celular adotiva é a transferência de células imunológicas cultivadas que tenham reatividade antitumoral em um paciente portador de tumor. As células a serem transferidas são propagadas de linfócitos de pacientes com tumor. Um protocolo para a imunoterapia celular adotiva consiste em gerar células LAK pela cultura de leucócitos do sangue periférico de pacientes com tumor em altas concentrações de IL-2 e injetar as células LAK de volta nos pacientes (Fig. 17-8). Como discutido anteriormente, as células LAK são derivadas principalmente de células NK. A terapia adotiva com células LAK autólogas, combinada com a administração in vivo de IL-2 ou drogas quimioterapêuticas, produziu resultados impressionantes em camundongos, tendo havido regressão de tumores sólidos. Até o momento, as tentativas de terapia com células LAK em humanos foram bastante restritas aos casos avançados de tumores metastáticos, e a eficácia dessa abordagem parece variar de paciente para paciente. Uma variação dessa abordagem é o isolamento de TIL dos infiltrados inflamatórios presentes no interior e ao redor de tumores sólidos, obtidos em amostras de ressecção cirúrgica, e a propagação dos TIL por meio de cultura com IL-2. A fundamentação dessa abordagem é que os TIL podem ser enriquecidos por CTL específicos para tumor e células NK ativadas. A terapia TIL para melanoma metastático é atualmente usada em muitos centros. Outra abordagem para a terapia adotiva sendo desenvolvida atualmente é a terapia de gene de receptor de célula T (TCR), na qual as células T de um paciente de tumor são transduzidas in vitro com genes codificando um TCR específico para um antígeno tumoral, expandidas, e depois inseridas de volta no paciente.
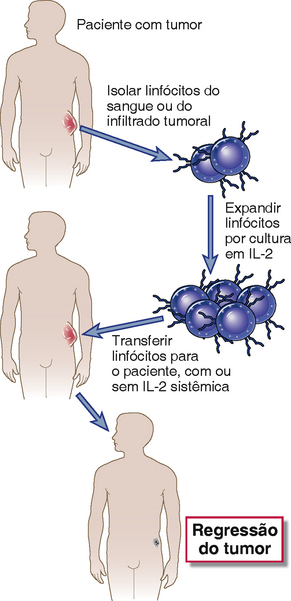
FIGURA 17-8 Terapia celular adotiva. Em uma abordagem comumente usada para terapia celular adotiva, linfócitos isolados do sangue ou do infiltrado tumoral de um paciente são expandidos por cultura em IL-2 e são inseridos de volta no paciente. Este tratamento, frequentemente combinado com a administração sistêmica de IL-2, leva à regressão do tumor em alguns pacientes.
Efeito Enxerto-versus-Leucemia
Em pacientes com leucemia, a administração de células T alorreativas juntamente com transplantes de células-tronco hematopoiéticas pode contribuir para erradicação do tumor. Este efeito enxerto-versus-leucemia é dirigido às moléculas do MHC alogênicas presentes nas células hematopoiéticas do receptor, inclusive as células de leucemia. O desafio no uso deste tratamento para melhorar o resultado clínico é reduzir ao mínimo a perigosa doença enxerto-versus-hospedeiro, que pode ser mediada pelas mesmas células T doadoras (Cap. 16).
Terapia com Anticorpos Antitumorais
Anticorpos monoclonais específicos para tumor podem ser úteis na imunoterapia específica contra tumores. A possibilidade do uso de anticorpos como “munição mágica” foi fascinante para os pesquisadores durante muitos anos, e ainda é uma área ativa da pesquisa. Atualmente, há mais de 100 diferentes anticorpos monoclonais sendo considerados, em estudos experimentais em animais ou em experiências humanas, como agentes terapêuticos para câncer, e alguns foram aprovados para uso clínico (Tabela 17-4). Os anticorpos tumorais podem erradicar os tumores por meio dos mesmos mecanismos efetores usados na eliminação de micro-organismos, incluindo opsonização e fagocitose, ativação do sistema do complemento, e citotoxicidade celular dependente de anticorpos (Cap. 12). É provável que estes mecanismos funcionem em pacientes com linfoma de célula B tratado com anti-CD20, um dos tratamentos antitumorais com anticorpos mais bem-sucedidos até hoje. Além disso, alguns anticorpos podem ativar diretamente vias de apoptose intrínsecas nas células tumorais; este é o mecanismo proposto para o uso de anti-CD30 para tratar linfomas, atualmente em experiências clínicas. Um anticorpo monoclonal (Herceptina) específico para o produto oncogênico HER2/Neu, é um tratamento aprovado para pacientes com câncer de mama cujos tumores expressam altos níveis de HER2/Neu. Além de estimular os mecanismos imunológicos efetores, os anticorpos anti-HER-2/Neu interferem com as funções de sinalização de crescimento da molécula de HER-2/ Neu.
TABELA 17-4 Anticorpos Monoclonais Antitumorais em Experimentação ou Aprovados para Uso Clínico
| Especificidade de Anticorpo | Forma do Anticorpo Usado | Uso Clínico |
|---|---|---|
| HER2/Neu | Monoclonal murino humanizado | Câncer de mama (aprovado) |
| CD20 (marcador de célula B) | Monoclonal murino humanizado | Linfoma de célula B (aprovado) |
| CD25 | Monoclonal murino humanizado, imunotoxina | Linfomas de célula T/leucemias (experimentos) |
| Antígeno carcinoembriônico | Monoclonal murino humanizado | Cânceres gastrointestinais, câncer de pulmão (experimentos) |
| CA-125 | Monoclonal murino | Câncer de ovário |
| GD3 gangliosídeo | Monoclonal murino humanizado | Melanoma (experimentos) |
Uma vez que os anticorpos antitumorais usados nos estudos iniciais em humanos eram anticorpos monoclonais de camundongos, frequentemente ocorriam respostas imunológicas contra Ig murinas, resultando em anticorpos anti-Ig murinas que causavam a eliminação acelerada dos anticorpos antitumorais, ou bloqueavam a ligação do agente terapêutico com o seu alvo. Esse problema foi reduzido com o uso de anticorpos “humanizados”, que eram regiões variáveis de anticorpos monoclonais murinos específicos para o antígeno tumoral combinadas com porções de Fc humanas. Um dos problemas mais difíceis no uso de anticorpos antitumorais é o crescimento excessivo das variantes com perda de antígenos das células tumorais que não mais expressam os antígenos reconhecidos pelos anticorpos. Uma maneira de evitar esse problema pode ser o uso de coquetéis de anticorpos específicos para diferentes antígenos expressos pelo mesmo tumor.
Muitas variações em anticorpos antitumorais foram tentadas em ensaios visando melhorar sua eficácia. Anticorpos específicos para tumor podem ser acoplados a moléculas tóxicas, radioisótopos e drogas antitumorais para promover a distribuição desses agentes citotóxicos especificamente para o tumor. Toxinas como a ricina e a toxina diftérica são potentes inibidoras da síntese proteica e podem ser eficazes em doses extremamente baixas, se forem conduzidas para os tumores acopladas a anticorpos antitumorais; esses conjugados são chamados de imunotoxinas. Essa abordagem requer a ligação covalente da toxina (sem o componente de ligação celular) a uma molécula de anticorpo antitumoral, sem que haja a perda da toxicidade ou especificidade do anticorpo. A imunotoxina injetada sistemicamente é endocitada pelas células tumorais, e a porção com a toxina é conduzida ao seu local de ação intracelular. Várias dificuldades práticas precisam ser superadas para que essa técnica tenha sucesso. A especificidade dos anticorpos deve ser tal que eles não se liguem às células não tumorais. Uma quantidade suficiente de anticorpos deverá atingir o alvo apropriado no tumor antes que eles sejam eliminados do sangue pelas células fagocíticas portadoras de receptor Fc. As toxinas, fármacos e radioisótopos ligados ao anticorpo podem ter efeito sistêmico resultante da circulação através dos tecidos normais. Por exemplo, síndromes de hepatotoxicidade e permeabilidade capilar são problemas comuns na terapia com imunotoxinas. A administração de imunotoxinas pode causar reações dos anticorpos contra as toxinas e anticorpos injetados. Devido a essas dificuldades práticas, ensaios clínicos com imunotoxinas têm tido sucesso modesto e variável.
Anticorpos anti-idiotípicos têm sido usados no tratamento de linfomas de células B que expressam em sua superfície determinados idiótipos de Ig. O idiótipo é um antígeno tumoral altamente específico, uma vez que é expresso apenas nos clones neoplásicos de células B, e já se teve esperança de que os anticorpos anti-idiotípicos pudessem ser reagentes terapêuticos eficazes, com absoluta especificidade tumoral. (Anticorpos anti-idiotípicos são produzidos pela imunização de animais com as células B do tumor de um paciente e pela redução do soro de reatividade contra todas as outras imunoglobulinas humanas.) A abordagem não tem tido sucesso no geral, em grande parte por causa do crescimento seletivo de células tumorais com idiótipos alterados que não são reconhecidos pelo anticorpo anti-idiotípico. Esse resultado pode refletir, em parte, a alta taxa de mutação somática em genes Ig e o fato de que Ig de superfície é dispensável para o crescimento tumoral.
O crescimento tumoral é usualmente dependente de fatores de crescimento, os quais constituem alvos potenciais para terapia. Anticorpos que bloqueiam o receptor ao fator de crescimento epidérmico estão aprovados para o tratamento de tumores colorretais. Os tumores dependem da formação de novos vasos sanguíneos que suprem o tumor com oxigênio e nutrientes. Este processo, chamado de angiogênese tumoral, é dependente de outros fatores de crescimento especializados, incluindo o VEGF. Diversos inibidores destes fatores angiogênicos podem bloquear o crescimento tumoral. Anticorpos anti-VEGF estão agora aprovados para uso clínico, em combinação com agentes quimioterápicos, para tratar alguns tumores metastáticos, embora sua eficácia seja modesta.
Anticorpos antitumorais são usados também para remover células cancerosas da medula óssea antes de transplantes de medula autólogos. Nesse protocolo, parte da medula óssea do paciente é removida e o paciente recebe doses de radiação e quimioterapia letais o suficiente para destruírem as células tumorais, bem como o restante das células normais da medula. As células da medula óssea retiradas do paciente são tratadas com anticorpos ou imunotoxinas específicos para antígenos tumorais de modo a destruir a maioria ou todas as células tumorais. A medula tratada, tendo sido expurgada das células tumorais, é transplantada de volta no paciente para reconstruir o sistema hematopoiético, destruído pela irradiação e quimioterapia.
O PAPEL DO SISTEMA IMUNOLÓGICO NA PROMOÇÃO DO CRESCIMENTO TUMORAL
Embora grande parte da ênfase da imunologia tumoral tenha sido o papel do sistema imunológico na erradicação de tumores, está claro que o sistema imunológico também pode contribuir para o desenvolvimento de alguns tumores sólidos. Na realidade, a inflamação crônica é reconhecida há tempos como um fator de risco para o desenvolvimento de tumores em muitos tecidos diferentes, especialmente aqueles afetados por doenças inflamatórias crônicas como o esôfago de Barrett, a doença de Crohn, a pancreatite e a prostatite, por exemplo. Alguns cânceres associados a infecções também são considerados um resultado indireto dos efeitos carcinogênicos dos estados inflamatórios crônicos que são induzidos pelos organismos infecciosos. Estes incluem o câncer gástrico no contexto de infecção crônica por Helicobacter pylori e os carcinomas hepatocelulares associados a infecções virais crônicas por hepatites B e C. Embora os mecanismos pelos quais a inflamação crônica pode promover desenvolvimento tumoral não estejam bem compreendidos, há diversas possibilidades, suportadas por dados de modelos em roedores. As células do sistema imunológico natural são consideradas os mais diretos culpados por promover tumores entre as células imunes. Macrófagos do fenótipo M2 associados a tumores e outras células são fontes de VEGF, que promove a angiogênese, e metaloproteinases da matriz, que modificam o tecido extracelular. Assim, a ativação crônica das células imunes naturais é caracterizada por angiogênese e remodelação tecidual, ambas as quais favorecem a formação e a disseminação do tumor. As células imunes naturais também podem contribuir para transformação maligna de células, ao gerarem radicais livres que causam dano ao DNA e levam a mutações nos genes supressores tumorais e oncogenes. Alguns dados sugerem que as células do sistema imunológico natural, incluindo mastócitos, neutrófilos e macrófagos secretam fatores solúveis que promovem a progressão do ciclo celular e a sobrevivência de células tumorais. O fator de transcrição NF-κB, que é um dos principais mediadores de respostas imunológicas naturais, pode desempenhar um papel importante na progressão de câncer associado à inflamação. O sistema imunológico adquirido é capaz de promover ativação crônica das células imunes naturais de várias maneiras, incluindo ativação dos macrófagos mediada pelas células T, no contexto de infecções microbianas intracelulares persistentes, bem como durante a doença maligna inicial mesmo quando não há agentes infecciosos presentes. Também há evidência experimental de que linfócitos B podem contribuir para a progressão tumoral pela secreção de fatores que regulam diretamente os programas de proliferação em células tumorais bem como por sua habilidade de ativar cronicamente células imunológicas naturais presentes em tumores iniciais. Assim, o sistema imunológico adquirido pode indiretamente intensificar as atividades promotoras de tumores do sistema imunológico natural. Os efeitos promotores de tumores do sistema imunológico são paradoxais, e um tópico de investigação ativa no presente. Estes efeitos da inflamação crônica são teoricamente também excelentes alvos para intervenção farmacológica, porque existe uma grande variedade de drogas anti-inflamatórias eficazes já disponíveis. O desafio para os oncologistas é obter um equilíbrio benéfico no qual as respostas imunológicas adquiridas não sejam comprometidas, enquanto as reações inflamatórias crônicas, potencialmente prejudicais, sejam controladas.
• Os tumores expressam antígenos que são reconhecidos pelo sistema imunológico, mas a maioria dos tumores é fracamente imunogênica e as respostas imunológicas com frequência não previnem o crescimento de tumores. O sistema imunológico pode ser estimulado a destruir eficazmente os tumores.
• Antígenos tumorais reconhecidos pelos CTL são os principais indutores e alvos da imunidade antitumoral. Esses antígenos incluem mutantes de oncogenes e de outras proteínas celulares, proteínas normais cuja expressão é desregulada ou aumentada em tumores, e produtos de vírus oncogênicos.
• Anticorpos específicos para células tumorais reconhecem antígenos que são utilizados para diagnóstico e são alvos em potencial para a terapia com anticorpos. Esses antígenos incluem antígenos oncofetais, que são expressos normalmente durante o estágio fetal, e cuja expressão é desregulada em alguns tumores; glicoproteínas e glicolipídeos de superfície alterados; e moléculas expressas normalmente nas células das quais os tumores se originam, sendo, portanto, antígenos de diferenciação para tipos particulares de células.
• As respostas imunológicas capazes de destruir células tumorais consistem em CTLs, células NK e macrófagos ativados. O papel desses mecanismos imunológicos efetores na proteção de indivíduos contra tumores não está bem definido.
• Os tumores evadem as respostas imunológicas por meio de vários mecanismos, incluindo a infrarregulação da expressão de moléculas do MHC, crescimento de células que não expressam antígenos tumorais, produção de substâncias imunossupressoras e indução da tolerância a antígenos tumorais. Macrófagos associados a tumores e células supressoras derivadas de mieloides, encontradas na maioria dos tumores sólidos, suprimem a imunidade antitumoral.
• A imunoterapia contra tumores é elaborada visando amplificar as respostas imunológicas ativas contra estes tumores, ou administrar efetores imunológicos específicos para tumor em pacientes. As respostas imunológicas podem ser ativamente potencializadas pela imunização com células tumorais ou antígenos, pela administração de tumores modificados expressando altos níveis de coestimuladores ou citocinas, que ativam a proliferação e diferenciação de células T, e pela administração sistêmica de citocinas. A imunidade antitumoral também pode ser aumentada pelo bloqueamento das vias inibitórias da imunorregulação. As abordagens de imunoterapia passiva incluem administração de anticorpos antitumorais, anticorpos conjugados com medicamentos tóxicos (imunotoxinas), e células T e NK reativas a tumor, isoladas de pacientes e propagadas pelo cultivo com fatores de crescimento.
Respostas Imunológicas Contra Tumores
Boon T, Coulie PG, Van den Eynde BJ, van der Bruggen P. Human T cell responses against melanoma. Annual Review of Immunology. 2006;24:175-208.
Burnet FM. The concept of immunological surveillance. Progress in Experimental Tumor Research. 1970;13:1-27.
de Visser KE, Eichten A, Coussens LM. Paradoxical roles of the immune system during cancer development. Nature Reviews Cancer. 2006;6:24-37.
Dunn GP, Koebel CM, Schreiber RD. Interferons, immunity and cancer immunoediting. Nature Reviews Immunology. 2006;6:836-848.
Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140:883-899.
Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008;454:436-444.
Pardoll DM. Does the immune system see tumors as foreign or self? Annual Review of Immunology. 2003;21:807-839.
Berzofsky JA, Terabe M, Oh S, Belyakov IM, Ahlers JD, Janik JE, Morris JC. Progress on new vaccine strategies for the immunotherapy and prevention of cancer. Journal of Clinical Investigation. 2004;113:1515-1525.
Curiel TJ. Regulatory T cells and treatment of cancer. Current Opinions in Immunology. 2008;20:241-246.
Dranoff G. Cytokines in cancer pathogenesis and cancer therapy. Nature Reviews Cancer. 2004;4:11-22.
Farkas AM, Finn OJ. Vaccines based on abnormal self- antigens as tumor-associated antigens: immune regulation. Seminars in Immunology. 2010;22:125-131.
Gattinoni L, Powell DJJr, Rosenberg SA, Restifo NP. Adoptive immunotherapy for cancer: building on success. Nature Reviews Immunology. 2006;6:383-393.
Gilboa E. DC-based cancer vaccines. Journal of Clinical Investigation. 2007;117:1195-1203.
Laheru DA, Pardoll DM, Jaffee EM. Genes to vaccines for immunotherapy: how the molecular biology revolution has influenced cancer immunology. Molecular Cancer Therapy. 2005;4:1645-1652.
Melief CJM. Cancer immunotherapy by dendritic cells. Immunity. 2008;29:372-383.
Mougiakakos D, Choudhury A, Lladser A, Kiessling R, Johansson CC. Regulatory T cells in cancer. Advances in Cancer Research. 2010;107:57-117.
Peggs KS, Quezada SA, Korman AJ, Allison JP. Principles and use of anti-CTLA4 antibody in human cancer immunotherapy. Current Opinions in Immunology. 2006;18:206-213.
Reiter Y. Recombinant immunotoxins in targeted cancer cell therapy. Advances in Cancer Research. 2001;81:93-124.
Simpson AJ, Caballero OL, Jungbluth A, Chen YT, Old L. Cancer/testis antigens, gametogenesis and cancer. Nature Reviews Cancer. 2005;5:615-625.
Steinman RM, Banchereau J. Taking dendritic cells into medicine. Nature. 2007;449:419-426.
Stevanovic S. Identification of tumour-associated T-cell epitopes for vaccine development. Nature Reviews Cancer. 2002;2:514-520.
Terme M, Ullrich E, Delahaye NF, Chaput N, Zitvogel L. Natural killer cell–directed therapies: moving from unexpected results to successful strategies. Nature Immunology. 2008;9:486-494.
Waldmann TA. Effective cancer therapy through immunomodulation. Annual Review of Medicine. 2006;57:65-81.
Weiner LM, Surana R, Wang S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 2010;10:317-327.
Zou W. Regulatory T cells, tumour immunity and immunotherapy. Nature Reviews Immunology. 2006;6:295-307.